224例儿童急性胰腺炎临床分析
2024-01-03孟园吴婕叶晓琳吴旭红潘玉凤王鑫
孟园,吴婕,叶晓琳,吴旭红,潘玉凤,王鑫
(国家儿童医学中心,首都医科大学附属北京儿童医院消化内科,北京 100045)
急性胰腺炎(acute pancreatitis,AP)是胰酶激活引起胰腺组织发生消化、水肿、出血、坏死的炎症反应[1]。儿童AP多发生于5岁以上儿童,发生率为3.6~13.2/100 000,且呈上升趋势[2]。其中重症AP患儿起病急、进展迅速,多脏器衰竭发生率为40%,死亡率15%~30%[3]。研究[4]显示,不同地区、不同年龄儿童AP的病因均不同,缺乏特异性。目前,儿童AP的诊疗缺乏公认的标准。因此,深入了解儿童AP临床特点对减少漏诊、误诊的发生意义重大。本研究收集我院224例AP患者的临床资料,对儿童AP的病因、临床特点、治疗及结局进行分析,旨在为儿童AP的诊疗提供依据。
1 材料与方法
1.1 临床资料及分组
收集2016年1月至2023年1月于首都医科大学附属北京儿童医院消化内科住院的245例AP患者的临床资料。纳入标准:(1)根据改良的亚特兰大标准[5]诊断为AP。AP诊断标准为符合以下3项中的2项或2项以上:①具备AP的临床症状;②血清淀粉酶和(或)脂肪酶升高,≥正常值上限3倍;③影像学检查符合AP特征性变化;(2)资料齐全。排除标准:(1)慢性胰腺炎;(2)确诊AP时年龄≥18岁;(3)住院时间<72 h。本研究获得医院伦理委员会批准(批号:IEC-C-006-A04-V.07)。
共纳入224例,其中男136例,女88例;年龄1~17岁,平均年龄(8.5±4.2)岁;住院时间4~86 d,平均住院时间(15.6±10.7)d。根据年龄分为4组:婴幼儿组(<3岁,n=23)、学龄前期组(3~<6岁,n=44)、学龄期组(6~<12岁,n=86)、青春期组(12~<18岁,n=71)。
1.2 AP的分类
按照《NASPGHAN管理及分级标准》[6],AP分为3型:(1)轻症AP(mild AP,MAP),无器官功能障碍且无局部/系统性并发症,未加重慢性合并症(慢性肾病、慢性肺部疾病等);(2)中症AP(moderately severe AP,MSAP),器官功能障碍≤48 h,或出现局部/系统性并发症,或加重慢性合并症;(3)重症AP(severe AP,SAP),持续性器官功能障碍>48 h。
1.3 研究指标
收集患者的各项临床指标,包括一般临床指标(性别、年龄)、病因(解剖异常、胆源性、特发性、感染等)、临床症状[腹痛、呕吐、发热、腹胀、腹泻、其他(不明原因的哭闹、烦躁、精神萎靡、食欲下降)]、主要实验室指标[发病24 h内血淀粉酶、脂肪酶、肝肾功能、血糖、血钙、乳酸脱氢酶、白细胞、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、C反应蛋白(C-reaction protein,CRP)等]、超声影像学检查、治疗、并发症及结局等。
1.4 统计学分析
2 结果
2.1 病因及症状分析
224例AP患者中,解剖异常82例,其中胰腺分裂11例、胰胆管合流异常66例、胰管狭窄4例、胰管扩张1例;胆源性50例,其中胆结石44例、胆汁淤积4例、胆总管囊肿2例;感染30例,其中EB病毒感染10例、流感16例、肺炎支原体感染2例、结核感染2例;其他18例,其中高甘油三酯血症9例(学龄期组4例,青春期组5例)、外伤3例(腹部受外力重创引起)、基因异常1例、全身疾病5例(系统性红斑狼疮1例,炎性肠病4例)。主要症状为腹痛(92.0%)、呕吐(54.5%)和发热(30.4%)。MAP188例,MSAP24例,SAP12例。学龄前组、学龄期组、青春期组腹痛、发热患者较多,组间比较有统计学差异(均P<0.05),其他症状婴幼儿组较多,组间比较有统计学差异(P<0.001)。MAP、MSAP、SAP组间比较无统计学差异(均P> 0.05)。见表1。

表1 各组患者病因、临床症状和疾病严重程度比较[n(%)]
2.2 实验室指标比较
结果显示,224例AP患者中,MAP、MSAP、SAP患者的白细胞、CRP、淀粉酶、脂肪酶、ALT、AST水平比较,差异有统计学意义(均P<0.05)。见表2。
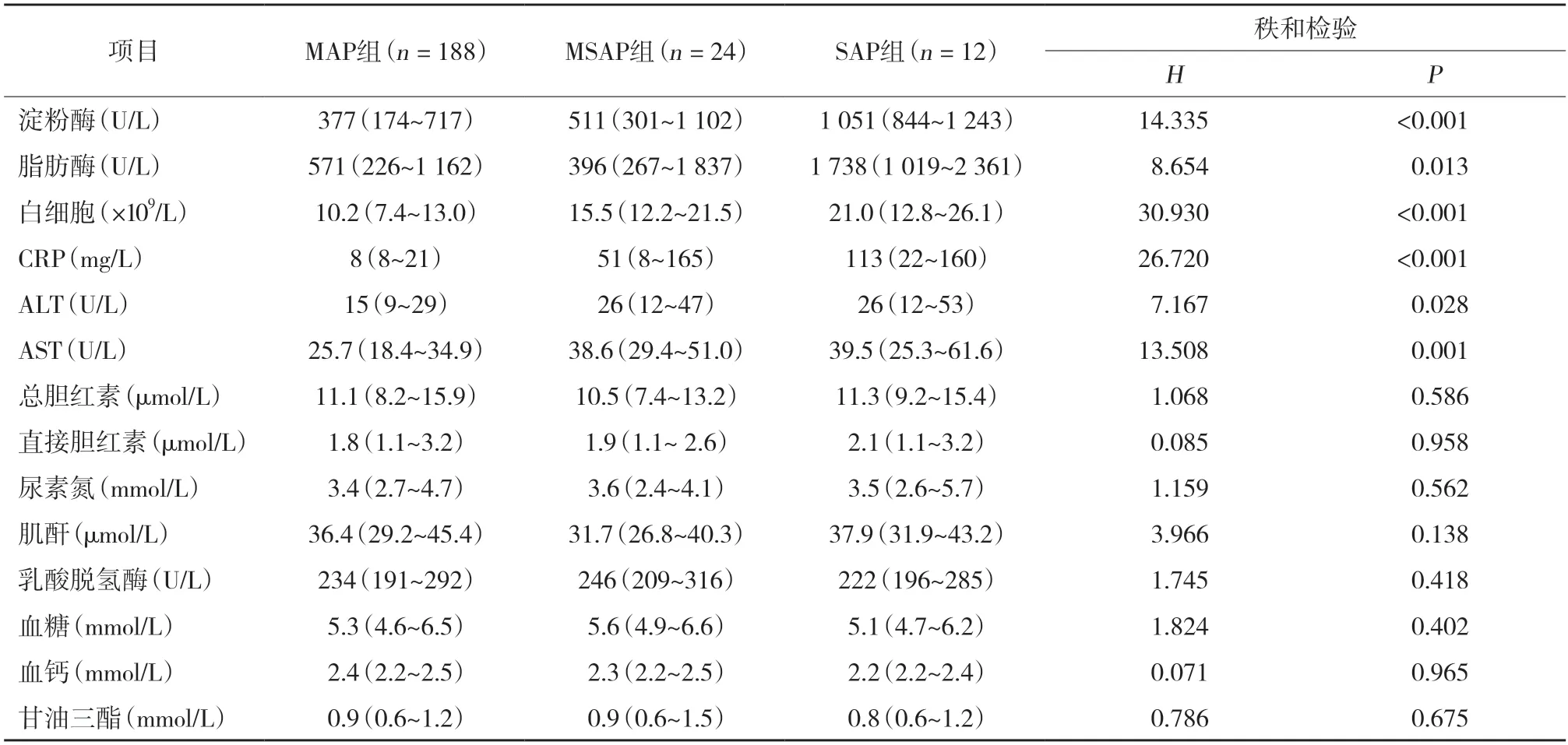
表2 MAP、MSAP、SAP组患者实验室指标比较
2.3 影像学检查及并发症比较
224例患者影像学检查中,超声检查、胰腺CT、磁共振胰胆管成像(magnetic resonance cholangiopan-creatography,MRCP)的完成率分别为100%(224例)、54.5%(122例)、77.7%(174例)。并发症统计结果显示,胰周积液33例(MAP 2例,MSAP 7例,SAP 5例),假性囊肿8例(MSAP 5例,SAP 3例),胰周坏死5例(MSAP 1例,SAP 4例),器官功能障碍3例(SAP)。其中MAP患者并发症仅见胰周积液。
2.4 患者肠内营养支持方式、持续时间及营养制剂种类分析
结果显示,经鼻胃肠管进行肠内营养140例,占62.5%;经口进食84例,占37.5%,各年龄组肠内营养方式比较差异无统计学意义(χ2=3.915,P=0.271)。各组患者肠内营养开始时间与持续时间比较无统计学差异(均P> 0.05)。AP患者肠内营养制剂包括水解肽类配方、多聚配方和氨基酸配方,其中选择水解肽类配方的患儿较多,占58.0%。见表3。各组疾病严重程度与肠内营养时间的相关分析结果显示,疾病严重程度与肠内营养开始时间、持续时间均呈正相关(r分别为0.447、0.449,均P<0.001)。
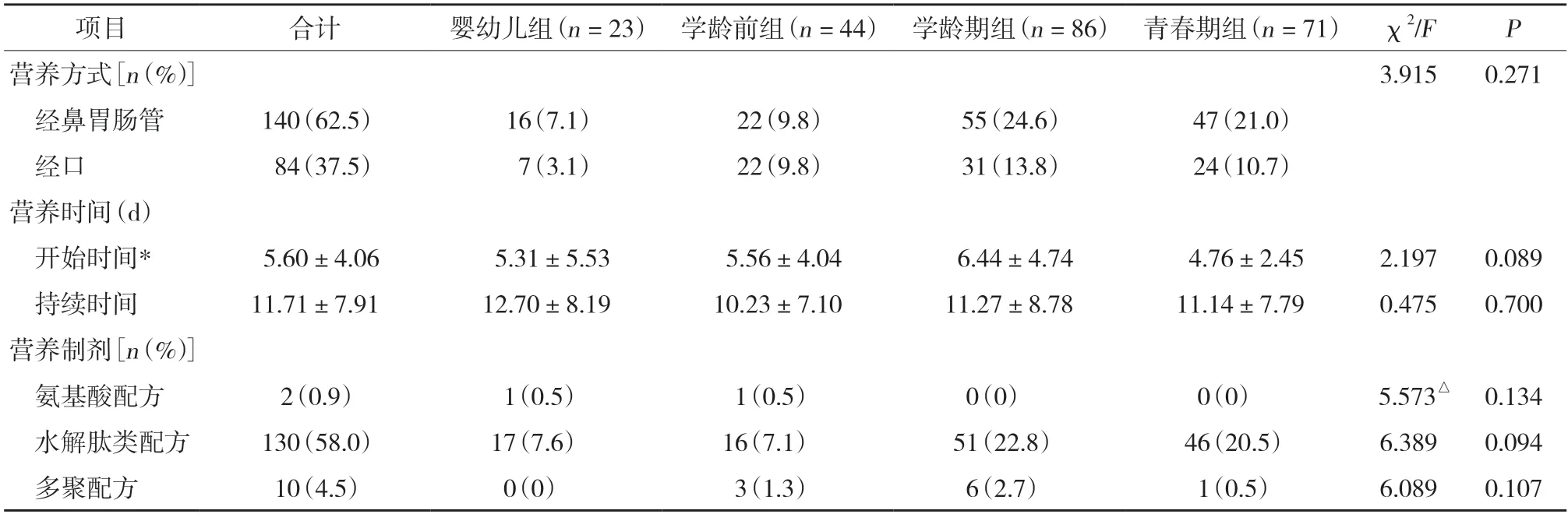
表3 AP患者肠内营养方式、营养时间及营养制剂分析
2.5 治疗与结局
患者均经过禁食水、积极液体复苏、肠内营养等系统治疗,均好转或治愈出院,无死亡病例。其中4例行内镜下逆行胰胆管造影术后携带胆管支架或胰管支架出院;3例合并呼吸功能障碍给予气管插管呼吸支持;4例因腹腔积液过多或囊肿过大超声引导下行穿刺引流术。
3 讨论
儿童AP病因复杂,与成人多有不同,有些患儿发病并非单一因素所致。有研究[7]显示5%~20%AP患儿中发现了胰胆管系统(胰腺分裂症、胰胆管合流异常、胰腺发育不良、环状胰腺、胆管狭窄和Oddi括约肌功能异常等)的解剖异常。本研究数据显示儿童AP 最主要的病因为解剖异常(胰胆管合流异常、胰腺分裂、胰管狭窄等),占36.6%,高于以往的研究数据,可能与近年来医学诊疗技术与检测手段进步有关。有研究[8-9]报道胆源性胰腺炎发生率占3%~30%,是儿童AP最常见的危险因素,且胆源性胰腺炎多见于合并有先天解剖结构异常的儿童。本研究结果显示胆源性居病因的第3位,占22.3%,与上述研究结果基本一致;而且常见的胆道疾病为胆结石、胆汁淤积、胆总管囊肿等。本研究结果显示,发病原因中特发性患者较多,仅次于解剖异常,说明儿童AP中不确定因素较多,发病机制更加复杂,与既往研究[10]报道(约30%原因不明)基本一致。另外研究结果显示,儿童AP多发生6~<18岁,与以往研究[11]结果一致。已有研究[12]显示AP与腮腺炎、流感、麻疹病毒和细菌性病原菌感染有关,与本研究结果相似。因此,对于病因不明的AP患者需警惕是否存在原发感染。有研究[13]报道,自身免疫性疾病(系统性红斑狼疮、过敏性紫癜、川崎病和炎性肠病等)与AP相关。本研究中系统性红斑狼疮1例,炎性肠病4例。另外,研究[14]显示高脂血症性AP的发病率也逐年增多;2%~7%AP患者有代谢性因素[15-16]。本研究中9例高脂血症性AP患者发生在学龄期和青春期,因此,中小学生应加强饮食管理,适当运动,减少高脂血症性AP发生的风险。近年来,儿童急性复发性胰腺炎的遗传因素(PRSS1、SPINK1、CFTR或CTRC基因变异)越来越丰富[17]。本研究中基因异常1例,PRSS1基因1个杂合突变:c.365G>A(p.R122H)。
本研究结果显示,儿童AP主要临床症状为腹痛、呕吐和发热,婴幼儿AP临床症状不典型。腹痛是胰腺炎的主要症状,本研究中92.0%患者出现腹痛,54.5%患者出现呕吐症状,因此,当儿童出现不能解释的呕吐、呕吐后腹痛不能缓解时,应考虑AP的可能。AP发热常源于全身炎症反应综合征、坏死胰腺组织继发感染,本研究中30.4%患者出现不同程度发热。
白细胞、CRP是关键的炎症指标;血清淀粉酶和脂肪酶是AP主要筛查指标。既往研究显示血脂肪酶、白细胞计数是预测AP患儿预后和发展为重症胰腺炎的关键因素[18];脂肪酶是判断儿童AP严重程度的重要指标[19]。本研究MAP、MSAP、SAP患者白细胞、CRP、淀粉酶、脂肪酶水平比较差异有统计学意义(均P<0.05),与以往研究结果基本一致。另外,本研究发现MAP、MSAP、SAP患者ALT和AST水平比较也有统计学差异(均P<0.05)。因此临床上还要关注患者肝功能情况,ALT和AST可以作为病情判断的指标。
目前国内外胰腺炎管理指南[20-21]将腹部CT,尤其是增强CT作为胰腺炎诊断的金标准。而超声具有价廉、无辐射且不需镇静等优势,在儿科患者中广泛使用,是初始筛查可疑胰腺炎和评估儿科患者胆道异常的最佳选择[22]。MRCP和CT检查都需要患者配合,无法配合时还需要在镇静状态下完成;但MRCP能更好完成胰胆管成像,可帮助医生明确诊断和治疗。本研究中超声检查的使用率为100%,明显高于MRCP(77.7%)和CT(54.5%)。影像学检查不仅有助于明确诊断,还能早期发现是否有局部并发症的发生,帮助临床医师准确判断AP患者疾病严重程度。
对症治疗是儿童AP主要治疗手段,其目的是减少胰液的分泌,使损伤的胰腺充分休息。因此,在对症治疗的同时,尽早给予营养支持治疗(肠外营养和肠内营养)尤为重要。研究[23]显示,与肠外营养比较,肠内营养可以显著降低死亡、感染、胰腺并发症、多器官衰竭等风险。CROCKETT等[24]研究结果显示,早期(24~48 h内)开始肠内营养可使AP患者更加受益。2021年我国AP诊治指南[25]推荐在胃肠功能耐受的情况下,应尽早开展经口或肠内营养;同时指出低脂、软食是安全的,氨基酸型相较于短肽型或整蛋白型营养制剂无显著临床获益。本研究中经鼻胃肠管进行肠内营养患者占62.5%,各组肠内营养开始时间与持续时间比较无统计学差异(P>0.05),说明各年龄段患者肠内营养的治疗方案大体一致。本研究中58.0%肠内营养患者选择水解肽类配方,水解肽类配方具有易消化吸收、热量高等优点,已成为临床首选的肠内营养制剂。本研究中,AP严重程度与肠内营养开始时间、持续时间均呈正相关(P<0.001)。
综上所述,儿童AP多发生于6~<18岁,解剖异常、特发性是常见的病因;婴幼儿AP临床表现常不典型,需引起注意。目前超声是临床上主要检查手段,MRCP检查可帮助医生明确诊断和治疗。局部并发症发生及白细胞、CRP、淀粉酶、脂肪酶、ALT和AST水平有助于判断AP严重程度。主要的治疗方式为对症治疗和肠内营养支持,而且AP严重程度与肠内营养开始时间、持续时间均呈正相关。本研究为单中心回顾性研究,样本量较小,还需要多中心、大样本的临床数据来进一步验证。
