PPAR-γ抑制高糖微环境下NCI-H460细胞增殖的分子机制
2024-01-03胡明亮
胡明亮
(中国医科大学附属盛京医院胃肠营养外科,沈阳 110004)
肺癌是发病率和死亡率较高的恶性肿瘤之一,致死率居恶性肿瘤首位[1]。糖尿病患者的肿瘤发生率远高于非糖尿病人群,且预后较差。高血糖是各类肿瘤发生的重要危险因素[2],与结直肠癌、胰腺癌、肝癌、胃癌、乳腺癌等肿瘤的发生、发展甚至死亡密切相关[3-6],但目前糖尿病与肺癌的关系仍不明确[7]。因此,探讨高糖微环境对肺癌细胞增殖的影响,并深入揭示其分子机制,对指导高危人群的自我防范、开拓治疗肺癌的新方法具有重要意义。
炎症和持续性感染在肿瘤的发生、发展、恶性转化、侵袭、转移等不同阶段均起关键作用。炎症小体是一类大分子多蛋白复合物,是介导机体多种炎症反应的重要信号。Nod样受体蛋白3(Nod like receptor protein 3,NLRP3)炎症小体被活化后,促使无活性的pro-caspase-1生成有活性的caspase-1,并切割白细胞介素(interleukin,IL)-1β和IL-18前体,生成有活性的IL-1β和IL-18并释放到细胞外,启动炎症相关的细胞程序性死亡[8],参与肿瘤细胞的增殖、分化,在肿瘤的发生发展中发挥关键作用[9]。本研究利用高糖培养基模拟高血糖微环境,以特异性PPAR-γ激活剂罗格列酮和NLRP3炎症小体激动剂尼日利亚菌素钠盐(Nigericin sodium salt,NSS)处理人大细胞肺癌NCI-H460细胞,探究PPAR-γ对高糖微环境下NCI-H460细胞增殖的影响,探讨高糖微环境下肺癌发生发展的分子机制,为肺癌的精准诊疗提供新的靶点和思路。
1 材料与方法
1.1 材料
人大细胞肺癌NCI-H460细胞(中科院上海细胞库),1640培养基[以色列Biological Industries(BI)公司],胎牛血清(美国Hyclone公司),CCK-8试剂盒(美国Abbkine公司),葡萄糖、甘露醇、DMSO(美国Sigma公司),罗格列酮(美国MCE公司),NSS(美国GLPBIO公司),BCA蛋白浓度检测试剂盒(中国碧云天生物技术有限公司),NLRP3抗体、caspase-1抗体(美国Abcam公司),IL-1β抗体、IL-18抗体(美国Abbkine公司),PPAR-γ抗体、GAPDH抗体(美国Proteintech公司)。
1.2 方法
1.2.1 细胞培养及分组:用含10%胎牛血清的1640培养基,在37 ℃、5% CO2培养箱中培养NCI-H460细胞。待细胞生长至80%~90%后,0.5%胰蛋白酶消化,按1 ∶2传代培养。分别用5.5 mmol/L葡萄糖(空白组)、5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇(高渗对照组)和30 mmol/L 葡萄糖(高糖组)培养基处理NCI-H460细胞,用终浓度为20 μmol/L的罗格列酮或终浓度为10 μmol/L NSS处理细胞作为实验组,加入等量的DMSO作为对照组。
1.2.2 CCK-8法测定细胞增殖能力:收集各组NCI-H460细胞,并制成单细胞悬液,以2×103/孔接种于96孔板中,每孔加入100 μL培养液,培养箱中继续培养(0、24、48、72 h),加入CCK-8溶液10 μL/孔,在培养箱中继续孵育1 h,利用多功能酶标仪测定450 nm波长处的吸光度(optical density,OD)值,并绘制细胞生长曲线。
1.2.3 平板克隆形成实验:各组NCI-H460细胞处理后,胰蛋白酶消化制成细胞悬液,以2×103/孔接种于6孔板中,反复吹打并摇匀,使细胞均匀分散,继续培养至>50个细胞/集落,4%多聚甲醛固定细胞15 min,0.1%结晶紫染色30 min,显微镜下计数并分析集落形成数。
1.2.4 Western blotting:各组NCI-H460细胞处理后,RIPA常规提取细胞总蛋白,按照BCA蛋白浓度测定试剂盒说明书测定蛋白浓度。蛋白充分变性,取30 μg行SDS-聚丙烯酰胺凝胶电泳分离蛋白,100 V 50 min转印至PVDF膜上,5%脱脂奶粉室温封闭1 h,加入NLRP3抗体、caspase-1抗体、IL-18抗体、IL-1β抗体、PPAR-γ抗体(1 ∶1 000稀释)及GAPDH抗体(1 ∶2 000稀释),4 ℃孵育过夜,TBST洗膜,相应二抗(1 ∶5 000稀释)室温孵育1 h,TBST洗膜后,ECL发光,Bio-rad凝胶成像分析仪扫描分析蛋白丰度。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。实验数据均由3次独立实验结果的±s表示,采用单因素方差分析或t检验比较。P<0.05为差异有统计学意义。
2 结果
2.1 高糖微环境对NCI-H460细胞增殖的影响
CCK-8及平板克隆形成实验结果显示,与空白组和高渗对照组相比,30 mmol/L高糖处理72 h并培养24 h后,高糖组NCI-H460细胞OD值显著升高(图1A),克隆形成体积更大、数量更多(图1B),差异均有统计学意义(均P<0.05),说明高糖微环境能够提高人大细胞肺癌NCI-H460细胞的增殖能力。
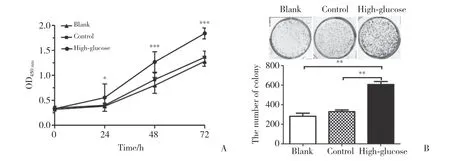
图1 高糖微环境对人大细胞肺癌NCI-H460细胞增殖的影响Fig.1 The effect of high-glucose microenvironment on proliferation of human large cell lung cancer NCI-H460 cell
2.2 高糖微环境对NCI-H460细胞炎症小体的影响
Western blotting结果显示,与空白组和高渗对照组比较,30 mmol/L高糖处理72 h后,高糖组NLRP3、caspase-1及活性IL-18、IL-1β表达均显著升高,差异均有统计学意义(均P<0.05),提示高糖微环境能够诱导NLRP3炎症小体活性升高。见图2。
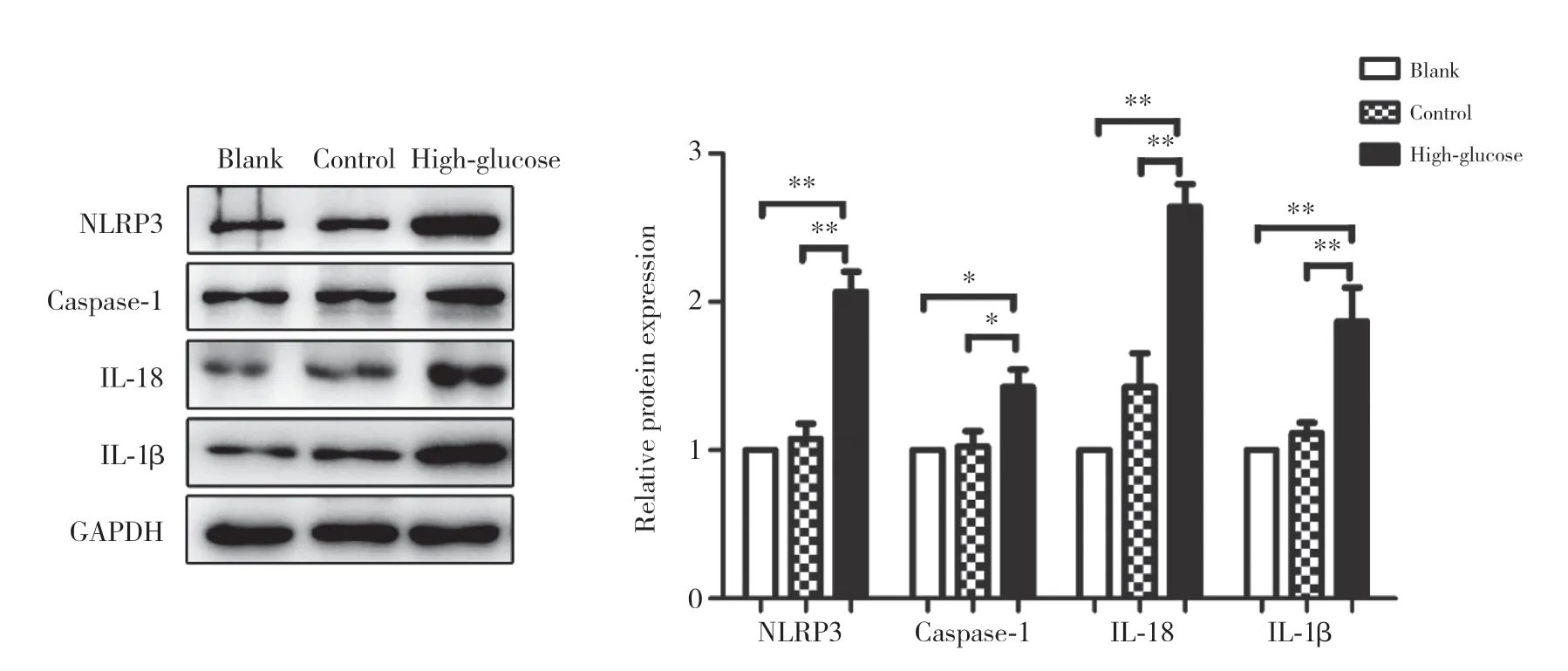
图2 高糖微环境对人大细胞肺癌NCI-H460细胞炎症小体的影响Fig.2 The effect of high-glucose microenvironment on NLRP3 inflammasome of human large cell lung cancer NCI-H460 cell
2.3 高糖微环境对NCI-H460细胞PPAR-γ蛋白表达的影响
Western blotting结果显示,与空白组和高渗对照组相比,30 mmol/L高糖处理72 h后,PPAR-γ蛋白表达显著下调,差异均有统计学意义(均P<0.05),提示高糖微环境可能通过PPAR-γ调控NLRP3炎症小体的活性。见图3。
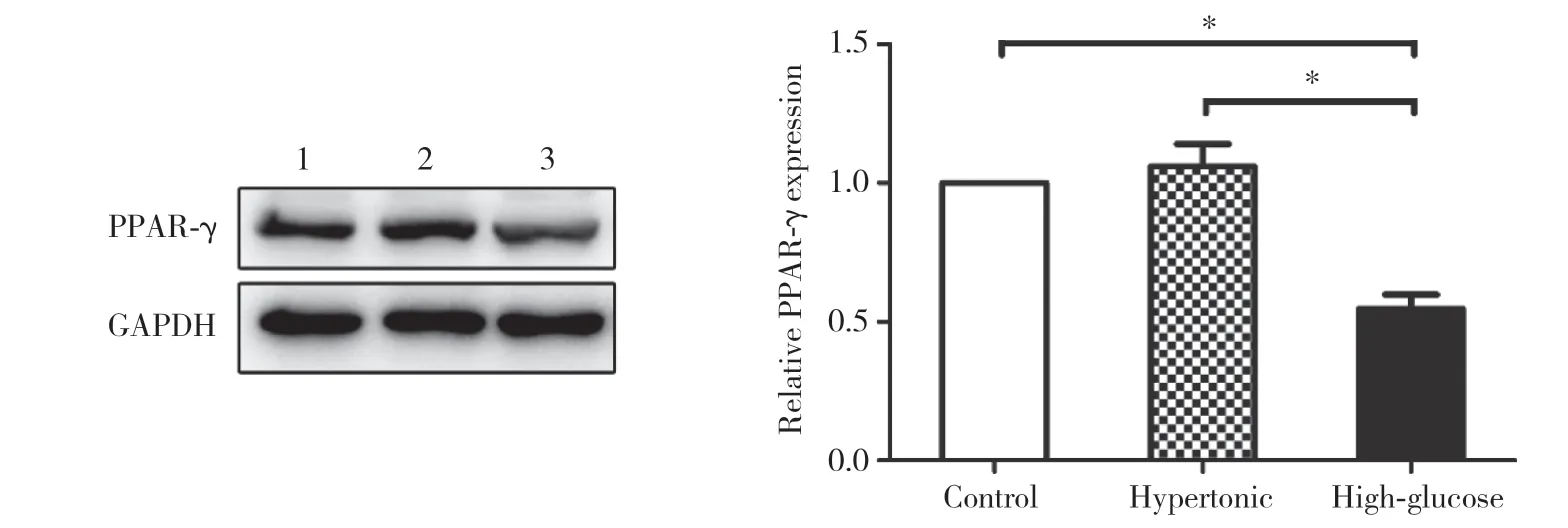
图3 高糖微环境对人大细胞肺癌NCI-H460细胞PPAR-γ蛋白的影响Fig.3 The effect of high-glucose microenvironment on PPAR-γ protein of human large cell lung cancer NCI-H460 cell
2.4 罗格列酮对高糖微环境下NCI-H460细胞炎症小体的影响
用特异性PPAR-γ激活剂罗格列酮刺激高糖微环境下的NCI-H460细胞,分析NLRP3炎症小体相关蛋白表达情况,结果显示,在高糖微环境下罗格列酮能够显著下调NLRP3炎症小体相关蛋白的表达,差异均有统计学意义(P均<0.05),提示PPAR-γ能有效抑制NLRP3炎症小体的活性。见图4。
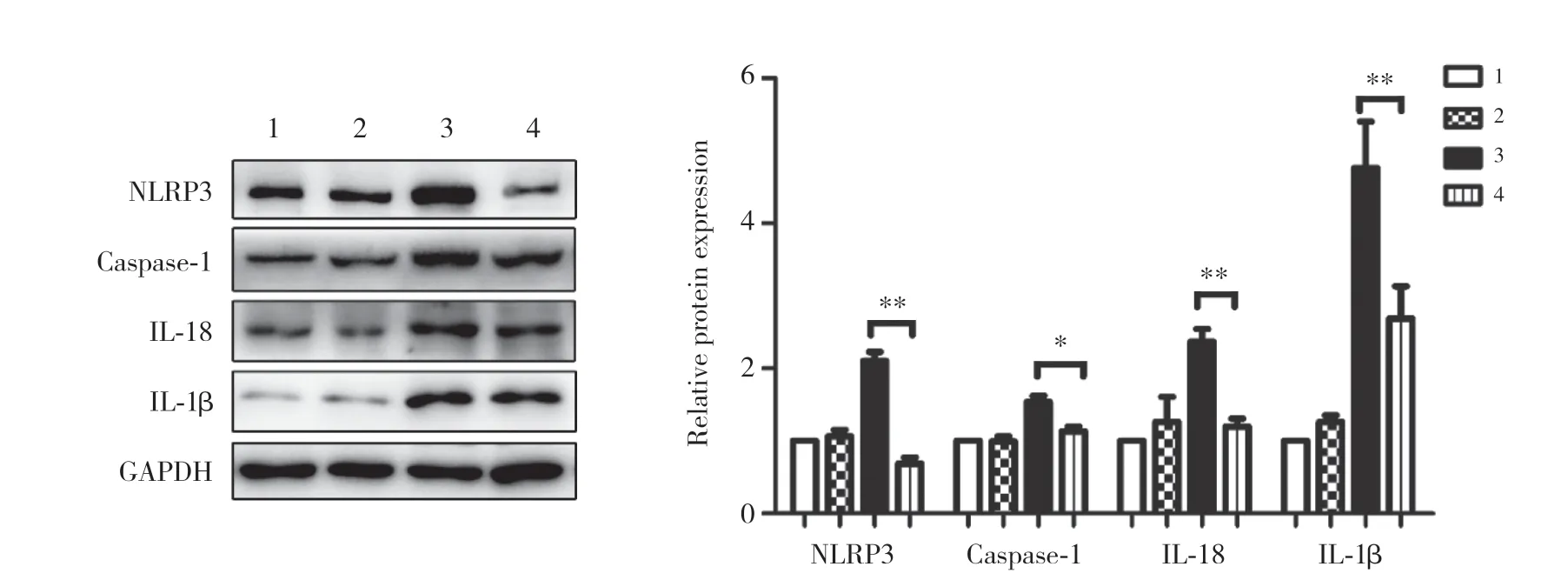
图4 罗格列酮对高糖微环境下人大细胞肺癌NCI-H460细胞炎症小体的影响Fig.4 The effect of rosiglitazone on NLRP3 inflammasome of human large cell lung cancer NCI-H460 cell in high-glucose microenvironment
2.5 罗格列酮对高糖微环境下NCI-H460细胞增殖的影响
利用CCK-8细胞增殖检测试剂盒和平板克隆技术分析高糖微环境下PPAR-γ对NCI-H460细胞增殖能力的影响,结果显示,与高糖组相比,30 mmol/L高糖+PPAR-γ处理72 h后,NCI-H460细胞OD值在48 h后显著降低(图5A),克隆形成体积更小、数量更少(图5B),差异均有统计学意义(P均<0.01),说明PPAR-γ能够抑制高糖微环境下NCI-H460细胞的增殖。
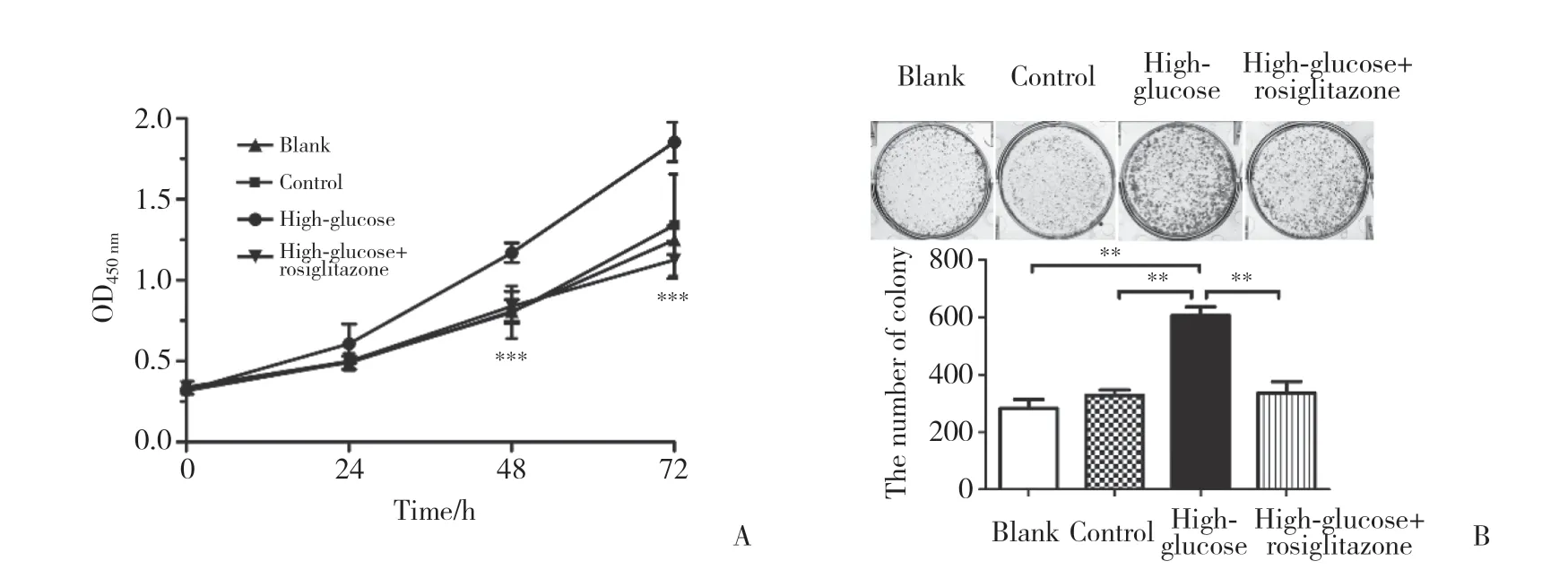
图5 罗格列酮对高糖微环境下人大细胞肺癌NCI-H460细胞增殖的影响Fig.5 The effect of rosiglitazone on proliferation of human large cell lung cancer NCI-H460 cell in high-glucose microenvironment
2.6 PPAR-γ通过抑制NLRP3炎症小体影响高糖微环境下NCI-H460细胞增殖
应用NLRP3炎症小体激动剂NSS联合罗格列酮处理30 mmol/L高糖培养的NCI-H460细胞并分析细胞增殖情况,结果显示,与30 mmol/L高糖+PPAR-γ组相比,高糖+PPAR-γ+NSS组NCI-H460细胞OD值在48 h后显著升高,形成克隆体积更大、数量更多,差异均有统计学意义(P均<0.05)。提示NLRP3炎症小体激动剂NSS能逆转高糖微环境下PPAR-γ对NCI-H460细胞增殖的抑制作用。见图6。
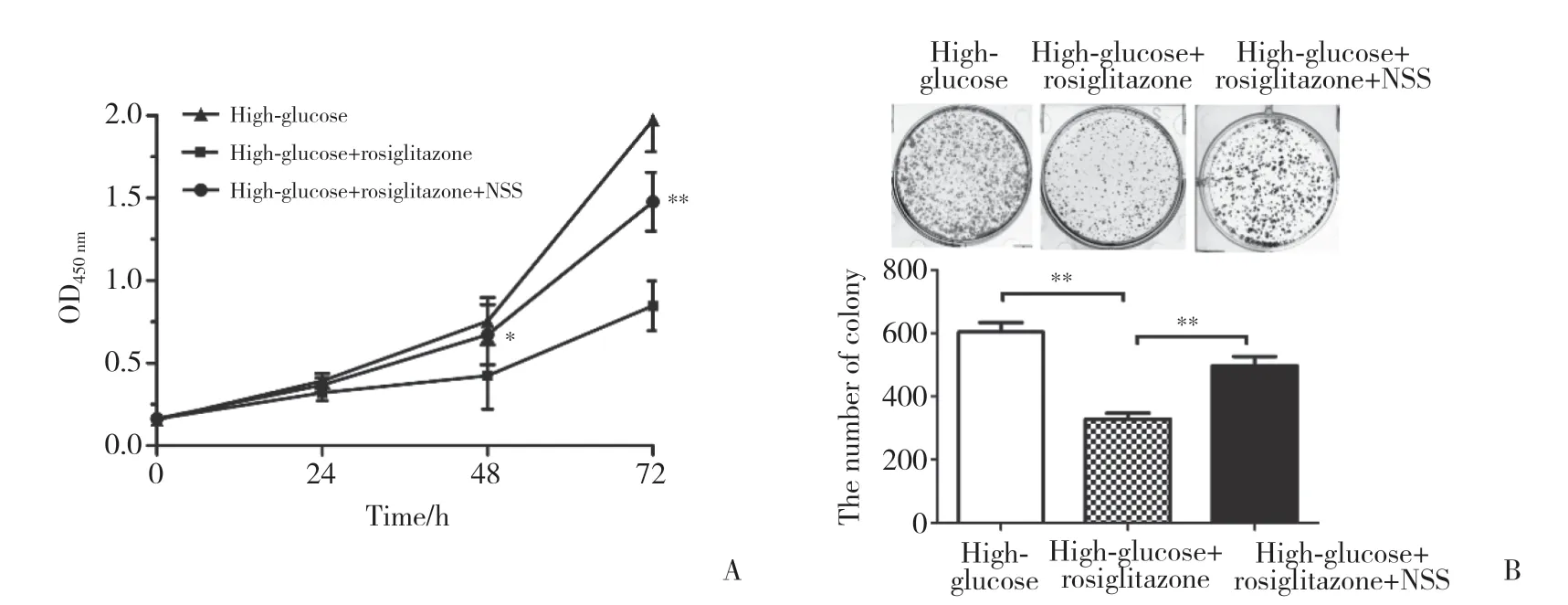
图6 NLRP3炎症小体介导PPAR-γ在高糖微环境下抑制NCI-H460细胞增殖Fig.6 NLRP3 inflammasome mediates inhibition of PPAR-γ on the proliferation of NCI-H460 cells in high-glucose microenvironment
3 讨论
研究[10-12]表明,血糖升高与肿瘤的发病风险、病情进展及预后密切相关。目前普遍认为,高血糖、高胰岛素血症、慢性炎症、脂质代谢紊乱及性激素水平异常可能是糖尿病患者肿瘤高发的主要危险因素,然而其分子机制尚不明确。因此,积极寻找有效的生物学靶点,对避免肿瘤发生、延缓肿瘤发展、辅助肿瘤治疗具有重要的临床意义。
葡萄糖是肿瘤生长的能量来源,本研究利用高糖(30 mmol/L葡萄糖)培养基模拟体内高血糖微环境处理人大细胞肺癌NCI-H460细胞,结果发现,高糖微环境可显著增强NCI-H460细胞的增殖能力。研究[13]表明,糖尿病可能通过多种机制影响肿瘤进展,并可能成为肺癌预后不良的危险因素[14],其中,炎症是最重要的机制之一。炎症和持续性感染可能导致各种恶性肿瘤的发生[15-16],越来越多的证据表明炎症在肿瘤的发生、发展、血管生成和侵袭中发挥着重要的作用[17-18]。NLRP3炎症小体与炎症性疾病、代谢性疾病、自身免疫性疾病及肿瘤等的发生密切相关。NLRP3炎症小体的效应分子IL-1β和IL-18参与肿瘤细胞的增殖、分化,在肿瘤的发生、发展中发挥关键作用。本研究发现,高糖微环境可显著提高NLRP3炎症小体相关蛋白如NLRP3、caspase-1、IL-1β和IL-18的表达,提示高糖微环境下炎症小体被激活,可能参与了高糖微环境对肿瘤的影响。
高糖微环境下,肿瘤细胞增殖旺盛,合理降糖对肺癌的治疗具有重要的意义。研究发现,胰岛素可促进肿瘤细胞增殖和分化,并引起化疗耐药,而治疗2型糖尿病的一线口服药物PPAR-γ配体激动剂罗格列酮不仅能够有效降低血糖,同时还具有抗肿瘤作用。PPAR-γ具有抑制肿瘤细胞增殖、血管生成等抗肿瘤作用,可降低肿瘤的发病率和死亡率,但具体分子机制尚不清楚[19]。在晚期前列腺癌、卵巢癌、前列腺癌和睾丸癌等肿瘤中,PPAR-γ表达水平较高[20-23],但高水平PPAR-γ在肿瘤发生发展中的作用尚不清楚。临床研究[24]发现,高PPAR-γ水平对结肠癌、宫颈癌、滤泡性甲状腺癌和食道癌预后有益。体外研究[24-26]发现,PPAR-γ过表达能抑制肿瘤细胞增殖和肿瘤生长,而沉默PPARγ则逆转该效应。研究表明,PPAR-γ天然配体15-脱氧-Δ-前列腺素 J2(15-deoxy-Δ-prostaglandin J2,15d-PGJ2)可通过抑制NF-κB诱导肿瘤细胞凋亡。合成的PPAR-γ配体,如阿格列酮、曲格列酮和西格列酮,可通过诱导肿瘤细胞凋亡抑制肿瘤生长[23]。此外,西格列酮能够提高顺铂对卵巢癌的治疗效果。本研究发现,高糖微环境下PPAR-γ蛋白表达显著下调。PPAR-γ通过抑制NLRP3炎症小体活性发挥抗炎作用,为了明确PPAR-γ是否通过NLRP3炎症小体影响高糖微环境下肺癌细胞的增殖能力,本研究利用PPAR-γ激活剂罗格列酮处理高糖微环境下NCI-H460细胞,结果发现,罗格列酮能有效抑制NLRP3炎症小体的活性、下调NCI-H460细胞的增殖能力,而这一作用可被NLRP3炎症小体激动剂逆转。以上结果提示,在高糖微环境下,PPAR-γ通过下调NLRP3炎症小体,抑制NCI-H460细胞增殖。
综上所述,本研究利用30 mmol/L葡萄糖处理人大细胞肺癌NCI-H460细胞,探讨高糖微环境下肺癌发生发展的分子机制。结果显示,PPAR-γ通过抑制NLRP3炎症小体活性,减少高糖微环境下NCI-H460细胞的增殖,从而发挥抗肿瘤的作用。以上结果为指导肺癌合并糖尿病患者的治疗奠定了理论基础。
