襄阳地区高温大曲真菌群落结构及其风味品质解析
2024-01-03向凡舒蔡文超田龙新刘菊珍周加平叶明波单春会壮1
向凡舒,蔡文超,田龙新,刘菊珍,周加平,叶明波,单春会,郭 壮1,,
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.襄阳市酱香型白酒固态发酵企校联合创新中心,湖北 襄阳 441053;3.石河子大学食品学院,新疆 石河子 832000;4.酱香型白酒固态发酵襄阳市重点实验室,湖北 襄阳 441053;5.湖北东方明珠酒业有限责任公司,湖北 襄阳 441053)
我国白酒种类众多,包括酱香、浓香和清香等12 种香型的白酒,不同香型白酒所用酒曲的类型亦有所不同[1]。正所谓“曲乃酒之骨”,酒曲通过提供丰富的微生物及酶系推动了白酒的发酵过程[2]。酱香型白酒作为香味最丰富的白酒,其不仅酿造工艺复杂,所使用的高温大曲亦较为特殊[3]。相较于其他酒曲,高温大曲培菌阶段的温度最高,可达60~70 ℃[4]。较高的发酵温度可能使高温大曲中富集较为特殊的微生物群,又或使微生物在极端环境下的代谢产物较为特殊,最终赋予了高温大曲较为独特的风味品质[5]。此外,高温大曲在白酒酿造过程中的投入量较大,与粮食的投入比例相当,因而它可能也为酱香型白酒提供了香味基底,其自身的风味品质不容忽视[4]。然而,由于受到排列方式和发酵热的影响,曲房温度会在空间尺度上有一定的波动,这使得排列在不同位置的高温大曲其微生物类群和品质在空间尺度上亦会出现波动,外观上通常出现白色、黄色和黑色3 种颜色[4]。白色高温大曲通常产生于靠门窗和墙壁等温度相对较低的位置,黄色高温大曲通常均匀分布在大曲堆中,而黑色高温大曲通常产生于温度相对较高的大曲堆中部[6]。目前,已有许多研究人员从理化性质、微生物类群及感官特性等方面对不同颜色高温大曲展开了研究,结果表明3 种颜色高温大曲在以上方面均存在显著差异[7-9]。此外,不同企业生产的高温大曲微生物群落结构亦存在较大差异。例如贵州茅台高温大曲中的微生物主要以芽孢杆菌属(Bacillus)和曲霉菌属(Aspergillus)为主,四川古蔺郎酒高温大曲中却不含有Bacillus,安徽古井贡酒的高温大曲中真菌主要以嗜热真菌属(Thermomyces)为主[10-12]。上述研究结果表明温度差异和生产工艺的不同可能均是影响高温大曲微生物群落结构的因素,而以往研究大多只关注到了其中的一个方面。此外,作为酱香型白酒的新产区之一,湖北襄阳地区生产的高温大曲在上述方面的研究还尚少。
以MiSeq高通量测序为代表的第二代测序技术,在实现快速全面分析和降低实验成本方面具有显著优势,目前也作为解析酿酒微生物类群的常用技术手段之一。例如使用该技术对低温大曲微生物类群进行解析时,Cai Wenchao等[13]发现红心曲的细菌丰度和多样性最高,而清茬曲真菌丰度和多样性较高;Huang Zirui等[14]使用该技术解析了不同种类的米酒曲,结果发现红曲和白曲中的细菌和真菌类群存在显著不同。由此可见,MiSeq高通量测序技术在解析不同分组样品间微生物类群差异方面亦合适。电子鼻是利用电子传感器识别食物香气的设备,它能够识别芳香类物质、烷烃类、萜类和有机硫化物等挥发性香气成分大类,不需要分离和识别具体的挥发性化合物类别[15]。因而该技术具有操作简单、检测快速和无需特殊的样品前处理等优点,是替代耗时且昂贵的色谱分析方法的合适方案,目前已广泛应用于食品、饮料和医药保健领域,例如Viejo等[16-17]使用该技术有效识别了不同咖啡和啤酒的香气特征和强度。
本研究首先采用MiSeq高通量测序技术与电子鼻技术对比分析襄阳地区A企业生产的3 种颜色高温大曲真菌类群及其挥发性香气成分;然后从MG-RAST数据库中下载B企业高温大曲的真菌序列数据,并对两个企业生产的不同颜色高温大曲真菌群落结构进行合并分析;最后采用纯培养法对其中的酵母菌菌株进行分离鉴定。本研究旨在为当地酱香型白酒企业生产的高温大曲风味品质提供数字化评价,为其配曲工艺的提升以及智能化制曲应用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)合成培养基 中国医药集团有限公司;Neasy mericon Food Kit DNA基因组提取试剂盒 德国QIAGEN公司;TaqDNA聚合酶和T载,正/反向引物ITS3F/ITS4R(ITS3F:5′-GCATCGATGAAGAACGCAGC-3′;ITS4R:5′-TCCTCCGCTTATTGATATGC-3′)和引物26S1/26S2(引物26S1:5′-GCATATCAATAAGCGGAGGAAAAG-3′;引物26S2:5′-GGTCCGTGTTTCAAGACGG-3′)上海桑尼生物科技有限公司;Illumina MiSeq测序试剂盒v3美国Illumina公司。
1.2 仪器与设备
Vetiri聚合酶链式反应(polymerase chain reaction,PCR)梯度基因扩增仪 美国AB公司;MiSeq PE300高通量测序平台 美国Illumina公司;R930机架式服务器美国DELL公司;PEN3电子鼻(配备8 个传感器)德国Airsense公司;ECLIPSE Ci生物显微镜 日本Nikon公司。
1.3 方法
1.3.1 样品收集
本研究于2022 年8 月从湖北省襄阳市(E 110°45′~113°06′,N 31°13′~32°37′)生产酱香型白酒的A企业采集到高温大曲样品30 份,其中白色、黄色和黑色高温大曲(以下分别简称为白曲、黄曲和黑曲)各10 份,分别编号为W1~10、Y1~10和B1~10。所有样本均由A企业同一批次生产,且储存于同一库房中。采样时首先根据大曲堆的高度将大曲堆均分成上中下3 层,然后每种颜色高温大曲从上层和下层的不同位置分别随机选取3 块,从中间层的不同位置随机选取4 块[6]。将采集到的大曲块装入无菌自封袋后在常温下运送回实验室,并在实验室条件下将曲块打碎至粉末状后置于-80 ℃,以便用于后续提取宏基因组DNA、电子鼻上机检测和酵母菌菌株分离鉴定。此前,已有研究人员对襄阳地区B企业生产的高温大曲微生物类群展开了分析[9]。因而本研究从MG-RAST数据库中下载了B企业高温大曲的真菌序列数据,以探讨不同企业生产的高温大曲真菌群落结构差异。两个企业在生产高温大曲时使用的曲模规格、翻曲时间节点和培养温度等工艺参数均有所差异(图1)。
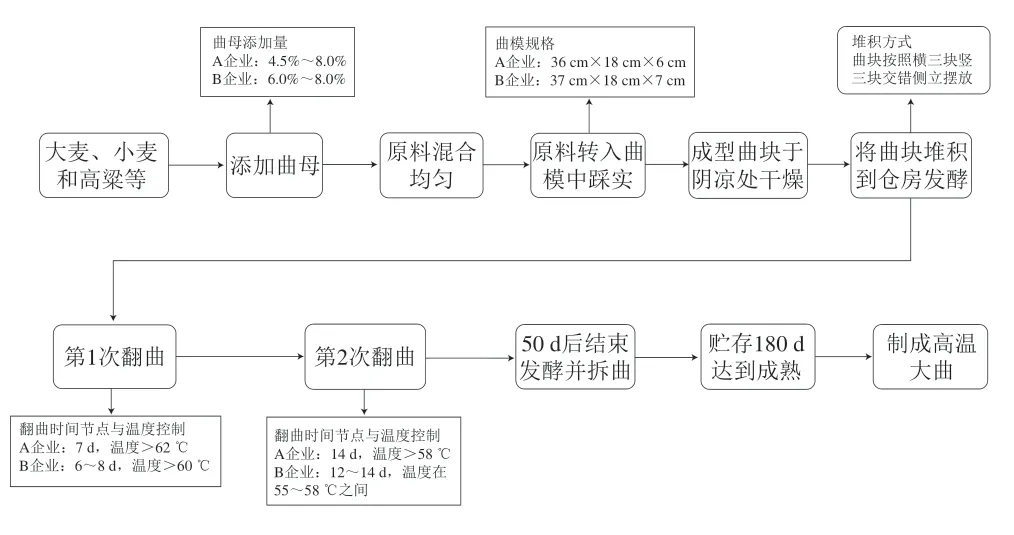
图1 高温大曲制曲流程图Fig.1 Flow chart of high-temperature Daqu production
1.3.2 宏基因组DNA提取、PCR扩增及测序
高温大曲样品的宏基因组参照DNA试剂盒中提供的方法进行提取,参照姚衡斌等[18]的方法使用引物ITS3F/ITS4R(含有核苷酸标签)对真菌内源转录间隔区(internally transcribed spacer,ITS)2区进行PCR扩增并纯化PCR产物,纯化后的PCR产物寄至上海美吉生物医药科技有限公司完成高通量测序。
1.3.3 生物信息学分析
本研究通过高通量测序获得的序列数据均基于QIIME(v 1.9.0)平台完成生物信息学分析。首先使用PyNAST软件根据核苷酸标签信息将下机数据进行拆分和归并至各样品,继而使用FLASH(v 1.2.7)软件对双端序列进行拼接[19],参照Caporaso等[20]提出的标准对序列进行质控,得到的高质量序列依据97%序列相似度进行分类操作单元(operational taxonomic units,OTU)的构建[21],并采用Chimera Slayer软件去除嵌合体OTU[22],基于Unite(v 7.2)数据库完成真菌物种信息注释[23]。此外,真菌发现物种数和Shannon指数等α多样性指数以及基于非加权和加权OTU的UniFrac距离主坐标分析(principal coordinate analysis,PCoA)均依靠QIIME(v 1.9.0)平台完成计算,最后使用线性判别分析(linear discriminant analysis,LDA)Effect Size(LEfSe)甄别不同企业生产的高温大曲真菌标志物。
1.3.4 基于电子鼻技术高温大曲气味指标分析
每份样品均称取8.0 g于电子鼻检测顶空瓶中,装样的顶空瓶于45 ℃条件下水浴10 min后进行顶空进样,每份样品均设置3 组平行实验。进样条件参照Huang Minzheng等[24]的方法进行设置,选取49、50 s和51 s传感器响应值的平均值作为后续分析数据。
1.3.5 酵母菌菌株的分离与鉴定
称取10.0 g高温大曲粉加入至90 mL无菌生理盐水(内含10~15 颗玻璃珠)中,在28 ℃摇床中振荡30 min后进行10 倍系列梯度稀释,选择10-2~10-5梯度稀释液涂布至PDA平板中,在28 ℃条件下培养3~5 d。培养结束后挑取平板上的单菌落进行纯化,已纯化的菌株采用甘油保藏法将其保藏于-80 ℃。参照徐文欢等[25]的方法提取基因组DNA并对真菌26S rRNA进行PCR扩增和产物纯化。纯化后的PCR产物被送至上海桑尼生物科技有限公司完成测序,测序返回的序列在NCBI网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对。
1.4 数据处理与分析
采用R软件(v 4.1.2)绘制小提琴图和PCoA图分别对高温大曲真菌α多样性和β多样性数据进行可视化;采用R软件(v 4.1.2)绘制气泡图对优势真菌类群数据进行可视化;使用Origin 2021软件绘制多因子箱型图对电子鼻检测数据进行可视化,同时采用SAS(v 8)软件计算优势真菌属与气味指标之间的相关性,并采用R软件(v 4.1.2)绘制相关性热图;利用在线作图网站(http://huttenhower.sph.harvard.edu/galaxy/)绘制LEfSe图;使用R软件(v 4.1.2)绘制upset图和瀑布图对各样品中的OTU数量进行统计。使用MAGE7软件构建分离株系统发育树;使用Past3软件中的Mann-Whitney和Kruskal-Wallis检验法评估不同组数据间的差异显著性。
2 结果与分析
2.1 3 种颜色高温大曲真菌群落结构的比较分析
经高通量测序共得到1 952 058 条序列,过滤掉低质量和嵌合体序列共33 041 条后,余下1 919 017 条有效序列,有效序列按97%序列相似度归并得到8 689 个OTU,平均每个样品含有63 595 条有效序列和2 150 个OTU。通过计算α多样性指数发现,白曲、黄曲和黑曲的平均发现物种数分别为1 824、1 944和1 719,平均Shannon指数分别为5.67、5.40和4.94(图2a、b)。经Kruskal-Wallis检验和Mann-Whitney检验发现,3 种颜色高温大曲间亦或是任意两种颜色高温大曲间的发现物种数和Shannon指数均不存在显著差异(P>0.05),这表明3 种颜色高温大曲间的真菌丰富度和多样性差异均不显著。基于非加权OTU的UniFrac距离PCoA显示3 种颜色高温大曲的95%置信区间均有重叠,且白曲和黄曲的95%置信区间完全重叠(图2c)。此外,在基于加权OTU的UniFrac距离PCoA中,3 种颜色高温大曲的95%置信区间亦出现较多重叠区域,且白曲和黑曲的95%置信区间完全重叠(图2d),这表明不管考虑物种丰度与否,3 种颜色高温大曲间真菌群落结构均无明显差异。由此可见,3 种颜色高温大曲的真菌α多样性和β多样性均较为相似。
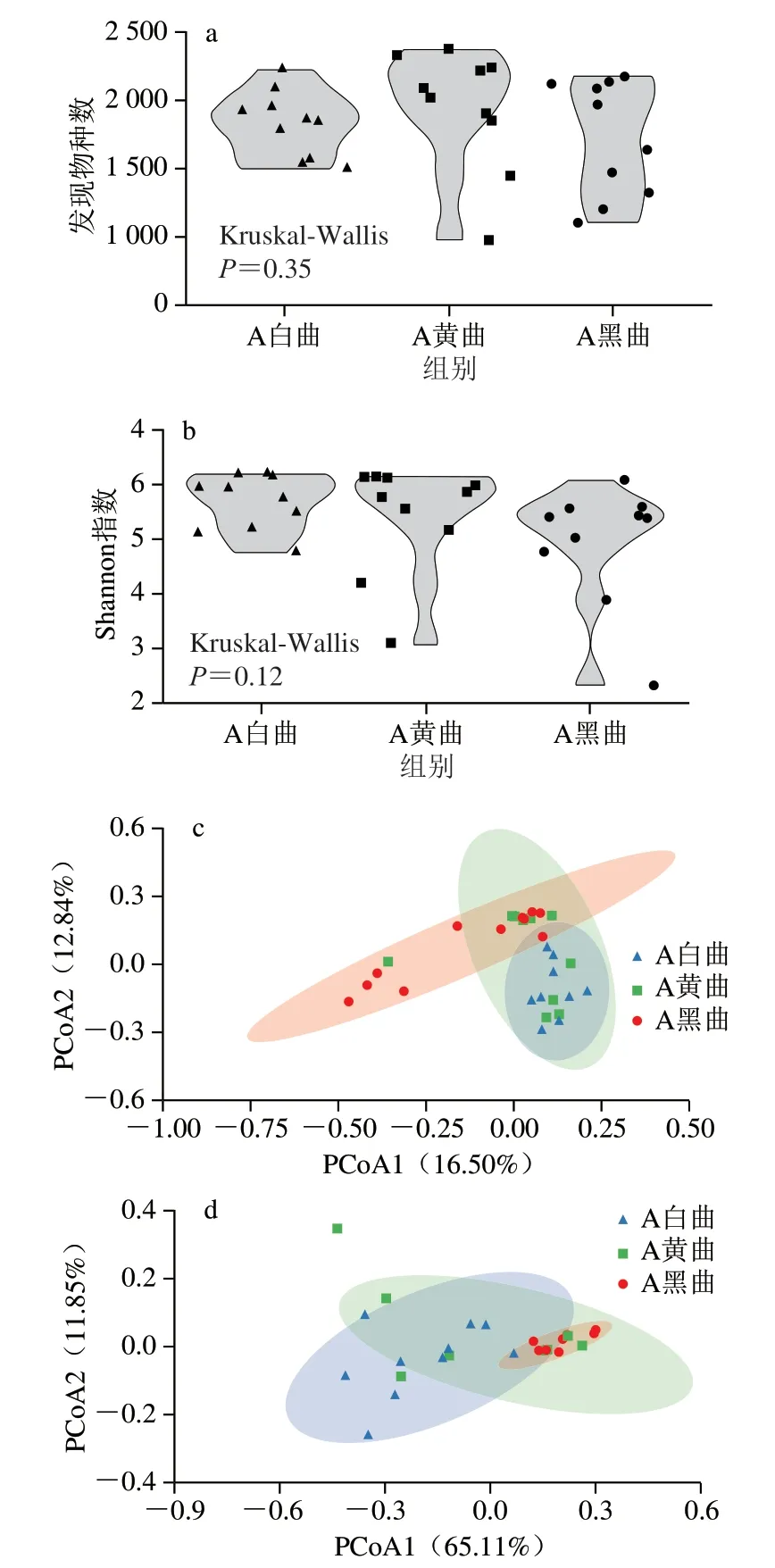
图2 不同颜色高温大曲真菌发现物种数(a)、Shannon指数(b)、非加权OTU的UniFrac距离(c)和加权OTU的UniFrac距离(d)PCoAFig.2 Observed species index (a),Shannon index (b) and PCoA plots of UniFrac distance based on unweighted OTU (c) and weighted OTU (d) of different colored high-temperature Daqu
2.2 3 种颜色高温大曲的真菌类群解析
测序获得的所有有效序列经Unite数据库比对后共鉴定到6 个门、14 个纲、26 个目、44 个科和71 个属,其中平均相对含量>1.0%的门和属被定义为优势门和属。本研究进一步从优势门和属水平上分别解析了3 种颜色高温大曲中的真菌类群。所有高温大曲样品中共有2 个优势门,分别为子囊菌门(Ascomycota,96.67%)和毛霉菌门(Mucoromycota,2.55%)(图3a)。经Kruskal-Wallis检验发现,3 种颜色高温大曲在2 个优势门的相对含量上均存在显著差异,主要表现为黄曲和黑曲中的Ascomycota相对含量显著高于白曲,而Mucoromycota相对含量则相反(P<0.05)。所有样品共含有7 个优势属,分别为隶属于Ascomycota的嗜热丝孢菌属(Thermomyces,36.50%)、嗜热子囊菌属(Thermoascus,27.15%)、酵母菌属(Saccharomycopsis,9.23%)和双足囊菌属(Dipodascus,1.19%);隶属于Mucoromycota的曲霉属(Aspergillus,9.36%)、根霉菌属(Rhizopus,1.44%)和毛霉菌属(Rhizomucor,1.03%)(图3b)。经Kruskal-Wallis检验发现,3 种颜色高温大曲在Saccharomycopsis、Rhizopus、Dipodascus和Rhizomucor的相对含量上存在高度显著差异(P<0.001),且这些优势属在黑曲中的相对含量显著偏低(P<0.05)。由此可见,尽管3 种颜色高温大曲的真菌群落结构较为相似,但它们在各个优势门和属的相对含量分布上仍表现出了较大差异。
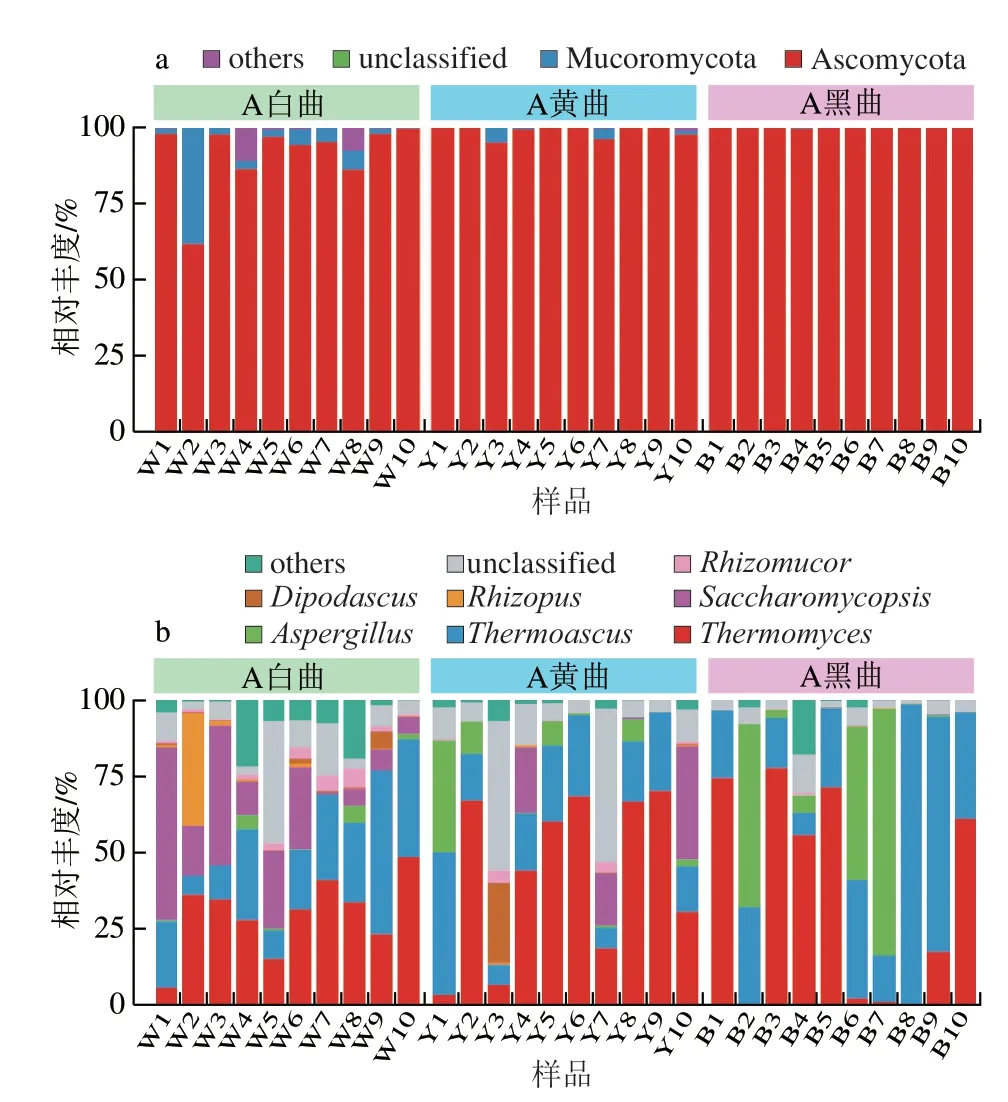
图3 高温大曲优势真菌门(a)和真菌属(b)相对含量分析Fig.3 Relative abundance of the dominant fungal phyla (a) and genera (b) in high-temperature Daqu
2.3 基于电子鼻技术高温大曲气味品质解析
本研究进一步利用电子鼻传感器W1C(对芳香类物质灵敏)、W3C(对芳香类物质灵敏)、W6S(对氢气有选择性)、W5C(对芳香类物质灵敏)、W3S(对烷烃类物质灵敏)、W5S(对氢氧化物灵敏)、W1W(对有机硫化物、萜类物质灵敏)和W2S(对乙醇灵敏)对其中的挥发性风味物质进行检测。结果显示传感器W1W对高温大曲的响应值最高,传感器W5S、W2S、W3S和W6S次之,而传感器W5C、W3C和W1C响应值均较低(图4a、b)。这表明A企业生产的高温大曲中有机硫化物、萜类物质、氢氧化物、乙醇和烷烃类物质含量相对较高。此外,除了传感器W3S以外,其他传感器对3 种颜色高温大曲中的响应值间均存在显著差异(P<0.05)(图4a、b)。值得注意的是,对芳香类物质灵敏的WC传感器(W5C、W3C和W1C)对黄曲的响应值均显著高于黑曲(P<0.05),而传感器W1W、W5S和W2S则表现出相反的趋势。上述结果表明,相较于黑曲,黄曲中的挥发性芳香类物质含量显著偏高,而有机硫化物、萜类物质、氢氧化物和乙醇等含量显著偏低(P<0.05)。此外,绝大多数传感器对白曲的响应值大小均位于黄曲和黑曲之间,这表明黄曲的风味品质可能相对较优,白曲次之。本研究进一步计算了优势属与电子鼻传感器响应值之间的相关性(图4c)。结果显示,Rhizomucor与传感器W3C 响应值之间存在显著负相关关系(R=-0.409,P<0.05),而其他优势属与传感器响应值之间均未表现出显著相关关系。由此可见,高温大曲中的优势真菌与高温大曲气味指标间的关联性较弱。
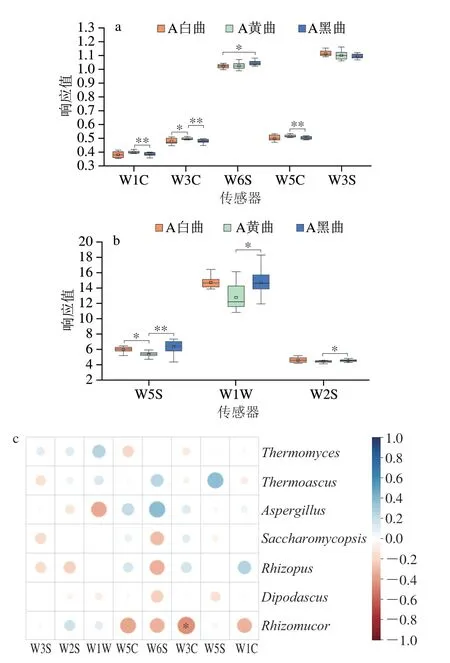
图4 3 种颜色高温大曲的气味指标(a、b)及其与优势真菌属间的相关性(c)分析Fig.4 Odor indicators (a) and their correlation with dominant fungal genera (b) in three colored high-temperature Daqu
2.4 不同企业高温大曲真菌群落结构比较分析
本研究从MG-RAST数据库中下载了襄阳地区B企业生产的30 份高温大曲(白色、黄色和黑色高温大曲各10 份)样品序列,进一步探究了不同企业生产的高温大曲真菌群落结构差异。结果显示,A企业和B企业高温大曲真菌的平均发现物种数分别为1 829和1 235,平均Shannon指数分别为5.44和4.76(图5a、b)。经Mann-Whitney检验发现A企业生产的高温大曲其平均发现物种数高度显著高于B企业(P<0.001),而Shannon指数极显著高于B企业(P<0.01),这表明A企业高温大曲其真菌丰富度和多样性均显著偏高(P<0.05)。基于非加权OTU的UniFrac距离PCoA亦显示出了A企业和B企业高温大曲样品点在空间结构上较明显的分离趋势。A企业高温大曲样品主要分布在2、4象限对角线的上半部分,而B企业高温大曲样品主要分布在2、4象限对角线的下半部分,且两个企业高温大曲样品的95%置信区间重叠区域较小,这表明不同企业生产的高温大曲真菌群落结构间差异较大(图5c)。此外,本研究进一步将不同颜色和不同企业生产两个因素同时考虑在内,采用马氏距离对两个企业生产的3 种颜色高温大曲展开了聚类分析(图5d)。结果显示,来源于同一企业的3 种颜色高温大曲距离更近,且B企业的样品均聚在了同一大分支上。此外,两个企业样品分支间的差异高度显著(P<0.001),这表明不同企业生产工艺上的差别对高温大曲真菌群落结构产生的影响较大。

图5 不同企业高温大曲真菌发现物种数(a)、Shannon指数(b)、基于非加权OTU的UniFrac距离PCoA(c)和马氏距离聚类分析(d)Fig.5 Observed species index (a),Shannon index (b),PCoA plot of UniFrac distance based on unweighted OTU (c),cluster analysis based on Euclidean distance (d) of fungal communities in high-temperature Daqu produced by different companies
本研究进一步通过LEfSe甄别了两个企业高温大曲各自的生物标志物。A企业高温大曲中的真菌标志物主要隶属于酵母菌纲(Saccharomycetes)和毛霉菌纲(Mucoromycetes)这两个分支,而B企业高温大曲中的真菌标志物主要隶属于散囊菌纲(Eurotiomycetes)分支(图6a)。当LDA得分大于3.5时,A企业高温大曲中含有7 个生物标志物,在属水平上的生物标志物为Saccharomycopsis;B企业高温大曲中含有5 个生物标志物,在属水平上的生物标志物为Aspergillus(图6b)。可见,相较于B企业,A企业高温大曲中Saccharomycopsis丰度较高,而Aspergillus丰度较低。
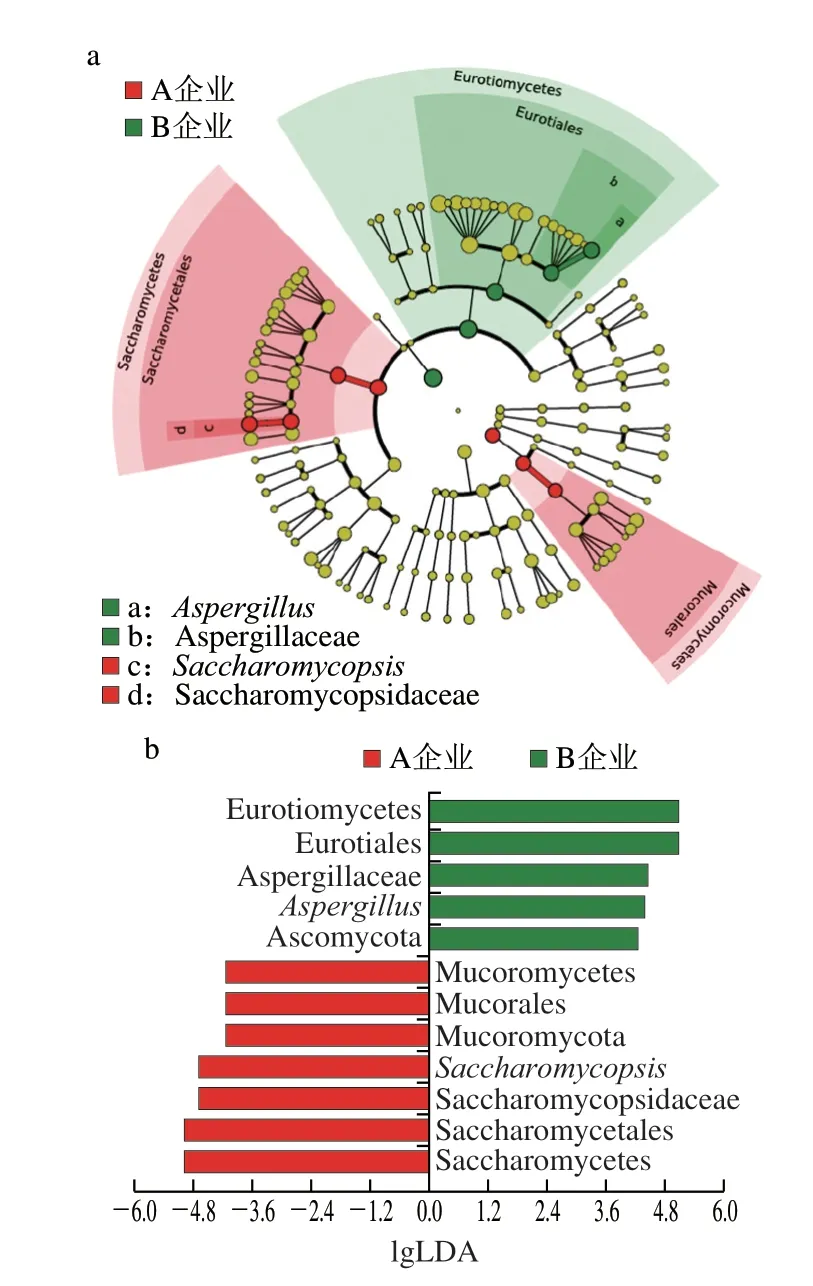
图6 不同企业高温大曲基于LEfSe分析的微生物群支系图(a)和LDA值分布柱状图(b)Fig.6 LEfSe analysis of fungal communities in high-temperature Daqu produced by different companies: clade diagram (a) and LDA value distribution (b)
2.5 基于OTU水平不同企业高温大曲核心真菌类群解析
本研究进一步从OTU水平上对两个企业高温大曲真菌群落结构进行了解析,并将仅出现在一个企业高温大曲中的OTU定义为该企业高温大曲中的特殊OTU,而将出现在每一份高温大曲(即60 份样品)中的OTU定义为核心OTU。OTU统计结果显示,A企业高温大曲中含有679 个独特OTU,B企业高温大曲中仅含有178 个独特OTU,而有2 001 个OTU在两个企业生产的高温大曲中均有出现,其中包含2 个核心OTU,即OTU 5907和OTU 10836,它们分别被鉴定为Thermomyces(23.53%)和Aspergillus(6.05%),占总OTU比例的29.58%(图7)。可见核心真菌类群主要由Thermomyces和Aspergillus组成。
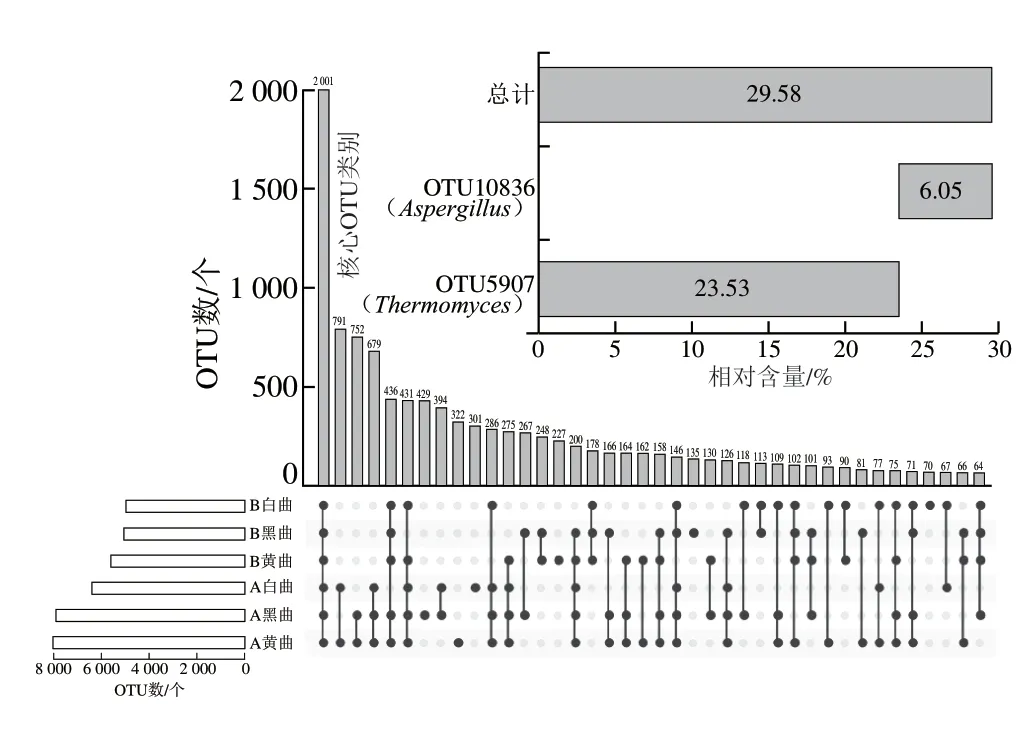
图7 基于OTU水平不同企业高温大曲的核心真菌类群解析Fig.7 Analysis of core fungal taxa in high-temperature Daqu from different companies based on OTU level
2.6 基于纯培养技术酵母菌的分离鉴定
酵母菌通常是酒曲中极为重要的一类能够发挥糖化作用和产酒精作用的微生物类群[26],因而本研究采用纯培养法对其中的可培养酵母菌进行了分离鉴定,以丰富大曲来源的酵母菌菌株,为后续筛选具有优良发酵特性的酵母菌菌株奠定基础。本研究共分离出4 株酵母菌分离株,其菌落形态均为白色,呈凸起状,且表面干燥;细胞形态呈不规则椭圆形或棒球形(图8a、b)。由系统发育树可知,4 株分离株与扣囊覆膜孢酵母(S.fibuligeraATCC36309)聚为一支(图8c),且它们的序列相似度均大于99.9%,因而分离株均被鉴定为S.fibuligera。

图8 酵母菌分离株的菌落形态(a)、细胞形态(b)及其系统发育树(c)Fig.8 Colony morphology (a),cell morphology (b) and phylogenetic tree (c) of yeast isolates
3 讨论与结论
本研究采用MiSeq高通量测序技术对湖北襄阳酱香型白酒A企业生产的3 种颜色高温大曲的真菌群落结构进行了比较分析。结果显示,3 种颜色高温大曲中真菌群落的丰富度和多样性均不存在显著差异(P>0.05),β多样性分析结果也显示3 种颜色高温大曲在空间排布上均有较大程度的重叠。这表明发酵过程中由空间异质性所引起的温度差异对高温大曲真菌群落结构影响较小,前人对该地区B企业高温大曲的研究结果与本研究结果相吻合[9]。然而,3 种颜色高温大曲的细菌群落结构对此所表现出的结果与真菌截然不同,它们之间往往存在显著差异[6]。值得注意的是,此前Zhou Qingfeng等[27]对低温大曲(顶温在40~50 ℃之间)、中温大曲(顶温在50~60 ℃之间)和高温大曲(顶温在60~70 ℃之间)的真菌群落结构进行了比较分析,结果表明上述3 种大曲的真菌群落结构之间存在显著差异。此外,在其他已有研究中还能发现Thermomyces含量在低温、中温和高温大曲中含量依次升高[13,28],这表明大曲中的真菌类群亦会受到发酵温度的影响,只是对温度波动的敏感度低于细菌。
物种注释结果显示Thermomyces、Thermoascus、Aspergillus和Saccharomycopsis等为主要的真菌类群,其中Saccharomycopsis中的部分菌种在酿酒领域的应用已十分广泛,例如酿酒酵母(S.cerevisiae)是常见的商业酿酒菌种[26,29]。Thermomyces和Thermoascus都属于嗜热菌群,它们在高温条件下仍具有优异的产酶特性,是高温大曲中不可或缺的微生物类群[30-32]。此外,Aspergillus中的A.niger不仅能够产酶,还能产柠檬酸,可在一定程度上为大曲增添风味物质[33-34]。通过电子鼻检测发现,A企业高温大曲中的挥发性有机硫化物、萜类、乙醇和烷烃类物质检测值相对较高,芳香类物质检测值较低。有趣的是,3个WC传感器(对芳香类物质敏感)对黄曲的响应值均极显著高于黑曲(P<0.01),而W1W(对有机硫化物、萜类物质敏感)等其他传感器对黄曲的响应值则显著低于黑曲(P<0.05)。挥发性有机硫化物具有低检测阈值和强烈的感官特性,是酒精饮料中的一类重要香气物质,但浓度较高时会产生类似洋葱和熟白菜等令人不愉快的香气[9,35]。这说明黄曲的风味品质相对较优,在酿造酱香型白酒时可适当提高它在3 种颜色高温大曲中的投入比例。相关性分析结果显示仅有Rhizomucor与传感器W3C响应值间存在显著负相关关系(P<0.05),其他优势真菌属与气味指标间均不存在显著相关关系。同样采用电子传感技术,Cai Wenchao等[9]针对B企业高温大曲的研究结果显示对芳香类物质灵敏的传感器在黑曲中的响应值最高,且优势真菌属与高温大曲气味指标间的相关性密切,这与本研究结果有明显不同。不过,Zhu Qi等[36]在甄别贵州地区高温大曲核心功能菌群时的结果与本研究较为相似,其研究结果显示细菌是产生挥发性香气成分的主要菌群,真菌与香气成分含量间存在的相关关系较少,且大多表现为负相关关系。这些研究结果的差异体现出不同企业高温大曲的微生物类群与其风味品质间的相关关系可能亦有所不同。此外,制曲过程中的高温发酵会促使大曲发生美拉德反应,其产物亦可能是高温大曲风味的主要来源之一[8]。可见,不同来源高温大曲中的微生物类群以及发酵过程中的美拉德反应对大曲风味品质形成所产生的贡献有所不同,这或许是不同企业生产的酱香型白酒风味特征各异的原因之一。
前人研究与本研究结果表明发酵过程中的温度波动对高温大曲真菌群落结构的影响较小,这与细菌群落结构对此呈现出的结果恰恰相反[6,9]。因而本研究进一步对同一地区不同企业生产的高温大曲真菌群落结构差异进行了解析,即探讨生产工艺上的差别是否会对真菌群落结构产生较大影响。α多样性分析结果显示,不同企业生产的高温大曲其真菌在丰富度和多样性上均存在极显著差异(P<0.01),且β多样性分析结果与α多样性结果相吻合。聚类分析显示同一企业生产的3 种颜色高温大曲间距离更近,这表明生产工艺的差异会对高温大曲真菌群落结构产生较大影响。LEfSe结果显示A企业高温大曲中的生物标志物主要为Saccharomycopsis;B企业高温大曲中的生物标志物主要为Aspergillus。核心OTU的统计结果显示不同企业生产的高温大曲中仍含有近三分之一的核心菌群,它们由Thermomyces和Aspergillus组成。此外,Zhu Min等[37]在探讨环境因素对中高温大曲发酵过程中微生物群落变化的影响时发现,环境湿度、CO2和水分对微生物群落的影响是显著的,这表明在发酵过程中除温度以外的环境因素亦会对真菌群落结构产生较大影响。
本研究通过纯培养法从A企业生产的高温大曲中仅分离到4 株酵母菌菌株,它们均被鉴定为S.fibuligera。S.fibuliger具有高效分泌α-淀粉酶、β-葡萄糖苷酶和酸性蛋白酶等特性,是谷物发酵中重要的功能微生物[38]。然而值得注意的是,本研究并未通过纯培养法分离得到较丰富的酵母菌菌种,出现这一现象的原因可能是较高的发酵温度或是样品经过低温贮存后使得大多数酵母菌菌种失活或是活性较弱,而富集酵母菌常用的PDA培养基成分较为单一,并不能满足菌株恢复活性所需的全部营养组分。此前,其他研究人员亦关注到了纯培养法的不足之处,并开发出了培养组学技术以更多地从样品中获得微生物资源[40]。例如,Lagier等[39]通过培养组学技术使从人类肠道中分离出的物种数量增加了一倍。此外,Yao Su等[40-41]从高温大曲中先后发现了两个新物种,它们分别被命名为大曲高温放线菌(Thermoactinomyces daqus)和大曲岩石芽孢杆菌(Scopulibacillus daqui)。因而,高温大曲中目前仍可能含有大量未知物种,采用培养组学技术挖掘出更多的大曲源物种是极为必要的。综上所述,襄阳地区A企业生产的3 种颜色高温大曲在部分优势真菌类群含量和风味特征上存在显著差异,且该地区A企业和B企业生产的高温大曲真菌群落结构间亦存在显著差异。由此可见,襄阳地区高温大曲中的真菌在发酵过程中受到温度波动的影响较小,而受到生产工艺的影响较大。
