基于行业标准中马和驴成分检测方法用于骡肉检测的分析
2024-01-03项佳林刘立兵王金凤孙晓霞王建昌
周 藏,项佳林,刘立兵,王金凤,付 琦,孙晓霞,王建昌,
(1.河北医科大学公共卫生学院,河北 石家庄 050017;2.石家庄海关技术中心,河北 石家庄 050051;3.河北省环境与人群健康重点实验室,河北 石家庄 050017)
2002年欧盟颁布的一般食品法中强调食品安全是食品政策和健康的关键优先事项,确认食品真伪是保证食品安全的重要内容之一[1]。然而,自2013年欧洲爆发了“马肉风波”后,肉类掺假事件在全球范围内层出不穷[2-4],严重危及了消费者对食品行业安全的信任,引起人们对肉类掺假现象的关注,促使加强食品安全监管的需求增加。快速、有效、准确、可靠的检测技术是监管和检测食品掺伪的关键。
目前已有多种关于动物源性成分检测方法用于肉类掺假鉴别,但其中大多数方法主要用于实验室研究,很少应用于食品行业的常规分析检测。色谱法和光谱法所需仪器昂贵,后续数据处理复杂,对操作人员的专业水平要求较高,不适用于在资源有限的地区开展检测[5-6];而酶联免疫吸附实验不能区分密切相关的物种,且因目的蛋白易变性,适用范围小,难以推广使用[7-8];与之相比,基于分子生物学的聚合酶链式反应(polymerase chain reaction,PCR)方法灵敏度高,特异性好,操作简单,且DNA受热稳定,使得其可用于热加工肉制品的检测。因此,PCR是应用最广泛的成熟动物源性成分检测方法[9-10]。目前我国已基于实时PCR(real-time PCR)技术建立了食品中多种动物源性成分检测的相关国家、行业或地方标准。
行业标准SN/T 3730.4—2013《食品及饲料中常见畜类品种的鉴定方法 第4部分:驴成分检测 实时荧光PCR法》和SN/T 3730.5—2013《食品及饲料中常见畜类品种的鉴定方法 第5部分:马成分检测 实时荧光PCR法》以驴和马线粒体基因ATPase 6为靶基因进行检测,是目前常用于马、驴成分检测的标准方法。但在实际样品检测过程中,发现对于已知来源的单一动物源性成分的肉制品,存在两种源性成分均有检出的情况,即结果显示马、驴两种成分均有检出,与实际情况不符;考虑样品为骡肉的情况,则与线粒体基因的严格母系遗传理论相悖[11]。针对在实际检测中发现的上述问题,本研究基于SN/T 3730.4—2013和SN/T 3730.5—2013分别对马肉、驴肉和骡肉中马、驴成分的检测结果进行分析,并就上述标准在骡肉中出现马、驴成分均可检出的情况进行深入的原因分析,旨在为实验室中骡肉样品的检测结果判定提供参考。
1 材料与方法
1.1 材料与试剂
共收集9 份生肉样品,包括3 份马肉H1~H3、3 份驴肉D1~D3和3 份骡肉L1~L3,所有样品均来自张家口蔚县某屠宰场。
食品基因组DNA 提取试剂盒 美国Promega公司;Perfect Start®II Probe qPCR SuperMix(2×)、2×EasyTaqPCR SuperMix(+dye)北京全式金生物技术有限公司;琼脂糖 上海贝晶生物技术有限公司;DNA Marker I分子质量标准 北京天根生化科技有限公司。
1.2 仪器与设备
1-14台式离心机 德国Sigma公司;NanoDrop 2000C超微量分光光度计 美国Thermo Scientific公司;Quant Studio 5实时荧光定量PCR仪 美国ABI公司;SL 202电子天平 德国赛多利斯公司;BT-20T恒温金属浴 上海本亭仪器有限公司;T-Gradient梯度PCR仪德国Biometra公司。
1.3 方法
1.3.1 引物和探针
参照SN/T 3730.4—2013和SN/T 3730.5—2013合成检测马、驴成分的特异性引物和探针;参考谌阳等[12]的方法分别合成基于线粒体基因和核基因检测马、驴成分的特异性引物。所有引物和探针均由捷瑞生物工程(上海)有限公司合成,序列如表1所示。
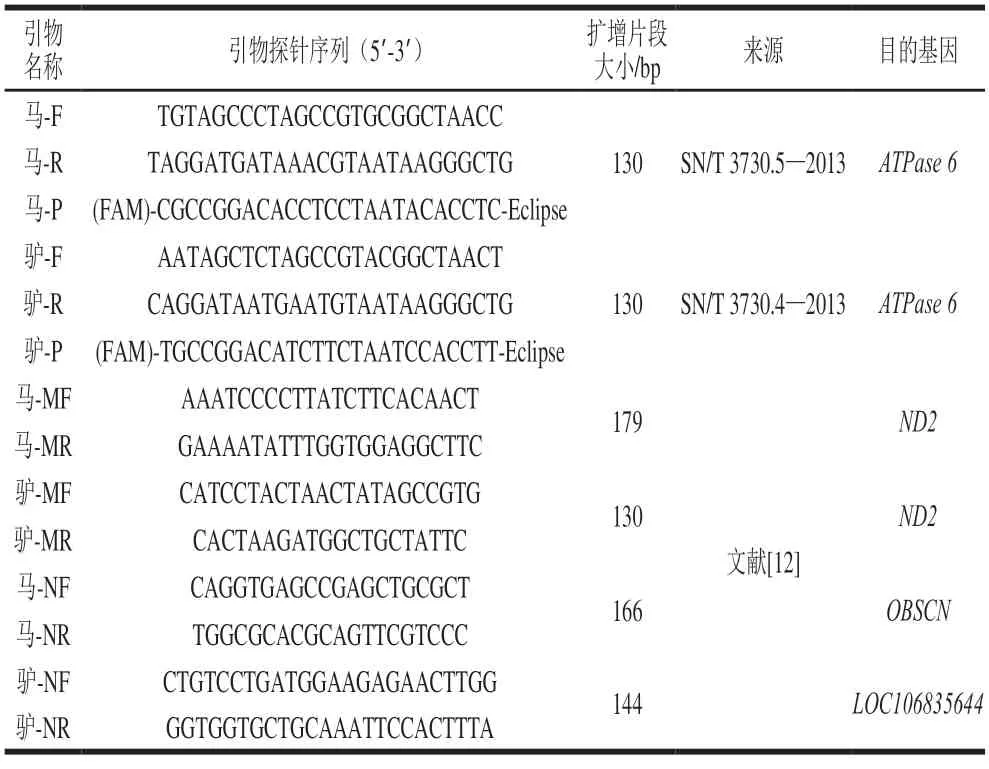
表1 所需引物和探针序列信息Table 1 Information of the primers and probes used in this study
1.3.2 动物基因组DNA的提取
使用干净无菌的剪刀对样品深层组织进行多点取样,置于研钵中使用液氮研磨成粉末,每取完一份样品更换一把剪刀。分别取50 mg已研磨均匀的肉粉,置于1.5 mL离心管中,按照食品基因组DNA提取试剂盒操作说明进行核酸提取,最终以100 μL无菌水溶解基因组DNA。使用NanoDrop 2000C超微量分光光度计测定DNA浓度和纯度,置于-20 ℃贮存,备用。同时提取实验室保存的马、驴肉粉各50 mg,重复以上步骤提取基因组DNA,作为阴、阳性对照模板。
1.3.3 样品种源确定
以提取的9 份生肉样品的基因组DNA为模板,参考文献[12]的引物分别基于线粒体基因和核基因对样品中的马、驴成分进行PCR扩增测序,分析其种源情况。PCR反应体系总体积为25 μL:2×EasyTaqPCR SuperMix 12.5 μL(终浓度1×),10 μmol/L的上、下游引物均为2 μL,模板DNA为1 μL,无菌水7.5 μL。进行PCR扩增的反应条件为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环;72 ℃终延伸5 min;4 ℃保存。
1.3.4 SN/T 3730.4—2013和SN/T 3730.5—2013标准方法的检测
以提取的9 份生肉样品的基因组DNA 为模板,以ddH2O为空白对照,以马、驴基因组DNA分别为阴性对照和阳性对照,使用SN/T 3730.4—2013和SN/T 3730.5—2013中的引物和探针对样品中马、驴成分分别进行检测。real-time PCR体系总体积为25 μL:2×PerfectStart®II Probe qPCR SuperMix 12.5 μL(终浓度1×),10 μmol/L的上、下游引物均为1 μL,10 μmol/L探针为1 μL,模板DNA为1 μL,无菌水8.5 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸30 s,40 个循环,在退火延伸时采集荧光信号。所有样品重复检测3 次,并记录循环阈值(cycle threshold,Ct)。
同时使用SN/T 3730.4—2013和SN/T 3730.5—2013中的引物对样品中马、驴成分分别进行普通PCR扩增。PCR体系总体积为25 μL:2×EasyTaqPCR SuperMix 12.5 μL(终浓度1×),10 μmol/L的上、下游引物均为2 μL,模板DNA为1 μL,无菌水7.5 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,32 个循环;72 ℃延伸10 min;4 ℃保存。取所有PCR扩增产物5 μL经2%琼脂糖凝胶电泳检测扩增结果。扩增的产物由擎科生物(北京)科技有限公司测序。使用Megalign软件结合Clustal W算法对扩增序列与马或驴的同源性进行分析,将同源性大于98%的样品归为同一种[13]。
2 结果与分析
2.1 样品DNA的浓度和纯度
使用NanoDrop 2000C超微量分光光度计对提取的样品DNA质量浓度和纯度进行检测。结果表明,所提取的样品DNA质量浓度均在200~500 ng/μL范围内,A260nm/A280nm值在1.7~2.0之间,A260nm/A230nm值在2.0左右,可用于后续PCR[14-15]。
2.2 样品种源的分析结果
使用引物马-MF/R、驴-MF/R、马-NF/R、驴-NF/R分别对9 份样品中的马、驴线粒体基因和核基因片段进行扩增,将扩增产物进行测序,分析其种源情况。如图1A所示,H1~H3在基于线粒体基因和核基因的检测中,均只检出马成分,其扩增产物分别命名为马M-H1~H3和马N-H1~H3;D1~D3在基于线粒体基因和核基因的检测中,均只检出驴成分,其扩增产物分别命名为驴M-D1~D3和驴N-D1~D3。而L1~L3在基于线粒体基因检测中,只检出马成分,其扩增产物分别命名为马M-L1~L3;而在基于核基因的检测中,马、驴成分均有检出,扩增产物分别命名为马N-L1~L3和驴N-L1~L3。
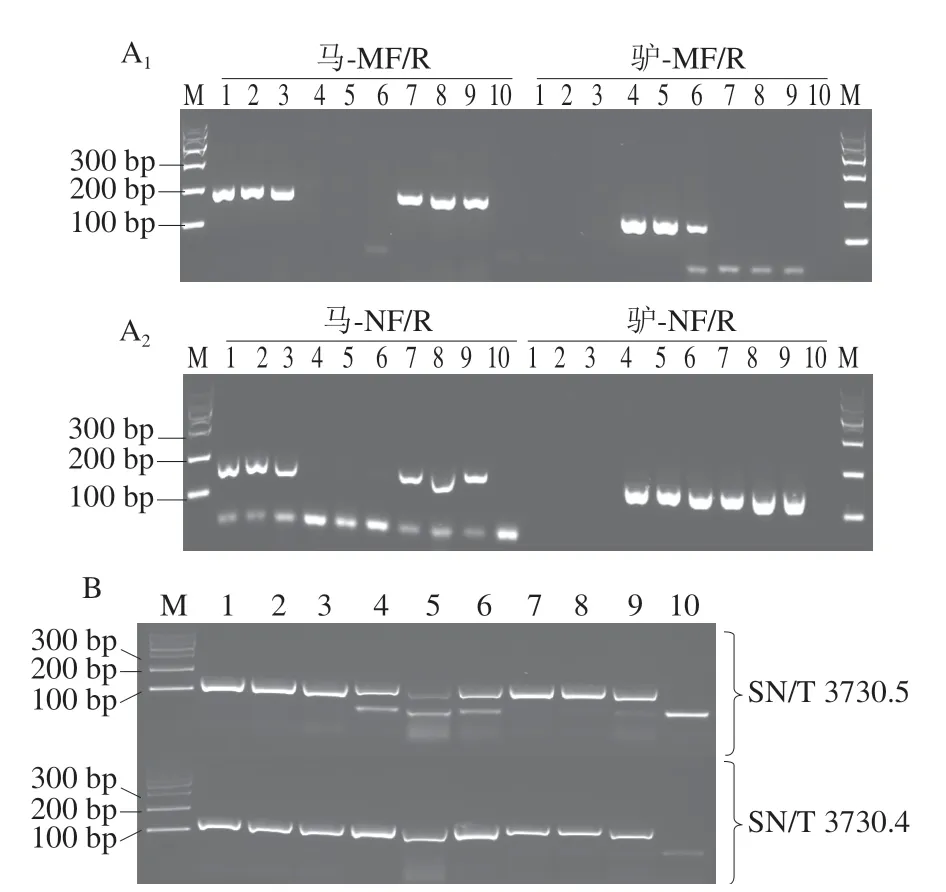
图1 样品中马、驴成分的PCR检测结果Fig.1 PCR results of horse-and donkey-derived ingredients in samples
进一步对扩增产物的测序结果进行分析,结果显示马M-H1和马M-L1~L3对马的同源性分别为99.3%、100%、100%、99.3%,驴M-D1对驴的同源性为100%;马N-H1和马N-L1~L3对马的同源性分别为98.4%、99.2%、99.2%、98.4%,驴N-D1和驴N-L1~L3对驴的同源性均为100%。测序分析结果与凝胶电泳成像显示的马、驴成分扩增情况一致,即H1~H3只含有马成分,D1~D3只含有驴成分,L1~L3既含有马成分,又含有驴成分。判断H1~H3均为马肉,D1~D3均为驴肉,L1~L3均为马骡肉,符合预期样品情况。
2.3 SN/T 3730.4—2013和SN/T 3730.5—2013标准方法的检测结果
以9 份样品的基因组DNA为模板,设立ddH2O为空白对照,马、驴基因组DNA各自为阴性对照和阳性对照,同时进行马、驴成分的real-time PCR方法检测。结果如图2所示,对于马成分检测,以驴基因组DNA作为阴性对照,未见扩增曲线,以马基因组DNA作为阳性对照,出现特异性扩增曲线;对于驴成分检测,以马基因组DNA作为阴性对照,未见扩增曲线,以驴基因组DNA作为阳性对照,出现特异性扩增曲线。
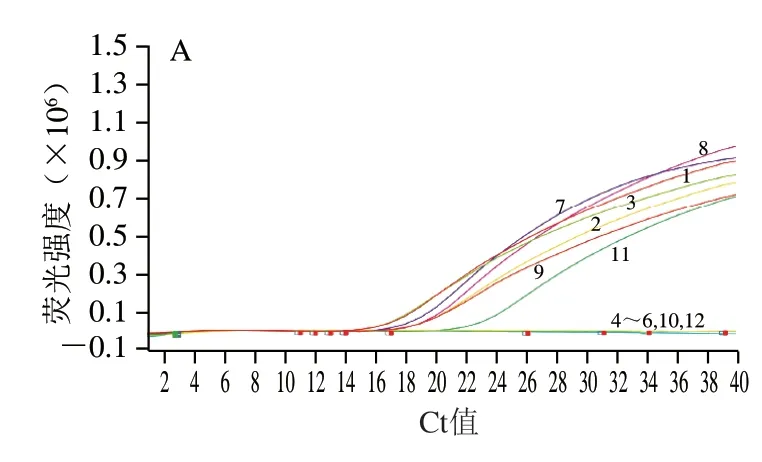
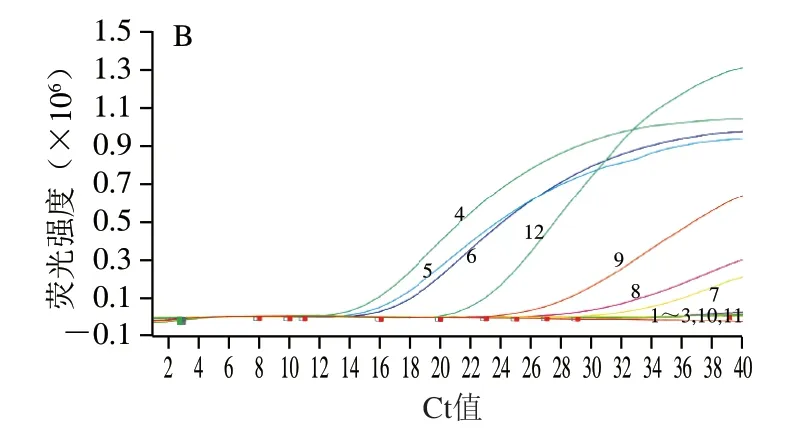
图2 样品中马、驴源性成分real-time PCR扩增情况Fig.2 Real-time PCR results of horse-and donkey-derived ingredients in samples
对9 份样品分别进行马、驴成分检测,结果显示,样品H1~H3、L1~L3均检出马成分,且Ct值在15.00~18.00范围内;样品D1~D3未检出马成分。样品D1~D3、L1~L3均检测出驴成分,其中D1~D3的Ct值在13.00~15.00范围内,L1~L3的Ct值在25.00~35.00范围内;样品H1~H3未检出驴成分。重复3 次real-time PCR检测,结果一致,所得Ct值如表2所示。
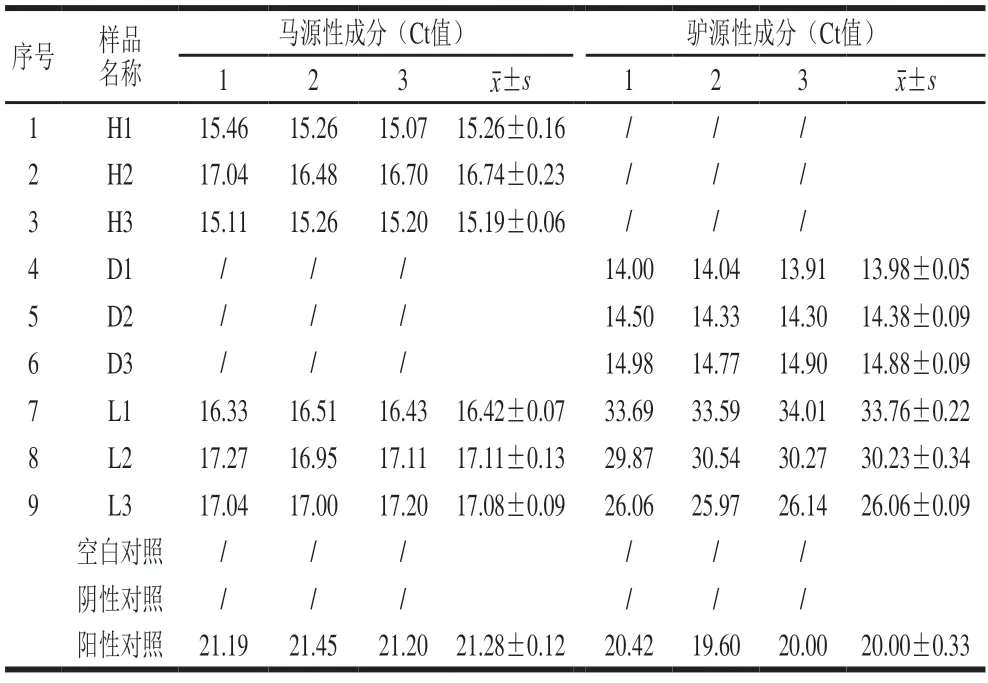
表2 real-time PCR方法检测结果Table 2 Real-time PCR results of horse-and donkey-derived ingredients in samples
使用SN/T 3730.4—2013和SN/T 3730.5—2013中的引物分别对9 份样品中的马、驴成分进行PCR扩增测序,对测序结果进行分析。如图1B所示,马、驴特异性的real-time PCR方法中的引物在普通PCR反应中对9份样品均有扩增,将SN/T 3730.5—2013中马成分的引物对样品1、样品4和样品7~9的PCR扩增产物分别命名为马-H1、马-D1、马-L1~L3;将SN/T 3730.4—2013中驴成分的引物对样品1和样品7~9的PCR扩增产物分别命名为驴-H1、驴-L1~L3。对扩增产物的测序结果进行分析,如图3所示,马-H1、马-L1~L3与马的同源性均为100%,与驴的同源性分别为86.1%、85.9%、86.1%、86.1%;马-D1与马的同源性为86.1%,与驴的同源性为100%。驴-H1与马的同源性为100%,与驴的同源性为86.1%;驴-L1~L3与马的同源性为91.0%、89.9%、88.6%,与驴的同源性为85.9%、91.1%、89.9%。将同源性大于98%的样品归为同一种,具体分类情况如表3所示。

图3 SN/T 3730.5—2013和SN/T 3730.4—2013对样品的PCR扩增产物序列Fig.3 Sequences of PCR amplification products from samples using SN-T 3730.5-2013 and SN/T 3730.4-2013 methods
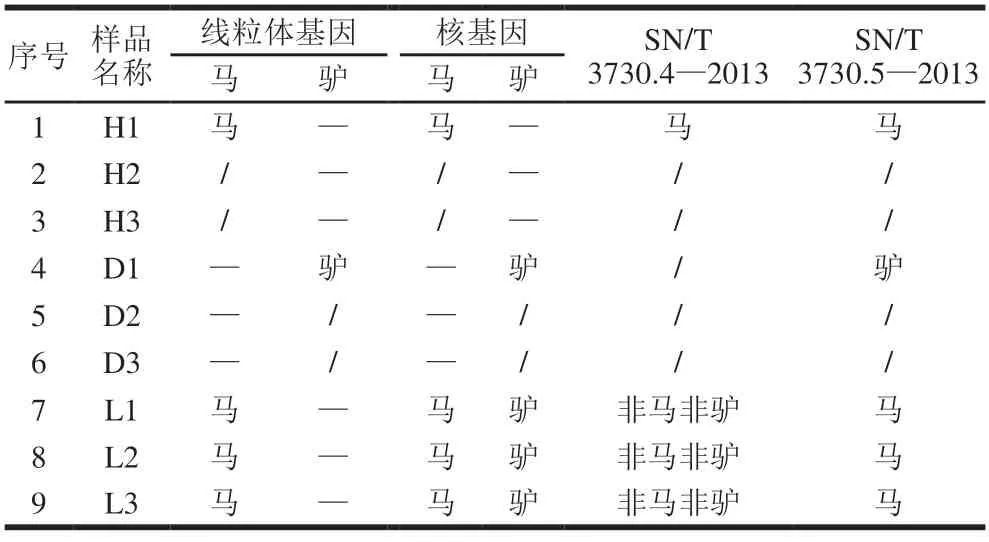
表3 样品中马、驴源性成分测序结果的种源分析Table 3 Origin analysis of sequencing results of horse-and donkeyderived ingredients in samples
3 讨论
骡是马驴杂交的后代,自身不具有繁育生殖能力,因此并不属于一个物种。目前尚无针对食品中骡成分特异性检测的相关研究。对骡成分的检测,通常是基于马和驴成分的检出情况进行综合判断:以核基因进行扩增检测时,若马、驴成分同时检出,则可判断为骡成分[11]。根据母系不同,骡又可分为马骡和驴骡。此时,根据线粒体基因严格母系遗传的理论,基于线粒体基因进行马和驴成分检测时,骡肉中可检出其母系物种,即马成分或驴成分[16-17]。在本研究中,先根据基于线粒体基因和核基因的检测确定了样品的种源情况,即样品H1~H3均为马肉,D1~D3均为驴肉,L1~L3均为马骡肉,从而可以进行后续验证实验。
SN/T 3730.4—2013和SN/T 3730.5—2013均以线粒体基因ATPase 6为靶基因,进行马、驴成分检测时,能够特异性区分马和驴成分,也是目前应用最为广泛的食品中马、驴成分特异性检测的标准方法。本实验室在使用上述标准进行日常实际样品检测过程中,发现部分明确为非混合肉样品,存在马、驴两种成分均有检出的情况,并且一种成分Ct值一般≤20.00,另一种成分的Ct值则在25.00~35.00之间。该现象严重困扰了检测人员的判断。本研究中针对马骡肉样品,使用SN/T 3730.4—2013驴成分real-time PCR法检测时,Ct值在25.00~35.00范围内出现扩增,根据标准中的结果判定原则,应判为检出驴成分,但是与实际样品成分不符。
李亚楠等[18]在SN/T 3730.4—2013标准中检出限合理性的探讨中,指出以非混合肉样品的基因组DNA为模板,马成分real-time PCR方法检测Ct值为17.00~20.00的同时,驴成分real-time PCR方法检测Ct值在25.00~35.00范围内,原因可能是对非混合肉样品中马成分的非特异性扩增。与其结论相比,本研究中使用SN/T 3730.4驴成分检测Ct值为25.00~35.00的样品也检出了马成分(Ct值为16.00~18.00),但并非所有Ct值在16.00~18.00范围内的马基因组DNA在驴成分检测方法中都出现非特异性扩增,且李亚楠等[18]的研究仅对样品检出的马成分进行了测序分析,未确定样品的种源,不能排除马骡肉的情况。
使用SN/T 3730.4—2013和SN/T 3730.5—2013的引物,通过普通PCR方法扩增马肉、驴肉的基因组DNA后,出现了相同的目的条带,尽管不能特异性区分马和驴,但无论是马成分引物对驴的非特异性扩增,还是驴成分引物对马的非特异性扩增,扩增片段的测序结果仍能正确鉴别出马和驴,如马-D和驴-H测序结果的种源分析。因此,若马骡中线粒体靶基因序列完全遗传自马,则驴成分引物同样能对其中的马成分进行扩增并且测序结果将与马同源。但实际结果显示,使用驴成分引物对马骡中线粒体靶基因序列的扩增产物与马的同源性分别为91.0%、89.9%和88.6%,不能归于马种,与驴的同源性分别为85.9%、91.1%和89.9%,也不能归于驴种。
基于线粒体基因严格母系遗传的理论,在对子代线粒体基因进行检测时,仅能检测出母系物种成分[19]。然而,对线粒体基因进行提纯较因难,在实际应用中,通常使用基因组DNA进行检测。已有研究表明,核基因中存在线粒体基因序列Numts[20]。自1994年,Lopez等[20]在家猫核基因组中发现了一段与线粒体基因组同源的序列,此后,已陆续在人类、真菌、植物、节肢动物、鸟类和其他哺乳动物中发现了大量的Numts[20-25]。目前,核基因中的Numts片段已经涵盖了线粒体基因组的全部基因,物种不同,其重复数不同,可为10~500 次[20-21],且Numts内部常会发生碱基的插入、缺失[23-27]。因此,针对线粒体基因进行检测时,若核基因中存在靶序列,将对检测结果产生干扰,并可能从子代基因组DNA中检测到父系线粒体基因片段。本研究针对马骡肉样品,应用SN/T 3730.4—2013和SN/T 3730.5—2013对样品进行马、驴成分检测,结果表明,两种成分均能检出,但Ct值差异明显。造成该现象的原因可能是马骡全基因组DNA中针对马、驴的扩增片段存在于两个不同的位点,即分别位于线粒体基因和核基因,且两个位点的拷贝数相差较大,分别对应线粒体基因的拷贝数和核基因中Numts的重复数[28],其中线粒体基因的拷贝数通常为102~104[29-30]。以确定的马骡肉样品基因组DNA为模板,进一步使用SN/T 3730.4—2013的引物进行普通PCR扩增,其测序结果与SN/T 3730.5—2013的测序结果不同,可能为驴的该线粒体基因片段在核基因中发生了部分碱基的插入或缺失,进一步使得马成分引物不能识别核基因中的位点,而驴成分引物可以识别该位点,从而与对线粒体基因位点的识别一同扩增,影响了测序的准确性,导致对扩增产物的测序结果既不与马同源,也不与驴同源。虽然本研究确定了样品的种源情况,验证了SN/T 3730.4—2013应用于骡肉检测的能力。但由于SN/T 3730.4—2013和SN/T 3730.5—2013中扩增片段均较短,为130 bp,因此,其扩增片段的测序结果在准确鉴别物种上存在一定的局限。
4 结论
在日常检测工作中,SN/T 3730.4—2013 和SN/T 3730.5—2013能够实现肉制品中马、驴成分的特异性鉴别检测。对已知来源于单一动物源性成分样品的分析中,出现一种成分Ct值较低(一般≤20.00),同时另一种成分也出现扩增且Ct值在25.00~35.00范围内,应考虑骡源性的可能。
