蛋白核小球藻胰脂肪酶抑制肽的分离纯化、鉴定及其降脂活性
2024-01-03柳雯郡黄俊媛贾瑷菁汪登谜
林 娈,柳雯郡,黄俊媛,贾瑷菁,汪登谜,刘 斌,赵 超
(1.福建农林大学食品科学学院,福建 福州 350002;2.泉州师范学院海洋与食品学院,福建 泉州 362000;3.福建省海洋藻类活性物质制备与功能开发重点实验室,福建 泉州 362000)
当前,全球约40%的成年人超重或肥胖,并呈现快速蔓延的趋势,肥胖已成为一种全球性的“流行病”[1]。肥胖患者能量摄入大于消耗,主要表现为脂肪过量堆积、脂质代谢紊乱,同时多伴有糖尿病、高胰岛素血症等引起胰岛素抵抗,在世界范围内造成严重的经济和社会负担[2]。目前常用降脂药物如他汀类、贝特类、奥利司他具有一定的降脂效果,但长期服用会产生恶心、腹胀、肌肉酸痛等不良反应,肝毒性大,对继发性脂代谢紊乱疗效不理想[3]。食源性肽具有显著的降脂效应,药效持续长,副作用小且获取来源广泛。现已从乳清[4-5]、大豆[6-8]、大米[9-10]、沙丁鱼[11]、牡蛎[12]以及小球藻[13]等蛋白源的水解产物中分离出了多种降脂肽,其中最早鉴定序列的是乳源蛋白多肽,但对于微藻蛋白源的研究较少。
小球藻是一类普生性单细胞微藻,属于绿藻门(Chlorophyta)、绿藻纲(Chlorophyceae)、绿球藻目(Chlorococcales)、卵囊藻科(Oocystaceae)、小球藻属(Chlorella),生态分布极广,生长速率快,易于培养,应用价值高,可作为理想的保健食品和预防或辅助药物,己被联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)列为21世纪人类的健康食品[14]。我国于60年代开始大规模养殖小球藻,以蛋白核小球藻(Chlorella pyrenoidosa)、普通小球藻(C.vulgaris)和椭圆小球藻(C.ellipoidea)较为常见[15]。蛋白核小球藻中含有大量蛋白质和叶绿素,含量分别高达其干质量的42%~58%和3%~5%,其氨基酸组成高于世界卫生组织和FAO颁布的用于人类营养的蛋白质标准,是一种食用安全的优质蛋白质资源,2012年我国卫生部将其列为新资源食品[16]。小球藻蛋白及其水解肽的多种生物活性已有相关报道,主要集中在抗氧化活性[17-18]、降血压[19-21]、抗肿瘤[22]、矿物螯合作用[23]等,对于降脂方面的研究较少。以小球藻蛋白为载体,酶解制备活性肽,将会最大程度挖掘肽生物活性的多样性,从而开发具有新颖结构和功能的活性肽产品。
Zhang Ruilin等[13]采用酶解、凝胶过滤、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)等方法从小球藻中分离得到一种新的十肽Leu-Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg对猪胰脂酶有较好的抑制效果,质量浓度为600 μg/mL时能够减少3T3-L1细胞内27.9%三酰甘油的积累,但对体内的降脂效果没有涉及。Shih等[24]利用血管内皮细胞(SVEC4-10细胞),通过酶联免疫吸附检测实验发现一种小球藻11肽Val-Glu-Cys-Tyr-Gly-Pro-Asn-Arg-Pro-Gln-Phe能显著抑制E-选择素、ICAM、VCAM、MCP-1和ET-1基因的表达,具有预防动脉粥样硬化的潜力。然而,这些肽功能应用的真正效果取决于它们在靶组织中的稳定性、转运速率和生物利用度,即肽能否保持完整并到达靶器官的能力取决于肽的特性(分子质量、电荷和疏水性)[25]。有关研究表明当多肽药物分子质量超过700 Da时,其生物利用度将随着分子质量增加而显著下降,而分子质量小于500 Da的小肽(2~6 个氨基酸)具有最高的生物利用度[26]。
本研究以蛋白核小球藻为原料,通过前期酶解工艺优化制备小球藻蛋白酶解物,采用超滤和葡聚糖凝胶对其进行分离纯化,以胰脂肪酶活性抑制率为指标筛选具有降脂活性的肽组分(记为PES),以高糖饮食秀丽隐杆线虫为模型评价纯化肽PES的降脂效果。采用LC-MS/MS鉴定PES肽序列,结合分子对接技术筛选出潜在的胰脂肪酶抑制肽并初步研究其抑制机制,为深入理解蛋白核小球藻及其他微藻蛋白肽调节脂代谢或抑制肥胖功能提供理论依据,同时有助于利用蛋白核小球藻资源开发安全高效的胰脂肪酶抑制肽,促进小球藻产业的发展。
1 材料与方法
1.1 材料与试剂
蛋白核小球藻粉 福清市新大泽螺旋藻有限公司;木瓜蛋白酶(800 U/mg)、脂肪酶(猪胰)上海源叶生物科技有限公司;秀丽隐杆线虫(Caenorhabditis elegans)野生型N2 福建上源生物科学技术有限公司;油红O染色液 生工生物工程(上海)股份有限公司;甘油三酯试剂盒、总胆固醇试剂盒、蛋白定量测定试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
Infinite M200 Pro多功能酶标仪 帝肯(上海)贸易有限公司;冷冻干燥机 北京博劢行仪器有限公司;HD-3紫外检测仪、DBS-100全自动部分收集、HL-2D恒流泵 上海青浦泸西仪器厂有限公司;SRA03-11恒温培养箱 上海一恒科学仪器有限公司;DHG-9203A荧光显微镜 德国蔡司股份有限公司;EASY-nLC 1200液相色谱仪、Q Exactive高分辨质谱仪 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 小球藻蛋白酶解物的制备
采用pH值调节法提取小球藻蛋白[27]。利用木瓜蛋白酶酶解小球藻蛋白,采用优化后的酶解条件:用纯水配制15 mg/mL的小球藻蛋白溶液,调节pH值至6.0,加入木瓜蛋白酶,酶底比为6 000 U/g,酶解温度50 ℃,酶解时间5 h,酶解结束后升温至100 ℃灭酶10 min,冷却到室温,于8 000 r/min离心15 min,取上清液得到小球藻蛋白酶解液,真空浓缩后冷冻干燥,得小球藻蛋白酶解物,记为PE。
1.3.2 PE相对分子质量分布测定
采用高效液相色谱测定PE相对分子质量。配制10 mg/mL的PE溶液,经0.45 μm膜过滤后进样,测试条件参照GB/T 22729—2008《海洋鱼低聚肽粉》进行。
1.3.3 小球藻蛋白酶解液的超滤膜分离
用截留分子质量10 kDa和5 kDa的超滤膜对小球藻蛋白酶解液进行超滤,得到不同组分:>10 kDa、5~10 kDa和<5 kDa。冷冻干燥后,分别测定3 个组分的胰脂肪酶活性抑制率,收集抑制率最高的组分。
1.3.4 Sephadex G-25凝胶层析
采用葡聚糖凝胶色谱进一步纯化,葡聚糖凝胶规格为Sephadex G-25,洗脱剂为超纯水,进样量为柱体积3%,进样质量浓度为25 mg/mL,流速为1 mL/min,检测波长为220 nm。收集每个主峰的洗脱液,冷冻干燥后,分别测定各主峰的胰脂肪酶活性抑制率,得到抑制率最高的主峰,即为蛋白核小球藻胰脂肪酶抑制肽。
1.3.5 胰脂肪酶活性抑制率的测定
参照廖家乐等[28]方法,稍作改动。将80 μL 的50 mmol/L Tris-HCl缓冲液(pH 8.0)、40 μL的样品溶液和120 μL的10 mg/mL胰脂肪酶溶液,混合均匀后于37 ℃温育10 min,立即加入160 μL的0.8 mmol/L棕榈酸对硝基苯酯(p-nitrophenyl phosphate,pNPP)作为底物,于37 ℃反应20 min。反应结束后,100 ℃水浴5 min以终止反应。离心去除沉淀,取200 μL上清液在405 nm波长处测定吸光度。对照组用缓冲液代替样品溶液,空白组用缓冲液代替酶液,使用奥利司他(8 μg/mL)作为阳性对照,每组实验重复3 次,并根据式(1)进行计算:
式中:A1为对照实验组吸光度;A2为样品实验组吸光度;A3为对照空白组吸光度;A4为样品空白组吸光度。
1.3.6 胰脂肪酶抑制动力学分析
参照黄琳翔[29]和廖家乐[28]等的方法,稍作改动。4-硝基苯酚(p-nitrophenol,pNP)标准曲线的绘制:利用二硝基亚砜配制5 mmol/L母液,用Tris缓冲液稀释,配制不同浓度的pNP溶液(0.01、0.02、0.03、0.04、0.05 mmol/L),测定其在405 nm波长处的吸光度。以pNP浓度为横坐标,以吸光度为纵坐标,得到pNP标准曲线(y=9.352 4x+0.053,R2=0.999 8)。
固定pNPP浓度为0.8 mmol/L,分别测定不添加和添加1 mg/mL酶抑制剂时,胰脂肪酶不同质量浓度(0、5、10、15、20 mg/mL)的酶促反应初速率,反应体系同1.3.5 节。根据pNP标准曲线得到相应的反应产物(pNP)的浓度(C/(mmol/L)),进而求出各反应速率。以酶促反应初速率对酶质量浓度作图,由图判断抑制类型(可逆或不可逆),添加抑制剂会得到一条通过原点且斜率降低的直线,可确定为可逆抑制作用类型[28]。
固定胰脂肪酶质量浓度为10 mg/mL,酶抑制剂配制成0、1、2 mg/mL的溶液,分别测定pNPP浓度为1、2、4、8 mmol/L时的酶促反应初速率,反应体系同1.3.5节。以反应速率倒数(1/V)对底物浓度倒数(1/[S])作图,得到Lineweaver-Burk双倒数曲线。曲线与X轴的截距=-1/Km,与Y轴截距=1/Vmax,根据Vmax和Km的变化可判断抑制类型,非竞争性抑制为Km不变,Vmax变小;竞争性抑制为Km增大,Vmax不变[30]。以双倒数曲线的斜率(k)为纵坐标,抑制剂质量浓度为横坐标,进行二次作图绘制可得抑制常数Ki[30]。
竞争性抑制剂的抑制常数可按式(2)进行计算:
式中:1/V为反应速率的倒数/((L·min)/μmol);1/[S]为pNPP底物浓度的倒数/(L/mmol);Km为米氏常数/(mmol/L);Vmax为酶促反应的最大反应速率/(μmol/(L·min));[I]为抑制剂质量浓度/(mg/mL);Ki为抑制常数/(mg/mL)。
非竞争性抑制剂的抑制常数按式(3)进行计算:
Lineweaver-Burk 双倒数曲线的斜率k计算见式(4):
1.3.7 秀丽隐杆线虫实验评价降脂活性
1.3.7.1 秀丽隐杆线虫的培养与同步化
线虫的培养使用线虫生长培养基(nematode growth medium,NGM),在表面涂布有OP50菌液作为线虫的食物,在20 ℃恒温培养箱中培养。参照王力等[31]采用次氯酸钠裂解法对线虫进行同步化处理,本实验所用线虫均为经过同步化处理生长至L4期的线虫。正式实验时,NGM中添加12.5 μg/mL 5-氟脲嘧啶[32]。
1.3.7.2 秀丽隐杆线虫的给药途径与分组
将同步化L4期线虫分成6 组,每组设置3 个平行,每板1 000 只,如表1所示。通过使用含10 mmol/L葡萄糖的NGM培养C.elegans进行高糖饮食诱导,构建C.elegans高脂模型。将PES溶解在OP50菌液中,吸取500 μL含PES的OP50菌液涂布于NGM平板上(90 mm),20 ℃恒温培养箱培养24 h待用。在此条件下,药物通过线虫摄食而进入到线虫体内[33]。每日更换NGM,72 h后收集虫体,用于后续实验。

表1 实验分组和给药剂量Table 1 Experimental grouping and doses of drugs
1.3.7.3 油红O染色
参照Wilber等[34]的方法,稍作改动。挑取同步化、给药结束的6 组线虫(n=100),加入适量磷酸盐缓冲液(phosphate buffered saline,PBS),离心弃上清液,加入体积分数60%异丙醇溶液,脱水3 min。去除异丙醇,加入油红O染色液,室温避光静置2 h,离心弃上清液。用PBS去多余染液,置于显微镜下观察拍照。将线虫转移至新的离心管,加入200 μL无水乙醇,混合摇晃5 min,离心取上清液测510 nm波长处的吸光度。
1.3.7.4 甘油三酯和总胆固醇含量的测定
挑取同步化、给药结束的6 组线虫(n=900),并配制M 9 缓冲液(称取3 g KH2PO4,15.14 g Na2HPO4·12H2O,5g NaCl,加水定容至1 L,高压灭菌,冷却后在超净工作台中加入1 mL 1 mol/L无菌MgSO4溶液,混合均匀)。用M9缓冲液洗线虫3 遍,离心,弃上清液。加入1 mL M9缓冲液重悬,将离心管放入液氮速冻10 min后置于室温解冻,反复3 次后研磨破碎虫体,制成线虫匀浆。按照试剂盒方法测定甘油三酯和总胆固醇含量,结果通过蛋白质浓度标准化。
1.3.8 基于LC-MS/MS鉴定纯化肽PES
委托深圳市微纳菲生物技术有限公司完成纯化肽PES的结构鉴定。采用EASY-nLC 1200液相系统,质谱采用Q Exactive系统结合纳升喷雾Nano Flex离子源,喷雾电压为1.9 kV,离子传输管加热温度为275 ℃,扫描范围为m/z100~1 500。质谱采集的原始图谱文件,采用PEAKS Studio 8.5软件进行数据加工处理和检索分析,从UniProt数据库下载Chlorella pyrenoidosa物种蛋白数据库。
1.3.9 分子对接技术
参照欧海亚等[35]方法,通过检索PDB蛋白数据库(www.rcsb.org/)获取人胰脂肪酶(human pancreatic triacylglycerol lipase,PTL)的3D晶体结构(PDB代码:1LPB)并将其作为受体,将晶体结构中的原始配体(甲氧基十一烷基磷酸)所在的位置定义为结合口袋。应用Molecular Operating Environment(MOE)软件中的对接模块进行基于结构的虚拟筛选,对接流程采用柔性的induced fit模式。配体的结合模式首先通过London dG打分函数进行排序,最优构象通过进一步优化和GBVI/WSA dG方法对结合自由能再次评价。结合自由能最低的构象被选为最佳的结合模式,采用PyMOL将对接结果可视化。
1.3.10 合成肽与活性验证
将确定的氨基酸序列委托生工生物工程(上海)股份有限公司采用Fmoc固相合成法制备,所得肽段经过液质联用仪鉴定纯度>95%。合成肽的胰脂肪酶抑制活性测定参照1.3.5节进行,胰脂肪酶抑制动力学分析参照1.3.6节进行。
1.4 数据分析
2 结果与分析
2.1 PE相对分子质量分布
如表2所示,将PE按分子质量大小可分为6 个部分,小于5 000 Da的肽段含量总和达到98.16%,其中180~1 000 Da的肽段比较集中,含量约为51.97%,还有31.86%的组分为游离氨基酸和氨基酸残基。由于组成多肽的氨基酸残基平均相对分子质量约为110 Da[36],因此预测组成PE的多肽大多是由少于10 个氨基酸组成的肽段。2~6 个氨基酸组成的小肽将有助于提升肽类药物在靶组织中的稳定性、转运效率和生物利用度。Zhang Ruilin等[13]研究获得的小球藻蛋白酶解物中小于1 000 Da的肽段仅占13.81%。

表2 PE相对分子质量分布Table 2 Relative molecular mass distribution of PE
2.2 超滤膜分离各组分对胰脂肪酶活性的抑制作用
由图1可知,在8 mg/mL质量浓度下观察PE及各个组分对胰脂肪酶活性的抑制作用,<5 kDa组分对胰脂肪酶活性抑制率最高((45.44±3.52)%),显著(P<0.05)高于PE和其他2 个组分,与奥利司他(8 μg/mL)没有显著差异(P>0.05)。因此,选择<5 kDa组分进一步分离纯化。

图1 超滤各组分的胰脂肪酶抑制活性Fig.1 Pancreatic lipase inhibitory activity of fractions obtained by ultrafiltration
2.3 Sephadex G-25分离纯化
如图2所示,<5 kDa组分经Sephadex G-25分离后得到2 个主峰(F1、F2)。根据凝胶柱分离原理可知F1分子质量大于F2,且F2的相对含量更高,这与前面PE分子质量分布测定结果一致。由图3可知,F1和F2均表现出一定的胰脂肪酶抑制活性,在8 mg/mL质量浓度下F2对胰脂肪酶活性抑制率显著(P<0.05)高于F1,达到(42.33±0.61)%。分子质量是影响蛋白质水解物或肽生物利用度的重要因素,因此确定分子质量较小且抑制率较高的主峰F2为蛋白核小球藻胰脂肪酶抑制肽(PES),作为进一步研究对象。

图2 <5 kDa组分的Sephadex G-25分离谱图Fig.2 Chromatogram of fraction with molecular mass less than 5 kDa separated on Sephadex G-25 column

图3 Sephadex G-25分离各主峰的胰脂肪酶抑制活性Fig.3 Pancreatic lipase inhibitory activity of fractions from Sephadex G-25 chromatography
2.4 纯化肽PES的降脂活性评价结果
2.4.1 油红O染色
油红O为脂溶性染料,能够进入线虫透明体着色,使组织内的脂滴呈现红色,从而量化虫体内的脂肪[37]。如图4所示,高脂模型组线虫虫体颜色整体较深,纯化肽PES各剂量组虫体颜色随质量浓度增大而逐渐变浅,在高剂量组中表现比较明显,高剂量组虫体颜色介于正常对照组与阳性对照组之间。

图4 油红O染色图Fig.4 Photographs of oil red O staining
通过对各组虫体染料的定量分析,可以反映油红O染色处理的吸光度与脂肪含量的关系,吸光度越大说明体内脂肪沉积越多[38]。由图5可知,高脂模型组线虫体内脂肪沉积量显著(P<0.05)高于正常对照组,说明使用含10 mmol/L葡萄糖NGM培养的C.elegans能够诱导脂肪过度生成。在高剂量1 mg/mL时,纯化肽PES对线虫体内的降脂效果最佳,其脂肪沉积量比高脂模型组低22.5%,与阳性对照组无显著差异(P>0.05)。
2.4.2 线虫体内甘油三酯和总胆固醇的含量
由图6可见,高脂模型组线虫体内甘油三酯、总胆固醇含量均显著高于正常对照组(P<0.05),说明使用含10 mmol/L葡萄糖的NGM培养C.elegans成功构建C.elegans高脂模型。纯化肽PES各剂量组线虫的甘油三酯含量均显著低于高脂模型组(P<0.05),与阳性对照组差异不显著(P>0.05),各剂量组之间差异不显著(P>0.05)。纯化肽PES各剂量组线虫的总胆固醇含量均显著低于高脂模型组(P<0.05),与阳性对照组差异不显著(P>0.05),中剂量组、高剂量组与正常对照组之间差异不显著(P>0.05)。整体来看,纯化肽PES具有较好的降脂能力,质量浓度为1 mg/mL时能够降低高脂模型组线虫体内27.4%甘油三酯和29.4%总胆固醇水平,改善高糖饮食线虫的脂代谢紊乱。

图6 纯化肽PES对线虫体内甘油三酯和总胆固醇含量的影响Fig.6 Effect of PES on triglyceride and total cholesterol contents in C.elegans
2.5 基于LC-MS/MS鉴定纯化肽PES
总离子流色谱图见图7,鉴定得到999 条肽段,来源于64 种小球藻蛋白。结果显示,999 条肽段中五肽的相对含量总和达到72%,六肽的相对含量总和达到23%,七肽及7 个氨基酸以上组成的肽段仅占5%,且相对分子质量在400~700 Da之间的肽段相对含量总和占比89.7%,其中肽段FLGPF的相对含量最高(图8),单个肽占比高达7.9%。有关研究表明当多肽药物分子质量超过700 Da时,其生物利用度将随分子质量增加而显著下降,而分子质量小于500 Da的小肽(2~6 个氨基酸)具有最高的生物利用度[26]。因此,以5~6 个氨基酸组成的肽段为主要研究对象,选取相对含量及图谱鉴定可信度较高的10 条肽段,按相对含量从高到低排序(表3),进入下一步分析。
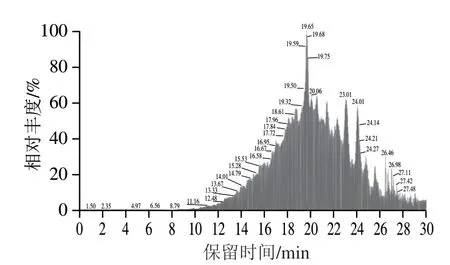
图7 纯化肽PES的总离子流色谱图Fig.7 Total ion current chromatogram of PES

图8 LC-MS/MS鉴定FLGPF的一级质谱图(A)和二级质谱图(B)Fig.8 Primary (A) and secondary (B) mass spectra of FLGPF by LC-MS/MS

表3 LC-MS/MS多肽测序结果Table 3 Results of polypeptide sequence identified by LC-MS/MS
2.6 分子对接虚拟筛选
分子对接技术实质是大分子蛋白受体与小分子配体之间通过能量匹配和几何匹配从而相互识别,用来模拟蛋白和小分子之间的相互作用[39]。采用MOE软件进行对接,将10 条肽段与PTL蛋白受体对接能绝对值由大到小排列,如表4所示。对接能绝对值越高,说明该分子与受体的结合亲和力越强。因此,可以认为HMPALV(-10.32 kcal/mol)、VPIIMH(-10.01 kcal/mol)、FLSQPF(-9.94 kcal/mol)、LLAPY(-9.60 kcal/mol)和FLGPF(-9.39 kcal/mol)肽段可能具有较强的抑制胰脂肪酶活性能力,用于下一步合成和活性验证。

表4 肽与PTL蛋白分子对接能Table 4 Molecular docking energy between peptides and PTL
2.7 合成肽的活性验证
采用Fmoc固相合成法制备HMPALV、VPIIMH、FLSQPF、LLAPY和FLGPF五条肽段,如图9所示,在1 mg/mL质量浓度时HMPALV对胰脂肪酶活性抑制率最低,FLGPF的抑制率最高。通过查看5 个肽段与酶蛋白的结合模式,发现虽然HMPALV对接能绝对值较高,但并不是在胰脂肪酶靶点上结合,所以没有起到良好的抑制作用。将VPIIMH、FLSQPF、LLAPY和FLGPF这4 条肽段序列与活性肽数据库(BioPepDB、DFBP和EROP-Moscow)中现存数据进行比较,没有发现相同的降脂肽序列,表明发现新的胰脂肪酶抑制肽,这为蛋白核小球藻在降脂方面的应用提供新的参考依据。

图9 合成肽的胰脂肪酶抑制活性Fig.9 Pancreatic lipase inhibitory activity of synthetic peptides
2.8 合成肽FLGPF与胰脂肪酶分子作用特征
如图10所示,测定了不同质量浓度下FLGPF的胰脂肪酶活性抑制率,使用奥利司他(8 μg/mL)作为阳性对照。可以看出FLGPF的胰脂肪酶活性抑制率呈现出一定的剂量依赖性增加,在质量浓度为4 mg/mL和8 mg/mL时,对胰脂肪酶活性抑制率分别达到(38.39±3.47)%和(50.12±0.84)%,与从红小豆中筛选得到的一种抗肥胖十三肽FDTGSSFYNKPAG在4 mg/mL时的胰脂肪酶抑制率(36.28%)[40]接近。

图10 不同质量浓度下FLGPF的胰脂肪酶抑制活性Fig.10 Pancreatic lipase inhibitory activity of FLGPF at different concentrations
由图11可知,抑制剂组和无抑制剂组拟合得到的曲线都通过原点,且添加1 mg/mL的FLGPF后,曲线斜率降低,说明FLGPF对胰脂肪酶的抑制作用类型为可逆抑制。FLGPF通过非共价键与酶和(或)酶-底物复合物进行可逆性地结合使酶活性降低或失活,影响酶催化效率。
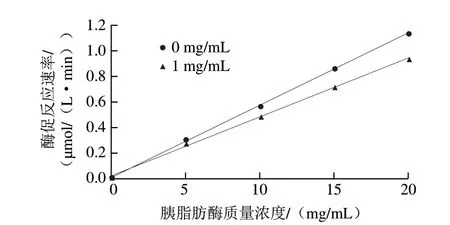
图11 FLGPF对胰脂肪酶的抑制作用类型Fig.11 Inhibition types of FLGPF on pancreatic lipase
由图12可知,在底物浓度1~8 mmol/L范围内,通过绘制添加1、2 mg/mL抑制剂组和无抑制剂组的Lineweaver-Burk曲线发现,3 条曲线相交于横轴,此时Km不变,Vmax变小,且Vmax随抑制剂质量浓度的增加而减小,表明FLGPF对胰脂肪酶的抑制作用类型为非竞争性抑制,其抑制作用不会随底物浓度增加而减弱,该特性比竞争性抑制剂更有利于控制餐后血脂的增高[30]。
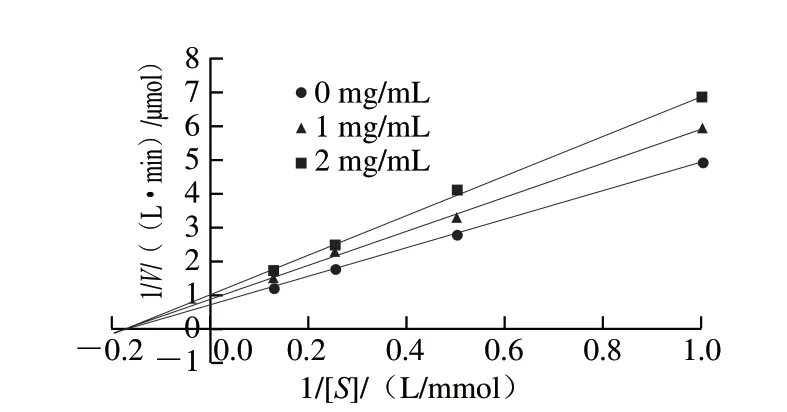
图12 FLGPF对胰脂肪酶的Lineweaver-Burk曲线图Fig.12 Lineweaver-Burk curve of the effect of FLGPF on pancreatic lipase
抑制常数Ki是反映酶和抑制剂复合物解离难易程度的重要指标,其数值越小,说明抑制剂与酶结合越紧密,酶与抑制剂越难分离,抑制作用越强[30]。以双倒数曲线的斜率(k)为纵坐标,抑制剂质量浓度为横坐标,进行二次作图绘制(图13)可计算得到FLGPF对胰脂肪酶的抑制常数Ki为5.23 mg/mL,小于廖家乐等[28]测定的枸杞叶黄酮对胰脂肪酶的Ki值(6.04 mg/mL)。

图13 FLGPF对胰脂肪酶的Lineweaver-Burk曲线斜率图Fig.13 Slope plot of the Lineweaver-Burk curve
为进一步明确FLGPF与胰脂肪酶的作用模式,进行分子对接(图14),FLGPF与PTL蛋白的结合位点形成了合适的空间互补。FLGPF的Phe1主链上—NH3+基团上的氢作为氢键供体,与PTL蛋白的Arg79侧链的氧原子形成氢键作用。FLGPF的Phe1主链上的—NH3+基团与PTL蛋白Trp252的苯环形成π-阳离子作用。FLGPF的Phe5主链上—NH3+基团上的氢与PTL蛋白Tyr114的苯环形成π-氢键作用。FLGPF与PTL蛋白也存在范德华力。相关研究发现底物(脂类)与胰脂肪酶活性中心催化位点Ser152、His263、Asp176相结合[30],而分子对接结果显示FLGPF与酶催化活性中心之外的位点Arg79、Trp252、Tyr114相结合,符合非竞争性抑制作用特征,此结果与图12所示的抑制动力学结果一致。
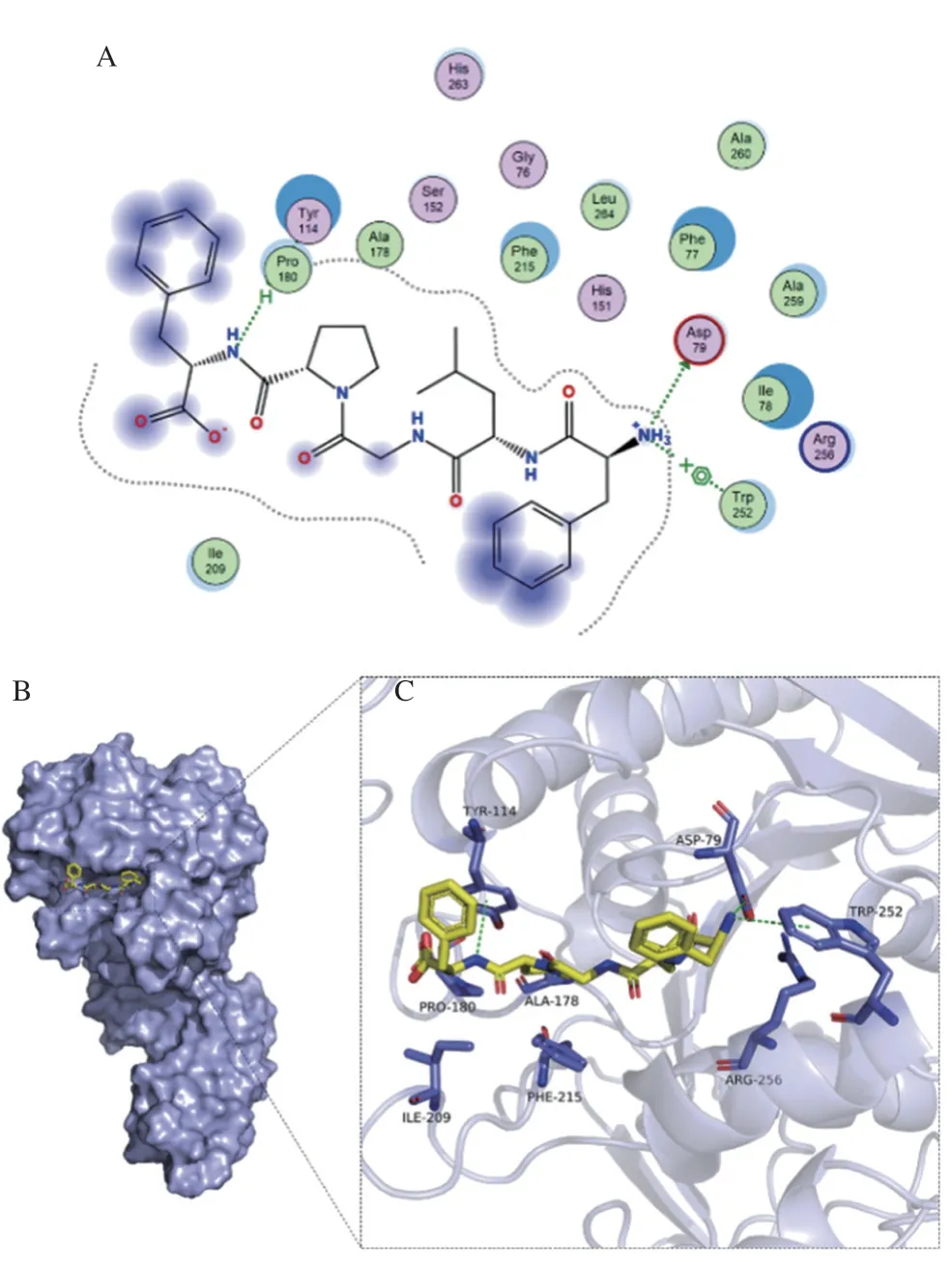
图14 FLGPF与PTL的二维(A)、表面(B)及三维(C)结合模式图Fig.14 2D (A),surface (B) and 3D (C) binding models of FLGPF and PTL
3 结论
本研究以蛋白核小球藻为原料,深入分析分离得到纯化肽(PES)的降脂效果,筛选出FLGPF、VPIIMH、LLAPY和FLSQPF 4 条新的胰脂肪酶抑制肽。结果表明,PES具有较好的降脂活性,能够有效抑制高糖饮食线虫体内的脂肪沉积,显著降低甘油三酯和总胆固醇水平。鉴定得到的短肽FLGPF为一种可逆非竞争性抑制的胰脂肪酶抑制肽,但其相关作用机制尚未明确,后期将从秀丽线虫脂代谢通路出发(如TGF-β和胰岛素代谢通路、sbp-1/mdt-15介导的固醇反应元件结合蛋白代谢通路、nhr-49介导的核激素信号通路、5-羟色胺(tph-1)介导的信号通路等),明确关键作用靶点,进一步探明其降脂作用机理。本研究可为小球藻降脂活性肽的开发提供理论参考。
