温和热辅助pH值碱性偏移处理对猪肝蛋白结构和功能特性的影响
2024-01-03唐永欣彭松林郭晨晨尚永彪
唐永欣,彭松林,郭晨晨,徐 毅,尚永彪
(西南大学食品科学学院,重庆 400715)
肉类行业每年生产大量副产品,如内脏、骨头、血、皮、角和蹄,其中很多副产物没有被有效利用,大量废弃物已成为影响资源充分利用的严重问题,更好地利用这些肉类副产品是全世界屠宰加工行业的共同目标[1]。在动物副产品中,动物内脏蛋白质含量丰富,可以作为生产高价值产品的潜在原料。猪肝是生猪屠宰的副产品,约占猪体质量的1.4%~2.5%,其蛋白质、铁、多种维生素(VA、VE、VB1、VB2、叶酸)等营养成分的含量远高于其他肉类产品[2]。
猪肝是价格低廉的高蛋白资源,猪肝蛋白(porcine liver protein,PLP)包括水溶性和水不溶性两类蛋白质,PLP以水溶性蛋白为主,占比高达78.6%,但PLP的分子质量较大、结构紧密、溶解性较差、乳化性和起泡性等功能特性欠佳[3],因此,PLP的加工利用受到很大局限。利用科学的方法对天然蛋白质进行人工修饰能够改变蛋白质的结构,可改善其功能特性。热处理是常用的蛋白改性方式,适当热处理能加速蛋白分子运动,促进疏水性氨基酸暴露,使得蛋白质三级结构部分或完全展开,从而使蛋白质结构更加灵活。Zhang Yazhen等[4]分别用70、80 ℃或90 ℃处理花生分离蛋白(peannut protein isolate,PPI)30 min,发现加热后的PPI具有更高的表面疏水性、膨胀模量和表面压力,加热也使其粒径减小、乳化稳定性增加。然而动物源蛋白质对温度较为敏感,热稳定性较差[5]。pH值偏移处理主要是将中性的蛋白质溶液pH值调至远离自身等电点的酸、碱性环境中,在酸、碱性环境处理一段时间后,再将蛋白溶液pH值调回中性。pH值偏移处理通过改变电荷的方式来调控蛋白分子间及分子内静电排斥作用力,从而使蛋白结构发生改变。相比于直接热处理,在酸、碱性条件下的热处理更为温和,既能改变蛋白质的三级结构,又对蛋白质分子二级结构的影响较小,避免蛋白质之间热聚集[6]。Yu Yali等[6]采用温和热处理和pH值碱性偏移处理相结合,提高蛋清蛋白的乳化性能。Farhad等[7]利用碱热处理蚕豆分离蛋白使溶解度分别在pH 3.0、6.0和7.0条件下从43%、14%和35%提高到90%以上,在pH 11.0条件下加热,也能有效改善起泡性和泡沫稳定性。这些研究均表明适度的碱热处理能有效促进动物蛋白分子在界面的吸附作用,从而对蛋白的乳化性起着正向积极作用。然而,目前关于pH值碱性偏移与温和热处理对PLP的相关研究鲜有报道。
本研究针对PLP功能特性差的问题,选择pH 9、11作为pH值碱性偏移处理条件,同时在25~50 ℃温度范围内对PLP进行加热改性,考察温和热处理与pH值碱性偏移处理相结合对PLP水合性质和表面功能特性的影响,分析探讨PLP功能特性变化的内在原因,旨在为猪肝资源的高值开发和有效利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜猪肝(80~120 kg洋三元公猪屠宰后约3 h)重庆北碚区天生丽街永辉超市;一级玉米油 山东三星玉米科技有限公司;透析袋(分子截留量为8 000~14 000 Da)美国生物医学公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒 北京索莱宝科技有限公司。
无水磷酸二氢钠、无水磷酸氢二钠、考马斯亮蓝R-250 上海麦克林生化科技有限公司;盐酸 宁波大川精细化工有限公司;五水硫酸铜 广东光华科技有限公司;酒石酸钾钠 宁波大川精细化工有限公司;8-苯胺基-1-萘磺酸铵(8-anilino-1-naphthalenesulfonic acid,ANS)上海源叶生物科技有限公司;牛血清蛋白、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)成都市科隆化学品有限公司;甘氨酸(Gly)、三羟甲基氨基甲烷(Tris)、SDS 德国Biofroxx公司;以上试剂纯度级别均为分析纯及以上。
1.2 仪器与设备
TGL-16高速冷冻离心机 四川蜀科仪器有限公司;UV-5100紫外-可见分光光度计 上海元析仪器有限公司;PowerPacTMBasic小型垂直电泳仪 美国Bio-Rad公司;XHF-D内切式匀浆机 宁波新芝生物科技股份有限公司;PHS-4C+酸度计 成都世纪方舟科技有限公司;ZEN3690马尔文激光粒度分析仪 英国马尔文仪器公司;Spectrum100红外光谱仪 美国珀金埃尔默仪器有限公司;F-2500荧光分光光度计 日本日立公司;BX53荧光正置显微镜 日本Olympus公司。
1.3 方法
1.3.1 PLP提取
参考潘成磊等[8]的方法并稍加修改。将猪肝洗净后剔除筋膜,切块清洗2 次沥干,再打成泥状。以料液比1∶3的比例向猪肝泥中加入0.05 mol/L pH 7.4的磷酸盐缓冲溶液,采用内切式匀浆机高速匀浆3 次(10 000 r/min,每次30 s),随后离心(4 ℃、9 000×g,20 min),再用纱布过滤除去脂肪,滤液收集于锥形瓶中,沉淀绞碎后按上述操作反复2 次,合并所有收集的滤液,透析48 h后冷冻干燥得到目标产物PLP粉。经测定,该PLP粉蛋白质量分数(以凯氏定氮法测定)为(87.67±0.8)%,水分质量分数为(4.79±0.21)%,脂肪质量分数为(1.34±0.16)%,灰分质量分数为(7.87±0.27)%,所提蛋白于-18 ℃冰箱密封保存。
1.3.2 PLP质量浓度测定
参考Cui Leqi等[9]的方法进行,牛血清蛋白作为标准蛋白,用双缩脲法测定PLP浓度,以蛋白质量浓度、吸光度为横、纵坐标,制得标准曲线为y=0.048 4x+0.000 8,R2=0.999 8。
1.3.3 样品处理
配制质量浓度为10 mg/mL的PLP溶液,冰水浴磁力搅拌30 min保证溶解充分。将溶液pH值调为7.0后冰水浴搅拌15 min,然后将溶液分为3 组,分别调整pH值至7、9、11,每组再以3 份试样为一小组,分别在25、40、50 ℃水浴加热30 min。以pH 7在25 ℃搅拌30 min为对照,各处理组分别命名为pH 7-40、pH 7-50、pH 9-25、pH 9-40、pH 9-50、pH 11-25、pH 11-40、pH 11-50。处理后的样品冷却后用2 mol/L的HCl溶液将pH值调至7.0搅拌15 min,样品由初始pH 7调整到9或11后再调回到pH 7的过程即为pH值偏移处理。具体实验分组见表1。

表1 实验样品分组Table 1 Experimental sample grouping
1.3.4 蛋白溶解度测定
参考计红芳等[10]方法。将稀释质量浓度为2.5 mg/mL的PLP溶液冷冻离心(4 ℃、5 500×g,15 min),用双缩脲法分别测定上清液及离心前溶液的蛋白质量浓度。蛋白溶解度按式(1)计算:
式中:C1为离心后上清液蛋白质量浓度/(mg/mL);C0为离心前溶液中蛋白质量浓度/(mg/mL)。
1.3.5 乳化活性测定
参考Pearce[11]和Kingsley[12]等的方法并稍作修改。将蛋白液(质量浓度2.5 mg/mL)和大豆油按3∶1的体积比加入50 mL塑料离心管中,高速匀浆后立即吸取50 μL底部乳化液至含有5 mL 0.1% SDS溶液的试管中,摇匀后立即用紫外分光光度计测定500 nm波长处的吸光度(A0),50 μL超纯水进行相同处理作为空白对照。PLP乳化活性指数(emulsifying activity index,EAI)按式(2)计算:
式中:φ为油相体积分数(油的体积/乳化体系的体积);ρ为蛋白质量浓度/(g/mL);A0为乳化液在0 min时的吸光度;稀释倍数为101。
1.3.6 乳液稳定性测定
参考Lu Yinyin等[13]的方法并稍作修改。测定稳定30 min乳液在500 nm波长处的吸光度,A500nm为浊度,表示乳液的乳化稳定性。
1.3.7 粒径分布及Zeta电位测定
参考吴佳[14]的方法并稍作修改。将所有样品用超纯水稀释为1mg/mL的PLP溶液,用激光粒度分析仪测定,记录其粒径分布。条件参数为散射角90°、平衡时间60 s、测试温度25 ℃,分散剂为水,黏度0.887 2,折射率1.330;蛋白,折射率:1.450。Zeta电位测定:将所有样品稀释成1 mg/mL的PLP溶液,用激光粒度分析仪测定其电位。
1.3.8 活性巯基的测定
参考Beveridge[15]和Gao Hao[16]等的方法测定PLP的游离巯基含量,并稍作修改。用4 mmol/L EDTA、0.09 mol/L Gly和0.086 mol/L Tris配制pH 8.0的Tris-Gly缓冲溶液,随后将PLP溶于缓冲液中配制成1 mg/mL的PLP溶液。将3 mL的PLP溶液与0.03 mL的4 mg/mL 5,5′-二硫代双(2-硝基苯甲酸)缓冲液混合,振荡混匀,于30 ℃水浴锅中避光水浴30 min,测定412 nm波长处吸光度,以缓冲液和蛋白溶液为空白,活性巯基含量按式(3)计算:
式中:A412nm为蛋白溶液在412 nm波长处吸光度;D为稀释因子;C为蛋白质量浓度/(mg/mL);73.53由106/(1.36×104)计算,摩尔吸收率为1.36×104。
1.3.9 SDS-PAGE测定
参考Li Yihe等[17]的方法适当修改。按照SDS-PAGE试剂盒的要求,制作体积分数分别为12%、5%的分离胶与浓缩胶。将蛋白样品(2.5 mg/mL)与上样缓冲液按4∶1(V∶V)的比例混合密封后,于100 ℃煮沸5 min后待其自然冷却。取20 μL注入浓缩胶泳道中,浓缩电压为60 mV,分离电压为80 mV。用考马斯亮蓝R-250染色3 h,然后配制脱色液(100 mL冰醋酸、50 mL无水乙醇,纯水定容至1 000 mL)进行脱色,保证脱色液液面高于凝胶,每隔30 min更换一次脱色液,直至条带清晰为止,结果用相机拍照。
1.3.10 红外光谱测定
参考赵飞[18]的方法并有所修改。将样品真空冷冻干燥,设定测定红外吸收光谱范围4 000~600 cm-1,分辨率4 cm-1,以不放样品为空白。用Spectrum软件对数据切换成吸光度后进行基线校正、数据调整、平滑、归一化等操作。Peakfitv4软件拟合谱带范围1 600~1 700 cm-1,计算PLP二级结构的含量。
1.3.11 荧光光谱测定
参考Gao Hao等[16]的方法并有所修改。配制0.25 mg/mL PLP溶液,在室温(25 ℃)条件下使用荧光分光光度计对蛋白溶液进行分析。荧光条件:石英比色皿光程1 cm,激发波长290 nm,发射光谱范围300~460 nm,狭缝宽度5 nm,电压700 mV,扫描速率300 nm/min。
1.3.12 表面疏水性测定
参考朱建宇等[19]的方法并稍作修改。取4.0 mL质量浓度调为0.25 mg/mL的PLP溶液,滴入8 mmol/L的ANS溶液20 μL,暗处振荡均匀,设定激发波长390 nm,发射波长480 nm,2 种狭缝宽度均为5 nm测定荧光强度。
1.3.13 乳液的光学显微镜观察
吸取10 μL均质后的乳液制作装片,制作过程中避免产生气泡,用光学显微镜观察并拍照记录。
1.4 数据处理与分析
2 结果与分析
2.1 温和热辅助pH值碱性偏移处理对PLP溶解度的影响
如图1所示,与对照组相比,处理组pH 7-40和pH 7-50的溶解度没有显著变化(P>0.05),说明单独加热处理不能显著提高PLP溶解度;在pH 9偏移条件下,溶解度相较于对照组大幅度增加,但50 ℃较40 ℃处理变化不显著(P>0.05);随着pH值碱性偏移处理程度的增强(pH 11偏移处理),蛋白质溶解度显著提高,且在同一pH值中,溶解度随处理温度的提高而显著上升(P<0.0.5)。Wang Yuntao等[20]研究发现单一热处理PPI时,其溶解度未有明显变化,而pH 10偏移结合适当加热能显著提高溶解度。王庆玲[21]发现仅热处理对汉麻蛋白溶解度没有显著影响,而碱热处理能显著提高汉麻蛋白的溶解度。Oliyaei等[22]在不同提取温度、不同碱性条件提取灯笼鱼蛋白,发现在pH 10、pH 12偏移条件下,随着提取温度的升高,溶解度逐渐增加。本实验结果与上述研究结果一致。

图1 温和热辅助pH值碱性偏移处理对PLP溶解度的影响Fig.1 Effect of mild heating assisted alkaline pH shift treatment on the solubility of PLP
2.2 温和热辅助pH值碱性偏移处理对PLP乳化活性的影响
如图2所示,pH 7-40的乳化性与对照组相比没有显著差异(P>0.05),50 ℃温和热处理使得PLP乳化活性比对照组更差(P<0.05)。在pH 9碱性偏移条件下,随着温和热处理温度的提高,PLP乳化活性先上升后下降,但pH 9-25与pH 9-50处理组之间并无显著差异(P>0.05),Li Lingyun等[23]认为pH 值碱性偏移处理使得蛋白质提前展开,这能提高蛋白在较高温度下热稳定性。在pH 11碱性偏移条件下,较高的温度下也能提高PLP乳化活性(P<0.05)。耿蕊[24]发现在pH值酸性偏移结合温和热处理大豆蛋白时,单独热处理(50 ℃、60 ℃)并未改善大豆分离蛋白的乳化性质,而pH 1.5与温和热处理结合显著改善其乳化活性与乳化稳定性。杨慧[25]在研究温度对大鲵肌浆蛋白乳化活性时,也发现适当加热能提高蛋白乳化活性,热处理温度升高至50 ℃,肌浆蛋白乳化活性开始降低。本实验结果与上述研究结果基本一致。
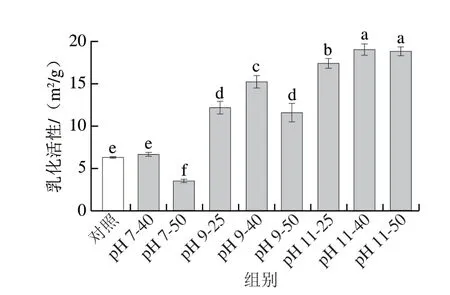
图2 温和热辅助pH值碱性偏移处理对PLP乳化活性影响Fig.2 Effect of mild heating assisted alkaline pH shift treatment on the emulsifying activity of PLP
2.3 温和热辅助pH值碱性偏移处理对PLP乳液稳定性的影响
乳化液是一种不稳定的分散体系,在长时间的静置状态下可能会出现失稳现象,乳化液的浊度或浊度比降低,出现分层现象,并且分层界面会随时间的推移不断从底层向上移动[26]。从图3可以看出,在50 ℃条件下pH 9和pH 11偏移处理均能提高乳化稳定性,且pH 11偏移处理更有利于提高乳化稳定性(P<0.05)。单纯温和热处理时,随着处理温度的提高,乳液的乳化稳定性显著下降(P<0.05);pH 9偏移处理时,随着处理温度的提高,乳液的乳化稳定性有所下降,但50 ℃处理组与40 ℃处理组之间无显著差异(P>0.05);pH 11偏移处理时,不同温度处理组之间的乳化稳定性无显著差异(P>0.05)。上述结果表明,与对照组相比,在pH值为7的条件下进行加热处理不能提高乳液的乳化稳定性,pH值大幅度碱性偏移(pH 11处理组)可显著提高乳化稳定性,单从乳化稳定性的角度看,25 ℃辅助pH 11偏移处理更为有利。

图3 温和热辅助pH值碱性偏移处理对PLP乳液稳定性的影响Fig.3 Effect of mild heating assisted alkaline pH shift treatment on the emulsion stability of PLP
2.4 温和热辅助pH值碱性偏移处理对PLP粒径分布、Zeta电位的影响
温和热辅助pH值碱性偏移处理对PLP溶液粒径分布及平均粒径的影响如图4A、B所示,与对照组相比,单一温和热处理时,蛋白质的粒径随着温度的升高而大幅度减小,但粒径分布指数(polymer dispersity index,PDI)并没有下降、粒度的分布范围仍然很广。在同样温度条件下,pH值碱性偏移处理能使蛋白质的粒径大幅度减小、粒径分布范围变窄,但各处理组之间的PDI没有显著差异。前人的研究发现,较高碱性pH值偏移处理能促进鹅肝蛋白[27]、蛋清蛋白[28]等蛋白聚集体解聚,从而降低蛋白粒径。Farhad等[7]研究发现单独加热或碱性pH值偏移协同热处理均能显著降低蚕豆蛋白粒径,但与单独pH值碱性偏移处理组相比,单独加热组的粒径更大。

图4 温和热辅助pH值碱性偏移处理对PLP粒径分布(A)、平均粒径(B)和Zeta电位(C)的影响Fig.4 Effect of mild heating assisted alkaline pH shift treatment on particle size distribution (A),average particle size (B) and zeta potential (C) of PLP
温和热辅助pH值碱性偏移处理后PLP的Zeta电位变化情况如图4C所示,所有蛋白试样在处理后恢复至中性环境,因此蛋白表面均为负电荷。对照组的Zeta电位绝对值为18.47 mV,除pH 7-40处理组外,其他处理组的Zeta电位绝对值均显著高于对照组,且pH 11-50处理组的Zeta电位绝对值最高(26.63 mV)。
上述的实验结果表明,温和热处理、pH值碱性偏移处理以及温和热辅助pH值碱性偏移处理均能够减小蛋白质的粒径、增加蛋白质表面的电荷数量,其中温和热辅助pH 11碱性偏移处理的效果最好。pH 11碱性偏移处理能使蛋白质粒径减小、增强蛋白质间的静电排斥作用,而适度的温和热辅助处理能加速分子间的运动,使蛋白分子相互碰撞,从而进一步减小粒径,这就解释了PLP溶解度提升的原因。此外,碱性条件提供负电荷使得蛋白结构提前展开,热处理又使得蛋白进一步展开,改善其界面活性和表面膜的形成,有助于蛋白质扩散到油-水界面,得到乳化性和乳化稳定性更好的乳液。
2.5 温和热辅助pH值碱性偏移处理对PLP活性巯基的影响
活性巯基是蛋白质中重要的功能基团,其含量的变化可以反映蛋白质空间构象的变化。从图5可以发现,在同一温度下,随着碱性pH值偏移程度的增加,PLP活性巯基含量呈现下降趋势(P<0.05),王瑛[29]在研究酸碱诱导重折叠对罗非鱼肌球蛋白的影响时也发现活性巯基含量较对照组明显下降,这可能是因为蛋白在去折叠、重折叠过程中发生不同程度的变性,不能完全恢复原本的结构,使巯基更易氧化成二硫键。在碱性pH 9偏移基础上结合热处理则加剧这一趋势(P<0.05),造成这一现象的原因可能是加热使PLP活性增强,活性巯基转化成二硫键导致活性巯基含量降低。本结果与吴晓娟等[30]在pH值偏移结合热处理米糠蛋白对活性巯基含量影响研究中的变化趋势一致。同时Du Xin等[31]也发现在pH 5~8条件下,镜鲤肌原纤维蛋白的总巯基含量随温度升高(30~90 ℃范围内)而明显下降。

图5 温和热辅助pH值碱性偏移处理对PLP活性巯基含量的影响Fig.5 Effect of mild heating assisted alkaline pH shift treatment on reactive sulfhydryl content of PLP
2.6 温和热辅助pH值碱性偏移处理对PLP的SDS-PAGE影响
为了研究温和热辅助pH值碱性偏移处理对PLP一级结构的影响,通过SDS-PAGE观察样品中PLP亚基的变化。如图6所示,PLP对照组的电泳条带分子质量分布范围为10~15 kDa以及25~200 kDa,而在40~70 kDa范围的电泳条带颜色更深。单独温和热处理与温和热辅助pH值碱性偏移处理的多数试样保持了与对照组相同的电泳条带特征,但pH 9-50、pH 11-25、pH 11-40组浓缩胶条带顶部有更深的条带。单独温和热处理、单独pH值偏移及温和热辅助pH值偏移处理后PLP的电泳条带相似,表明各处理均没有引起PLP的明显降解,可见在碱性条件下热处理使PLP溶解度增加的主要原因不是蛋白质水解,而是蛋白高级结构的变化与非共价键作用改变[32]。pH 9-50、pH 11-25、pH 11-40组浓缩胶顶部有更深条带的原因可能跟二硫键的形成有关,Wang Yuntao等[20]研究发现在加热处理或pH值偏移条件下的热处理蛋白过程中,较大的团聚体和聚合物产生的原因可能是二硫键的形成。
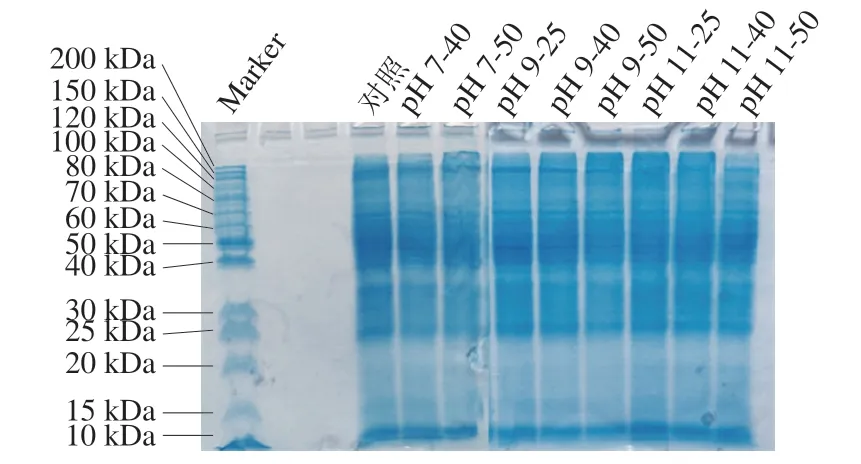
图6 温和热辅助pH值碱性偏移处理对PLP SDS-PAGE的影响Fig.6 Effect of mild heating assisted alkaline pH shift treatment on SDS-PAGE of PLP
2.7 温和热辅助pH值碱性偏移处理对PLP红外光谱的影响
蛋白质的红外光谱通常具有不同的酰胺区域,酰胺I带(1 600~1 700 cm-l,为C=O伸缩振动峰)和酰胺II带(1 500~1 600 cm-1,为C—N的伸缩振动峰和N—H弯曲振动峰)这2 个波段的光谱波长变化和强度大小常被用来表征蛋白质的二级结构变化,其中大多数研究者使用酰胺I带对蛋白二级结构进行研究。
如图7所示,PLP的红外图谱具有6 个主要特征吸收峰,分别在3 283(酰胺A带,为N—H伸缩振动吸收峰)、2 922(酰胺B带,C—H的对称和非对称伸缩振动峰)、1 638(酰胺I带,为C=O伸缩振动峰)、1 536(酰胺II带,为C—N的伸缩振动峰和N—H弯曲振动峰)、1 392 cm-1(为C—H弯曲振动峰)和1 231 cm-1(酰胺III带,为N—H变形振动峰)。对照组与处理组的红外光谱显示出相似的峰图,表明PLP的二级结构没有发生重大变化。然而,与对照组波数(1 638 cm-1)相比,单独热处理的波数更低(1 633 cm-1),碱性pH值条件下的热处理也有类似波数降低的情况,这可能是因为PLP的α-螺旋结构相对含量减少[33]。酰胺I带(1 600~1 700 cm-1)共拟合得出12 个蛋白峰,PLP二级结构相对含量如图8所示,单独热处理导致α-螺旋和β-转角结构相对含量下降,而β-折叠相对含量上升,表明PLP结构发生变化。相较于碱性条件下的热处理,单独热处理对二级结构的影响更加剧烈,PLP作为热敏感蛋白在较高温度下变性而无法有效地包裹油脂[34],这可能就是加热温度升高到50 ℃时(pH 7-50、pH 9-50),PLP乳化活性降低的原因。Fan Linlin等[35]与周若楠[36]分别发现热处理使β-乳球蛋白、菠萝蜜种子分离蛋白的α-螺旋和β-转角含量下降、β-折叠含量增加,并指出较高的β-折叠及无规卷曲会增加蛋白的柔性,从而有利于起泡能力的改善。李春翼[37]研究发现热处理使麦醇溶蛋白α-螺旋、β-转角含量下降、β-折叠含量增加。郑云芳等[38]研究表明热处理的温度升高、时间延长使得鲈鱼肌原纤维蛋白α-螺旋、β-转角含量下降,而无规卷曲和β-折叠含量相应增加。综上所述,温和热辅助pH值碱性偏移处理改变了PLP二级结构。
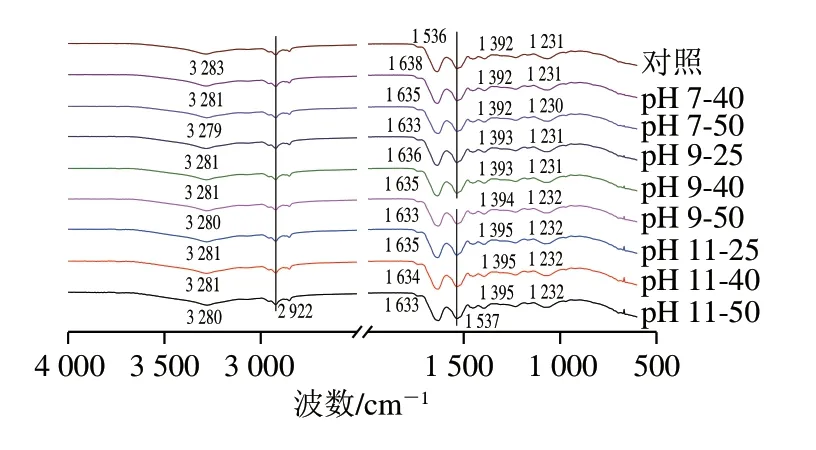
图7 温和热辅助pH值碱性偏移处理对PLP红外光谱的影响Fig.7 Effect of mild heating assisted alkaline pH shift treatment on infrared spectrum of PLP
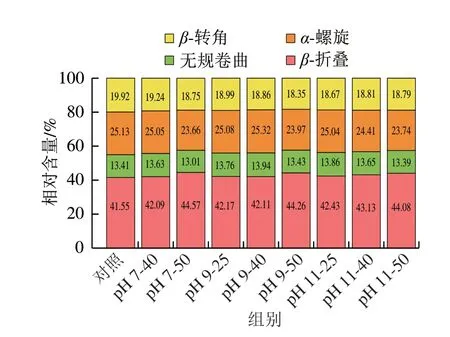
图8 温和热辅助pH值碱性偏移处理后PLP二级结构相对含量Fig.8 Relative contents of secondary structures in PLP after mild heating assisted alkaline pH shift treatment
2.8 温和热辅助pH值碱性偏移处理对PLP三级结构的影响
如图9所示,与对照组相比,内源荧光强度随热处理温度升高、碱性pH值偏移程度增加而下降,最大发射波长λmax从333 nm后移至337 nm。未进行pH值碱性偏移处理的PLP加热到40 ℃,其荧光强度降低幅度较小,而加热到50 ℃时,荧光强度下降幅度明显增加,说明未进行pH值碱性偏移处理加热到50 ℃时对PLP三级结构有较大影响。未处理PLP的荧光强度最高,这可能由于PLP分子结构有序折叠有助于内部芳香族氨基酸的包埋,而pH 11-50处理组的内源荧光强度明显降低,波长明显后移。内源荧光强度的减弱以及最大波长的后移表明PLP的三级结构被破坏,导致氨基酸暴露在极性溶剂中。总之,上述结果说明温和热辅助pH值碱性偏移处理使PLP蛋白结构进一步展开,改变蛋白的高级结构。王健等[39]在对pH值偏移结合热处理大豆蛋白的研究中也有类似发现。Yu Yali等[6]通过研究温和加热辅助碱性pH值偏移对蛋清蛋白的影响,发现在碱性pH值偏移条件下,随着加热温度的升高,蛋清蛋白的内源荧光强度逐渐下降,最大波长出现后移,这与本研究结果一致。

图9 温和热辅助pH值碱性偏移处理对PLP三级结构的影响Fig.9 Effect of mild heating assisted alkaline pH shift treatment on tertiary structure of PLP
2.9 温和热辅助pH值碱性偏移处理对PLP表面疏水性的影响
表面疏水性可以表征疏水基团在蛋白质表面分布情况,与乳化性和起泡性等依赖于蛋白质界面性质的功能特性有关[6]。蛋白质的表面疏水性对PLP在油/水界面的吸附行为起着重要作用,可以促进蛋白质在油滴表面的吸附作用,防止其聚集和絮凝。
如图10所示,温和热辅助pH值碱性偏移处理对PLP表面疏水性的影响总体趋势是表面疏水性随着热处理温度、pH值碱性偏移处理程度的增加而升高。未进行pH值碱性偏移处理时,温和热处理后PLP的表面疏水性较对照组有所增加,这可能是因为PLP在热诱导作用下蛋白分子相互碰撞而破坏蛋白疏水相互作用,使疏水氨基酸暴露在溶液中。蛋白表面疏水性的增加使得蛋白溶解度降低,从而可能导致PLP更容易聚集,乳液稳定性会变差而出现分层。碱性pH值偏移处理的PLP的表面疏水性也明显高于未处理的PLP,这可能与碱性pH值偏移过程中蛋白质发生去折叠与重折叠使蛋白结构发生重排有关,原本在疏水相互作用下形成的蛋白聚集体被破坏,蛋白粒径减小,暴露出内部包裹的疏水基团。在碱性pH值偏移条件下,温和热处理使PLP的表面疏水性相较于对照组进一步增加,继续提高热处理温度,表面疏水性的增加幅度变小,这表明蛋白质在碱性环境和热作用下,蛋白质进一步展开暴露出更多的表面疏水基团。表面疏水性的增强改善了界面活性和表面膜的形成,从而使界面上的分散性和乳化性更好,这与乳化活性的变化趋势一致。Ma Wuchao等[40]研究发现对鳕鱼蛋白预热处理后,预热温度的增加提高了鳕鱼蛋白的表面疏水性,与本实验结果一致。
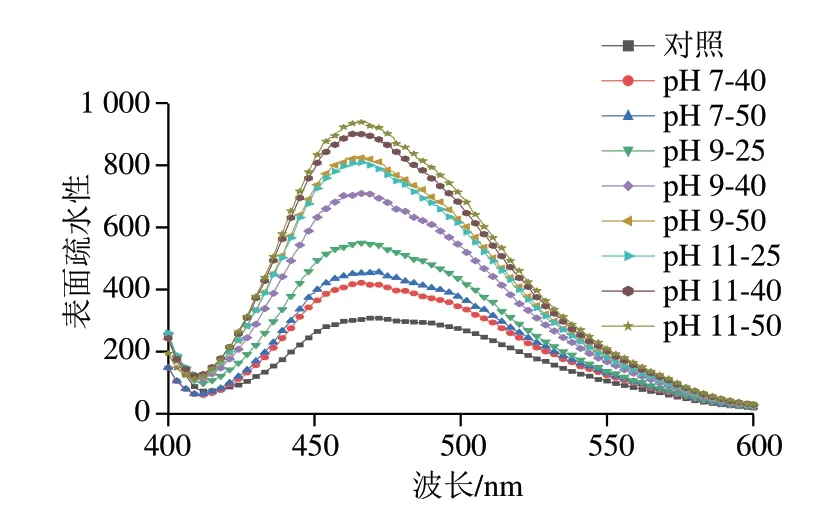
图10 温和热辅助pH值碱性偏移处理对PLP表面疏水性的影响Fig.10 Effect of mild heating assisted alkaline pH shift treatment on surface hydrophobicity of PLP
2.10 温和热辅助pH值碱性偏移处理对PLP乳液显微结构的影响
如图11所示,未处理PLP形成的乳液和温和热辅助pH值碱性偏移处理后蛋白形成的乳液显微结构有明显差异,可以清晰地看到对照组中的乳液液滴聚集体大小不一,加热到40 ℃(pH 7-40)时,乳液液滴粒径与对照组相比有所减小,但仍有较大粒径,加热到50 ℃(pH 7-50)时,乳液液滴不规则且发生明显的絮凝现象。在pH 9偏移条件下,相较于对照组,乳液尺寸逐渐减小。加热到40 ℃(pH 9-40)时,形成的乳液液滴尺寸比pH 9-25更小,加热到50 ℃(pH 9-50)时,乳液仍然出现少许絮凝现象,但pH 7-50组絮凝现象更为严重。在pH 11偏移条件下,乳液液滴尺寸小且呈现规则的球状,均匀分布在载玻片上,随着热处理温度的提升,乳液液滴尺寸进一步减小且分布均匀。乳液的显微结构变化与PLP粒径检测的结果略有不同,这可能是不同测定方法造成。对于粒度分布结果而言,样品混合步骤以及较低的蛋白浓度使得PLP颗粒难以聚集,而在显微镜观察中,热处理后PLP形成的乳液液滴相互排列,可能以更高的速率重新合并从而产生更多的絮凝[41]。

图11 温和热辅助pH值碱性偏移处理对PLP乳液显微结构的影响Fig.11 Effect of mild heating assisted alkaline pH shift treatment on microstructure of PLP emulsion
总的来说,pH 11-50组制备的乳液液滴尺寸最小且液滴分布状态均匀,单位面积内乳液液滴数量较多。有研究表明液滴粒径均匀分布和较小尺寸的液滴对于乳液的稳定至关重要[21]。李凌云[42]发现在pH 9条件下将肌球蛋白于75 ℃加热30 min后调回中性,相较于对照组直接加热,有更均匀和更小的乳液形态,表明碱性条件下的热处理相较于单独热处理可以改善乳液的稳定性。以上结果说明,较高的热处理不利于乳状液的稳定性,但碱性pH值偏移与热处理结合可以改善蛋白在油水界面的稳定性。
3 结论
在温和的温度变化范围内,单独热处理对PLP的溶解性无显著影响、对乳化活性及稳定性有不利的影响,单独热处理并不能有效展开蛋白的结构,仅是加速蛋白分子碰撞、减小粒径。温和热处理辅助pH值碱性偏移处理能有效地提高PLP的溶解性及乳化性质,特别是50 ℃热处理辅助pH 11偏移处理后,所得的PLP溶解度高、乳化性能稳定,且粒径小、Zeta电位绝对值大,形成的乳液分布均匀。此外,蛋白质的活性巯基含量减少,α-螺旋和β-转角结构相对含量下降,而β-折叠相对含量上升、表面疏水性提高,表明蛋白质发生一定程度的变性,其高级结构发生较大程度的改变。
综上所述,温和热辅助pH值碱性偏移处理对PLP进行处理能通过蛋白质分子结构和胶粒特性的改变使其水合性质和表面性质显著改善,温和热辅助pH值碱性偏移处理作为一种经济、安全且有效的改性手段,具有良好的应用前景。
