亚临界水法制备姜黄素纳米粒及其透膜性能分析
2024-01-03赵文英郑文迪宋晓旭朱庆书
赵文英,郑文迪,宋晓旭,王 珧,刘 蓓,陈 蕾,朱庆书,2,
(1.青岛科技大学化工学院,山东 青岛 266000;2.青岛科技大学高密校区,山东 高密 261550)
姜黄素是从姜科植物根茎中提取出的多酚类化合物,近年研究发现,姜黄素有优异的抗氧化、抗炎、抑菌等活性[1],可广泛用于食品、药品、化妆品等行业。但其水溶性差,难以跨膜转运,限制了应用[2]。对于水难溶性药物,近年来常将其制备成纳米制剂改善其缺陷[3-5]。目前,纳米制剂的制备主要分为两类,其中一类是将药物负载在纳米载体中,形成复合物靶向运送到给药位点[6-9],然而纳米载体本身或其降解产物常存在潜在毒性,因此,人们更倾向于制备无载体纳米粒[10-11]。
溶剂沉淀法[12-14]是一种制备无载体纳米粒的技术,其中需要使用有机溶剂溶解水难溶性药物,如Sharma等[15]采用反溶剂沉淀法,以丙酮为溶剂制备姜黄素纳米结晶,明显改善了姜黄素的溶解速率,但众所周知,丙酮等有机溶剂会产生溶剂残留并对人体和环境造成危害。因此,研究人员致力于使用绿色环保溶剂替代有机溶剂,如超临界CO2、亚临界水等。忻娜[16]、刘晓静[17]等采用超临界CO2抗溶剂法制备了姜黄素与不同载体材料的复合微粒,大幅度提高了姜黄素的溶出度,但鲜见采用亚临界水法制备姜黄素纳米粒的研究报道。将水加热至沸点以上,通过调节体系的压力使其依旧保持液体状态,称为亚临界水。亚临界水具有随温度升高,介电常数降低的特性,可用于代替有机溶剂溶解脂溶性强的药物[18]。目前已有使用亚临界水藕合溶剂沉淀法制备来曲唑[19]、磺胺甲恶唑[20]以及倍氯米松[21]等化学合成药物纳米粒的文献报道,从理论到实践证明了采用亚临界水技术制备水难溶性成分纳米粒的可行性。本研究采用亚临界水法制备姜黄素纳米粒,以期为开发姜黄素绿色环保递送系统提供支持,为天然来源功能性成分制备纳米粒提供技术和方法借鉴。
1 材料与方法
1.1 材料与试剂
姜黄素(纯度98%)南京都莱生物科技有限公司;家兔由青岛科技大学药理实验室提供;甲醇(色谱纯)德国Merck公司;乳糖、羟丙基甲基纤维素(hydroxypropyl methyl cellulose,HPMC)、聚乙烯吡咯烷酮K30(polyvinyl pyrrolidone K-30,PVPK30)、无水乙醇均为分析纯。
1.2 仪器与设备
UV1000型紫外分光光度仪 北京莱伯泰仪器有限公司;激光粉尘粒度仪 昆山鹭工精密仪器有限公司;regulus8100扫描电子显微镜(scanning electron microscope,SEM)日本日立株式会社;Nicolet IS10傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国赛默飞公司;DSC204F1差示扫描量热仪(differential scanning calorimetry,DSC)德国耐驰公司;U3000高效液相色谱仪 戴安中国有限公司;加压提取器由实验室自制。
1.3 方法
1.3.1 姜黄素纳米粒制备
称取适量姜黄素,置于加压提取器中,加入一定量的乙醇/水混合溶剂,密闭容器;容器内加压并保持在0.5 MPa,调节温度,当温度达到设定值时开始计时,保温30 min后,从取样口将提取器中的溶液匀速滴入到接收溶剂(含有稳定剂的去离子水)中,边滴加边搅拌(磁力搅拌,转速500 r/min),直至滴加结束,得到含有姜黄素纳米粒的混悬液。探讨接收溶剂温度、亚临界水温度、亚临界水/接收溶剂体积比、稳定剂类型及用量等因素对混悬液中姜黄素纳米粒的影响。
1.3.2 纳米混悬液载药量测定
按参考文献[22]的方法,以80%乙醇溶液为溶剂,在最大吸收波长426 nm处测定吸光度A426nm,绘制标准曲线,得回归方程:A426nm=0.137 1C+0.001 1(R=0.999 9),在0.4~6.4 μg/mL范围内具有良好的线性关系。根据标准曲线计算混悬液中姜黄素的含量。载药量计算公式如下:
1.3.3 纳米粒粒度分布测定
使用激光粉尘粒度仪测定姜黄素混悬液中纳米粒的粒径、多分散指数(polydisperse index,PDI)以及Zeta电位。将所制得姜黄素纳米粒混悬液用适量的去离子水稀释,取1.5 mL样品放入石英比色皿中,在25 ℃恒温条件下每组样品重复测定3 次。
1.3.4 FTIR分析
将姜黄素纳米粒和姜黄素原料药溶于无水乙醇,挥干溶剂后与溴化钾混匀,压片。在4 000~500 cm-1范围内对样品进行扫描,记录数据并绘图进行分析。
1.3.5 SEM表征
将姜黄素纳米粒混悬液滴加到硅片上,烘干后用导电胶黏附在样品台上,姜黄素原料药直接涂抹在导电胶上,将制备好的样品喷金后在SEM下观察颗粒形貌。
1.3.6 DSC分析
姜黄素原料药、姜黄素纳米粒进行DSC分析。扫描范围在24~245 ℃之间,以10 ℃/min速率升温。记录结果,绘制分析DSC曲线。
1.3.7 姜黄素纳米粒透膜性能考察
1.3.7.1 Franz扩散池法
以市售猪肠衣为半透膜,采用Franz扩散池法考察姜黄素纳米粒透膜性能。接受池中加入适量生理盐水,将温度设置为37 ℃,以300 r/min恒速磁力搅拌,定时取样。取出的样品用适量乙醇稀释,以80%乙醇溶液为空白对照,测定其在426 nm波长处的吸光度,带入标准曲线计算含量。以累积渗透量衡量药物透膜吸收的程度,计算公式如下:
式中:Q为累积渗透量/(μg/cm2);V0为接受池体积/mL;Cn为第n次取样测得的样品质量浓度/(μg/mL);V为取样体积/mL;Ci为第n-1次取样测得的样品质量浓度/(μg/mL);A为扩散池有效面积/cm2。
1.3.7.2 姜黄素体内转运过程
采用高效液相色谱法测定姜黄素在实验动物体内的质量浓度。色谱条件:Supersil ODS柱,柱温25 ℃,甲醇-2%冰醋酸溶液(75∶25,V/V)为流动相,流速1 mL/min。
配制不同质量浓度的姜黄素-血浆样品C,测量各样品中姜黄素的峰面积A,得到血浆中姜黄素的线性回归方程A=0.019 7C+0.026 1(R=0.999 2),质量浓度在2~200 ng/mL范围内线性良好。
选取家兔进行体内实验,分别配制20 mg/kg姜黄素原料药混悬液和20 mg/kg姜黄素纳米粒混悬液,灌胃给药后分别于0.17、0.5、1、2、3、4、6、8、10、12、24 h心脏取血2 mL,样品按常规方法处理后,注入高效液相色谱仪,测定样品中姜黄素的质量浓度,绘制药-时曲线。
1.4 数据处理
每个实验进行3 次,取平均值,使用Excel 2016软件作图,使用DAS2.0软件计算分析药动学参数。
2 结果与分析
2.1 制备姜黄素纳米粒影响因素分析
功能性成分的粒径越小,越易跨膜转运,因而具有较高的生物利用度,但物质的粒径越小,越具有较高的表面能而易发生团聚现象,造成分散体系不稳定[23],因此,在制备纳米粒时,必须兼顾粒径和体系稳定性。将制备好的姜黄素纳米粒在25 ℃测定粒径、PDI和Zeta电位,检测各因素对纳米粒粒径、粒径分布均匀度以及稳定性的影响,结果见表1。随亚临界水温度(110~140 ℃)升高,姜黄素粒径由177.5 nm增加至205.4 nm。目前普遍认为亚临界水法制备纳米粒的机理[24]是通过提高温度增加水难溶性物质在亚临界水中的溶解度,当环境温度降低时,溶液处于过饱和状态,水难溶性物质迅速析出,在一定范围内颗粒析出速率越快,析出的颗粒粒径越小。接收溶剂温度由30 ℃降至0 ℃,粒径由211.9 nm变为170.3 nm,进一步证实了该机理的合理性。但随温度升高,姜黄素在亚临界水中溶解度越大,在温度降低后,短时间形成晶核颗粒数量越多,这些具有较高表面能的晶核发生碰撞聚合的几率越大,从而形成更大粒径的颗粒。

表1 影响姜黄素纳米粒粒径、PDI、Zeta电位的因素Table 1 Influence of processing conditions on particle size,PDI and zeta potential of Cur nanoparticles
除亚临界水和接收溶剂温度会影响纳米粒粒径外,二者体积比也会影响姜黄素纳米粒的大小,接收溶剂用量增加至3 倍(由1∶1变为1∶3)则姜黄素粒径由269.8 nm降至170.7 nm。这是因为接收溶剂过少,瞬时形成的大量晶核不能迅速稀释,晶核之间容易发生碰撞,进而团聚成大颗粒;但当接收溶剂用量过大,与亚临界水的比例由1∶3增至1∶5时,姜黄素饱和溶液被接收溶剂稀释,晶核生成量相应减少,但晶体生长加剧,粒径也会变大。
Danaei等[25]研究认为,在一定范围内粒径小、分布窄的溶液系统具有良好的稳定性,并且PDI值在0.1~0.25之间表明粒径分布窄,大于0.5则表示粒径分布广。本实验制备的纳米粒PDI均在0.1~0.25 之间,制备工艺各因素对其粒径大小均匀度的影响较小。
纳米粒因具有较高的表面能,易发生团聚现象,因此接收溶剂中加入适量稳定剂,有助于姜黄素纳米粒均匀分散在水中,防止纳米粒团聚。通常认为添加一些位阻较大的长链分子或者枝状分子能起到提高纳米粒胶体稳定性的作用,这是因为位阻效应保证了纳米粒之间的有效排斥。基于此种考虑,本实验选择HPMC、PVPK30两种表面活性剂作为稳定剂,结果显示HPMC和PVPK30均使纳米粒粒径变大,并且稳定性变差(Zeta电位分别为0.3 mV和-17.1 mV);而选用水溶性糖类——乳糖作为稳定剂时,能有效降低纳米粒粒径,还能增强体系稳定性。其原因可能是乳糖吸附在纳米粒表面,降低了颗粒表面能,使晶体生长速度减慢,从而形成粒径更小的纳米粒。但当乳糖质量浓度(0.08 g/100 mL)超过一个临界值时,由于糖类本身具有的黏接性导致纳米粒黏附成团,反而使粒径增大,此前已有文献[20,26]证实,稳定剂浓度增加会产生类似的情况。为进一步考察稳定剂对纳米粒稳定性的影响,将加入3 种稳定剂的姜黄素纳米混悬液室温下放置7、14、21 d,结果见表2。随放置时间延长,以乳糖为稳定剂的混悬液中纳米粒粒径变化不明显,而HPMC和PVPK30为稳定剂的纳米粒粒径明显增大。

表2 稳定剂对姜黄素纳米粒粒径的影响Table 2 Influence of stabilizing agents on the mean particle size of Cur nanoparticles nm
由于姜黄素的水难溶性,尽管采用亚临界水为溶剂,其溶解度仍然较小,如在纯水体系中,所制备纳米粒粒径为141 nm,但其载药量仅为2.35%,因此考虑加入适量乙醇作为夹带剂改善姜黄素的溶解性。当增加体系中乙醇体积分数时,纳米粒的粒径逐渐增大,体系的载药量也逐渐增大,乙醇体积分数为30%时,粒径为168.4 nm,载药量增加至69.5%,乙醇体积分数增加至50%时,粒径为235.5 nm,载药量为87.3%,但体系的稳定性有所下降(Zeta电位的绝对值由29.5 mV降至22.4 mV)。原因在于姜黄素在乙醇/水混合溶液中的溶解度增大,则溶液中姜黄素含量增大,促进晶体成核、晶核间发生二次碰撞的概率增加,使纳米粒粒径增大,并使体系稳定性下降。
2.2 验证实验结果
在接收溶剂温度0 ℃、亚临界水温度120 ℃、亚临界水与接收溶剂体积比为1∶3、稳定剂乳糖质量浓度0.04 g/100 mL、夹带剂乙醇体积分数30%条件下,制得3 批姜黄素纳米粒,平均粒径为(166±2.7)nm,PDI为0.125±0.01,Zeta电位为(-29.8±0.62)mV,载药量为(70.2±0.93)%。
2.3 FTIR分析结果
如图1所示,3 361 cm-1处为姜黄素酚羟基伸缩振动峰,2 920、2 850 cm-1附近为亚甲基伸缩振动峰,1 660、1 646 cm-1和1 633 cm-1的峰与C=O和C=C基团的伸缩振动相关,1 470~1 416 cm-1范围内的峰与C=C和苯环相关[27]。姜黄素纳米粒与原料药在4 000~500 cm-1范围内的特征峰位置一致,峰强基本没有变化。由此可知,亚临界水制备姜黄素纳米粒没有改变药物的化学结构。

图1 姜黄素纳米粒和姜黄素原料药的FTIR图Fig.1 FTIR spectra of Cur and Cur nanoparticles
2.4 姜黄素纳米粒表征
2.4.1 SEM分析
图2a、b为姜黄素原料药SEM图谱,形态呈不规则块状;图2c、d为姜黄素纳米粒SEM图谱,呈现球形状态,颗粒大小分布均匀,分散度较好。

图2 姜黄素原料药(a、b)和姜黄素纳米粒(c、d)SEM图Fig.2 Scanning electron micrographs of Cur (a and b) and Cur nanoparticles (c and d)
2.4.2 DSC分析
由图3可知,姜黄素原料药的熔融峰在182.4 ℃,尖锐且强,说明其以稳定的晶体形式存在;姜黄素纳米粒的熔点为174.7 ℃,相比于原料有所降低。众所周知,熔点与微观结构中物质间的作用力大小有关,因此,熔点降低说明纳米粒的微观结构发生了改变;另外,姜黄素纳米粒的熔融峰由原来的尖而强变成矮而宽,可知姜黄素纳米粒的结晶度下降,倾向于以无定型形式存在,与SEM视野下纳米粒为球形结果一致。
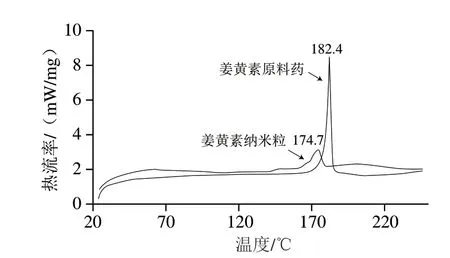
图3 姜黄素原料药和姜黄素纳米粒的DSC图谱Fig.3 DSC curves of Cur and Cur nanoparticles
2.5 姜黄素纳米粒透膜性能
2.5.1 Franz扩散池法
由图4可知,姜黄素纳米粒和原料药的累积渗透量随时间延长而增加,但原料药累积渗透量在12 h内缓慢增长,而姜黄素纳米粒的累积渗透量在12 h内迅速增加,尤其是在初始2 h内,其渗透速率为原料药的25 倍,这可能与姜黄素纳米粒水溶性增强,跨越肠衣膜后能迅速分散在接受液中,使膜两侧浓度差在一定时间内保持在较高水平有关;而后,随着膜两侧浓度差逐渐减小,姜黄素纳米粒的累积渗透量增长放缓,但仍远高于原料药的累积渗透量。12 h后,纳米粒的累积渗透量为180.22 μg/cm2,为原料药累积渗透量(27.68 μg/cm2)的6.6 倍,二者差异显著;24 h后原料药的最终透过率仅为33%,而纳米粒的跨膜透过率达到了90%以上,即姜黄素纳米粒经肠道跨膜转运几乎不会产生药物损失。依据药物溶出度和肠道渗透性原理,姜黄素属于低溶解性、低渗透性的第IV类成分(按照生物药剂学分类系统分类)[28],采用亚临界水法将其制备成纳米粒后,使其更易透过小肠壁跨膜转运,不仅能提高姜黄素吸收速率,而且能增加其吸收总量,有助于提高此类功能性成分在体内的作用。

图4 姜黄素原料药和姜黄素纳米粒体外透皮累积渗透量Fig.4 Transdermal permeability of Cur nanoparticles and Cur
2.5.2 姜黄素体内转运过程
姜黄素纳米粒及原料药在家兔体内口服药动学参数见表3,姜黄素在家兔体内药-时曲线如图5所示。姜黄素纳米粒和原料药在家兔体内消除半衰期一致,没有显著差异,转运过程符合一级动力学方程;姜黄素纳米粒在家兔体内质量浓度峰值为83.85 ng/mL,为原料药(21.86 ng/mL)的3.84 倍,这可能与原料药脂溶性高,易溶解于细胞膜的脂质双分子层中,而姜黄素制备成纳米粒后,在水中溶解性增强,更易跨过细胞膜进入血液循环有关。药时曲线下面积(AUC0-t)与进入家兔体内的药物量呈正比,姜黄素纳米粒及其原料药的AUC0-t分别为(357.68±5.41)ng·h/mL和(92.39±1.09)ng·h/mL,二者差异显著(P<0.01)。张心洁等[28]制备的姜黄素固体脂质纳米粒和微胶囊相比于未经处理的姜黄素,其生物利用度分别提高了4.31 倍和3.19 倍,与本实验结果相差不大。但Bao Chengliu等[29]设计的一种可渗透肠道黏液层的α-乳白蛋白纳米管制剂,药代动力学评估显示,所负载的姜黄素生物利用度比其游离状态高6.85 倍,与本实验体外透膜性能考察结果接近。对此,该研究团队认为活体动物肠道内的黏液可保护上皮表面不被大多数 纳米粒渗透,从而限制了口服药物的输送效率,而体外评价用肠衣去除了黏液层的影响。
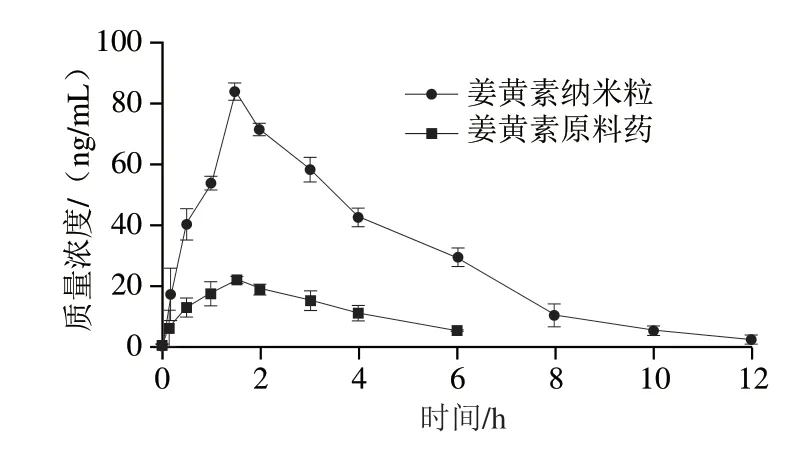
图5 姜黄素纳米粒与姜黄素原料药-时曲线Fig.5 Plasma concentration-time curves of Cur nanoparticles and Cur suspension after oral administration

表3 姜黄素纳米粒与姜黄素原料药药代动力学参数Table 3 Pharmacokinetic parameters of Cur nanoparticles and Cur
3 结论
采用亚临界水法制备姜黄素纳米粒,颗粒呈均一球形,在最佳制备工艺条件下,纳米粒粒径为166 nm,放置21 d后,其粒径仍然在胃肠道可吸收的范围内[30],而且在不借助其他载体情况下,载药量可高达70%以上。FTIR显示与原料药相比纳米粒的化学结构未发生改变,亚临界环境对姜黄素的化学结构没有产生影响。所制备的姜黄素纳米粒相较于原料药,在体外显示出更强的透膜性能,初始2 h的透膜速率为原料药的25 倍,12 h内累积渗透量约为原料药的6 倍。姜黄素纳米粒在家兔体内也表现出良好的跨膜转运能力,其达峰质量浓度和药时曲线下面积均提高至原料药的3 倍以上。
姜黄素作用广泛、毒性低,在医药和食品领域需求量日益增加,但受制于其本身理化性质缺陷,相关产品开发与应用十分有限,因此,寻求制备工艺简单,可进行工业化生产的姜黄素纳米制剂方法是推动姜黄素产业发展亟待解决的关键。亚临界水法制备姜黄素纳米粒,工艺过程简单,无需使用高分子载体,对机体无潜在危害;使用亚临界水代替有机溶剂,对环境友好,是一种新型、绿色、前景广阔的制备纳米制剂的方法。
