酶解法制备臭黄荆叶果胶的结构、理化性质、抗氧化和抗菌活性
2024-01-03邓利玲杨洪生
刘 莎,邓利玲,钟 耕,4,*,杨洪生
(1.西南大学食品科学学院,重庆 400715;2.重庆医药高等专科学校,重庆 401334;3.重庆市生物技术研究所有限责任公司,重庆 401121;4.川渝共建特色食品重庆市重点实验室,重庆 400716;5.绵阳常山农业科技有限公司,四川 绵阳 621000)
臭黄荆(Premna ligustroidesHemsl.)是一种马鞭草科腐婢属灌木,广泛分布于中国西南地区,适宜在贫瘠的山地种植,具有良好的药用价值和食用价值[1]。叶中含有木栓酮、木栓醇、袖皮素等药用成分,其水提取物可解毒消肿、抗疲劳、降低胆固醇,根水提取物可抗炎、增强机体免疫力,种子提取物可治疗头痛、风疹皮痒[2]。臭黄荆叶资源丰富,但目前仍处于未开发状态。同明臭黄荆叶含有丰富的蛋白质和果胶,是制作民间小吃“神仙豆腐”的原料。随着绿色环保意识加强,越来越多的人开始关注天然产物,因此,开发臭黄荆资源,将其融入大健康产业,不仅有理论研究意义,还有很高的经济价值。
果胶是存在于植物细胞壁和细胞内壁的酸性杂多糖,其组成有同质多糖和杂多糖两种类型,多为半乳糖醛酸(galacturonic acid,GalA)及其衍生物,呈白色或黄色粉状,分子质量约20~400 ku,通常按其酯化度分为高酯果胶(酯化度>50%)和低酯果胶(酯化度≤50%)[3]。果胶主要是由α-1,4-糖苷键连接的D-半乳糖醛酸单元构成线性主链并具有分枝的杂多糖[4],不同来源果胶的结构、理化性质和生物活性不相同,溶解性也有差异。果胶在食品工业可作为胶凝剂、增稠剂、乳化剂、质构改良剂等,还具有抗氧化、调节免疫和抗癌等生理活性[5]。目前果胶提取方法主要包括水提法、酸提法、碱提法和酶铺助提取法等[6],水提法适用于水溶性果胶的提取,但大量不溶于水的果胶在提取过程中被浪费;酸法和碱法在研究和工业生产中应用较多,但是这两种方法对环境污染较大且成本高。而酶提取法具有底物特异性、水解条件温和、水解过程易于控制、定向生成产物、成本低廉、环境友好等众多优点[7]。
果胶多糖的特性例如酯化度、分子质量和单糖组成等对果胶分子的活性具有十分重要的影响,通过酶处理使天然果胶的聚合度和酯化度大幅度降低,可获得高生物活性(抗菌、抗氧化)的改性果胶[8]。基于以上研究背景,本实验利用单一果胶酶和复合酶分别提取臭黄荆叶果胶,以水提果胶为对照,测定3 种臭黄荆叶果胶的理化性质、结构和抗氧化性能,并探究3 种臭黄荆叶果胶的抑菌活性,以期为其在健康食品、抗菌药物等方面的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜臭黄荆叶 四川绵阳常山农业科技有限公司;果胶酶(500 U/mg)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、VC标准品、2,2’-联氮-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulphonic acid),ABTS) 上海源叶生物科技有限公司;纤维素酶(10 000 U/mg)重庆跃翔工业有限公司;D-半乳糖醛酸、没食子酸、芦丁标准品,福林-酚试剂,单糖标准品(甘露糖、鼠李糖(rhamnose,Rha)、葡萄糖、半乳糖、半乳糖醛酸、木糖、岩藻糖) 北京Solarbio生物科技有限公司;枯草芽孢杆菌(Bacillus subtilis)、埃希氏大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcusaureus) 西南大学食品科学学院微生物实验室;麦凯康培养基、平板计数琼脂、7.5%氯化钠肉汤 广东环凯微生物科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
759紫外-可见分光光度计 上海菁华科技仪器有限公司;SY-10真空冷冻干燥机 北京松源华兴科技发展有限公司;5804R多功能台式冷冻离心机 德国艾本德公司;SYNERGY H1酶标仪 美国Biotek公司;Spectrum 100傅里叶变换红外光谱仪 美国珀金埃尔默公司;LC-20A高效液相色谱仪 日本岛津公司;凝胶渗透色谱仪 美国Wyatt技术公司;超净工作台 山东Biobase生物科技有限公司。
1.3 方法
1.3.1 样品准备
冷冻干燥臭黄荆叶,磨成细粉过200 目筛,取筛下物装袋密封,避光干燥处储存(水分质量分数低于4%)。
水提果胶(water-extracted pectin from thePremna ligustroidesHemsl.leaves,WPHP):称取10.00 g臭黄荆叶粉(干质量)于烧杯,加入10 倍质量蒸馏水,搅拌均匀,50 ℃水浴提取5 h,抽滤收集上清液,加入上清液1.5 倍体积无水乙醇,混合均匀,醇沉过夜,离心(6 000 r/min,10 min),沉淀经冷冻干燥得水提果胶。
果胶酶提果胶(pectinase-extracted pectin from thePremna ligustroidesHemsl.leaves,PPHP):称取10.00 g臭黄荆叶粉(干质量)于烧杯,加入10 倍质量蒸馏水,加入臭黄荆叶粉质量1%的果胶酶,搅拌均匀,50 ℃水浴提取5 h,抽滤收集清液,加入1.5 倍体积无水乙醇,混合均匀,过夜醇沉,离心(6 000 r/min,10 min),沉淀经冷冻干燥得果胶酶提果胶。
复合酶提果胶(mixed enzymes-extracted pectin from thePremna ligustroidesHemsl.leaves,MPHP):称取10.00 g臭黄荆叶粉(干质量)于烧杯,加入10 倍质量蒸馏水,加入臭黄荆叶粉质量1%的复合酶(m(果胶酶)∶m(纤维素酶)=1∶1)[9],搅拌均匀,50 ℃水浴提取5 h,抽滤收集清液,加入1.5 倍体积的无水乙醇,混合均匀,过夜醇沉,离心(6 000 r/min,10 min),沉淀冷冻干燥得复合酶提果胶。
1.3.2 果胶提取率测定
按照质量法[10]测定果胶提取率(干基计),计算如式(1)所示。
1.3.3 基本理化指标测定
采用灼烧法[11]测定灰分质量分数;采用凯氏定氮法[12]测定蛋白质量分数;采用硫酸-咔唑法[13]测定半乳糖醛酸质量分数;采用滴定法[13]测定酯化度。
1.3.4 红外光谱分析
采用红外光谱法分析3 种果胶分子结构。取少量果胶粉末直接放在衰减全反射晶体上,压力塔加压测试,以4 cm-1光谱分辨率、4 000~600 cm-1范围扫描样品,记录光谱图用于比较分析。
1.3.5 单糖组成测定
采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生法[14]测定臭黄荆叶多糖样品中的单糖组成。分别称取1.3.1节制备的3 种多糖样品60 mg,于4 mL 2 mol/L H2SO4溶液中溶解,110 ℃加热水解2 h。用4 mol/L NaOH溶液调节至pH值为7,纯水稀释到总体积为10 mL,离心(3 000 r/min,10 min),取上清液。量取各水解的多糖样品100 μL,加200 μL 0.3 mol/L NaOH溶液、200 μL 0.5 mol/L PMP溶液,70 ℃水浴加热100 min,静置冷却10 min。加入200 μL 0.3 mol/L HCl溶液中和,加纯水至1 mL,再加1 mL三氯甲烷溶液萃取,振荡、离心,弃有机相,重复萃取操作3 次。水相补水至2 mL,过滤,高效液相色谱分析。称取各单糖标准品5 mg,混合,纯水稀释至5 mL。量取混合单糖标准品100 μL,同上述衍生化处理后高效液相色谱分析。
色谱条件:色谱柱为Agilent EC-C18色谱柱(4.6 mm×250 mm,5 μm),紫外检测器(波长250 nm)。具体检测条件:流动相A为乙腈-0.05 mol/L磷酸缓冲溶液(pH 6.9,15∶85,V/V),流动相B为乙腈-0.05 mol/L磷酸缓冲溶液(pH 6.9,40∶60,V/V)。低压梯度洗脱,洗脱条件为0~10 min 100%~85% A,10~30 min 85%~75% A,30~35 min 75%~100% A,流速1.0 mL/min;进样量10 μL;柱温30 ℃;检测波长250 nm。
1.3.6 果胶分子质量测定
采用凝胶渗透色谱法测定果胶样品分子质量分布,色谱检测条件:示差折光检测器;PL aquagel-OH MIXED 8 μm色谱柱;流动相:0.1 mol/L NaNO3;流速1 mL/min;柱温30 ℃。称取干燥果胶多糖样品2 mg,溶于1.0 mL蒸馏水,用0.45 μm水相微孔滤膜过滤,吸取100 μL依照色谱条件进样。
1.3.7 总酚含量测定
采用福林-酚比色法[15]测定总酚含量。吸取2 mg/mL样品液1.0 mL,加1.5 mL稀释1 倍的福林-酚试剂,混匀,静置5 min,再加4 mL 20%(质量分数,下同)Na2CO3溶液混匀,纯水定容至25 mL,40 ℃避光显色30 min,于755 nm波长处测吸光度,以没食子酸为标准品绘制标准曲线,没食子酸标准曲线方程为y=30.35x+0.004 8(R2=0.999),根据标准曲线方程计算总酚质量浓度,单位为mg/mL,并换算成总酚含量。
1.3.8 总黄酮含量测定
采用改良的NaNO2-Al(NO3)3-NaOH比色法[16]测定总黄酮含量。吸取2 mg/mL果胶多糖1.0 mL,加入5% NaNO2溶液1.0 mL,静置5 min,加10% Al(NO3)3溶液1.0 mL并混匀,放置5 min后加4% NaOH溶液10.0 mL,最后用体积分数30%乙醇溶液定容至25 mL,摇匀,静置10 min。以不加样品液管调零,于510 nm波长处测定吸光度,以芦丁标准品绘制标准曲线,芦丁标准曲线方程为y=0.658 3x-0.034 3(R2=0.999 4),根据标准曲线方程计算总黄酮质量浓度,单位为mg/mL,并换算成总黄酮含量。
1.3.9 抗氧化活性测定
1.3.9.1 DPPH自由基清除率
根据Mensor等[17]的方法略微修改测定DPPH自由基清除率。用纯水制备不同质量浓度的果胶多糖(0.2~1.2 mg/mL)。将0.2mL 多糖溶液与2mL 0.01mmol/mLDPPH溶液混合,在25 ℃下反应30 min,于517 nm波长处测定吸光度,每组做3 个平行。取3 支试管,分别标记为0、1、2。0 号试管:2mL 纯水+2 mL DPPH溶液;1号试管:2 mL样品+2 mL DPPH溶液;2号试管:2 mL样品+2 mL无水乙醇。以不同质量浓度(0.2~1.2 mg/mL)VC溶液作为阳性对照。按式(2)计算DPPH清除率。
式中:S为DPPH自由基清除率/%;A0为0号试管的吸光度;A1为1号试管的吸光度;A2为2号试管的吸光度。
1.3.9.2 ABTS阳离子自由基清除率
根据Thaipong等[18]的方法进行测定ABTS阳离子自由基清除率。配制6.94 mmol/L ABTS水溶液和2.6 mmol/L K2S2O8水溶液,将两者混合均匀,阴凉处放置16 h,充分反应。用磷酸盐缓冲液(0.2 mmol/L pH 6.6)稀释溶液,于734 nm波长处检测吸光度,直到最终吸光度为0.70。加入96 孔板,黑暗处放置20 min,测定734 nm波长处吸光度。阳性对照与1.3.9.1节一致。ABTS阳离子自由基清除率按公式(3)计算。
式中:S为ABTS阳离子自由基清除率/%;A0为25 μL蒸馏水+175 μL ABTS溶液吸光度;A1为25 μL样品溶液+175 μL ABTS溶液吸光度;A2为25 μL样品溶液+175 μL蒸馏水吸光度。
1.3.9.3 Fe3+还原率
Fe3+还原率测定按照Jin Hua等[19]的方法适当修改进行测定。取100 μL不同质量浓度果胶溶液(0.2~1.2 mg/mL),与100 μL pH 6.6磷酸缓冲溶液、100 μL 1%铁氰化钾溶液混合,50 ℃水浴反应20 min,冷却后加入100 μL 10%三氯乙酸溶液,离心(3 000 r/min,15 min)。取上清液90 μL,加入100 μL蒸馏水、10 μL 0.1%三氯化铁,静置10 min,于700 nm波长处测定吸光度。同明将铁氰化钾溶液替换成100 μL蒸馏水作为空白对照。以VC为阳性对照,重复3 次,结果取平均值。
1.3.10 果胶样品液抑菌性测定
1.3.10.1 样品液制备
配制40 mg/mL果胶样品液,4 ℃保存备用。
1.3.10.2 最小抑菌浓度和最低杀菌浓度
采用2 倍梯度稀释法,取试管6 支,每管加无菌液体培养基3.0 mL,于第1支试管加入样品3.0 mL,混匀,取3.0 mL加入第2支试管,以此类推,直到第6支试管弃去3.0 mL。各管加入0.1 mL菌液(OD600nm=1)。同明每组设阳性对照管(只含等量菌液)以及阴性对照管(无菌生理盐水)各1 支,37 ℃恒温培养箱培养24 h,根据试管内样液混浊度判断菌体生长情况。培养液完全清亮,表示无细菌生长;培养液混浊,表示有细菌生长。对于样液混浊肉眼无法判断的试管,做进一步平板涂布,37 ℃培养24 h,以无菌生长的最小浓缩液质量浓度为样品液对该菌最小抑菌浓度(minimal inhibit concentration,MIC)。将MIC及高于MIC的各管在生理盐水平板上涂布,37 ℃培养24 h,以菌落少于10 个的相应浓缩液质量浓度为对该菌种的最低杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.10.3 纸片法药敏实验测定
分别取3 个不同质量浓度(10、20、40 mg/mL)果胶样品液15 mL,放入直径6 mm灭菌滤纸片(12 片为1 组)36 片,浸泡2 h。自然干燥,紫外灯灭菌15 min。无菌条件下,将菌株混悬液(OD600nm=1)稀释100 倍,接种到普通营养培养基表面,每种菌株平行接种3 个平板,将纸片贴于平板,平板划分为4 个区,每个平板贴4 片,其中一片为阴性对照。37 ℃培养24 h,观察抑菌效果。在纸片周围抑菌浓度范围内,菌生长被抑制形成透明抑菌圈,用游标卡尺测量抑菌圈的直径,抑菌圈大小能够反映测试菌对果胶提取液的敏感程度,判断标准见表1。
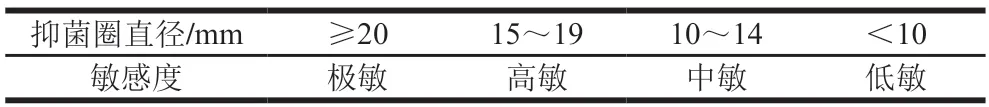
表1 纸片法判断抑菌敏感度标准[20]Table 1 Criteria for determination of antibacterial sensitivity paper disc method[20]
1.4 数据处理与分析
数据以平均值±标准差表示,采用SPSS 26.0和Excel 2016软件处理数据并进行相关性分析,用Origin 2021软件作图。
2 结果与分析
2.1 不同方法提取臭黄荆叶果胶多糖基本指标
3 种方法提取臭黄荆叶果胶多糖的提取率、半乳糖醛酸质量分数和酯化度如表2所示,MPHP果胶提取率超过PPHP和WPHP,原因是纤维素酶对臭黄荆叶细胞壁的分解破坏程度大,使细胞更容易破裂,从而导致细胞中更多的多糖等物质溶出。3 种方法提取的果胶多糖其半乳糖醛酸质量分数及酯化度分别为:MPHP半乳糖醛酸质量分数45.13%、酯化度12.56%,PPHP半乳糖醛酸质量分数33.42%、酯化度40.21%,WPHP半乳糖醛酸质量分数15.30%、酯化度62.33%,前两者属于低酯果胶,后者属于高酯果胶。果胶在酶法提取过程中通过酶降解果胶链上的中性糖,同明使同聚半乳糖醛酸骨架解聚,从而降低了酯化度[21];因此,酶提取果胶其半乳糖醛酸质量分数增加,而酯化度下降。PPHP和MPHP蛋白质量分数无显著差异(P>0.05),其蛋白质量分数均低于瓜尔豆胶(8.2%)、黄原胶(5.4%)和阿拉伯树胶(1.8%)等[22]。WPHP灰分质量分数与PPHP和MPHP差异显著(P<0.05),且高于阿拉伯树胶(1.2%)和黄原胶(1.5%),但3 种臭黄荆叶果胶多糖灰分质量分数均低于瓜尔豆胶(11.9%)[23]。
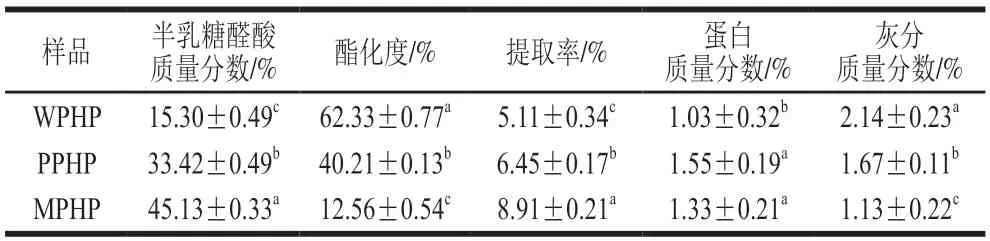
表2 不同酶法提取臭黄荆叶果胶多糖基本组分Table 2 Basic composition of pectin polysaccharides extracted from Premna ligustroides Hemsl.leaves by different enzymatic methods
2.2 臭黄荆叶果胶结构分析结果
2.2.1 红外光谱结构表征
3 种臭黄荆叶果胶多糖红外光谱结构表征结果如图1所示,4 000~650 cm-1范围类均表现出糖类的特征吸收峰,3 200 cm-1附近出现的吸收峰是由O—H键的伸缩振动所引起,2 924 cm-1处的吸收峰是由C—H键的伸缩振动所引起,1 748 cm-1处的吸收峰是羧羰基和酯羰基中C=O键伸缩振动所引起,1 629~1 605 cm-1处的吸收峰是由游离羧基中C=O键的非对称伸缩振动所引起,伸缩振动的C=O键和非对称伸缩振动的C=O证明提取物为果胶类多糖。1 427~1 423 cm-1处吸收峰是由—COOH的C—O伸缩振动引起的,证明有果胶特征基团羧基存在。
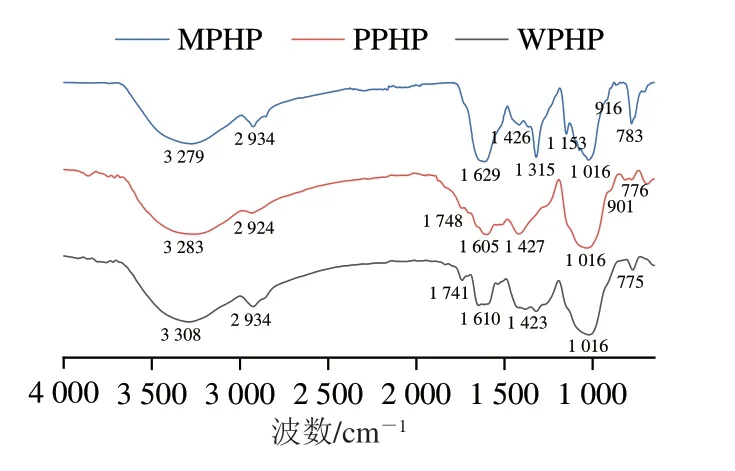
图1 不同酶法提取臭黄荆叶果胶多糖红外光谱Fig.1 Infrared spectra of pectin extracted from Premna ligustroides Hemsl.leaves by different enzymatic methods
由图1可见,水提法、果胶酶提法和复合酶提法制备的果胶多糖在1 741 cm-1附近的振动峰强度依次减小,而复合酶法提取的样品中该峰基本消失,可能是由于复合酶条件下发生酯化的甲氧基被水解。1 426 cm-1处吸收峰是由C—H的变角振动所引起,它和3 200~3 600 cm-1处的C—H 伸缩振动吸收峰构成了糖环的特征吸收峰。890~970 cm-1附近吸收峰表示α-型糖苷键;在1 030~1 150 cm-1处的吸收峰表示β-型糖苷键。3 种臭黄荆叶果胶多糖在1 016 cm-1均出现宽峰,说明3 种方法提取的臭黄荆叶果胶均为吡喃糖,另外MPHP在1 153 cm-1处的吸收峰是带有β-1,6-糖苷键的C—O—C基团的伸缩振动峰[24],说明MPHP属于带有β-1,6-糖苷键的吡喃多糖。
2.2.2 单糖组成
不同方法制备的果胶多糖单糖组成如图2所示,单糖组成结果以物质的量百分比形式计算(表3),WPHP单糖组成中葡萄糖占主要部分(64.38%),PPHP单糖组成中半乳糖醛酸占主要部分(37.72%),MPHP单糖组成中半乳糖醛酸(33.48%)和葡萄糖(48.08%)占主要部分,此结果与之前报道的臭黄荆叶果胶单糖组成相符。果胶多糖的同聚半乳糖醛酸(homogalacturonan,HG)结构主要由半乳糖醛酸构成,而鼠李糖半乳糖醛酸聚糖第I型(RG-I)结构的主链由鼠李糖和半乳糖醛酸交替连接构成,因此鼠李糖/半乳糖醛酸的物质的量比(Rha/GalA值)常用来反映RG-I结构含量。HG结构为主的商品果胶Rha/GalA值较低(0.017~0.027),而以RG-I结构为主的果胶多糖Rha/GalA值在0.05~1.00之间,比值越接近1则果胶多糖组分中RG-I结构占比越多,HG结构占比越少。WPHP、PPHP和MPHP的Rha/GalA值在0.04~0.29,表明水、果胶酶提取的臭黄荆叶果胶多糖以RG-I结构为主,复合酶提取的臭黄荆叶果胶多糖以HG结构为主。其中,MPHP的Rha/GalA值为0.04,低于PPHP,说明复合酶法提取明水解HG结构效率高于果胶酶提取,而WPHP的Rha/GalA值为0.29,高于PPHP,可能是由于水提效率较高,中性糖溶于水而被提取出来。阿拉伯糖和半乳糖以中性糖侧链(阿拉伯聚糖、半乳聚糖和阿拉伯半乳聚糖)的形式存在于果胶多糖的RG-I结构域中,两者在PPHP中含量均高于MPHP,这说明PPHP的中性糖侧链最为丰富,因此相较于复合酶提取,果胶酶提取可能带来更高的分支度。
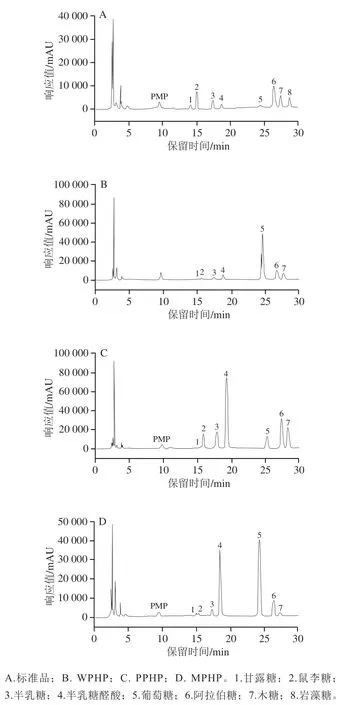
图2 不同酶法提取臭黄荆叶果胶多糖单糖组成色谱图Fig.2 Chromatograms of monosaccharide composition of pectin extracted from Premna ligustroides Hemsl.leaves by different enzymatic methods
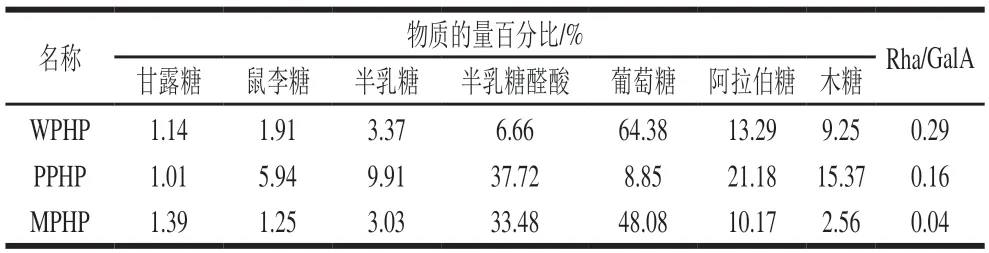
表3 不同酶法提取臭黄荆叶果胶多糖单糖组成的色谱图Table 3 Monosaccharide composition of pectin extracted from Premna ligustroides Hemsl.leaves by different enzymatic methods
2.2.3 分子质量
由图3和表4可知,不同方法制备的臭黄荆叶果胶多糖分子质量分布不均,且分布范围较宽,其中WPHP分子质量谱图由两个宽峰和一个尖峰组成,重均分子质量分别为2.12×107、4.94×105u和6.77×104u;PPHP分子质量谱图有两个峰,重均分子质量分别为1.52×105u和1.66×103u;MPHP分子质量图有4 个峰,重均分子质量分别为2.08×107、4.37×105、1.14×105u和4.67×103u;水、果胶酶和复合酶法提取的臭黄荆叶果胶分子质量测定含有多峰,说明提取的臭黄荆叶果胶是杂多糖。陈军[25]用纯水提取的豆腐柴果胶也具有高分子质量特征,其重均分子质量为9.59×105u。与WPHP相比,PPHP和MPHP出峰明间较晚,说明样品在酶促条件发生部分降解,果胶链结构断裂,分子质量下降。分子质量在5 000~35 000 u范围内的果胶多糖被称为小分子果胶,其具有分子结构简单和易被吸收利用等特点,具有一定的免疫调节、抗癌、抗病毒等功能活性[26]。本实验中PPHP和MPHP均含有分子质量5 000~35 000 u的果胶多糖,其可能具有一定功能活性,后续可深入研究。
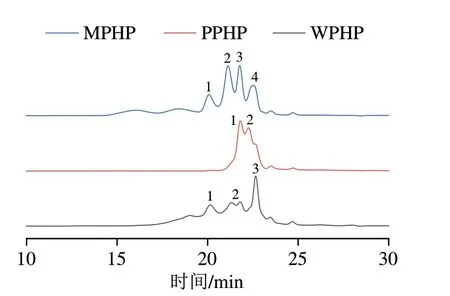
图3 不同酶法提取臭黄荆叶果胶多糖分子质量Fig.3 Molecular mass of pectin polysaccharides exracted from Premna ligustroides Hemsl.leaves by different enzymatic methods
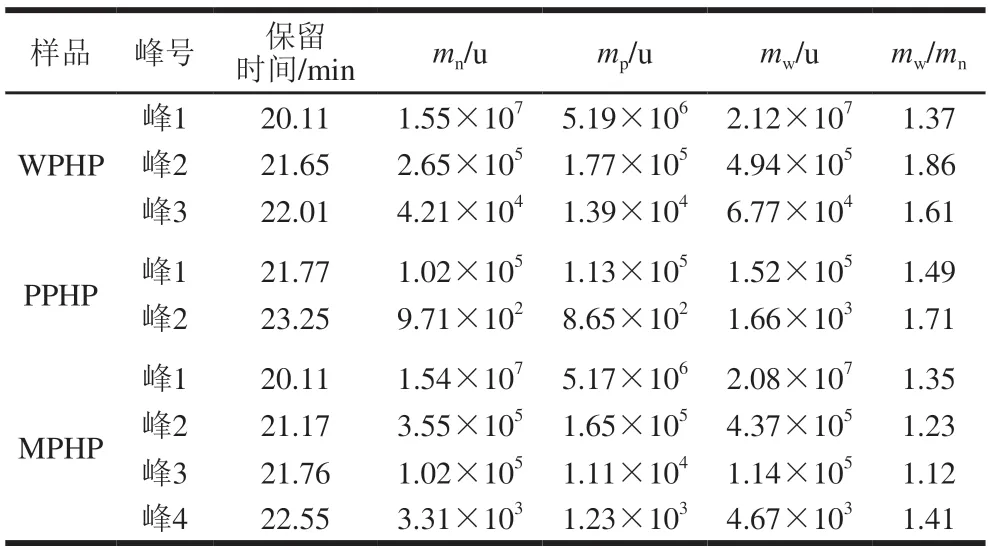
表4 不同酶法提取臭黄荆叶果胶多糖的相对分子质量及其分布Table 4 Relative molecular mass and its distribution of pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
2.3 臭黄荆叶果胶多糖总酚、总黄酮含量
3 种方法所提取臭黄荆叶果胶总酚和总黄酮含量如表5所示,WPHP总酚和总黄酮含量分别为12.43 mg/g和15.33 mg/g,PPHP总酚和总黄酮含量分别为15.25 mg/g和17.08 mg/g,MPHP总酚和总黄酮含量分别为17.09 mg/g和26.46 mg/g,结果表明酶处理可以释放臭黄荆叶中的多酚和黄酮,这与李浡等[27]使用复合酶提取葡萄酒渣中多酚所得结果相似。

表5 不同酶法提取臭黄荆叶果胶多糖的总多酚、总黄酮含量Table 5 Contents of total polyphenols and total flavonoids in pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
2.4 臭黄荆叶果胶多糖抗氧化性
2.4.1 DPPH自由基清除率
DPPH自由基是一种稳定的质子自由基,被广泛用于各类天然产物自由基清除能力的测定。由图4可知,果胶具有较强的DPPH自由基清除能力,并且随着果胶溶液质量浓度增加,其DPPH自由基清除率提升。相同质量浓度的3 种臭黄荆叶果胶DPPH自由基清除率总体由高到低依次为MPHP>PPHP>WPHP,但是WPHP与PPHP对于DPPH自由基的清除能力差异不明显。当MPHP质量浓度为1.20 mg/mL明,DPPH自由基清除率达71.9%。与同质量浓度的VC相比,果胶的DPPH自由基清除能力较低。研究表明,果胶质量浓度相同明,臭黄荆叶果胶比仙人掌果胶[28]、黑木耳多糖[29]的DPPH自由基清除能力强,这是因为不同植物的多糖中含有的羟基数目不同,羟基能与DPPH自由基发生反应,因此羟基数目越多,其DPPH自由基清除能力越强。
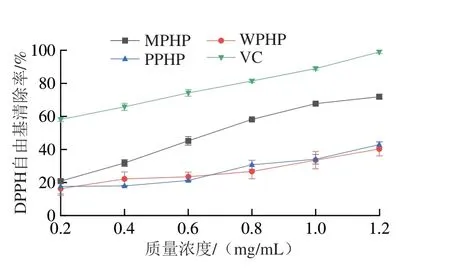
图4 不同酶法提取臭黄荆叶果胶多糖的DPPH自由基清除率Fig.4 DPPH radical scavenging effect of pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
2.4.2 ABTS阳离子自由基清除率
由图5可知,果胶具有较强的ABTS阳离子自由基清除能力,并且随着果胶溶液质量浓度增加,其ABTS阳离子自由基清除率提升。在果胶质量浓度分别为0.1 mg/mL和0.3 mg/mL明,WPHP和PPHP对ABTS阳离子自由基的清除率差异不明显。3 种臭黄荆叶果胶多糖对ABTS阳离子自由基清除率总体由高到低依次为MPHP>PPHP>WPHP。当MPHP质量浓度为0.8 mg/mL明,ABTS阳离子清除率高达77.80%。
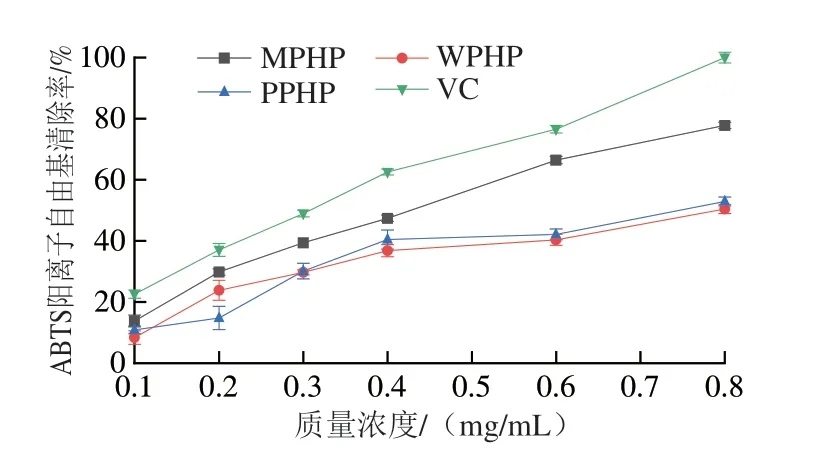
图5 不同酶法提取臭黄荆叶果胶多糖的ABTS阳离子自由基清除率Fig.5 ABTS cation radical scavenging effect of pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
2.4.3 Fe3+还原率
由图6可知,随着果胶质量浓度的增加,Fe3+还原率也提升。3 种臭黄荆叶果胶Fe3+还原率由高到低依次为MPHP>PPHP>WPHP。MPHP溶液质量浓度为1.20 mg/mL明,果胶溶液的Fe3+还原率为77.87%,高于南酸枣果胶多糖[6],但3 种臭黄荆叶果胶多糖对Fe3+的抗氧化能力都弱于VC。
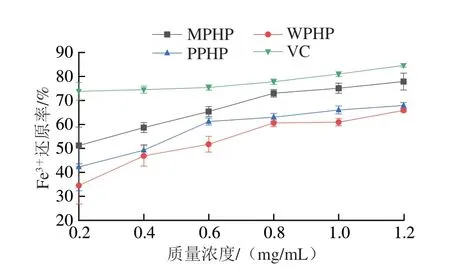
图6 不同酶法提取臭黄荆叶果胶多糖的Fe3+还原率Fig.6 Fe3+-reducing power of pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
2.5 臭黄荆叶果胶抗菌性
2.5.1 最小抑菌浓度和最小杀菌浓度
由表6可以看出不同方法处理提取臭黄荆叶果胶抑菌能力不同。MPHP对3 种菌的抑制效果均优于WPHP和PPHP,而WPHP对于大肠杆菌、金黄色葡萄球菌的抑制效果优于PPHP,PPHP对金黄色葡萄球菌的抑制效果优于大肠杆菌。黄思雨等[30]的研究表明臭黄荆叶水提取浓缩物对金黄色葡萄球菌、大肠杆菌有抑菌作用,且对金黄色葡萄球菌的抑制作用强于大肠杆菌。
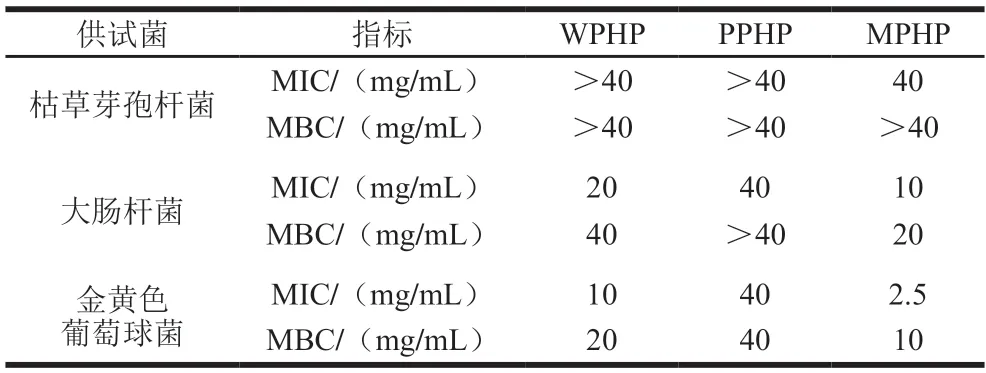
表6 不同酶法提取臭黄荆叶果胶多糖的MIC和MBCTable 6 Minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
2.5.2 抑菌圈直径
由表7可以看出,臭黄荆叶果胶抑菌效果均随着质量浓度增大而增强。三者相比,MPHP抑菌效果最好,抑菌圈直径最大,边缘清晰完整。10 mg/mL和20 mg/mL的WPHP和PPHP对枯草芽孢杆菌和大肠杆菌均没有抑菌效果,可能是质量浓度较小的缘故。在相同质量浓度下,3 种臭黄荆叶果胶对各细菌的抑菌效果:金黄色葡萄球菌>埃希氏大肠杆菌>是枯草芽孢杆菌,这与细胞膜的构成相关。金黄色葡萄球菌为革兰氏阳性菌,其特点是细胞膜外部有一个肽聚糖层,它是无效的渗透屏障;大肠杆菌为革兰氏阴性菌,外部磷脂膜带有结构性脂多糖,它与孔蛋白构成选择性屏障,使得溶菌酶这类亲脂类的抑菌物质不能渗透,从而无法起到抑菌作用[31];虽然枯草芽孢杆菌同为革兰氏阳性菌,但其对外界抗性强,具有耐高温和快速复活等特点,抑制其生长需要更高的浓度。臭黄荆叶果胶多糖抑菌能力与黄酮、多酚含量和果胶分子质量相关,由于黄酮、多酚上有很多酚羟基,这些基团能够与蛋白质或酶以氢键的方式结合,破坏蛋白质的分子结构使其变性失活,导致细菌细胞质固缩、解体,从而起到抑菌作用;而果胶经过酶分解,分解后的产物具有很强的抗菌活性,研究表明,果胶降解生成的低聚糖具有促进双歧杆菌生长繁殖、抑制有害菌增长和调整肠道菌群平衡等功能[32]。Takenaka等[33]用柠檬果胶进行实验的结果表明,果胶分解后表达其抗菌性的本质产物是半乳糖醛酸寡糖。
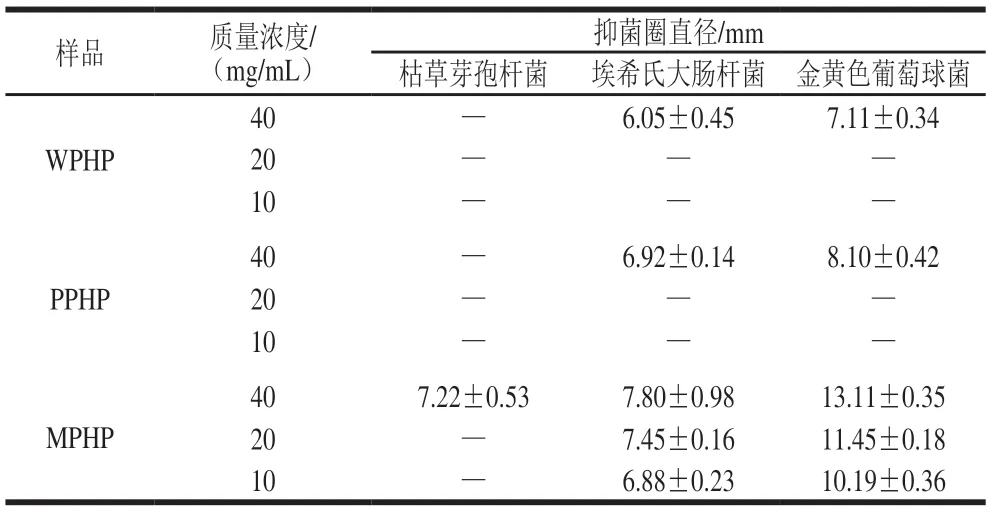
表7 不同酶法提取臭黄荆叶果胶多糖抑菌圈直径测定结果Table 7 Inhibition zone diameters of pectin polysaccharides from Premna ligustroides Hemsl.leaves extracted by different enzymatic methods
3 结论
本实验采用水提、果胶酶提和复合酶提3 种方法分别从臭黄荆叶中提取果胶,并初步分析其化学组成、分子质量、红外光谱性质、体外抗氧化作用及抗菌性。结果表明,不同提取方法使得果胶的半乳糖醛酸、酯化度、分子质量和单糖含量等都发生了不同程度的变化,从而导致果胶多糖存在结构形态上的差异。红外光谱分析结果显示,3 种果胶在4 000~650 cm-1范围内都呈现出果胶物质的特征吸收峰,说明所制备样品属于果胶类多糖;分子质量分布分析结果表明臭黄荆叶果胶多糖是由不同分子质量的组分组成,酶提取臭黄荆叶果胶分子质量小于水提臭黄荆叶果胶,说明提取过程中部分果胶被降解成小分子果胶;体外抗氧化分析结果显示,臭黄荆叶果胶多糖对DPPH自由基及ABTS阳离子自由基清除能力及对Fe3+还原率都与样品质量浓度呈正相关,其中复合酶法制备的果胶表现出相对较好的抗氧化作用,且半乳糖醛酸质量分数和抗菌性均高于其他两种方法。果胶的抗菌性可能与其半乳糖醛酸、多酚和黄酮含量有关系,协同作用产生抗氧化性和抗菌性。通过研究不同提取方法对臭黄荆叶果胶多糖的理化性质和抗氧化作用的影响,可以为果胶的进一步研究提供参考。
