TRV介导的溪荪VIGS转化体系的构建与鉴定
2024-01-02刘桂伶史恭发
刘桂伶 徐 诺 史恭发 王 玲
(东北林业大学园林学院,哈尔滨 150040)
溪荪(Iris sanguinea)为鸢尾科(Iridaceae)鸢尾属(Iris)多年生草本植物,由于其极强的抗寒能力和较高的观赏价值成为了东北地区的重要园林绿化植物[1]。目前对于溪荪的研究主要集中于种子生物学[2]、开花生物学[3]和新品种选育[4]等方面。鸢尾科仅唐菖蒲(Gladiolus gandavensis)[5]等少数植物建立了完整的遗传转化体系,在溪荪遗传转化体系研究中,仅唐彪[6]以花茎诱导出来的愈伤为受体,进行GUS 基因的转化,但并未获得不定芽。目前,溪荪的基因功能验证只能通过模式植物进行,溪荪等鸢尾属植物基因功能研究进展缓慢。病毒诱导基因沉默技术(Virus-induced gene silencing,VIGS)适用于缺乏稳定遗传转化体系的物种进行基因功能分析,其操作简单,无需遗传转化和组织培养,试验周期较短,加速了基因功能分析的进程,是反向遗传学研究基因功能的重要手段[7]。已在非洲菊(Gerbera jamesonii)[8]、矮牵牛(Petunia hybrida)[9]、唐菖蒲(Gladiolus hybridus)[10]等多个观赏花卉的基因功能研究中成功使用。
八氢番茄红素脱氢酶基因(Phytoene desaturease,PDS)的功能丧失会导致植物出现光漂白现象,常作为VIGS 体系构建的指示基因[11]。PDS蛋白的C末端均含有1个FAD保守结构域,作为植物类胡萝卜素合成途径中的关键酶,其失活会导致类胡萝卜素合成遭到破坏,导致本应呈绿色的叶片组织变成白色。这个明显的表型变化极易观察,效果明显且产生表型所需时间较短。PDS基因在小麦(Triticum aestivum)[12]、水稻(Oryza sativa)[13]、大麦(Hordeum vulgare)[14]、番茄(Solanum lycopersicum)[15]等多个植物的VIGS 体系构建中被应用。Burch-Smith 等[16]在拟南芥(Arabidopsis thaliana)幼苗上建立PDS与AtCUL1基因可视化VIGS 体系的基础上,进行了植物抗病研究。这些研究中,PDS基因被用作为报告基因与其他基因结合作为基因功能研究和遗传改良的手段。
本研究以烟草脆裂病毒(Tobacco rattle virus,TRV)为病毒载体,以IsPDS为报告基因,建立溪荪叶部的VIGS 体系,不仅对解析溪荪乃至鸢尾属植物基因功能具有重要意义,也对其他遗传转化体系构建困难的单子叶植物VIGS 体系构建提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料
VIGS试验用苗为东北林业大学园林学院苗圃(126°64′N,45°72′E)露地栽培的5年生溪荪实生苗;2021年6月采集溪荪干净叶片,立即置于液氮冷冻后在超低温冰箱中-80 ℃保存,用于RNA的提取。
1.1.2 病毒载体和菌株
TRV 病毒载体pTRV1 和pTRV2 由山东农业大学徐宗大教授惠赠,所选用大肠杆菌感受态为DH5α(全式金,CD201-02),农杆菌(Agrobacterium tumefaciens)感受态为GV3101(上海唯地,AC1001)。
1.2 方法
1.2.1 IsPDS基因片段的扩增
按RNA提取试剂盒(康为世纪,CW0535)的操作说明提取溪荪叶片的总RNA,以1 μg 的总RNA做模板,进行反转录(TaKaRa,D2680A)后稀释备用;从课题组前期溪荪花瓣转录组中筛选出PDS基因(GenBank:OR295217),在其ORF 区域内根据SGN(http://vigs.solgenomics.net/)网站选取长度299 bp 的特异性片段[17],基因片段克隆引物(F:5′-ATGAAACAACAGGGTGTGCCTGA-3′,R:5′-GCGAGTAAAAGGTGCTTCACTGTTC-3′),并在正向和反向引物的5′端分别添加pTRV2载体的同源臂碱 基 序 列(F:TGAGTAAGGTTACCGAATTCTCTAGAATGAA-ACAACAGGGTGTGCCTGA, R:GCCTCGAGACGCGTGAGCTCGGTACCGCGAGTAAAAGGTGCTTCA-CTGTTC,下划线为引物序列的同源臂),使用KOD-Plus-Neo(东洋纺,KOD-401)进行PCR 反应,反应体系参考说明书,经琼脂糖凝胶电泳检测,将正确的条带切下后进行胶回收。
1.2.2 重组病毒载体pTRV-IsPDS构建
纯化后的PCR 基因片段,与经XbaⅠ-KpnⅠ双酶切线性化的pTRV2 质粒用同源重组试剂盒(诺唯赞,C115-01)连接。将上述连接产物转化大肠杆菌DH5α感受态,鉴定阳性克隆并测序。
1.2.3 VIGS沉默体系的建立
分别将含有pTRV1、pTRV2 和pTRV2-IsPDS的质粒用冻融法转化农杆菌GV3101,在50 mg·L-1卡那霉素和25 mg·L-1利福平抗性条件下筛选转化子,挑取单菌落至含以上两种抗生素的1 mL YEB培养液中,28 ℃,200 r·min-1培养12 h,取1 mL 上述菌液,加入25 mL YEB 液体培养基(50 mg·L-1卡那霉素,25 mg·L-1利福平)中,28 ℃, 200 r·min-1培养10~12 h,当菌液的OD600为1.8~2.0 时,用含有10 mmol·L-1MgCl2、10 mmol·L-1MES、200 μmol·L-1AS的200 mL重悬液重悬菌体,重悬液OD600为0.8~1.0。
使用1 mL 注射器,分别将下列每组菌液中成分按1∶1体积比混合后,25 ℃避光静置活化3 h:将含有pTRV1 与pTRV2 的农杆菌GV3101 菌液作为病毒空载对照组,含有pTRV1 与pTRV2-IsPDS的农杆菌GV3101菌液作为试验组,试验组和病毒空载对照组选择同一溪荪植株上长势相近的叶片进行。另外,每组试验均设置空白对照Mock 组,将等体积无菌水注射溪荪叶片中,并观察叶片注射后是否出现坏死的现象。
试验在大田环境中进行,气温15~20 °C,选择晴朗天气的下午6~8时进行,用1 mL注射器针头扎伤生长一致的溪荪叶片上表皮,沿着平行脉缓慢注射重悬液1 mL至溪荪叶片维管束中(见图1)。

图1 溪荪VIGS侵染技术示意图Fig.1 Schematic diagram of VIGS infection technology of I. sanguinea
1.2.4 基因表达量分析
从pTRV2-IsPDS侵染的溪荪叶片白化部分、注射pTRV2 侵染的溪荪叶片的相应部分提取总RNA 并进行反转录,以Actin为内参基因(F:CGGTATGGAGGCTGCTGGTA,R:TCAACGTGCAATCACAATCTC),采用qRT-PCR 对IsPDS基因的相对表达情况进行定量分析,所用定量引物(F:GAAATCCACCTGAGAGGCTATG,R:TGTTCCATCAGAGTTCAGCTC)。 按 照FastStart Universal SYBR Green Master Mix Kit 说明在LightCycler 96 well Real-Time PCR System 上进行检测。反应体系 20 μL。反应程序为95 ℃,2 min;95 ℃,15 s;60 ℃,31 s,30 个循环,参考2-ΔΔCt法对目的基因的相对定量表达进行分析[18]。
1.2.5 数据处理
通过统计出现明显光漂白现象的叶片的植株数,计算溪荪VIGS的沉默率:
植株沉默率=(白化株数/转化总株数)×100%。
2 结果与分析
2.1 IsPDS基因片段的克隆结果
IsPDS基因在299 片段扩增出目标条带(见图2A),经测序,序列与转录组测序结果一致,在GenBank 数据库中进行Blast 分析表明,该片段与已知基因番红花(Crocus ancyrensis)的PDS基因(GenBank:KT124380.1)同源性为92.1%,表明已经成功克隆出溪荪PDS基因的特异性片段。
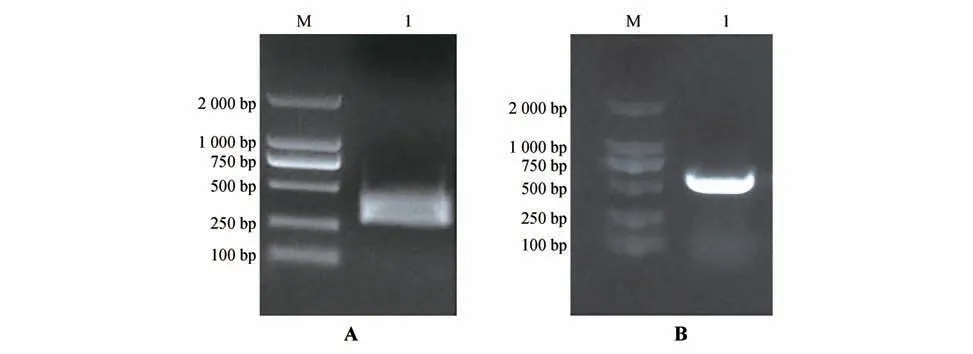
图2 PDS基因片段的PCR扩增结果A.IsPDS 特异性片段PCR 扩增(M.DNA 标准分子量;1.IsPDS 基因片段);B.TRV2-IsPDS 重组质粒PCR 鉴定(M.DNA 标准分子量;1.pTRV2-IsPDS重组质粒)。Fig.2 PCR amplification results of IsPDS A.Amplification of IsPDS fragmen(tM.DNA Marker;1.Fragment of IsPDS);B.Identification of vial vector TRV2-IsPDS by PCR(M.DNA Marker;1.Fragment of pTRV2-IsPDS).
2.2 IsPDS基因VIGS重组载体的构建
构建获得溪荪重组病毒载体pTRV2-IsPDS(见图2B),通过PCR 鉴定和测序验证,说明pTRV2-IsPDS基因沉默载体构建成功。
2.3 表型鉴定及IsPDS基因表达情况
自接种第1 日起,14 d 之后,观察叶片白化情况,其中注射无菌水的空白对照组的叶片未产生任何白化表型,且未出现叶片破损腐烂等现象。病毒空载体处理的样本中无明显的叶片颜色变化,与空白对照组及病毒空载体组相比,在病毒与目的基因复合载体处理的试验组样本中,产生了叶片白化表型(见图3A)。侵染20 d后叶片的其他位置也出现了白化现象。对溪荪叶片进行PCR检测发现,TRV病毒已经成功在溪荪叶片中表达(见图3B)。
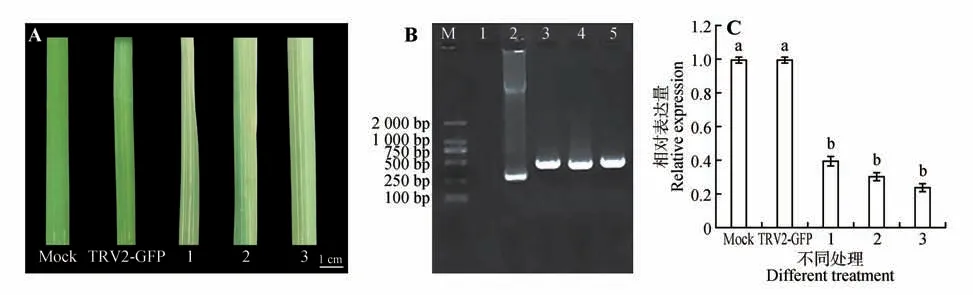
图3 植株表型变化及IsPDS基因在叶片中qRT-PCR表达分析A.溪荪PDS 基因沉默后的叶片白化表型(M.注射无菌水的叶片;TRV2-GFP.病毒空载对照叶片;1~3.试验组出现沉默表型叶片);B.溪荪叶片TRV2基因PCR结果(M.DNA标准分子量;1,M.注射无菌水植株;2.TRV2-GFP病毒空载对照组;3~5.试验组出现沉默表型的叶片);C.空白对照组、病毒空载组及试验组的IsPDS基因表达量分析。Fig.3 Phenotypic change of plant and qRT-PCR analysis of IsPDS in leaves A.Phenotypes of albino leaves after PDS gene silencing in I.sanguinea(M.Leaves injected with sterile water;TRV2-GFP;1-3.Phenotype of PDS gene silenced);B.PCR detection results of TRV2 gene(M.DNA Marker;1,M.Leaves injected with sterile water;2.TRV2-GFP,3-5.IsPDS gene silenced);C.Analysis of PDS gene expression in photobleached plants.
通过统计具有光漂白现象的植株数计算VIGS的沉默效率为56%,收集沉默植株的叶片,利用qRT-PCR 分析IsPDS基因的表达量,结果显示,相比于阴性对照植株和空白植株,3组试验组溪荪中IsPDS基因的表达量平均降低了50.39%(见图3C),而注射无菌水的Mock组与注射TRV2病毒空载组之间无显著差异。说明沉默体系能够对目标基因进行沉默。
3 讨论
VIGS 技术为遗传转化困难和生长周期较长的植物提供了基因功能分析的简便方法[19],基于TRV 的VIGS 病毒载体是目前使用最广泛的载体,其接种后植株沉默效率高,沉默表型持续性较好[20],但由于寄主范围的限制,对TRV 以单子叶植物为研究对象而建立VIGS 体系却鲜有报道[21]。鸢尾属植物的遗传转化体系的构建困难,溪荪的VIGS 体系的成功构建可加快鸢尾属植物基因功能研究的速度。
PDS基因可视化效果明显,提高了VIGS 试验的时效性,VIGS 技术处理的植株由于病毒侵染效率的差异会出现沉默效率不一致、时期不统一等现象,导致VIGS 试验失败的原因较多,无法判断问题出现在VIGS 体系上,还是对应沉默基因的功能上。而利用PDS基因为指示基因,将沉默结果肉眼可见,为后续试验材料的收集以及数据的分析带来极大的便利。如沉默小麦品种的穗部PDS沉默后,接种病毒14 d 后开始出现叶片的白化现象,且基因表达量下调超过60%,沉默性状稳定[22]。PDS基因在大豆(Glycine max)中沉默后,叶片出现了高度均匀的光漂白表型,沉默后的植株的整个生命周期都性状稳定,并且基因沉默性状遗传到了其20%的种子中,这些种子的幼苗都出现了白化的表型[23]。由于PDS基因序列的保守性,异源PDS基因片段也用于实现目的植物物种中PDS基因的瞬时沉默表达[24-25],可见,PDS基因在多种植物VIGS体系构建中的重要性。
在溪荪VIGS 体系构建中,存在基因沉默脱靶导致试验失败的风险,VIGS 试验的成功需要确保靶基因的高度特异性,这样才能确保较高的沉默效率。只有选择了沉默基因的特异性片段才能成功获得沉默表型,现在已开发出许多软件(如SGN、pssRNAit、DEQOR 等)来辅助进行预测VIGS沉默效率,以期取得更好的沉默表型[17,26-27]。本研究利用了SGN 网站选择了299 bp 的特异性片段,取得了较好的沉默效果。
针对不同植物种类的特点,目前已开发了多种VIGS 试验中的农杆菌侵染方法。除常见的真空渗透、注射器侵染等,还有用牙签挑出农杆菌并刺伤植株幼苗叶片,以及农杆菌直接喷洒植物幼苗等方法,都获得了良好的沉默效果[28-29],已有的接种方式,如真空渗透和灌根法更适用于幼苗及室温环境下的植物材料,并不适用于大田条件下的溪荪。小麦的大田苗VIGS 采用穗部摩擦接种法进行,但是出现了病毒接种浓度不均匀等问题,造成沉默效果大打折扣[22]。本研究针对于露地栽培溪荪采用叶片注射方法:1 mL 注射器针头扎伤溪荪叶片,沿着平行脉缓慢注射1 mL 重悬液至溪荪叶片上表皮维管束中。让菌液在溪荪的叶片中充分存留并发挥功效,此方法菌液注射的位置白化现象较为明显。
玫瑰(Rosa rugosa)[30]、矮牵牛[31]等多数植物在VIGS 处理后,为了缓解病毒侵染对植物材料的伤害都需要进行一定时间的人工遮光处理[32]。本研究从大田条件下的溪荪生长情况出发,将具体的接种时间安排为下午的6~8 点,此时环境温度相对较低,菌液不会快速蒸发,较为适合VIGS 接种,且接种以后无需人为制造遮光条件,使得操作方法更加简捷,省时省力,值得大田植物VIGS 体系构建来参考借鉴。
溪荪VIGS 体系中病毒侵染液的配制方法与现有的其他植物方法操作相似[30],但是考虑到本试验在大田环境中操作,相比于实验室环境较为特殊,影响其温度、湿度和光照强度等因素较多,且本试验种所用的溪荪为多年生的成熟植株,其本身具备较强的抗侵染能力和较强的抗性,为了提高农杆菌的侵染能力和效率及病毒的存活基数,本试验采用了侵染液现用现配的方式,提高携带病毒载体的农杆菌的浓度至OD600为1.8~2.0。保证了在自然条件下,溪荪叶片接种区域内携带病毒载体的农杆菌具有足够的存活基数,使整个试验的侵染效率得到提高。而侵染矮牵牛[31]、非洲菊[8]等植物的农杆菌浓度仅为OD6001.0~1.2,这与试验环境条件和试验用苗的生长状态有关。
在环境因素中,温度是影响烟草花叶病毒有效传播的最重要因素。在多种观赏植物研究中发现,VIGS 病毒感染的最适温度为15~20 ℃[33]。在温度22 ℃下,侵染高粱(Sorghum bicolor)叶片后发现仅有10%的植株产生了针对高粱PDS基因沉默的白化现象[34]。后人又对高粱VIGS 的试验体系进行了环境温度的优化,发现将沉默后的高粱植株转移到18 ℃温室后,1 个月后出现了100%的光漂白现象,证明了低温更有利于VIGS 病毒的侵染[35]。同样的,在对番茄VIGS 体系进行改进时,研究人员发现环境温度15 ℃为最佳,此时番茄叶片、果实和花朵90%以上的沉默表型[36],本研究选择在哈尔滨的室外温度为15~20 ℃的5月底进行,温度条件满足VIGS 所需的最适温度,故试验结果较为理想。
4 结论
综上所述,对于单子叶植物溪荪的VIGS 操作方法为:选择IsPDS的特异性片段,构建pTRV2-IsPDS载体后转化农杆菌,pTRV1 和pTRV2-IsPDS的菌液OD600调至1.8~2.0 后重悬,重悬液OD600调至0.8~1.0,在室外温度为15~20 ℃的下午6~8时进行,用1 mL 注射器针头扎伤溪荪叶片外表皮,沿着平行脉缓慢注射重悬液1 mL 至溪荪叶片维管束中,平均14 d 后溪荪叶片会出现明显的白化表型。本研究以溪荪为材料建立了VIGS 体系,克服了由于无遗传转化体系而导致的无法验证溪荪等鸢尾属植物利用本源开展基因功能研究的瓶颈。
