楸树DELLA基因家族生信分析及CbuGRAS9的功能分析
2024-01-02王珊珊樊二勤付鹏跃曲冠证
王珊珊 王 瑞 樊二勤 付鹏跃 曲冠证 王 楠
(1.林木遗传育种全国重点实验室,东北林业大学,哈尔滨 150040; 2.中国林业科学研究院,北京 100091)
成花转变是植物从营养生长到生殖生长的关键发育过程,该过程受到遗传和环境等诸多因子调控[1-2]。学者们基于模式植物拟南芥(Arabidopsis thaliana)揭示了许多植物成花诱导的分子机制[1,3]。植物开花由多条内外信号途径调控,主要遗传途径包括光周期途径、春化途径、自主途径、赤霉素途径、温度以及年龄途径[4-5]。这些途径通过激活成花调控因子FT、SOC1以及LFY 等促进开花,而ELF3、SVP、TEM1 和TEM2 等因子能抑制开花基因的表达[6]。赤霉素(GAs)途径被认为是调控开花的主要途径之一,当赤霉素受体感知GA 信号后,通过调控相关开花基因(如FT、FLC、SOC1及LFY)的表达进而影响植物开花[7-9]。生长抑制因子DELLA 蛋白是GA 信号转导的关键成分,目前许多研究已经证实DELLA 蛋白的多个保守结构域在GAs 信号通路中发挥调控作用[10]。DELLA蛋白C端的GRAS结构域高度保守,可以通过参与蛋白间的互作和转录调控过程抑制GAs 信号,同时对于维持DELLA 蛋白的功能也发挥了至关重要的作用[11]。DELLA 蛋白的N 端是不高度保守的,其N 端调控区所包含的DELLA 和TVHYNP 序列作为GA 信号的感知结构域,对GID1 结合至关重要,是GAs 诱导DELLA 蛋白降解的结构基础[12-13]。GAs 存在或者浓度增加的情况下,GAs 与GID1 受体结合促进GID1-GA-DELLA 复合物的形成,然后经过SCFSLY1E3 泛素酶介导靶向DELLA蛋白泛素化,最后致使DELLA 蛋白在26S 蛋白酶体中的最终降解[14-17]。有相关研究表明,DELLA调控植物生长可通过不依赖于GA 的方式进行[18],如发生琥珀酰化的DELLA 能够通过SIM-SUMO 结构域与GID1相互作用,随后DELLA蛋白的泛素化降解被诱导[19-21]。尽管已有研究表明DELLA 蛋白可能在生殖调控中发挥重要作用,但是不同物种中DELLAs 蛋白数目差异及功能分化还有待进一步研究[22]。
对于多年生木本植物而言,开花对其发育以及经济价值的提高至关重要。适宜的开花时间作为木本关键性状之一,很大程度上影响木本植物的品质[23]。楸树(Catalpa bungei)是紫葳科(Bignoniaceae)梓属(Catalpa)多年生木本植物,作为我国特有的珍贵树种和观赏树种,广泛分布在河南、安徽等地[24]。‘百日花’楸树(Catalpa‘Bairihua’)的获得是以F1代楸树为母本,滇楸(C.fargesiif.duclouxii)为父本,经过人工控制杂交获得的F2代杂种[25]。楸树一般在种植5~7 年后首次开花,而‘百日花’楸树作为一个新品种,嫁接当年就能开花,且花期要远长于普通楸树,每年累积花期可达100 d,这在木本植物中很少发生[23,26-27]。因此,‘百日花’楸树可作为木本植物中研究生殖转变相关调控机制的重要材料。本研究从楸树基因组中共鉴定到5 个DELLAs 基因,分析了其在‘百日花’和对照9-1(Catalpa bungei‘Luoqiu No.1’)中的表达量差异,明确了差异最显著的基因CbuGRAS9的分子功能,筛选了与CbuGRAS9 互作的蛋白。本研究不仅有助于进一步解析‘百日花’楸提早开花的分子机制,也将为其他木本植物生殖调控研究提供理论参考。
1 材料与方法
1.1 试验材料
试验材料是2022 年5 月在河南省南阳市采集的1 年生嫁接苗9-1 楸(对照)和‘百日花’楸,砧木为1 年生梓树(C.ovata)。试验中所用到的拟南芥(Arabidopsis thalianaCol-0)和烟草(Nicotiana benthamiana)均由林木遗传育种全国重点实验室提供。
1.2 CbuDELLAs蛋白基本信息学分析使用
利用ExPASy(https://web.expasy.org)网站在线预测CbuDELLAs 蛋白的氨基酸数目、等电点和分子质量;利用Plant-mPloc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/#)在线工具对CbuDELLAs 的蛋白进行亚细胞定位预测;通过SOPMA(https://npsa-prabi.ibcp.fr)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)在线工具对其进行蛋白质二级结构和三级结构预测;通过TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)和SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)在线工具对其跨膜结构域和信号肽进行分析。使用EMBLEBI(http://pfam.xfam.org/+TBtools)在线工具对楸树的氨基酸序列进行保守结构域的分析鉴定;使用MEME(https://meme-suite.org/meme/meme_5.3.2/tools/meme)网站对楸树CbuDELLAs 蛋白的保守基序进行在线分析,motifs 数目设置为12[28]。根据已知楸树基因组序列,提取转录起始位置(ATG)前2 000 bp 序列作为启动子序列,通过PlantCare 在线网站对基因启动子顺式作用元件进行预测。
1.3 楸树CbuDELLAs基因克隆
从楸树基因组中提取CbuGRAS1、CbuGRAS2、CbuGRAS9、CbuGRAS22和CbuGRAS32的 基 因 序列。利用植物总RNA 提取试剂盒(北京兆葵生物科技有限公司)提取9-1 楸和‘百日花’楸不同组织部位的总RNA,包括顶芽、幼叶、功能叶、茎、木质部、韧皮部以及‘百日花’楸树的花,提取详细方法参照试剂盒说明书。使用TaKaRa 公司的PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒将总RNA 反转录合成cDNA。利用Bioedit 软件进行引物设计,以cDNA 为模板,使用特异性引物扩增目的片段,所用引物见本刊网站电子附表1。反应体系与程序参考东洋纺(上海)生物科技有限公司的KOD-Plus-Neo 说明书。PCR 产物进行1%琼脂糖凝胶电泳检测,使用胶回收试剂盒对目的条带单一的胶块进行胶回收。回收得到的DNA片段与pEASY-T1 进行DNA 连接,连接产物通过热激法转入大肠杆菌感受态,涂布于具有Kan 抗性的LB 平板上,37 ℃倒置培养16~18 h。随机在抗性平板上挑取单克隆菌斑进行PCR 检测,检测正确的单克隆送至生工生物工程(上海)股份有限公司进行测序。
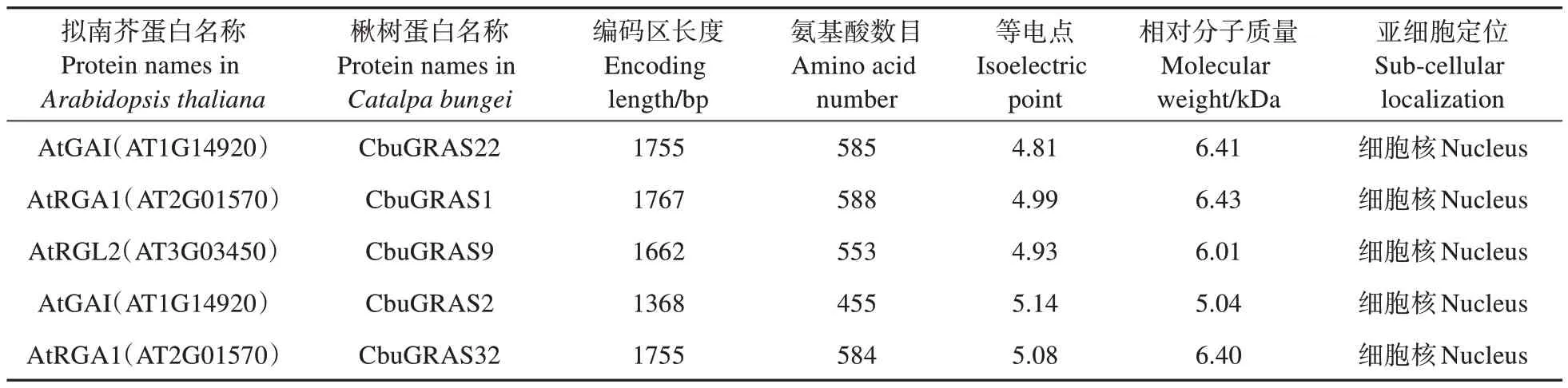
表1 CbuDELLAs蛋白的基本信息Table 1 Basic information of CbuDELLAs
1.4 楸树CbuDELLAs组织特异性表达分析
利用Instegrated DNA Technologies 在线网站进行定量引物设计,以CbuActin(evm.model.group3.531)为内参基因,以无性系9-1楸和‘百日花’楸不同组织部位的cDNA为模板进行qRT-PCR检测分析。定量PCR检测所需引物见附表1,实时荧光定量PCR体系参考TB GreenTMPremix ExTaqTMⅡ试剂说明书。使用2-△△CT法分析数据,分析CbuDELLAs在9-1楸和‘百日花’楸不同组织的相对表达量。
1.5 CbuGRAS9基因异源转化及表型分析
将目的片段CbuGRAS9与过表达载体pROKⅡ连接并转入GV3101 农杆菌(AgrobacteriumStrain),使用花序侵染法转化拟南芥。对转基因拟南芥进行表型观察分析。
1.6 农杆菌介导烟草叶片瞬时转化及亚细胞定位观察
构建pGWB405-35S::CbuGRAS9-GFP 质粒转化至GV3101农杆菌菌种中,使用注射法[29]对小叶烟草叶片瞬时转化,黑暗室温条件下培养48 h;取注射后叶片在激光共聚焦显微镜下观察亚细胞定位试验结果。
1.7 CbuGRAS9 蛋白转录激活活性分析及酵母双杂交文库筛选
将CbuGRAS9基因构建到pGBKT7 载体,在SD/-Trp/-Leu 液体培养基中分别加入Y2HGold(pGBKT7-CbuGRAS9)、阳性对照、阴性对照和毒性对照于恒温条件下培养;菌液分别稀释100、1 000、10 000 倍。菌液点样至SD/-Trp/-Leu/-Ade/-His(QDO)培养基,于恒温培养箱中培养72 h,观察转录自激活活性。挑取诱饵载体的单菌落加入SD/-Trp 液体培养基活化,活化菌液划线培养。单菌落过夜培养至OD600到达0.8。将酵母菌液加入液体培养基重悬细胞。将楸树酵母文库工作菌液与重悬的菌液一同加入液体培养基,在恒温振荡培养箱中培养;20 h 后,40 倍光学显微镜下观察杂交样品中是否出现三叶草形状的结合子。将培养后的菌液离心后再次用液体培养基重悬菌体,重复2次;取部分菌液梯度稀释100、1 000、10 000倍,分别将原液与稀释菌液涂在平板上培养。观察培养基上的白色菌落,随机挑取单菌落进行PCR检测[23]。
1.8 高通量测序及GO富集和KEGG富集分析
将酵母双杂交筛选的所有菌落混合后进行纯化回收送至深圳华大基因股份有限公司进行高通量测序。测序结果利用cutadapt2.6[30]去除引物序列,将去除引物后的reads 利用bowtie2.3.5.1[28]比对到参考基因组。比对到各个基因的测序reads count 使用bedtools v2.29.0[31]进行提取,将count>0的基因进行GO 富集分析和KEGG 富集。GO 分析标注目的基因并且注释分类;通过目的基因的分布情况,判断目的基因相关功能。将目的基因与KEGG数据库比对,标记目的基因的分布及富集情况及显著相关的信号通路[32]。
2 结果与分析
2.1 CbuDELLAs蛋白基本信息学
提取拟南芥中的AtDELLAs 蛋白序列并在楸树基因组中BLAST,鉴定到5 个同源蛋白。将5 个CbuDELLAs蛋白根据拟南芥数据库中蛋白质注释分别命名为CbuGRAS1、CbuGRAS2、CbuGRAS9、CbuGRAS22 和CbuGRAS32,均属于GRAS 家族,DELLA 亚家族。如表1 所示,全部蛋白的氨基酸数目455~588,相对分子质量5.04~6.43 kDa,等电点4.81~5.14。亚细胞定位的预测结果显示,5 个CbuDELLAs 蛋白均定位于细胞核中。除了Cbu-GRAS22 不稳定系数小于40 之外,其他几个蛋白不稳定系数都大于40,表明仅CbuGRAS22 是稳定蛋白,其余为不稳定蛋白。根据预测结果显示,CbuDELLAs 蛋白亲水性平均系数-0.246~-0.174,全部为亲水性蛋白。
2.2 CbuDELLAs蛋白二级与三级结构
将CbuDELLAs 蛋白进行二级结构预测,5 个蛋白二级结构中α螺旋所占比例最多,在50%左右;其次是无规则卷曲,占比28.57%~40.82%;β转角和延伸链占比分别为4.40%~5.64%和8.90%~10.55%;因此CbuDELLAs 蛋白的主要组成成分是α螺旋和无规则卷曲(图1,表2)。蛋白三级结构预测结果如图2 所示,CbuGRAS1、CbuGRAS32 和CbuGRAS9 都 由15 个α螺 旋 和9 个β折 叠 组 成,CbuGRAS2 由14 个α螺 旋 和11 个β折 叠 组 成,CbuGRAS22 由14 个α螺旋和9 个β折叠组成,表明CbuGRAS1、CbuGRAS32 和CbuGRAS9 的 三 级结构特征相似,与其他两个有所不同。
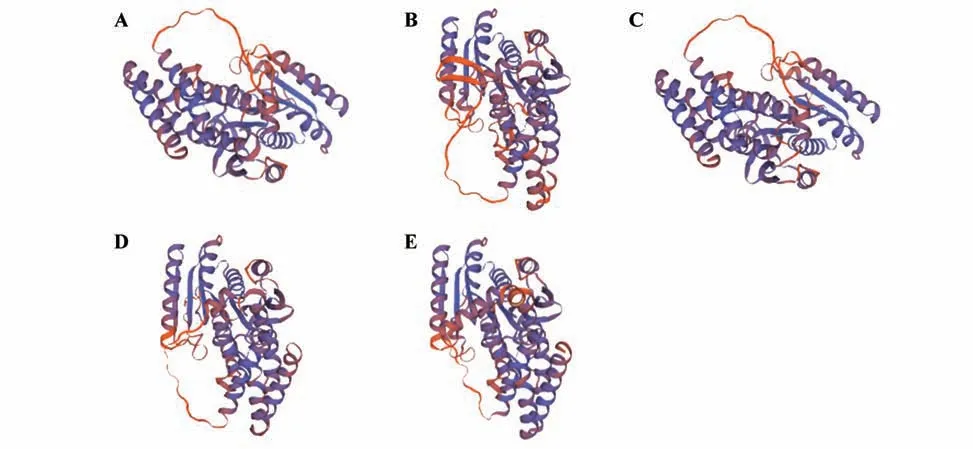
图2 CbuDELLAs蛋白三级结构预测A.CbuGRAS1蛋白三级结构;B.CbuGRAS2蛋白三级结构;C.CbuGRAS9蛋白三级结构;D.CbuGRAS22蛋白三级结构;E.CbuGRAS32蛋白三级结构。Fig.2 Tertiary structure prediction of CbuDELLA proteins A.Tertiary structure of CbuGRAS1;B.Tertiary structure of CbuGRAS2;C.Tertiary structure of CbuGRAS32;D.Tertiary structure of CbuGRAS9;E.Tertiary structure of CbuGRAS22.
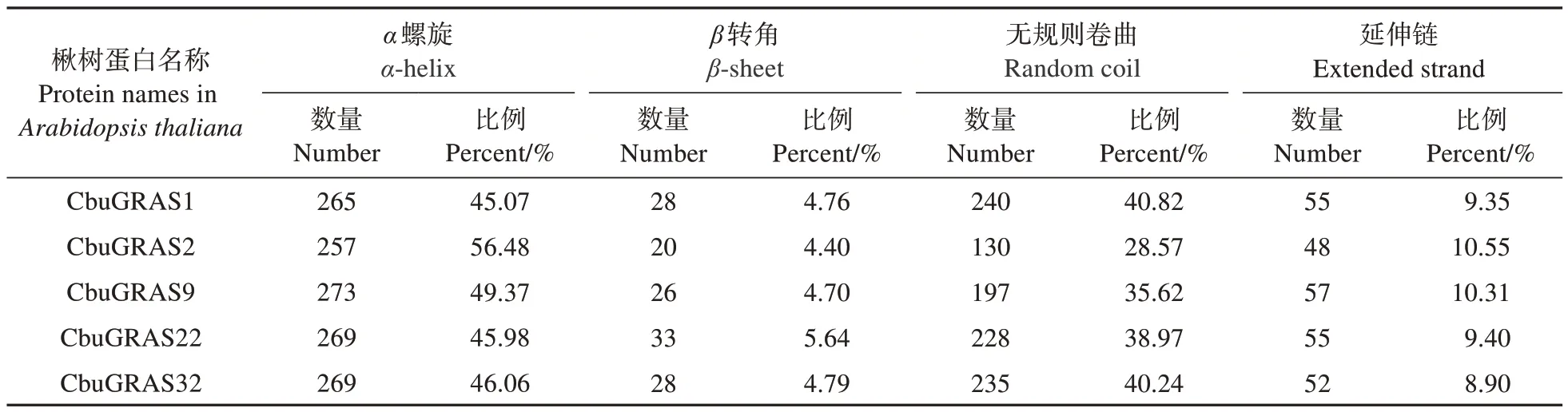
表2 CbuDELLAs蛋白的二级结构分析Table 2 Secondary structure analysis of CbuDELLAs
2.3 CbuDELLAs保守结构域与保守基序
CbuDELLAs 蛋白均包含C 端的GRAS 保守结构域和N 端的DELLA 结构域(见图3)。使用MEME 在线工具对楸树DELLAs 蛋白的保守基序分析,motifs数量设置为12;CbuGRAS2缺少motif 8和motif 12,而CbuGRAS1、CbuGRAS9、CbuGRAS22和CbuGRAS32 的12 个保守基序相同且位置基本一致。由此表明CbuGRAS22、CbuGRAS1、Cbu-GRAS9 和CbuGRAS32 有较高的相似性,而Cbu-GRAS2与其他蛋白存在差异性。
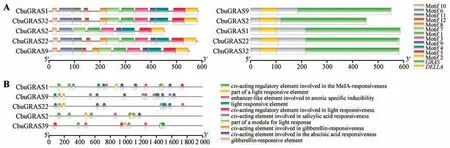
图3 CbuDELLAs蛋白保守结构域与启动子顺式作用元件A.左:CbuDELLAs蛋白保守结构域;右:CbuDELLAs蛋白保守基序;B.CbuDELLAs启动子顺式作用元件分析。Fig.3 Analysis of conserved domain of CbuDELLAs and cis-acting elements of CbuDELLAs promoter A.Left:conserved domain CbuDELLAs;Right:conserved motif of CbuDELLAs;B.Cis-acting elements of CbuDELLAs promoter.
2.4 CbuDELLAs启动子顺式作用元件
从楸树基因组序列提取CbuDELLAs转录起始位置前2 000 bp 序列,通过PlantCare 在线网站预测基因启动子顺式作用元件。预测结果显示,CbuDELLAs基因启动子含有真核生物启动子的基本元件CAAT-box 和TATA-box(见图3B)。经可视化分析,CbuDELLAs基因启动子含有光响应作用元件、激素诱导元件(参与赤霉素反应的顺式作用调节元件和参与脱落酸反应的顺式作用调节元件)等,因此推断CbuDELLAs基因可能通过介导赤霉素信号通路参与‘百日花’楸树的早花过程。
2.5 CbuDELLAs基因克隆
利用附表1中的引物克隆基因片段,克隆产物经1%琼脂糖凝胶电泳检测,显示出的条带位置与目的序列大小一致(见图4A)。将胶回收后的片段与pEASY-T1进行连接并转化大肠杆菌,随机挑取单克隆菌斑进行PCR检测(见图4),挑选检测结果正确的单克隆菌斑进行测序分析,测序结果与CbuDELLAs基因序列相似性高达99%以上。
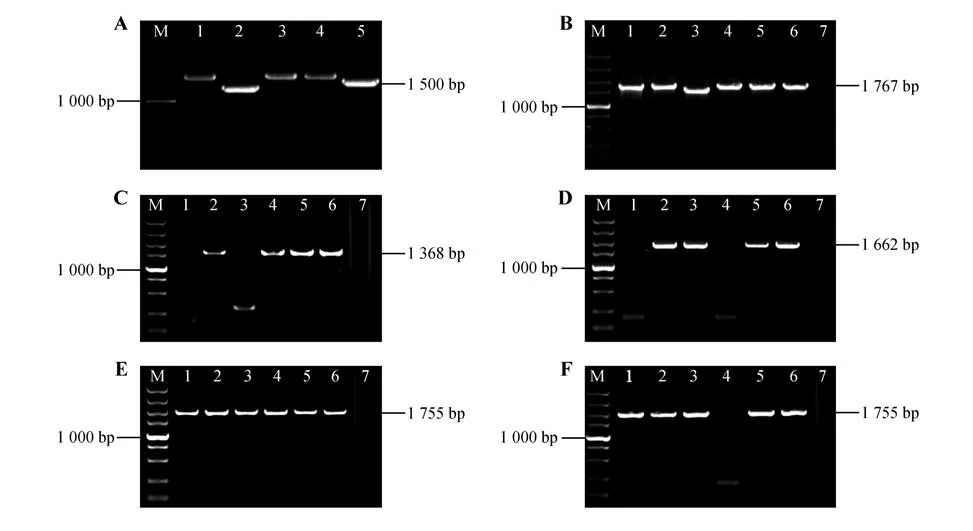
图4 目的片段克隆及连接到pEASY-T1大肠杆菌菌液PCR检测M.DL5000 DNA Marker;7.阴性对照;A.楸树DELLA 基因克隆(1~5.基因CbuGRAS1、CbuGRAS2、CbuGRAS22、CbuGRAS32、CbuGRA9 克隆产物);B.pEASY-T1-CbuGRAS1 在大肠杆菌菌液中的PCR 检测(1~6.pEASY-T1-CbuGRAS1 菌液PCR 产物);C.pEASY-T1-CbuGRAS2 在大肠杆菌菌液中的PCR 检测(1~6.pEASY-T1-CbuGRAS2 菌液PCR 产物);D.pEASY-T1-CbuGRAS9 在大肠杆菌菌液中的PCR 检测(1~6.pEASY-T1-CbuGRAS9菌液PCR 产物);E.pEASY-T1-CbuGRAS22在大肠杆菌菌液中的PCR 检测(1~6.pEASY-T1-CbuGRAS22菌液PCR 产物);F.pEASYT1-CbuGRAS32在大肠杆菌菌液中的PCR检测(1~6.pEASY-T1-CbuGRAS32菌液PCR产物)。Fig.4 Cloning of the target sequence and PCR detection of the fragment linked to E.coli pEASY-T1 M.DL5000 DNA Marker;7.Negative control;A.Sequences of Catalpa bungei DELLA(s1-5.CbuGRAS1,CbuGRAS2,CbuGRAS22,CbuGRAS32,Cbu-GRA9 PCR products);B.PCR detection of pEASY-T1-CbuGRAS1 in E.col(i1-6.PCR products of pEASY-T1-CbuGRAS1);C.PCR detection of pEASY-T1-CbuGRAS2 in E.col(i1-6.PCR products of pEASY-T1-CbuGRAS2);D.PCR detection of pEASY-T1-CbuGRAS9 in E.col(i1-6.PCR products of pEASY-T1-CbuGRAS9;E.PCR detection of pEASY-T1-CbuGRAS22 in E.col(i1-6.PCR products of pEASY-T1-CbuGRAS22);F.PCR detection of pEASY-T1-CbuGRAS9 in E.col(i1-6.PCR products of pEASY-T1-CbuGRAS9).
2.6 CbuDELLAs在不同组织部位的特异性表达
以9-1楸和‘百日花’楸不同组织部位的cDNA为模板,检测CbuDELLAs基因的表达水平。结果表明,CbuDELLAs主要在顶芽和幼叶中表达,在茎和韧皮部中表达量较低。CbuGRAS9在9-1 中整体表达量最高,CbuGRAS32次之,CbuGRAS2表达量整体最低(见图5A)。而在‘百日花’楸中,除了木质部之外CbuGRAS9在各个组织部位表达量都最高,CbuGRAS32整体表达量高于CbuGRAS22,Cbu-GRAS2表达量最低(见图5B)。其中,CbuGRAS9在‘百日花’楸和9-1楸顶芽中的表达量差异最大,其在‘百日花’楸中的表达量比在9-1 楸中高达26倍,由此推测CbuGRAS9基因可能在‘百日花’楸早花中发挥关键作用。
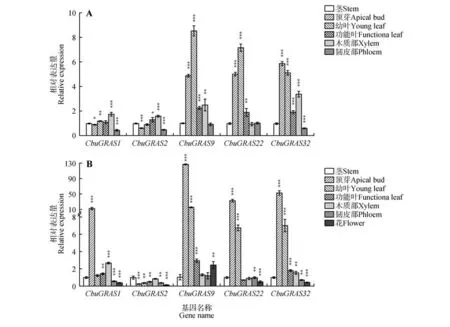
图5 组织特异性表达分析A.CbuDELLAs 在‘9-1’楸不同组织中表达分析;B.CbuDELLAs 基因在‘百日花’楸不同组织中表达分析;*代表P<0.05,**代表P<0.01,***代表P<0.001。Fig.5 Tissue-specific expression analysis of CbuDELLAs A.Expression analysis of CbuDELLAs among different tissues in Catalpa bungei‘ Luoqiu No.1’;B.Expression analysis of CbuDELLAs among different tissues in Catalpa‘ Bairihua’;* represented P value was less than 0.05,** represented P value was less than 0.01,*** represented P value was less than 0.001.
2.7 pROKІІ-CbuGRAS9 转基因植株的表型鉴定及功能分析
将CbuGRAS9构建至pROK 载体并转化至农杆菌中,使用浸花法侵染拟南芥,创制由35S 启动子驱动的过表达拟南芥植株。以T3 代拟南芥DNA 进行PCR 鉴定,电泳检测结果显示DNA 条带与目标序列条带大小一致,证明目的载体成功转入拟南芥(见图6C)。表型观察发现,转基因株系的开花时间明显被推迟,且转基因株系的叶片大小、株高等指标也明显受到抑制(见图6A~B)。选取最显著的3 个株系进行qRT-PCR 分析,发现转基因拟南芥中CbuGRAS9基因表达量显著提高(见图6D)。以上结果表明,CbuGRAS9基因参与介导植物的开花过程。
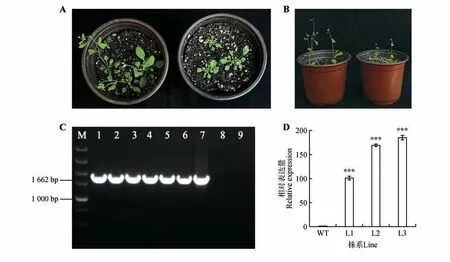
图6 CbuGRAS9基因异源转化表型观察及表达模式分析A~B.左侧为野生型拟南芥,右侧为过表达CbuGRAS9转基因拟南芥。阳性鉴定后,选取3株分别取叶片进行qRT-PCR分析;C.转基因拟南芥DNA 水平检测;M.DL5000 DNA Marke(r1~6.转基因株系PCR 产物;7.阳性对照;8.野生型拟南芥;9.ddH2O 作为阴性对照);D.转基因拟南芥qRT-PCR检测(WT.野生型拟南芥株系;L1~L3.转基因拟南芥株系);***P<0.001。Fig.6 Phenotype observation and expression pattern analysis of heterologus transformation of CbuGRAS9 A-B.The left side of wild-type Arabidopsis thaliana,the right side over-expression of CbuGRAS9 Arabidopsis thaliana.After positive identification,three strains were selected and leaves were taken for qRT-PCR analysis;C.Detection of transgenic Arabidopsis DNA leve(lM.DL5000 DNA Marker;1-6.PCR products of transgenic lines;7.Positive control;8.Wild type Arabidopsis thalianas;9.ddH2O as a negative control);D.qRT-PCR detection of transgenic Arabidopsis thaliana(WT.Wild-type Arabidopsis thaliana;L1-L3.Transgenic Arabidopsis thaliana);*** represented P value was less than 0.001.
2.8 CbuGRAS9蛋白亚细胞定位
使用Plant-mPloc 在线网站对CbuGRAS9 蛋白进行亚细胞定位预测,发现其定位于细胞核。为了验证这一预测,构建pGWB405-35S::CbuGRAS9-GFP载体,将构建的载体及空载分别瞬时转化至烟草叶片中,通过激光共聚焦显微镜观察GFP荧光信号观察,证实CbuGRAS9是核定位蛋白(见图7A)。
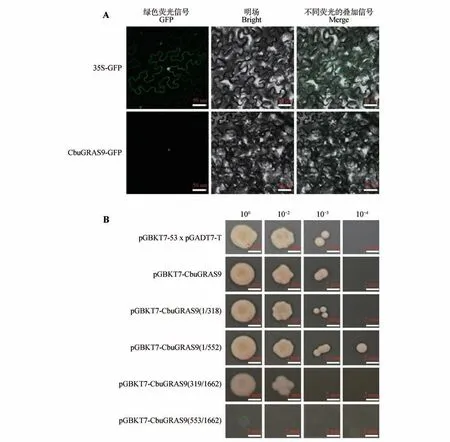
图7 CbuGRAS9亚细胞定位及转录激活活性分析A.35S::CbuGRAS9-GFP;CbuGRAS9与GFP的融合载体;B.CbuGRAS9转录激活活性分析。Fig.7 Sub-cellular localization and transcriptional activation activity of CbuGRAS9 A.35S::CbuGRAS9-GFP;fusion vector of CbuGRAS9 and GFP;B.Transcriptional activation activity of CbuGRAS9.
2.9 筛选与CbuGRAS9互作的蛋白
为揭示CbuGRAS9 蛋白介导楸树早花的分子机制,是否通过结合蛋白质调节信号转导途径,使用楸树酵母文库筛选可能与CbuGRAS9 互作的蛋白质,利用高通量测序进一步分析互作蛋白质的生物学过程与分子功能。
将构建好的pGBKT7-CbuGRAS9载体转入Y2HGold 酵母菌液中,在SD/-Trp/-Leu/-Ade/-His(QDO)培养基上30 ℃培养72 h,pGBKT7-Cbu-GRAS9酵母菌落生长正常,说明CbuGRAS9蛋白存在转录激活活性且无毒性;将CbuGRAS9 蛋白分为4段分别构建至pGBKT7载体中并转入Y2HGold中,在QDO 培养基上培养,结果表明CbuGRAS91-552区间存在转录激活活性且无毒性(见图7B)。
将CbuGRAS9基因无转录激活活性(553~1 662 bp)的片段构建至pGBKT7载体中,与实验室保存的楸树cDNA 核蛋白二代文库进行杂交,在QDO 培养基上进行筛选;每10~15 个单菌落混合后进行PCR 鉴定,电泳结果显示每个混合样品均有条带且大小有明显差异,证明与文库互作成功(见本刊网站电子附图1)。将所有的PCR 产物纯化回收后进行高通量测序,共筛选到2 392 个蛋白,其中包含103 个转录因子(见本刊网站电子附件2)。将筛选到的全部基因进行基因本体论(GO)分析,结果显示在生物学过程分类中,代谢、细胞和单个组织进程的条目被明显富集;在细胞组学分类中,主要富集在细胞组分;在分子功能分类中,结合和催化活性条目被明显富集(见图8A)。KEGG 富集分析结果,与CbuGRAS9 互作的蛋白主要在核糖体、氨基酸合成、次级代谢、光合作用、TCA循环等代谢通路(见图8B)。
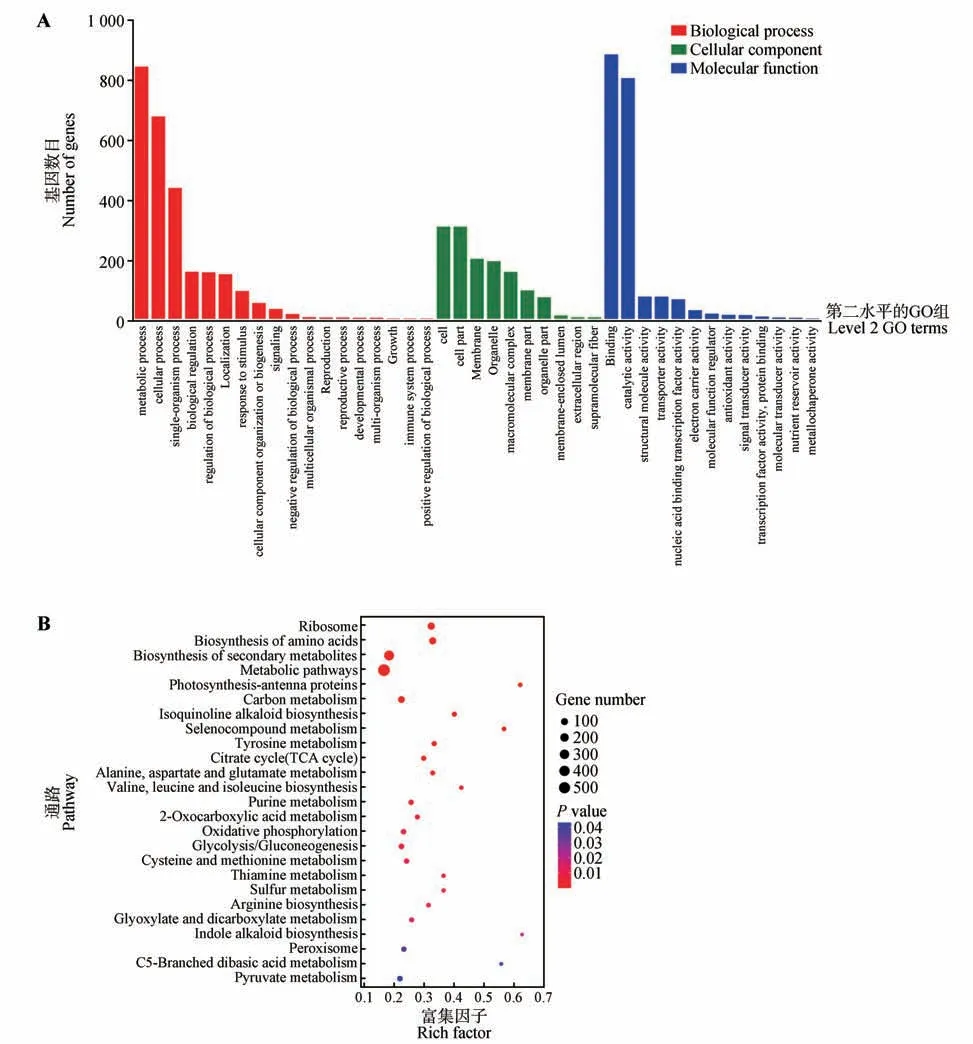
图8 GO富集及KEGG Pathway富集分析Fig.8 GO enrichment and KEGG Pathway enrichment analysis
3 讨论
通过生物信息学分析,在楸树中获得的5 个CbuDELLAs氨基酸数目为455~588,相对分子质量5.04~6.43 kDa,等电点4.81~5.14;CbuDELLAs蛋白均含有DELLA 和GRAS 保守结构域,全部为亲水性蛋白且可能是不参与细胞信号传导的蛋白质。亚细胞定位结果显示CbuDELLAs 蛋白均定位于细胞核中,这与水曲柳(Fraxinus mandshurica)、烟草和葡萄(Vitis vinifera)等物种中同源蛋白的亚细胞定位类似[33-35]。瞬时转化烟草叶片,再次证实了楸树中的CbuGRAS9 蛋白是核定位蛋白。CbuDELLAs基因的启动子上含有光响应作用元件和激素诱导元件(参与赤霉素反应的顺式作用调节元件和参与脱落酸反应的顺式作用调节元件),表明楸树中的CbuDELLAs可能参与光信号和赤霉素信号调控,进而可能通过赤霉素途径参与早开花过程[36-37]。
根据CbuDELLAs在‘百日花’楸与9-1 楸不同组织部位的相对表达量分析发现,CbuDELLAs基因在楸树顶芽和幼叶中表达;在‘百日花’楸中CbuDELLAs基因表达量高于对照9-1 楸,其中,CbuGRAS9在‘百日花’楸中的表达量最高。将CbuGRAS9在拟南芥中异源过表达,转基因拟南芥表现出了开花时间延迟等表型。在拟南芥中,根据DELLA 结构域和保守的GRAS 结构域的特征区分了五类DELLA 蛋白,分别为GAI、RGA、RGL1、RGL2 和RGL3。GAI 和RGA 的功能丧失完全抑制了ga1-3突变体(严重的GA 缺陷突变体ga1-3)的矮化表型,表明GAI 和RGA 参与抑制茎的伸长[38-39]。在花的发育过程中,RGA、RGL1 和RGL2发挥了共同调节的作用。ga1-3突变体的雄性不育表型可通过RGA、RGL1 和RGL2 的功能缺失突变的组合来抑制。RGL2 抑制种子发芽,在GAI 和RGA 的 作 用 下 其 抑 制 功 能 得 到 加 强[40-43]。CbuDELLAs 蛋白在GA 信号通路中显示出重叠且一些不同的功能可能对GA 介导的整个植物发育过程提供负调控作用[44-45]。梨树(Pyrus sorotina)中得到了4 个DELLA基因,这些DELLA基因对植物的生长有抑制效应且功能相似,而其中PbDELLA2基因发挥了最强的抑制作用,对植物的生长发育调控最重要[46]。不同的DELLA 蛋白发挥的功能可能重叠或不同,不同物种间的DELLA 蛋白可能发挥相似或不同的功能。
目前高通量测序成为分子生物学不可或缺的手段,助力于进一步解析目的蛋白介导细胞中信号转导的分子机制。酵母互作文库筛选到的2 392 个与CbuGRAS9 互作的蛋白,这些蛋白主要在核糖体、氨基酸合成、次级代谢、光合作用、TCA循环等代谢通路。筛选出的2 392 个蛋白中共有104 个转录因子,包含开花调控相关转录因子SPL、MYB 和NF-YC 等。已有相关研究表明,拟南芥中SPL 转录因子与赤霉素信号途径中的DELLA蛋白相互作用,调控下游基因SOC1和miR172 等,进而影响植物开花[43]。在陆地棉(Gossypium hirsutum)中,过表达GhMYB44a和GhMYB44b都促进了拟南芥早开花;水稻(Oryza sativa)MYB21-like基因Os01g45090和Os05g49310参与调控水稻开花[47-48]。在拟南芥中过表达陆地棉的GhNFYC4导致拟南芥提前开花,表明转录因子NF-YC 可能参与调控早花[49]。楸树中CbuGRAS9 蛋白是否能与开花相关的转录因子CbuSPL9、MYB 和NF-YC 发生互作,直接或间接调节相关基因表达,从而影响楸树的花期有待进一步验证。
