两性霉素B菌种选育及发酵工艺研究
2024-01-02随子华孙术超鞠加学葛鹍鹏赵国忠陈瑶瑶
随子华,孙术超,鞠加学,葛鹍鹏,赵国忠,陈瑶瑶
(1.华北制药华胜有限公司,河北石家庄052160;2.微生物药物国家工程研究中心,河北石家庄 052165;3.河北省工业微生物代谢工程技术研究中心,河北石家庄 052165;4.华北制药集团新药研究开发有限责任公司,河北石家庄 052165)
两性霉素B(amphotericin B,AmB)是由结节链霉菌(Streptomycesnodosus)产生的一种多烯大环内酯类抗生素。其作为重要的广谱抗真菌药物[1-3],通过与敏感真菌细胞膜上的固醇相结合形成通道,损伤细胞膜的通透性,破坏细胞的正常代谢,从而抑制真菌生长,这种独特的抗菌机制避免了真菌产生耐药性[4]。两性霉素B自上市以来,不可替代地被用于治疗全身真菌感染[5-6]。两性霉素B对新型隐球菌、毛霉菌、念珠菌和曲霉菌等[7-10]侵袭性真菌感染治疗效果优异。毛霉菌病在过去的病死率高达50%,一线药物也是两性霉素B,与其他药物联用可以进一步提高疗效[11-12]。此外,两性霉素B脂质体[13-14]以及两性霉素B纳米复合物[15]的出现,不但提高了药物稳定性,还使不良反应的发生率明显下降。
工业上通过生物发酵法获得两性霉素B,提高发酵单位,降低生产成本,才能满足两性霉素B及其相关产品的临床需求。张雨函[16]和王昂等[3]通过在发酵过程中添加不同的前体物质和调控发酵策略优化发酵工艺等方式来提高两性霉素B的发酵单位。选育高产菌株提升菌种的生产性能可进一步降低生产成本。紫外诱变是传统诱变方式之一,王亚军等[17]采用紫外诱变选育的两性霉素B高产菌株发酵单位较出发菌株提高了20%。单一诱变剂的重复使用往往会导致抗性饱和,而2种或2种以上诱变方式的合理搭配会产生协同效应。胡悦等[18]采用LiCl-ARTP复合诱变处理地衣芽孢杆菌,获得了高产碱性蛋白酶的优良菌株。张昳[19]采用“ARTP+EMS+Strr”三重复合诱变处理筛选,得到刺糖多孢菌突变菌株AES-8,其多杀菌素产量较出发菌株提高86.81%,且具有遗传稳定性。
目前工业生产两性霉素B发酵水平低、生产工艺不稳定,导致生产成本高,难以满足逐渐扩大的市场需求。本研究通过对两性霉素B产生菌采用紫外诱变和常压室温等离子体(atmospheric and room temperature plasma, ARTP)诱变的复合诱变方式进行菌株选育,经抗性筛选,最终获得稳定传代的两性霉素B高产菌株。采用响应面设计对发酵培养基配方进行优化,获得适合高产菌株的培养基组成。高产菌株和发酵配方经50 L发酵罐试验验证,提高了两性霉素B发酵水平,对提高工业化生产水平、降低生产成本、提高企业竞争力具有重要意义。
1 材料与方法
1.1 材 料
1.1.1 实验材料
结节链霉菌(Streptomycesnodosus)A318-10,由华北制药集团新药研究开发有限责任公司菌种保藏中心提供。
1.1.2 培养基配制
向种子培养基中加入葡萄糖20 g、酵母粉15 g、鱼蛋白胨1.5 g、氯化钾0.8 g、七水硫酸镁2.5 g、碳酸钙8 g,加蒸馏水定容至1 L,用NaOH调节pH值至7.0,120 ℃灭菌30 min。
向发酵培养基中加入葡萄糖30 g、淀粉10 g、中温豆粉15 g、鱼蛋白胨2 g、氯化钾1 g、碳酸钙8 g,加蒸馏水定容至1 L,用NaOH调节pH值至7.0,120 ℃灭菌30 min。
1.1.3 实验仪器设备
常温常压等离子体诱变育种仪(ARTP-IIS型),天木生物科技有限公司提供;高速冷冻离心机(64R型),美国贝克曼库尔特有限公司提供;电子天平(JJ2000型)、分析天平(JJ224BC型),常熟市双杰测试仪器厂提供;超净工作台(BCM-1600A),苏州安泰空气技术有限公司提供;真空干燥箱(DZF-6050型),上海简户仪器设备有限公司提供;高压蒸汽灭菌锅(LMQ.C-100E),济南来宝医疗器械有限公司提供;酸度计(FE20),梅特勒-托利多仪器(上海)有限公司提供;摇床(New Brunswick Innova 2300),新泽西科学公司提供;恒温恒湿培养箱(LRH-150-SH),广东泰宏君科学仪器股份有限公司提供;高效液相色谱仪(Waters e2695-2489)、色谱柱(Symmetry C18),沃特世科技(上海)有限公司提供;15 L种子罐、50 L发酵罐,上海国强生化工程装备有限公司提供。此外,紫外诱变箱为自制。
1.2 方 法
1.2.1 培养方法
将结节链霉菌保藏种液以4%(体积分数,下同)的接种量接种于装有15 mL培养基的50 mL三角瓶中,26 ℃,180 r/min振荡培养2 d,再将培养好的种子液以5%(体积分数,下同)的接种量接种于装有300 mL培养基的1 L三角瓶中,在26 ℃,220 r/min振荡条件下培养6 d。
1.2.2 效价测定
1)样品处理 取1.0 mL发酵液于试管中,加入9.0 mL二甲基亚砜,室温条件下振荡摇匀,然后静置浸泡15 min。取2.0 mL上清液置于离心管中,10 000 r/min离心3 min。移取离心液1.0 mL,用甲醇稀释于100 mL容量瓶中,得样品溶液。用0.22 μm微孔滤膜过滤,滤过液进行HPLC分析。
2)检测条件 Waters e2695-2489高效液相色谱仪,色谱柱为Symmetry C18(4.6 mm × 250 mm,5 μm);流动相为甲醇-乙腈-EDTA溶液(2.5 mmol/L)(体积比为50∶25∶35),用4.25%(质量分数)磷酸调节pH值为5.00±0.05;流速为1.0 mL/min;柱温为30 ℃;检测器波长为405 nm;进样量为20 μL。
1.3 试验设计
1.3.1 高产菌株诱变试验
1)紫外诱变 取结节链霉菌单孢子悬液置无菌平皿中,于紫外诱变箱(照射距离为32 cm,紫外功率为30 W)分别照射10,20,30,60和90 s,同时以未经照射的菌液为空白对照,于平板培养基中培养后分别计算致死率和正突变率。
2)ARTP诱变 取结节链霉菌单孢子悬液涂于金属载片上,于ARTP诱变箱(照射距离为2 mm,电源功率为110 W,工作气流量为10 L/min),分别处理20,35,50,70和90 s后,以未经诱变的菌液为对照,于平板培养基中培养后分别计算致死率和正突变率。
3)两性霉素B抗性质量浓度的选择 取两性霉素B单孢子悬液涂布于含不同质量浓度(7 000,8 000,9 000,11 000,13 000,15 000 μg/mL)的两性霉素B抗性平板上培养。
诱变菌株致死率=(未诱变平板菌落数—诱变后平板菌落数)/未诱变平板菌落数×100%。诱变菌株突变率的计算以发酵效价为标准,发酵效价提高或降低10%以上的诱变菌株定义为突变株。发酵效价提高的突变株定义为正突变株。正突变率=正突变株数/总诱变菌株数×100%。
1.3.2 单因素试验
在均匀设计获得的已知配方中挑选主要碳源和氮源的4个效应因子进行单因素分析,筛选影响较大的效应因子进行响应面优化,试验设计见表1。
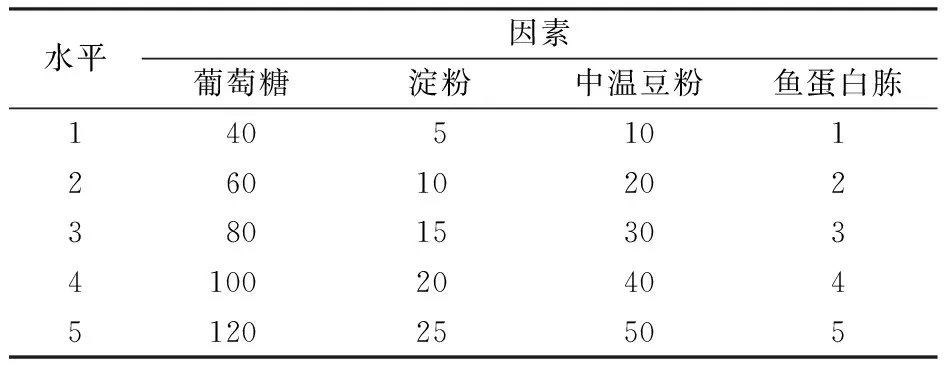
表1 单因子试验设计表
1.3.3 响应面优化试验
在前期单因素试验的基础上,结合单因子试验结果,选取葡萄糖、中温豆粉、淀粉作为试验考察因素,采用Box-Behnken Design(简称BBD)在Design-Expert 12软件上进行响应面分析试验,各因素水平编码见表2。
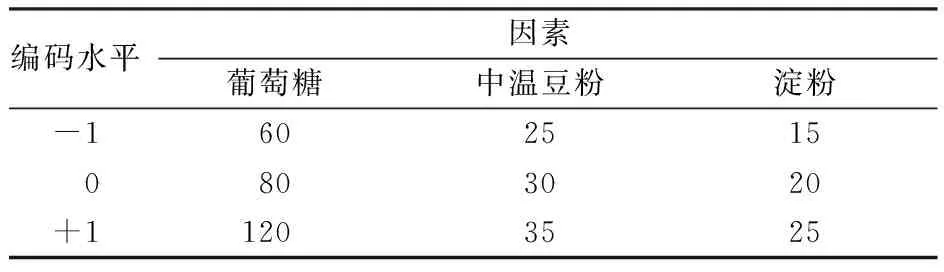
表2 Box-Behnken设计的因素水平及编码
1.3.4 发酵优化配方验证
依据软件Design-Expert 12优化后得到的最佳添加量,在1 L三角瓶中进行试验,以及在50 L发酵罐进行发酵验证。
2 结果与分析
2.1 诱变条件的选择
采用方法“1.3.1”进行诱变条件的选择,由表3可见,随着紫外线(ultraviolet,UV)处理时间延长,致死率逐渐增加,而正突变率呈先上升后下降的趋势。当UV处理60 s时,正突变率最大,达到25.2%,因此选取60 s为UV处理最适时间。由表4可见,当ARTP处理时间为35 s时,正突变率高达24.5%,选取35 s为ARTP处理最适诱变时间。
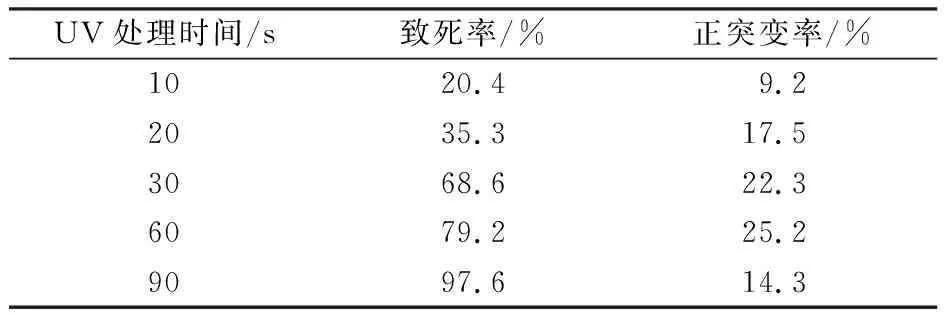
表3 不同UV处理时间的致死率和正突变率
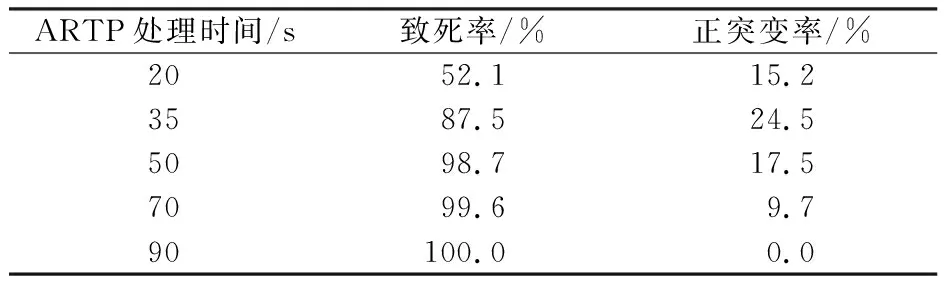
表4 不同ARTP处理时间的致死率和正突变率
由表5可见,当两性霉素B质量浓度在13 000 μg/mL及以上时,会抑制菌体生长,因此选取13 000 μg/mL为抗性质量浓度反复处理,筛选抗性菌株。

表5 不同抗性质量浓度对两性霉素B菌株生长的影响
2.2 复合诱变
根据确定的最适诱变条件将两性霉素B单孢子悬液经UV照射60 s后再经ARTP照射35 s,采用复合诱变处理后的两性霉素B菌悬液于平板培养基中培养,挑取单菌落经摇瓶发酵初筛,筛选出的菌株经3次摇瓶复试,最终获得较对照产量提高10%以上的3株高产菌株,其中菌株20-1-25较出发菌株提高20.8%,结果见表6。

表6 复合诱变筛选的两性霉素B高产菌株
2.3 自身产物抗性筛选
将复合诱变筛选的高产菌株20-1-25制备成单孢子悬液,涂布于含13 000 μg/mL两性霉素B的平板培养基上,培养结束后将生长出的单菌落转接于斜面培养基,筛选到的菌株经3次复试,获得6株高产菌株,其中菌株20-2-15提高达15.7%,结果见表7。
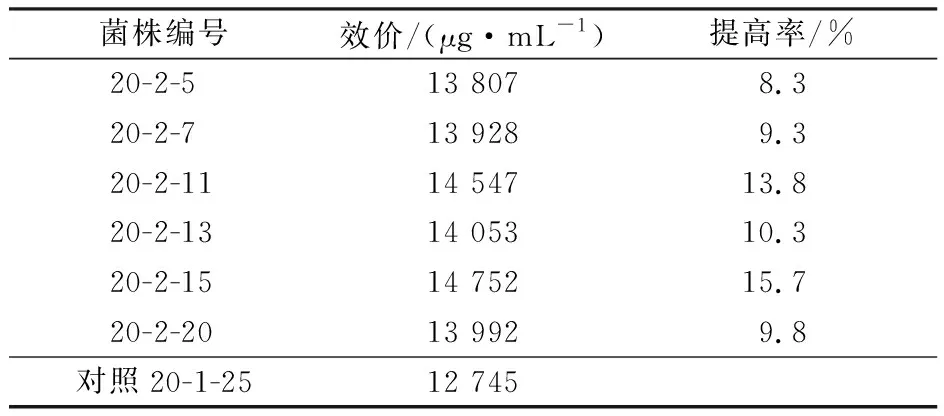
表7 抗性筛选的两性霉素B高产菌株
将比菌株20-1-25提高10%以上的3株菌,与出发菌株A318-10对比,经复合诱变和自身抗性筛选获得的高产菌株20-2-15比出发菌株提高37.5%,结果见表8。
2.4 稳定性试验
将选育的高产菌株20-2-15采用斜面传代方式,考察稳定性,连续传代5次,进行摇瓶试验测定发酵效价。由表9可见,菌株20-2-15从F1代到F4代,发酵效价波动水平不超过10%,说明高产菌株具有良好的传代稳定性,有利于规模化工业生产。
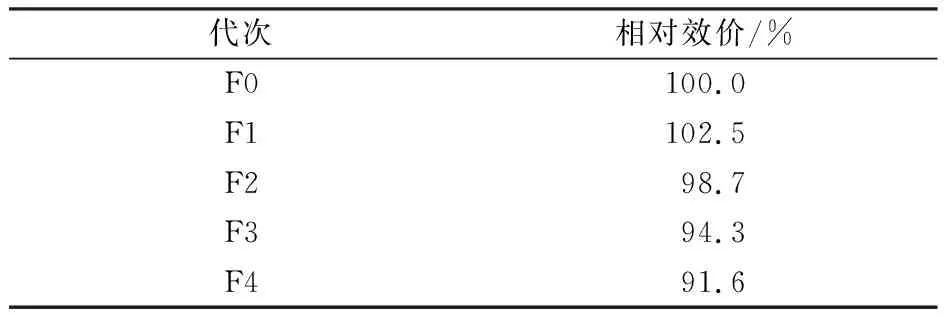
表9 高产菌株20-2-15遗传稳定性
2.5 效应因子的筛选
以选育出的高产菌株20-2-15为试验菌株,在均匀设计确定的培养基基础上,使用响应面分析再次对培养基配方进行优化。
在均匀设计获得的已知配方中挑选主要碳源和氮源的4个效应因子进行单因素分析,结果如图1所示。从图中可以看出,不同碳源和氮源浓度条件下,葡萄糖、淀粉、中温豆粉对发酵水平影响较为显著,鱼蛋白胨影响较小,所以选取葡萄糖、中温豆粉、淀粉进行响应面优化试验。
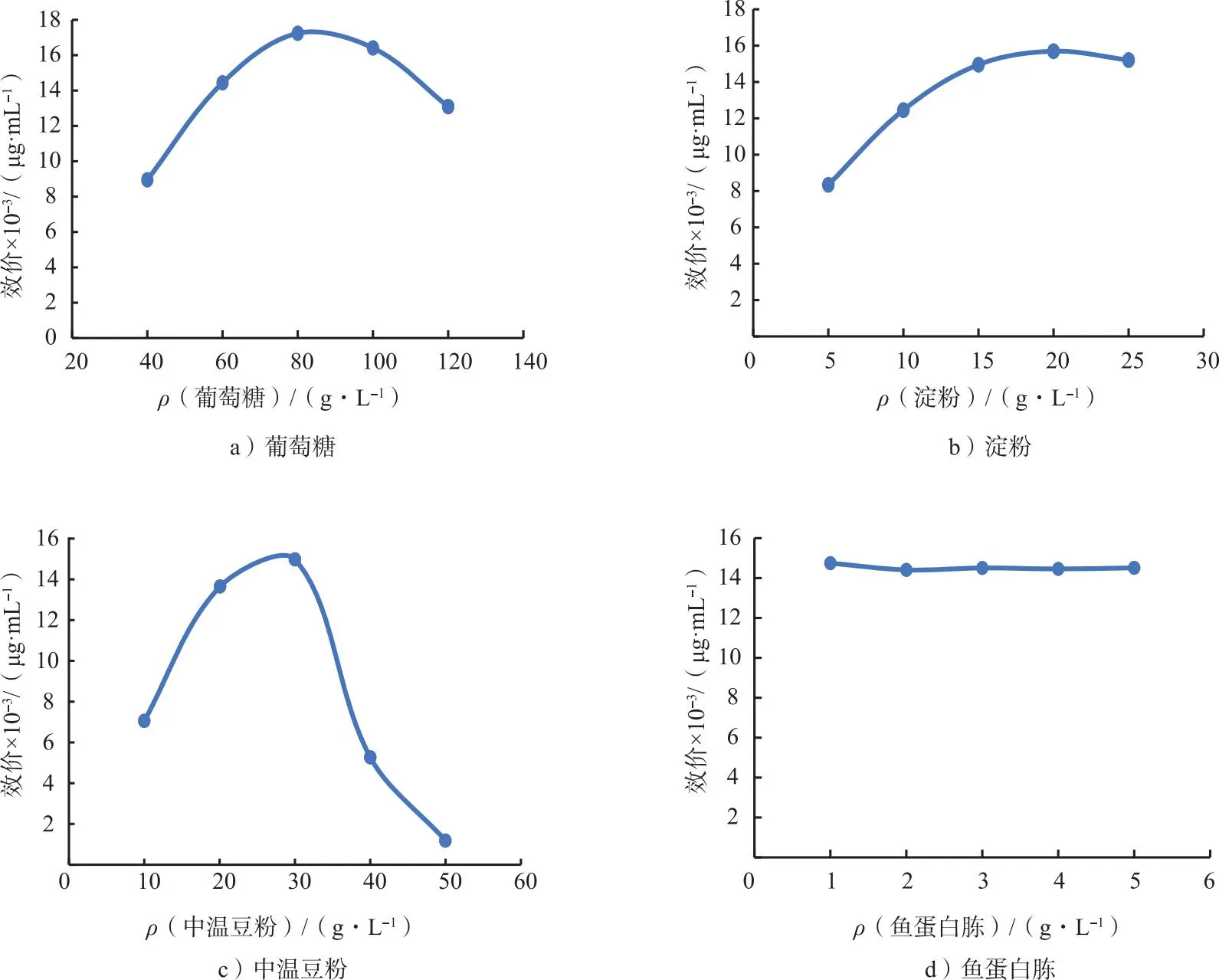
图1 碳源和氮源浓度对发酵水平的影响Fig.1 Effect of carbon and nitrogen sources concentration on fermentation level
2.6 响应面优化试验
对葡萄糖、中温豆粉、淀粉进行响应面优化试验,按照软件Design-Expert 12中的BBD生成的试验设计表进行试验,试验结果见表10。
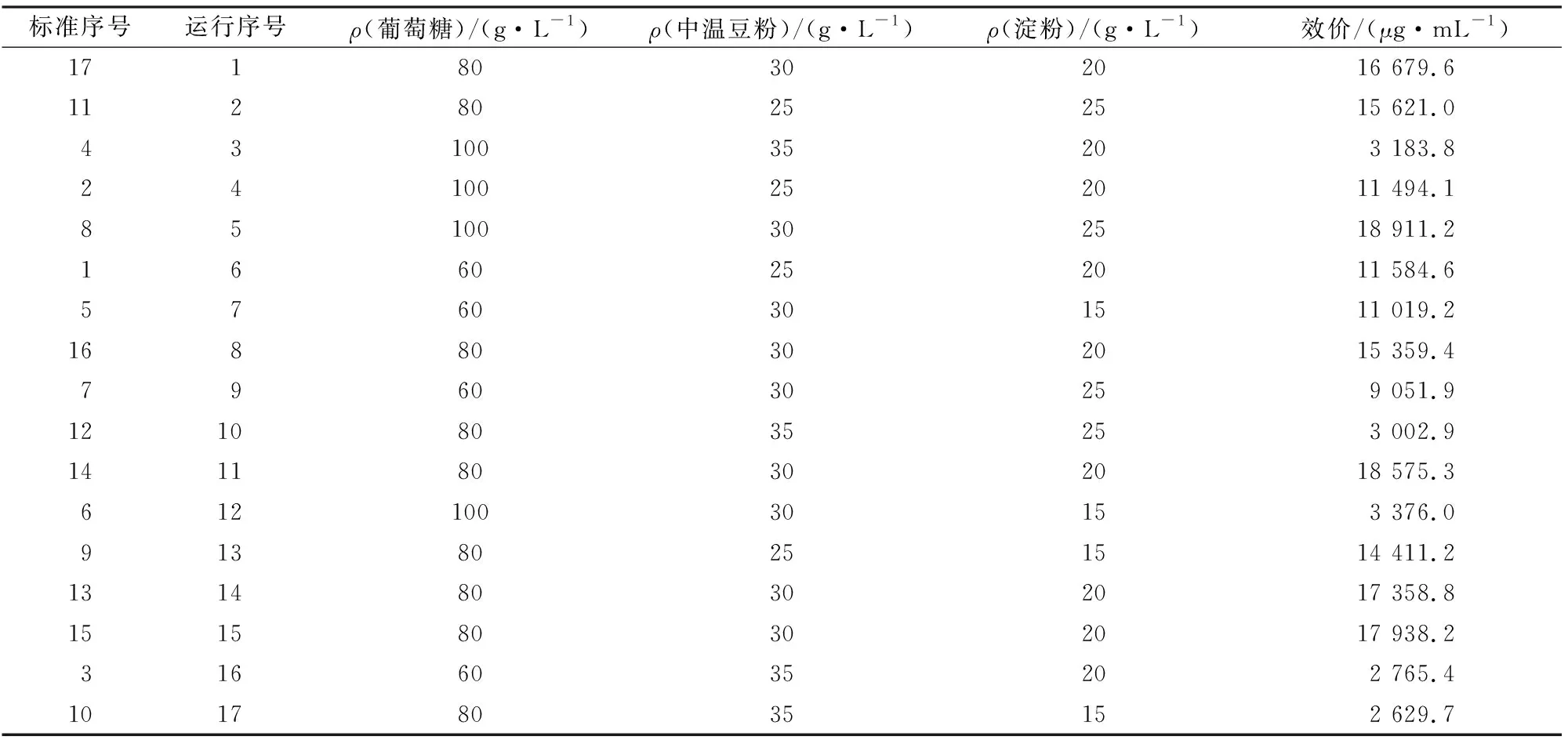
表10 BBD试验设计及结果
经Design-Expert 12软件拟合,各因素对两性霉素B产量的编码值回归方程如下:
效价=-206 734+752.99A+12 945.75B+1 075.99C+1.27AB+43.76AC-8.37BC-10.31A2-231.97B2-98.67C2。其中:A为葡萄糖;B为中温豆粉;C为淀粉。回归方程校正系数R2为0.949 5,说明方程的拟合度良好,可有效预测两性霉素B产量的最优组合。方差分析结果见表11,残差正态分布如图2所示。
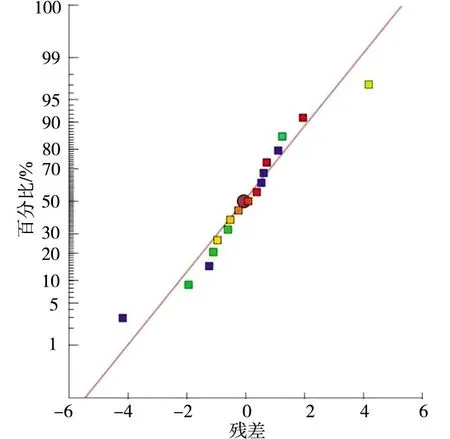
图2 残差正态分布图Fig.2 Normal distribution of residuals
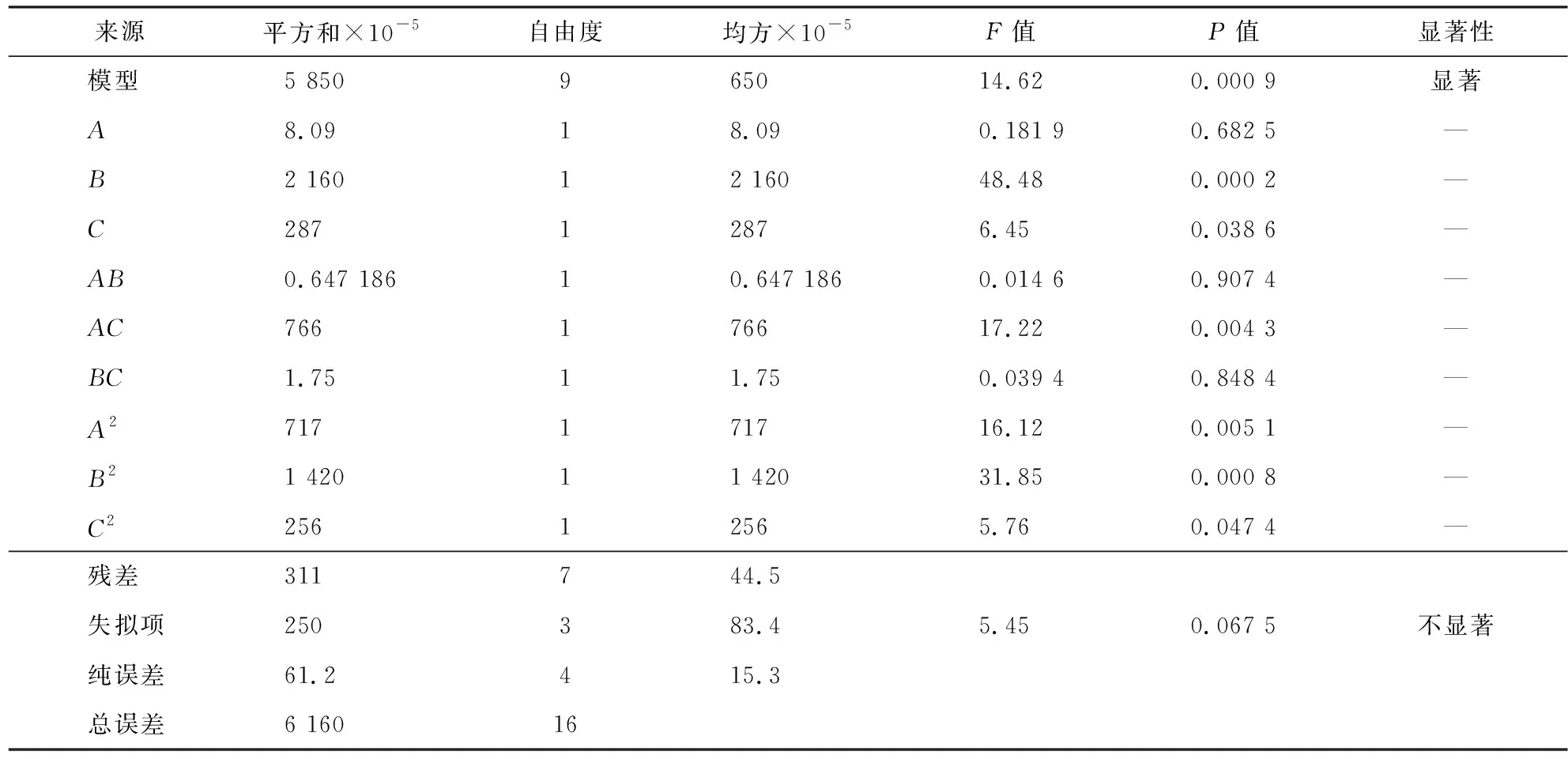
表11 BBD方差分析结果
由表11和图2可知,模型显著(p<0.05),失拟项不显著(p=0.067 5>0.05),残差正态分布明显趋近于直线,说明该模型选择合适。将葡萄糖、中温豆粉和淀粉两两组合,绘制与效价的3D响应面和等高线,如图3所示。
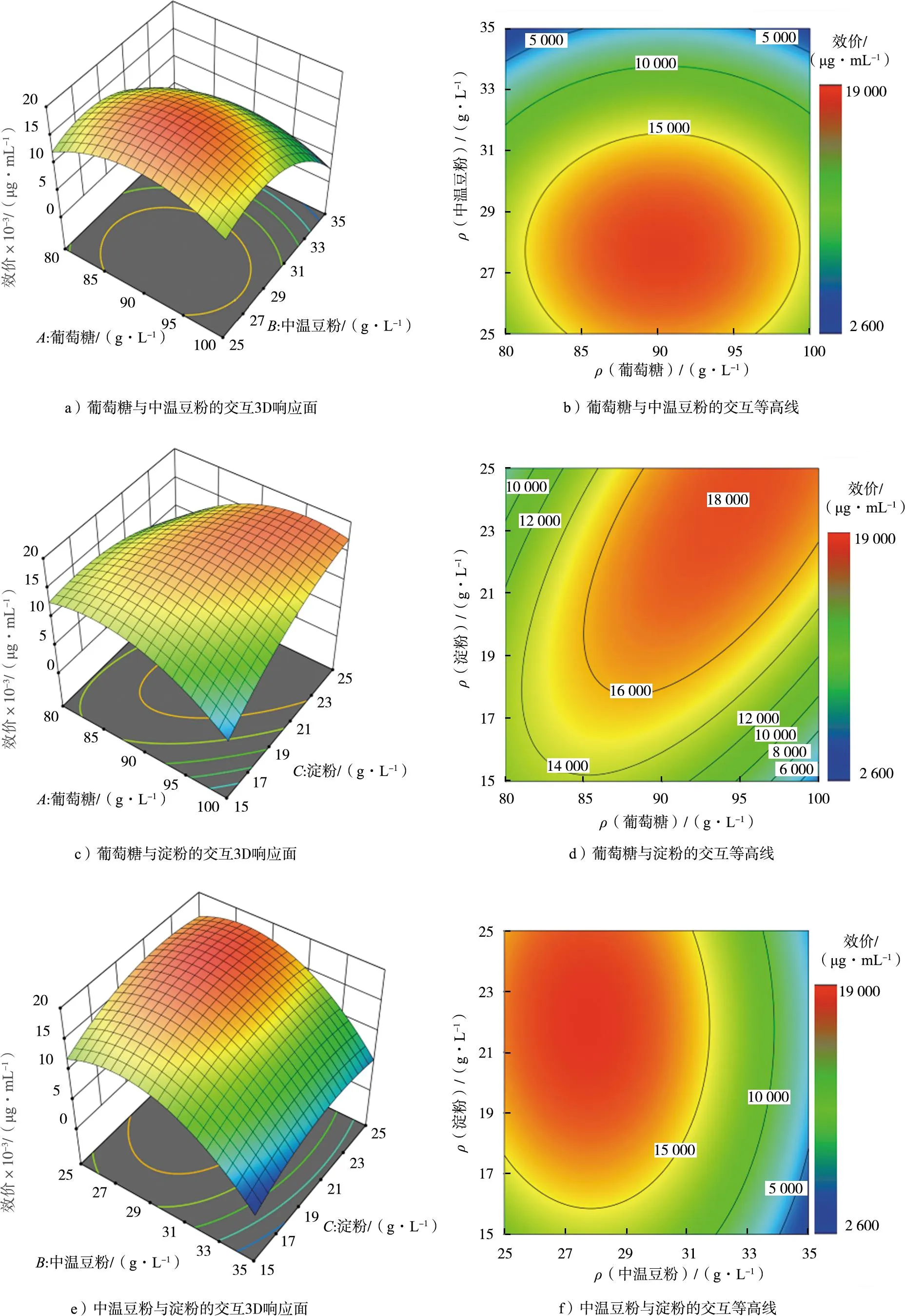
图3 3个主要因素交互影响两性霉素B产量的响应面优化结果Fig.3 Response surface optimization result of pairwise interaction of the three main factor on amphotericin B yield
根据软件预测优化结果:葡萄糖为94.6 g/L,中温豆粉为27.7 g/L,淀粉为24.1 g/L,最优解的效价预测值为19 213.3 μg/mL。
2.7 发酵优化配方验证
用筛选得到稳定高产菌株20-2-15进行1 L摇瓶发酵配方验证,结果见表12。由表可见,高产菌株20-2-15采用发酵新配方后效价比原配方提高了32.6%。

表12 高产菌株20-2-15摇瓶验证结果
采用优化后配方进行3批50 L发酵罐验证,结果见表13。由表可见,50 L罐发酵平均效价达到20 856 μg/mL,比原配方提高29.4%。
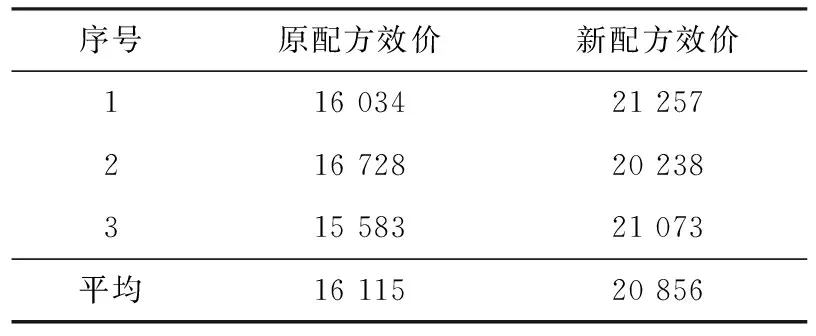
表13 高产菌株20-2-15 50 L发酵罐验证结果
3 结 语
本研究通过菌种选育获得了稳定遗传的高产菌株,可用于两性霉素B工业化发酵生产,采用配方优化可进一步提高发酵水平,降低生产成本。
1)建立了UV-ARTP复合诱变策略,以结节链霉菌A318-10为出发菌株,采用紫外诱变和ARTP诱变2种方式进行评估,选取UV处理60 s后再经ARTP照射35 s,获得的菌株经两性霉素B自身抗性筛选,最终获得一株高产菌株20-2-15,发酵单位较出发菌株提高37.5%。该菌株经斜面传代稳定性研究,连续传代4次,发酵效价波动水平不超过10%,说明复合诱变策略对结节链霉菌的选育可行有效。
2)采用响应面试验设计对发酵配方中的主要碳源和氮源进行优化,获得了适合高产菌株的发酵培养基配方,50 L发酵罐发酵水平最高可达到21 257 μg/mL,应用于工业化发酵生产后可降低生产成本。
工业发酵生产两性霉素B的过程中会产生副产物两性霉素A。本研究采用的紫外诱变和ARTP诱变都具有操作简单、突变率高且突变稳定性好的特点,但两者都是在不明晰微生物遗传背景的条件下进行。后期可考察不同的诱变处理方式对两性霉素A组分的影响,开发出新型诱变策略选育菌株,在提高两性霉素B发酵水平的同时降低副产物两性霉素A的含量,降低生产成本。
优化后的发酵培养基配方适合简单的分批发酵,后续可开发分批补料控制工艺,提高底物的利用率,使物质代谢最大程度地向有利于产物合成的代谢途径进行,提高两性霉素B的产量。在此基础上通过代谢组学筛选关键前体物质,以关键代谢物为物质代谢流的控制节点,促进两性霉素 B 的生物合成,同时能够有效控制副产物两性霉素A的增长,降低生产成本。
