经鼻高流量湿化氧疗对慢性阻塞性肺疾病合并呼吸衰竭患者血气参数、心功能及炎症状态的影响
2024-01-02李银娇黎小华
李银娇,黎小华,李 维
(肇庆市高要区人民医院呼吸内科,广东 肇庆 526040)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以呼吸困难、咳嗽、咳痰为主要表现的异质性疾病。当COPD合并呼吸衰竭时,可伴有缺氧和二氧化碳潴留,患者可能会出现低氧血症和高碳酸血症等,严重威胁患者生命[1]。鼻导管吸氧能在一定程度上改善患者氧合功能,但吸入氧浓度不恒定,受患者呼吸的影响大,用于重症患者的效果欠佳,且容易导致二氧化碳潴留[2]。近年来,经鼻高流量湿化氧疗(HFNC)作为一种新的无创呼吸支持技术,多应用于未达气管插管、机械通气标准的成人患者及婴幼儿患者,并取得良好治疗效果[3]。报道显示,HFNC治疗COPD的效果优于传统氧疗方案,且可以降低患者气管插管的风险[4]。但HFNC用于COPD合并呼吸衰竭患者的报道较少,应用价值有待更多的临床研究证实。基于此,本研究比较HFNC和鼻导管吸氧应用于COPD合并呼吸衰竭患者的效果,并分析不同氧疗方法对患者血气指标、心功能及炎症因子水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月至2022年12月肇庆市高要区人民医院收治的60例COPD合并呼吸衰竭患者的临床资料,根据氧疗方式不同分为观察组(30例,行HFNC)和对照组(30例,行鼻导管吸氧氧疗)。观察组患者中男性26例,女性4例;年龄50~80岁,平均年龄(64.24±3.28)岁;COPD病程4~15年,平均COPD病程(8.86±1.42)年。对照组患者中男性25例,女性5例;年龄50~80岁,平均年龄(65.92±3.92)岁;COPD病程4~14年,平均COPD病程(8.27±1.28)年。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经肇庆市高要区人民医院医学伦理委员会批准。纳入标准:①符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》[5]中COPD的诊断标准和《严重急性低氧性呼吸衰竭急诊治疗专家共识》[6]中呼吸衰竭的诊断标准;②年龄50~80岁。排除标准:①合并恶性肿瘤者;②合并严重咯血、纵隔气胸者;③合并肝、肾等多脏器功能衰竭者。
1.2 治疗方法 两组患者均接受常规治疗,包括抗感染、化痰、平喘、纠正酸碱失衡、维持水和电解质平衡及营养支持等。对照组患者行鼻导管吸氧,2~3 L/min。观察组患者行HFNC。采用高流量无创呼吸湿化治疗仪(湖南明康中锦医疗科技股份有限公司,湘械注准20172080225,型号:OH-70C),初始参数设定为:氧浓度29%~50%,温度34~37 ℃,流量35~55 L/min。氧浓度及流量根据患者血气水平调整,动脉血氧分压(PaO2)>60.00 mmHg(1 mmHg=0.133 kPa)者,可暂停氧疗;50.25 mmHg<PaO2≤60.00 mmHg者,设定参数:氧流量35~45 L/min,氧浓度29%~35%;39.75 mmHg<PaO2≤50.25 mmHg者,设定参数:氧流量45~50 L/min,氧浓度35%~40%;PaO2≤39.75 mmHg者,设定参数:氧流量50~55 L/min,氧浓度40%~50%。两组患者均治疗1周。
1.3 观察指标 ①比较两组患者血气指标。分别在治疗前后采集患者桡动脉血1 mL,采用血气、电解质和生化分析系统(罗氏诊断公司,国械注进20172227195,型号:cobas b 221<6>system)检测PaO2、动脉血二氧化碳分压(PaCO2)及血氧饱和度(SaO2)。②比较两组患者炎症因子水平。于治疗前后采集患者清晨空腹肘静脉3 mL,采用离心机(安徽中科中佳科学仪器有限公司,型号:HC-1010)以2 500 r/min 进行离心15 min(离心半径为8.5 cm),采用全自动化学发光免疫分析仪(重庆科斯迈生物科技有限公司,渝械注准20192220077,型号:SMART 500S)测定白细胞介素-6(IL-6)、白细胞介素-8(IL-8);采用全自动生化分析仪[贝克曼库尔特商贸(中国)有限公司,国食药监械(进)字2011第2403311号,型号:AU5811)测定C反应蛋白(CRP)。③比较两组患者心肌损伤标记物水平。取血清方式同②,采用全自动荧光免疫分析仪(南京岚煜生物科技有限公司,苏械注准20202221107,型号:LS-3000)测定氨基末端脑钠肽前体(NT-proBNP),采用全自动生化分析仪测定胱抑素C(CysC)水平。④比较两组患者临床症状积分。对患者气短、水肿、紫绀及胸闷症状按严重程度进行赋分:无(0分)、轻度(1分)、中度(2分)、重度(3分)。分数越高表示患者临床症状越严重[6]。⑤比较两组患者肺功能指标。分别在治疗前后采用肺功能仪[德国耶格,国食药监械(进)字2012第2214578号,型号:MasterScope]测定用力肺活量(FVC)、第1秒用力呼气容积(FEV1),并计算FEV1/FVC。
1.4 统计学分析 采用SPSS 20.0统计学软件对数据进行处理。计量资料以()表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血气指标比较 两组患者治疗前的血气指标比较,差异无统计学意义(P>0.05);治疗后,两组患者PaO2和SaO2水平高于治疗前,PaCO2水平低于治疗前,且观察组PaO2和SaO2水平高于对照组,PaCO2水平低于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者血气指标比较()

表1 两组患者血气指标比较()
注:与同组治疗前比较,*P<0.05。PaO2:动脉血氧分压;PaCO2:动脉血二氧化碳分压;SaO2:血氧饱和度。1 mmHg=0.133 kPa。
组别例数PaO2(mmHg)PaCO2(mmHg)SaO2(%)治疗前治疗后治疗前治疗后治疗前治疗后观察组3056.40±4.3576.47±4.39*62.59±3.2748.49±4.36*78.58±5.2494.65±4.24*对照组3056.47±3.2372.59±4.01*62.39±3.6455.11±3.26*78.96±5.7492.12±3.49*t值0.0713.5740.2246.6600.2682.523 P值>0.05<0.05>0.05<0.05>0.05<0.05
2.2 两组患者炎症因子水平比较 两组患者治疗前的炎症因子水平比较,差异无统计学意义(P>0.05);治疗后,两组患者IL-6、IL-8及CRP水平低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者炎症因子水平比较()
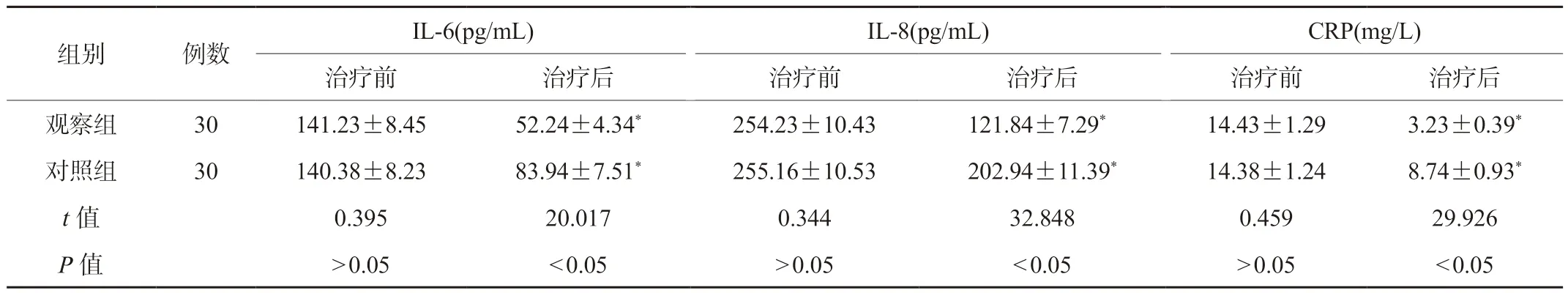
表2 两组患者炎症因子水平比较()
注:与同组治疗前比较,*P<0.05。IL-6:白细胞介素-6;IL-8:白细胞介素-8;CRP:C反应蛋白。
组别例数IL-6(pg/mL)IL-8(pg/mL)CRP(mg/L)治疗前治疗后治疗前治疗后治疗前治疗后观察组30141.23±8.4552.24±4.34*254.23±10.43121.84±7.29*14.43±1.293.23±0.39*对照组30140.38±8.2383.94±7.51*255.16±10.53202.94±11.39*14.38±1.248.74±0.93*t值0.39520.0170.34432.8480.45929.926 P值>0.05<0.05>0.05<0.05>0.05<0.05
2.3 两组患者心肌损伤标记物水平比较 两组患者治疗前的心肌损伤标记物水平比较,差异无统计学意义(P>0.05);治疗后,两组患者血清NT-proBNP和CysC水平低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者心肌损伤标记物水平比较()
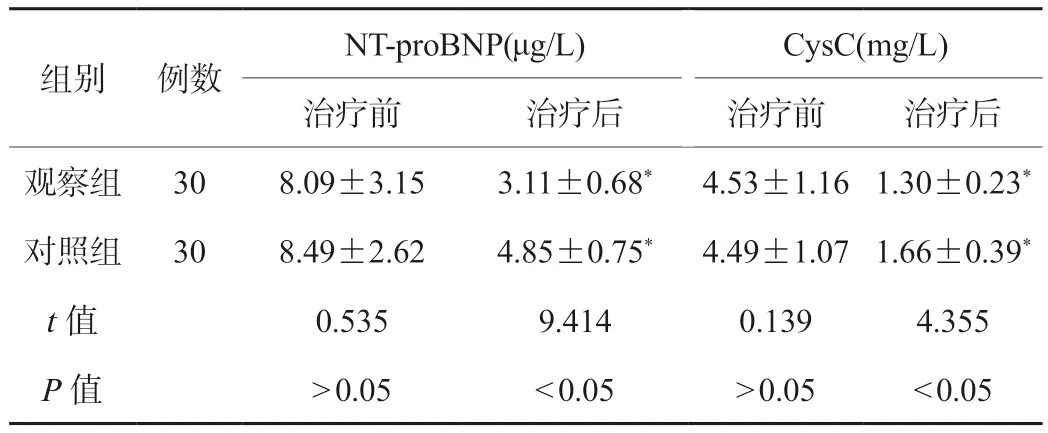
表3 两组患者心肌损伤标记物水平比较()
注:与同组治疗前比较,*P<0.05。NT-proBNP:氨基末端脑钠肽前体;CysC:胱抑素C。
NT-proBNP(μg/L)CysC(mg/L)治疗前治疗后治疗前治疗后观察组308.09±3.153.11±0.68*4.53±1.161.30±0.23*对照组308.49±2.624.85±0.75*4.49±1.071.66±0.39*t值0.5359.4140.1394.355 P值>0.05<0.05>0.05<0.05组别例数
2.4 两组患者临床症状积分比较 两组患者治疗前的临床症状积分比较,差异无统计学意义(P>0.05);治疗后,两组患者临床症状积分低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者临床症状积分比较(分,)

表4 两组患者临床症状积分比较(分,)
注:与同组治疗前比较,*P<0.05。
组别例数气短水肿紫绀胸闷治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组302.23±0.560.43±0.10*2.12±0.570.38±0.10*2.18±0.430.29±0.05*2.14±0.610.30±0.03*对照组302.10±0.630.83±0.29*2.04±0.530.76±0.18*2.24±0.540.54±0.13*2.05±0.530.46±0.10*t值0.8457.1420.56310.1080.4769.8310.6108.394 P值>0.05<0.05>0.05<0.05>0.05<0.05>0.05<0.05
2.5 两组患者肺功能指标比较 两组患者治疗前的肺功能情况比较,差异无统计学意义(P>0.05);治疗后,两组患者FVC、FEV1及FEV1/FVC高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患者肺功能指标比较()
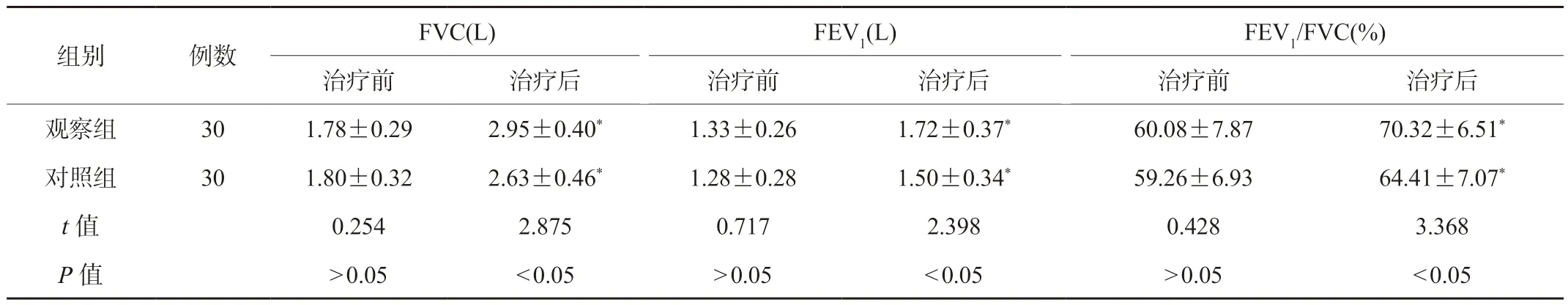
表5 两组患者肺功能指标比较()
注:与同组治疗前比较,*P<0.05。FVC:用力肺活量;FEV1:第1秒用力呼气容积。
组别例数FVC(L)FEV1(L)FEV1/FVC(%)治疗前治疗后治疗前治疗后治疗前治疗后观察组301.78±0.292.95±0.40*1.33±0.261.72±0.37*60.08±7.8770.32±6.51*对照组301.80±0.322.63±0.46*1.28±0.281.50±0.34*59.26±6.9364.41±7.07*t值0.2542.8750.7172.3980.4283.368 P值>0.05<0.05>0.05<0.05>0.05<0.05
3 讨论
COPD是一种以持续性、进行性气流受限为特征的肺部疾病,在患者病情急性加重时容易出现各种并发症,如呼吸衰竭,尤以Ⅱ型呼吸衰竭多发,可危及患者生命。持续低流量鼻导管吸氧无法达到高流量、高浓度氧气供给的效果,难以在最短的时间内全面纠正COPD患者合并呼吸衰竭患者机体的缺氧状况[7]。HFNC可给予患者相对恒定的吸氧浓度,产生一定水平的呼气末正压,冲刷上呼吸道生理死腔,从而维持黏液纤毛功能,改善患者的通气和部分换气功能。
本研究结果显示,治疗后,两组患者PaO2和SaO2水平高于治疗前,PaCO2水平低于治疗前,且观察组PaO2和SaO2水平高于对照组,PaCO2水平低于对照组,分析原因,HFNC可有效改善COPD合并呼吸衰竭患者氧合功能,促进CO2排出,进而改善PaO2和SaO2水平。本研究结果显示,治疗后,两组患者IL-6、IL-8及CRP水平低于治疗前,且观察组低于对照组。分析原因,HFNC可利用高流量氧疗促进气体交换,减少呼吸做功,减轻对膈肌的损伤,降低IL-6、IL-8及CRP水平,进而减轻炎性反应。张鑫等[8]也认为HFNC有利于减轻患者全身炎症状态,改善整体病情,支持本研究结果。本研究结果显示,治疗后,两组患者血清NT-proBNP和CysC水平低于治疗前,且观察组低于对照组,分析原因,HFNC可为机体提供稳定的高浓度氧流量,改善机体氧合状态,降低心肌耗氧量,提高心肌收缩力,减轻心肌损伤,改善心功能,进而纠正血清NT-proBNP和CysC水平。NT-proBNP是在心肌细胞受损后分泌的脑利钠肽前体裂解产物,能反映心室功能,评估预后,且NT-proBNP稳定性好,不受生理节律影响。另外,CysC是一种非糖基化蛋白质,与COPD患者的肺功能呈显著负相关性,其水平异常升高将显著增加发生心力衰竭的风险[9]。COPD合并呼吸衰竭患者病情严重,常存在CO2潴留、气流受限加重及肺循环血管收缩等问题。另外,患者右心负荷进一步加重,使心功能持续恶化[10]。本研究结果也说明HFNC能调节患者NT-proBNP和CysC水平,这对于改善患者心功能,促进病情恢复具有重意义。还有研究显示,HFNC应用于COPD合并心力衰竭的治疗中取得显著的效果,可改善患者心肺功能,缓解患者临床症状[11],与本研究结论一致。本研究结果显示,治疗后,两组患者临床症状积分低于治疗前,且观察组低于对照组,分析原因,HFNC可将高浓度、高流量湿化氧气输送至肺部,缓解缺氧状态,进而减轻气短、胸闷、紫绀、水肿等呼吸衰竭症状。本研究结果显示,治疗后,两组患者FVC、FEV1及FEV1/FVC高于治疗前,且观察组高于对照组,分析原因,HFNC可为患者提供恒定高流量氧疗,进而改善通气和换气功能,这对于缓解病情,改善患者生活质量具有重要意义。
综上所述,HFNC治疗COPD合并呼吸衰竭效果显著,可有效改善患者血气水平、心肺功能指标,减轻炎症反应及缓解临床症状,值得临床应用。
