重组人干扰素α-1b治疗小儿轮状病毒感染性肠炎的效果及对患儿肠功能的保护分析
2024-01-02潘祥龙崔文权卜晓敏
潘祥龙,崔文权,卜晓敏
(仪征市人民医院儿科,江苏 仪征 211400)
小儿轮状病毒性肠炎是由于感染轮状病毒所引起的一种消化道急性传染病。患儿主要以发热、呕吐以及腹泻为主要症状,同时患儿还会存在脱水、电解质紊乱等并发症,严重时患儿还会出现重症胃肠炎[1-2]。小儿轮状病毒性肠炎的主要发病年龄在6个月~2岁[3-4]。临床上在治疗小儿轮状病毒性肠炎时主要是以维持水电解质平衡及机体酸碱平衡为主,但效果一般。患儿持续性高热及呕吐和腹泻会导致多器官功能出现障碍[5-6]。重组人干扰素α-1b具有调节免疫功能和抗病毒等功效,近年来,重组人干扰素α-1b在小儿呼吸道合胞病毒肺炎、带状疱疹等病毒感染性疾病的治疗中具有良好效果[7]。基于此,本研究对64例小儿轮状病毒感染性肠炎患儿应用重组人干扰素α-1b,探究其对轮状病毒的具体效果以及对患儿肠功能的保护作用,现将资料整理如下。
1 资料与方法
1.1 一般资料 选取仪征市人民医院在2020年1月至2022年12月收治的小儿轮状病毒感染性肠炎患儿64例,利用随机数字表法进行分组,将上述患儿分成两组,一组为对照组,有患儿32例,另一组为试验组,同样为32例。对照组男18例,女14例;年龄6个月~6岁,平均年龄(3.49±2.18)岁;病程4~20 h,平均病程(12.69±2.58) h。试验组男17例,女15例;年龄7个月~6岁,平均年龄(3.53±2.15)岁;病程5~22 h,平均病程(12.53±2.63) h。两组患儿一般资料比较,差异无统计学意义(P>0.05),具有可比性。此研究经仪征市人民医院医学伦理委员会批准。患儿家属对研究内容知情并签署知情同意书。
纳入标准:①入组患儿均为轮状病毒感染性肠炎确诊患儿;②临床症状相同,符合《诸福棠实用儿科学》(第8版)[8]诊断标准;③均存在发热、呕吐和腹泻症状;④意识状态良好。排除标准:①先天性器官功能不全患儿;②胃肠存在畸形患儿;③患有免疫缺陷性疾病患儿;④严重营养不良患儿;⑤对研究药物有过敏反应患儿;⑥因误食等其他原因导致的急性腹泻患儿。
1.2 治疗方法 对照组患儿采用常规治疗方式,主要包括口服补液盐或静脉补液,来维持机体酸碱平衡和水、电解质平衡,同时月龄较小患儿应以无乳糖饮食为主,年龄较大患儿应减少食用刺激性食物。指导患儿服用蒙脱石散治疗。蒙脱石散[思密达,博福-益普生(天津)制药有限公司,国药准字H20000690,规格:3 g/袋,10袋/盒]用法用量:使用50 mL温水冲泡,摇匀后服用。12个月以下患儿:1袋/d,分3次服用;1~2岁患儿:1~2袋/d,分3次服用;2岁以上患儿:2~3袋/d,分3次服用。连续治疗3 d。
在对照组患儿治疗基础上,试验组患儿联合重组人干扰素α-1b进行治疗。注射用重组人干扰素α-1b[赛若金,深圳科兴药业有限公司,国药准字S10960059,规格:30 μg/支]。用法用量:肌内注射。6~12个月之间患儿:1次/d,0.6 μg/次;12个月以上患儿:1次/d,10 μg/次。连续治疗3 d。
1.3 观察指标 ①对比两组患儿治疗结果。患儿治疗后临床症状全部消失表示显效;临床症状有所缓解表示有效;病情在治疗后无任何好转则表示无效。总有效率=(显效例数+有效例数)/总例数×100%。②对比两组患儿包括发热、呕吐、腹泻在内的各项临床症状消失用时。③对比两组患儿免疫功能指标。抽取患儿治疗前和治疗后5 mL的静脉血进行检测,离心速度为3 500 r/min,离心时间为10 min,利用酶联免疫吸附法(ELISA)对患儿免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)水平进行检测。④对比两组患儿治疗前后肠黏膜损伤指标。将患儿静脉血5 mL经3 500 r/min、10 min离心处理后,选择上清液,通过鲎试剂偶氮显色基质法对患儿内毒素(ET)水平进行检测;利用ELISA对患儿晚期糖基化终末产物(AGEs)水平进行检测;利用分光光度法对患儿二胺氧化酶(DAO)水平进行检测。
1.4 统计学分析 试验所得的数据通过SPSS 22.0统计学软件进行分析和计算。计数资料以[例(%)]表示,行χ2检验,等级资料以秩和检验;计量资料均呈正态分布,以()表示,行t检验。当P<0.05时,表示数据差异有统计学意义。
2 结果
2.1 两组患儿治疗结果比较 试验组患儿经联合治疗后,治疗结果为96.88%,较对照组的71.88%更高,差异有统计学意义(P<0.05),见表1。
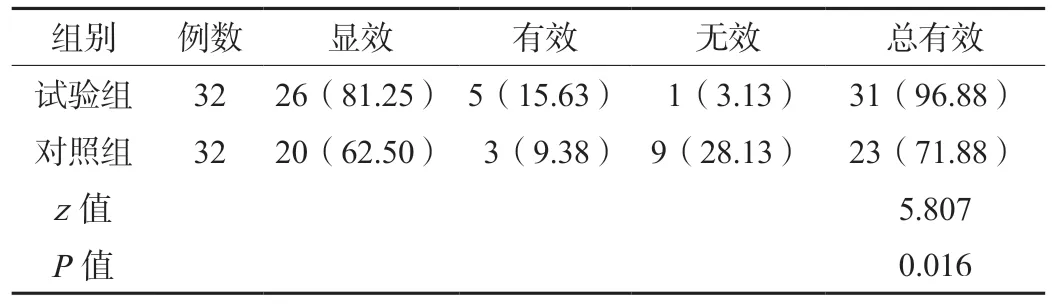
表1 两组患儿治疗有效率比较[例(%)]
2.2 两组患儿症状消失用时比较 对照组患儿发热症状、呕吐症状、腹泻症状消失时间均较试验组患儿用时更长,差异具有统计意义(P<0.05),见表2。
表2 两组患儿症状消失时间比较(d,)

表2 两组患儿症状消失时间比较(d,)
组别例数发热呕吐腹泻试验组322.78±1.314.39±1.365.26±1.25对照组324.14±1.055.32±1.186.34±1.85 t值4.5822.9222.736 P值<0.0010.0050.008
2.3 两组患儿免疫功能指标比较 治疗前,两组患儿IgA、IgG、IgM与对照组患儿上述指标水平比较,差异较小(P>0.05);治疗后,两组患儿上述各项免疫功能指标明显高于治疗前,且试验组更高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患儿免疫功能指标比较(g/L,)

表3 两组患儿免疫功能指标比较(g/L,)
注:与治疗前比较,*P<0.05。IgA:免疫球蛋白A;IgG:免疫球蛋白G;IgM:免疫球蛋白M。
组别例数IgAIgGIgM治疗前治疗后治疗前治疗后治疗前治疗后试验组323.73±1.344.84±1.05*10.10±1.5618.89±3.22*1.09±0.241.21±0.08*对照组323.70±1.324.01±1.12*10.06±1.5314.29±2.95*1.11±0.221.14±0.08*t值0.0903.0580.1045.9590.3483.500 P值0.9280.0030.918<0.0010.729<0.001
2.4 两组患儿肠黏膜损伤指标比较 治疗前,两组患儿ET、AGEs、DAO水平比较,差异无统计学意义(P>0.05);治疗后,两组患儿以上各项肠黏膜损伤指标明显低于治疗前,且试验组更低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患儿肠黏膜损伤指标比较()

表4 两组患儿肠黏膜损伤指标比较()
注:与治疗前比较,*P<0.05。ET:内毒素;AGEs:血清晚期糖基化终末产物;DAO:二胺氧化酶。
ET(EU/mL)AGEs(ng/L)DAO(U/L)治疗前治疗后治疗前治疗后治疗前治疗后试验组321.98±0.570.32±0.13*437.22±44.52165.42±17.14*3.22±0.500.57±0.12*对照组321.96±0.590.79±0.26*435.91±45.22245.52±30.76*3.24±0.481.56±0.25*t值0.1389.1460.11712.8680.16320.195 P值0.891<0.0010.907<0.0010.871<0.001组别例数
3 讨论
轮状病毒是导致轮状病毒性肠炎的主要病原体,轮状病毒主要感染人群为6个月~2岁幼儿,轮状病毒主要传播途径为粪口传播,也可通过呼吸道进行传播。患儿发热症状可持续3 d左右,呕吐症状持续4 d左右,腹泻症状持续5 d左右。长期的呕吐和腹泻以及高热会导致患儿出现脱水以及惊厥等严重并发症的发生,威胁患儿生命[9-10]。
临床上在治疗轮状病毒时,暂无特效药物。作为自限性疾病,治疗轮状病毒性肠炎主要以预防和纠正患儿脱水情况,并保护患儿肠黏膜为主,但临床效果欠佳[11-12]。重组人干扰素α-1b作为一种可调节人体免疫系统的药物,具有广谱的抗病毒功能和抗肿瘤功能和免疫调节功能[10],但在轮状病毒性肠炎中报道较少。在本研究中,试验组患儿在常规治疗基础之上联合重组人干扰素α-1b治疗后,临床效果与采取常规治疗的对照组之间差异有统计学意义。同时,试验组患儿临床症状持续时间更短,患儿恢复更快,患儿免疫球蛋白因子水平也均较对照组患儿更高。主要原因在于,作为一种通过DNA重组技术而产生的α-1b型基因干扰素,重组人干扰素 α-1b 可以结合患儿体内敏感细胞表面的干扰素受体,形成抗病毒蛋白,从而使病毒最终能够得到降解,将巨噬细胞的能力进行增强,提高自然杀伤细胞对病毒的吞噬及杀伤力,并使免疫球蛋白的合成得到较好的调节[13-14]。除此之外,试验组患儿肠黏膜受损指标在治疗后明显低于对照组患儿。原因在于肠黏膜受损指标AGEs 参与了肠黏膜损伤的全过程,可导致一系列炎症反应的出现,诱发细胞损伤及血管内皮细胞损伤,而肠功能受损指标中的ET和DAO通常在肠黏膜上皮细胞受损时被释放,并升高患儿血液中 的ET 和 DAO 水平。在使用重组人干扰素α-1b 后,可以使蛋白激酶得到激活,并使病毒得到复制,对于肠黏 膜修复以及纠正肠黏膜屏障功能有重要意义[15]。
综上所述,在对轮状病毒感染性肠炎患儿进行治疗时,为降低病毒性感染对肠黏膜的损伤,可将重组人干扰素α-1b应用于其中,对促进病情转归有显著作用,治疗手段值得应用。
