全身骨显像联合单光子发射计算机断层扫描/计算机断层扫描融合显像诊断乳腺癌骨转移的临床应用价值分析
2024-01-02陈丽媚
陈丽媚
(贵港市人民医院核医学科,广西 贵港 537100)
骨作为乳腺癌常见的远处转移部位,主要通过血运转移,乳腺癌骨转移一般为多发病灶,大多表现为局部压痛,夜间痛最为显著,可出现病理性骨折、脊髓压迫、椎体压缩及高钙血症等并发症,严重影响患者生活质量[1]。研究表明,全身骨显像被临床广泛用于恶性肿瘤患者骨转移的初筛诊断检查中,但对于早期不典型形态的病灶及单发放射性浓聚病灶的检出率较低[2]。而单光子发射计算机断层扫描(SPECT)/计算机断层扫描(CT)融合显像可获得患者病灶部位SPECT、CT信息,能有效提高诊断准确率[3]。本研究探讨全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移的临床价值,为临床诊断提供参考,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2019年1月至2021年1月贵港市人民医院收治的204例乳腺癌患者的临床资料。患者年龄40~60岁,平均年龄(50.12±4.28)岁;体质量48~55 kg,平均体质量(51.52±2.15)kg。本研究经贵港市人民医院医学伦理委员会批准。纳入标准:①符合乳腺癌的诊断标准[4],且均经病理检查确诊;②年龄>18岁;③全身骨显像有异常浓聚灶,且浓聚部位行SPECT/CT融合显像检查;④骨转移最终经病理或影像、临床随访半年以上证实;⑤临床资料完整。排除标准:①未明确诊断者;②合并其他恶性肿瘤者;③病灶未行局部SPECT/CT融合检查者;④病历资料不完整者;⑤合并心脏、肝脏等重要脏器功能严重不全者。
1.2 检查方法 全身骨显像检查前嘱患者饮水1 L,并于检查前2.5~3.5 h排空膀胱,去除金属物品。首先,给予患者肘静脉注射555~740 BMq99mTc-MDP(无锡市江原实业技贸有限公司江原制药厂,国药准字H10973005,规格:每瓶内含亚甲基二膦酸5 mg与氯化亚锡0.5 mg),等待2.5~3.5 h后对乳腺癌患者实施全身骨显像检查。患者取仰卧位。采用SPECT/CT(西门子,型号:Symbia T16)以低能高分辨率准直器,按照程序采用双探头对其进行全身骨前、后位图像采集,参数设置如下:能峰:140 keV,窗口:20%,矩阵:256 mm×1 024 mm,放大倍数:1.00,扫描长度:200 cm,扫描速度:16~20 cm/min。SPECT/CT检查时将全身骨显像检查结果显示的病灶部位设为中心,采集SPECT与CT图像。SPECT图像采集时采用双探头平行采集,探头旋转180°,20 s/帧,采集30帧,矩阵:128 mm×128 mm。CT图像采集,电压:120 keV,电流:160 mAs,层厚:3.0 mm,视野:500 mm,层间距:2.5 mm,扫描速度:0.6 s/圈。图像分析由两名影像学专业医师采用双盲法阅片,并分析全身骨显像、SPECT/CT图像,根据诊断标准评判病灶是否出现转移。全身骨显像诊断乳腺癌骨转移的诊断标准[5]:多处散在多发异常放射性浓聚区,不对称,骨转移症状明显,且排除外伤、手术及其他骨骼病变等影响因素后,诊断为骨转移,单发或可疑病灶需要结合病史、临床症状等。SPECT/CT融合显像诊断乳腺癌骨转移的标准[5]:排除手术、非病理性骨折后等因素,在骨中仍存在异常放射性分布。同时CT显示骨质破坏(包括溶骨型、成骨型、混合型骨质破坏)。对所有患者行半年的随访,了解其病史、影像学及组织病理学检查结果。①骨转移:3~6个月后再实施SPECT/CT融合显像检查,发现初次确诊骨转移处病灶增加,形态变大。SPECT/CT显像检查1个月内,对患者病灶进行MRI检查,结果显示其3D T1加权成像(T1WI)、3D T2加权成像(T2WI)、脂肪抑制(STIR)像呈低、高信号。②无骨转移:MRI检查显示病灶异常放射性区域无明显变化及疼痛,CT未见明显骨质破坏。最终确诊骨转移的结果为:病理确诊;其他影像如CT、MR等均支持骨转移;随访半年以上病灶有进展。
1.3 观察指标 ①分析最终明确诊断乳腺癌骨转移情况。②分析全身骨显像诊断乳腺癌骨转移情况。③分析全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移情况。④比较全身骨显像单独诊断与联合SPECT/CT融合显像诊断乳腺癌骨转移的敏感度、特异度及准确率。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;准确率=(真阳性例数+真阴性例数)/(真阳性例数+假阴性例数+假阳性例数+真阴性例数)[6]。
1.4 统计学分析 采用SPSS 22.0统计学软件对数据进行处理。计数资料以例数和百分比(%)表示,组间比较行χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 最终明确诊断乳腺癌骨转移情况 最终证实204例患者中骨转移者65例,无骨转移者139例。65例骨转移患者中,共有223个病灶,累及部位从多到少依次为:脊柱、胸廓、骨盆、四肢、颅骨,见表1。139例无骨转移患者中,65例为脊柱退行性病变,30例为骨折,24例为炎性病变,20例肿瘤样病变。
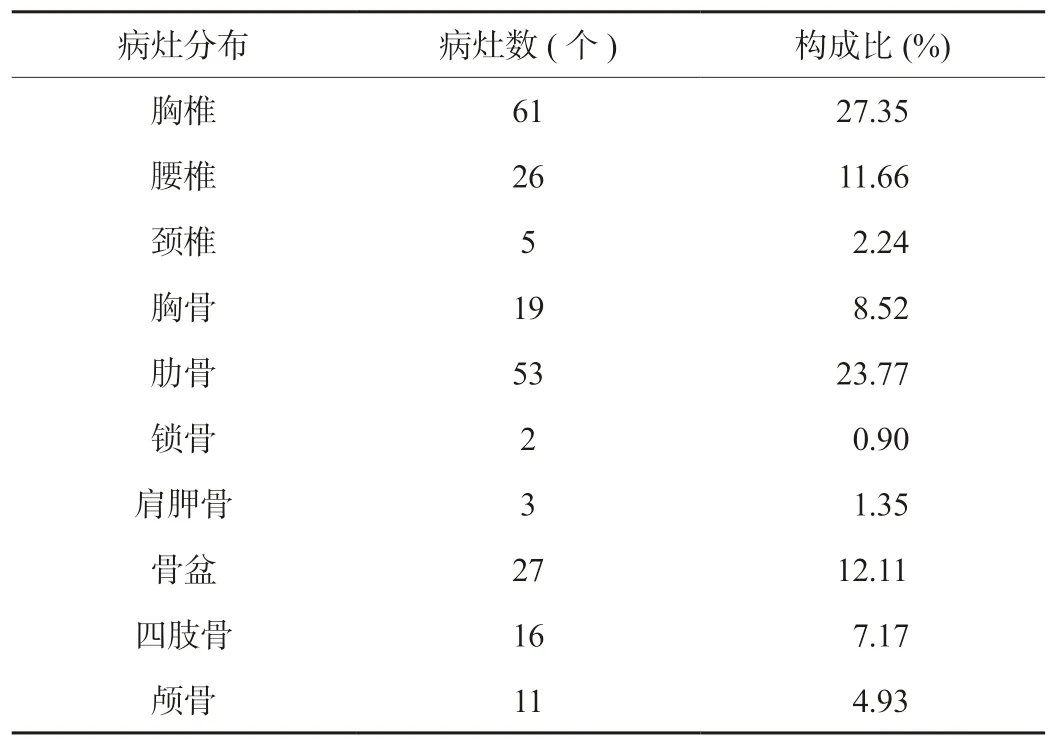
表1 65例乳腺癌骨转移患者病灶分布及构成比分析
2.2 全身骨显像诊断乳腺癌骨转移情况 全身骨显像诊断71例骨转移,133例无骨转移,见表2。
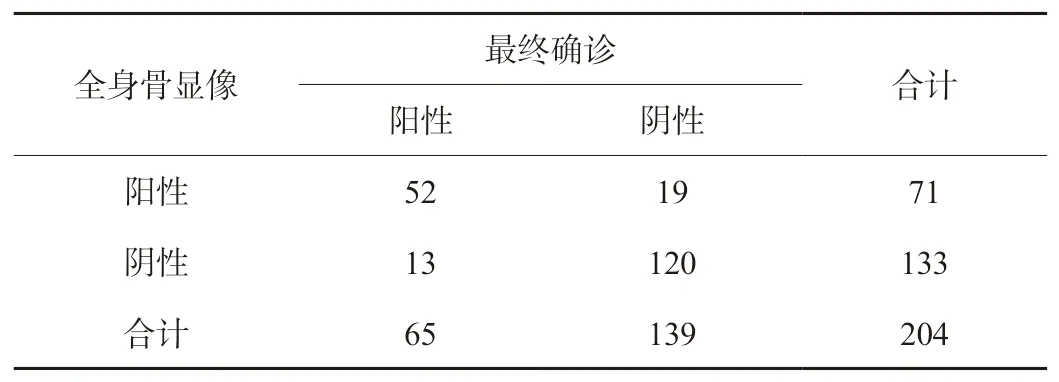
表2 全身骨显像诊断乳腺癌骨转移情况(例)
2.3 全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移情况 全身骨显像联合SPECT/CT诊断72例骨转移,132例无骨转移,见表3。

表3 全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移情况(例)
2.4 全身骨显像单独诊断与联合SPECT/CT融合显像诊断乳腺癌骨转移的效能比较 全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移的敏感度、特异度及准确率高于全身骨显像,差异有统计学意义(P<0.05),见表4。
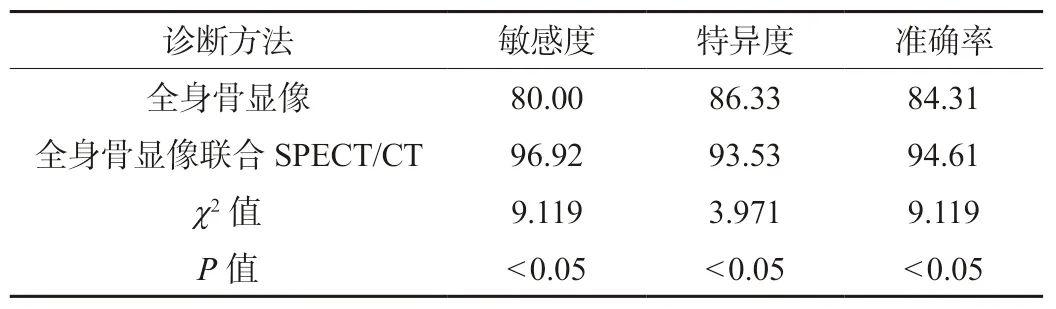
表4 全身骨显像单独诊断与联合SPECT/CT融合显像诊断乳腺癌骨转移的效能比较(%)
3 讨论
乳腺癌早期常表现为乳房肿块、乳头溢液、腋窝淋巴结肿大等症状,晚期可因癌细胞发生远处转移而出现多器官病变,严重影响患者日常活动及生活质量[7]。因此,早期发现骨转移病灶,并采取治疗,有利于改善患者生活质量,延长生存期[8]。研究表明,全身骨显像具有简便、安全及敏感度较高等优点,但在肿瘤骨转移及骨退行性病变诊断中无法确定病灶的重叠部位,不能清晰显示骨转移病灶具体部位[9]。而SPECT/CT融合显像可为临床医师提供具体解剖图像,有利于其准确判断肿瘤病变性质[10]。
本研究结果显示,最终确诊证实204例患者中骨转移者65例,无骨转移者139例。65例骨转移患者中,共有223个病灶。乳腺癌最常见的累及部位依次为:脊柱、胸廓、骨盆、四肢、颅骨。139例无骨转移患者中,65例为脊柱退行性病变,30例为骨折,24例为炎性病变,20例肿瘤样病变。全身骨显像诊断71例乳腺癌骨转移,无骨转移者133例。全身骨显像联合SPECT/CT诊断72例骨转移,132例无骨转移者。全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移的敏感度、特异度及准确率高于全身骨显像,这提示全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移具有较高的临床价值[11]。全身骨显像对于诊断骨转移瘤具备有高敏感度,并可完成全身骨骼一次成像,但其特异度较低,难以检测骨盆、脊柱等部位的重叠病灶,容易出现误诊或漏诊,延误治疗[12]。全身骨显像检查采用亚锡亚甲基二膦酸静脉注射,能与患者骨骼中的无机盐羟基磷灰石晶体吸附、浓聚,但转移性骨肿瘤患者通常溶骨性病灶较多,该显像剂效果欠佳。这种情况下,容易造成漏诊,延误患者治疗[13]。而SPECT/CT融合显像可弥补全身骨显像检查上述缺陷,其可对患者骨转移病灶进行准确定位,并能将骨转移灶分为溶骨型、成骨型和混合型。对于未明确原发灶的骨转移,SPECT/CT融合显像有助于寻找原发肿瘤并指导治疗决策,对于容易与骨转移相混淆的退行性病变及创伤性病变,具有较好的识别能力与鉴别作用[14]。本研究将SPECT/CT融合显像与全身骨显像联合可高效诊断乳腺癌骨转移,具备较高的敏感度,与贺煜[15]的研究结论相符。另外,SPECT/CT融合显像技术能够改善全身骨显像的组织对比度,并能准确地定位骨转移病灶,其断层及融合图像技术可进一步明确病情,大大提高诊断准确率[16]。
综上所述,与单纯全身骨显像检查比较,全身骨显像联合SPECT/CT融合显像诊断乳腺癌骨转移的敏感度、特异度及准确率更佳,应用价值较好,值得临床应用。
