单细胞转录组测序揭示化疗增强乳腺癌细胞亚精胺代谢激活肿瘤免疫
2024-01-02刘子菲黄鹏翰江咏雪曾文锋
刘子菲,黄鹏翰,江咏雪,曾文锋
乳腺癌发病率日益增加,世界卫生组织国际癌症研究机构2020 年癌症报告显示,乳腺癌超越了肺癌成为世界上最普遍的恶性肿瘤,并位于癌症相关死亡人数的前5 位[1]。乳腺癌是全球包括中国在内的多个国家和地区女性发病率最高的恶性肿瘤。在中国,乳腺癌发病率约占中国女性恶性肿瘤总发病率的15%,而且发病率和死亡人数呈逐年上升趋势[2,3]。2020 年世界卫生组织公布的我国癌症数据显示,乳腺癌是我国第四大女性癌症死亡原因,仅次于肺癌、结直肠癌和胃癌[3]。而且乳腺癌年轻化的问题在我国尤为突出,在小于45 岁的中国女性人群中乳腺癌已经成为首要的癌症死亡原因[2]。目前乳腺癌的治疗主要依靠外科手术、放疗、化疗、内分泌治疗和靶向治疗。其中新辅助化疗是乳腺癌患者的重要根治性手段之一,研究其抑制肿瘤进展的作用和机制有助于我们加深肿瘤化疗的理解和临床上合理地选择化疗药物。近年来的研究表明,化疗除了对肿瘤本身的杀伤作用外,还可能还可以调节肿瘤微环境代谢改变[4-6]及激活抗肿瘤免疫[7]。
研究表明,恶性肿瘤中多胺生物合成酶的表达增加,并且在癌细胞内出现精胺和亚精胺蓄积。化疗能促进癌细胞多胺代谢通路激活,但该癌细胞代谢通路对微环境的影响还未被阐明。传统观点认为,精胺和亚精胺的富集与恶性肿瘤免疫抑制相关[8-10],但随着研究的深入,近年来有研究者发现多胺代谢的亢进是引起自身免疫性疾病的原因之一,例如银屑病[11]。此外,补充亚精胺可以导致T 淋巴细胞线粒体活性增强[12]并增强抗肿瘤免疫,而且亚精胺可以作为疫苗的佐剂刺激免疫反应[13]。除了适应性免疫外,亚精胺对固有免疫细胞例如自然杀伤细胞的作用也被逐渐揭示[14]。亚精胺代谢促进肿瘤免疫存在争议,乳腺癌亚精胺代谢与肿瘤免疫之间的关系及其调控机制尚不明确。化疗作为肿瘤多胺代谢通路的激活手段之一,其是否有参与调控乳腺癌亚精胺代谢从而影响肿瘤免疫也有待进一步探讨。
1 资料与方法
1.1 数据资料收集
于GEO 基因表达数据库(https://www.ncbi.nlm.nih.gov/geo/)检索新辅助化疗乳腺癌单细胞测序相关数据信息。经检索,符合的数据集为GSE189302[15],该数据来源于自发成瘤鼠肿瘤单细胞测序。为扩大分析范围,我们收入了人乳腺癌单细胞测序数据集GSE176078[16]进行数据验证。
1.2 单细胞测序数据分析
利用R 包Seurat[17,18]进行单细胞数据预处理,两个数据集的细胞注释内容都依据原文或在线数据提供的注释文献,并从测序数据中筛选出上皮细胞进行进一步聚类。利用R 包Harmony[17]对数据进行去批次处理。
1.3 单细胞数据基因表达可视化
利用R 包Nebulosa[19]以及Seurat 中的VlnPlot、FeaturePlot 函数对单细胞数据中亚精胺代谢关键基因的表达水平进行可视化处理。
1.4 单细胞样本分组与差异基因分析
在单细胞测序数据分析的基础上,利用R 包Seurat 中的AddMouduleScore 函数将GOBP_SPERMIDINE_METABOLIC_PROCESS(https://www.gseamsigdb.org/gsea/msigdb/human/geneset/GOBP_SPER -MIDINE_METABOLIC_PROCESS.html)数据集中的基因合并添加到GSE176078 单细胞测序数据中,根据该数据的加权平均数将患者分为癌细胞亚精胺代谢高(high:CID45171;CID4530N;CID4535;CID4523;CID4066;CID3921;CID3948;CID44991;CID3941;CID4513)与亚精胺代谢低(low:CID4471;CID4290A;CID3963;CID4067;CID4465;CID44971;CID4515;CID4461;CID4495;CID4463)两组。利用R 包Seurat 中的FindMarkers 函数分析癌细胞亚精胺代谢高低样本中各类淋巴细胞的差异表达基因。利用R包ggplot2(H.Wickham.ggplot2:Elegant Graphics for Data Analysis.Springer-Verlag New York,2016。)可视化差异表达基因并绘制火山图。并运用ggrepel 包显示出P<0.05 且log2FC>0.5 的差异表达基因的基因名称。
1.5 功能富集分析
利用R 包ClusterProfiler[20]以获得差异基因在细胞内的生物学过程(Biological Process,BP)情况,α 设为0.05,P 值校正方法选择Benjamini &Hochberg 法,即对每个P-value 做校正,转换为qvalue。q=P*n/rank,其中rank 是指P-value 从小到大排序后的次序,获得基因本体论(GO)分析结果。
1.6 统计学方法
采用R4.1.0软件和Rggpubr包进行分析。两两比较采用t检验,以P<0.05 为具有统计学差异。
2 结 果
2.1 化疗导致乳腺癌细胞亚群分布改变
为了探究化疗是否能够影响乳腺癌细胞的亚精胺代谢,对GSE189302 数据集进行分析。GSE189302 将MMTV-Wnt1 肿瘤细胞注射到野生型C57BL6/J 小鼠的乳房脂肪垫使其成瘤,待肿瘤体积达到~200 mm3,化疗组每日腹腔注射多柔比星4 mg/kg 共5 天,对照组不做处理,末次给药48 小时后分别获取肿瘤组织进行单细胞转录组测序[15]。该数据集包括1 例化疗组(GSM5698657)及1 例对照组(样本GSM5698658)的单细胞转录组测序结果,将两者合并进行UMAP 聚类分析,得到包括癌细胞及免疫细胞的共10个细胞群,其中3群细胞根据上皮细胞标记基因注释为癌细胞(图1A)。提取癌细胞进行再聚类,获得9 个细胞亚群(图1B)。如图1C、D 所示,化疗组与对照组的癌细胞分布存在明显差异,化疗后癌细胞0、1、7 群减少,2-6 群增加,其中第2、5 群细胞呈现“从无到有”的显著改变。

图1 GSE189302 化疗前后乳腺癌细胞聚类分析 A:肿瘤组织所有细胞UMAP 聚类散点图;B:癌细胞的UMAP 聚类散点图;C:化疗组及对照组癌细胞的UMAP 聚类散点图;D:两组癌细胞的亚群堆叠图
2.2 化疗诱导乳腺癌亚精胺代谢旺盛细胞亚群形成
为了进一步探究化疗前后癌细胞的改变,对化疗组和对照组的基因表达做差异分析,从而获得两组差异基因,以差异倍数>0.5,校正P值<0.05作为筛选阈值。详见图2A 火山图,其中化疗组上调基因有342 个,下调基因有406 个。分析差异基因发现,亚精胺代谢重要限速酶鸟氨酸脱羧酶1(OCD1)[21]表达水平上调,绘制基因表达水平小提琴图如图2B 所示;亚精胺代谢的另一重要分子精胺氧化酶(SMOX)虽然未达到筛选阈值,但其基因表达水平在两组之间仍存在显著差异(图2C),这些差异提示化疗后癌细胞亚精胺代谢水平升高。为了探究此改变是否与前述癌细胞亚群分布变化有关,在癌细胞聚类散点图中分别显示OCD1 及SMOX 基因表达水平,以及根据亚精胺代谢数据集对各样本的癌细胞进行综合评分(图2D~G),对照图1 中细胞亚群的位置,可以看到第5 群癌细胞具有OCD1、SMOX 高表达,并且亚精胺代谢水平显著升高。以上数据表明多柔比星化疗诱导乳腺癌细胞中亚精胺代谢旺盛亚群形成。
2.3 乳腺癌患者肿瘤细胞亚精胺代谢水平存在差异
为了探究人类乳腺癌细胞亚精胺代谢情况,对GSE176078 数据集进行相关分析。该数据集包含26 例未经化疗的原发性乳腺癌组织的单细胞测序结果,包括11 例ER 阳性、5 例HER2 阳性以及10例三阴型乳腺癌,并提供细胞注释信息[16]。我们将其中6 例未注释癌细胞群的样本予以剔除,其余20 例样本的癌细胞UMAP 聚类结果如图3A、B所示。根据亚精胺代谢数据集对各样本的癌细胞进行综合评分,箱式图3D 显示各样本癌细胞亚精胺代谢水平存在差异。进而以评分中位值作为cut-off 值,将样本分为亚精胺代谢high、亚精胺代谢low 两组(图3C、E)。20 例样本的临床特征及分组信息如表1、表2 所示。
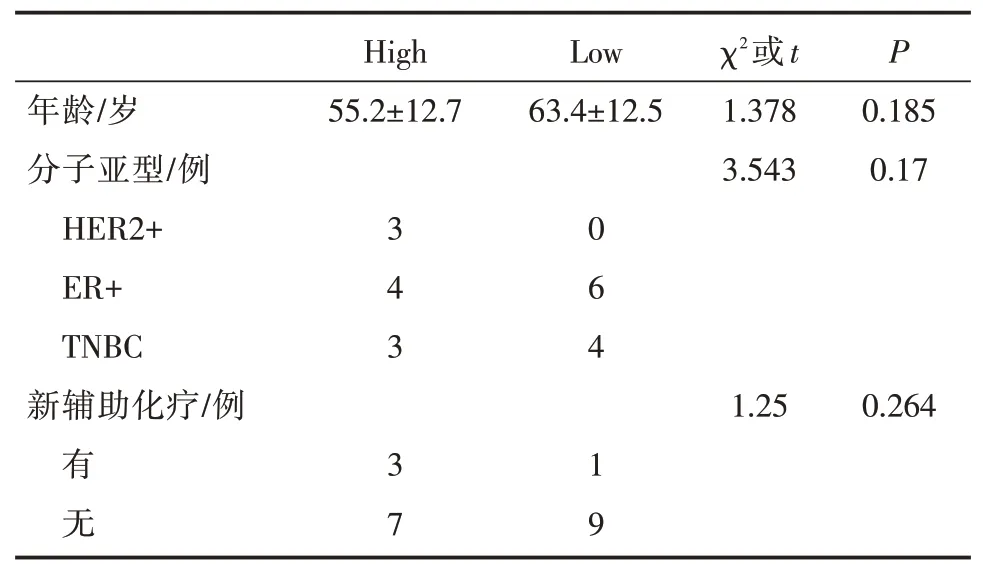
表2 GSE176078 亚精胺代谢high、low 两组的临床特征
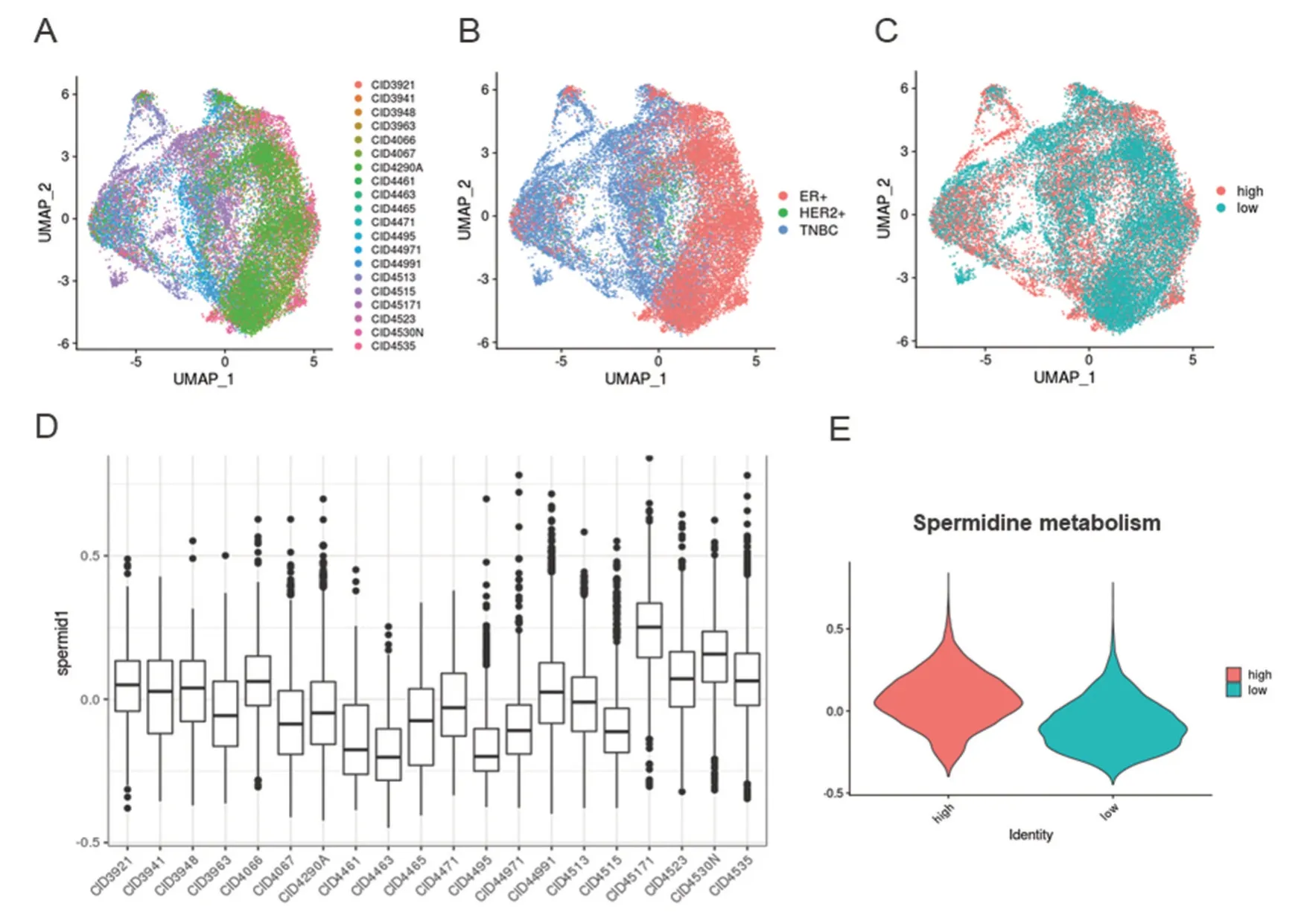
图3 GSE176078 乳腺癌细胞亚精胺代谢水平 A:各样本癌细胞的UMAP 聚类散点图;B:各分子亚型癌细胞的UMAP 聚类散点图;C:亚精胺代谢high、low 两组癌细胞的UMAP 聚类散点图;D:各样本亚精胺代谢水平;E:两组的亚精胺代谢水平
2.4 乳腺癌亚精胺代谢与肿瘤浸润T 细胞的关系
近期有研究报道,亚精胺能够通过增加脂肪氧化磷酸化增强CD8+T 细胞的线粒体活性和细胞毒性功能[12]。我们猜测癌细胞代谢产生的亚精胺能够作用于肿瘤浸润T 细胞,影响抗肿瘤免疫。为了验证假说,根据GSE176078 所提供的细胞注释信息,分析亚精胺代谢high、low 两组的免疫细胞浸润情况(表3)。如图4A、B,亚精胺代谢high的肿瘤具有相近T 细胞浸润比例,并且T 细胞各亚群的比例差异不大。GSE176078数据集的原作者根据基因表达特点对CD4+、CD8+T 淋巴细胞进行了再聚类,并将其注释为具有不同功能特点的4 个CD4亚群和5个CD8亚群[16]。比较发现亚精胺代谢high、low 两组之间亚群分布存在差异(图4C、D)。尤其值得注意的是,在亚精胺代谢high 的肿瘤中,高表达T 细胞激活及效应相关基因ZFP36[22]的CD8+亚群(c4)明显增多,以抑制性免疫检查点LAG3为特点的CD8+亚群(c8)、以衰老标志物GZMK[23]为特点的CD8+亚群(c5)明显减少(图4C),提示乳腺癌细胞亚精胺代谢水平对CD8+T 细胞的基因表达和功能存在影响。
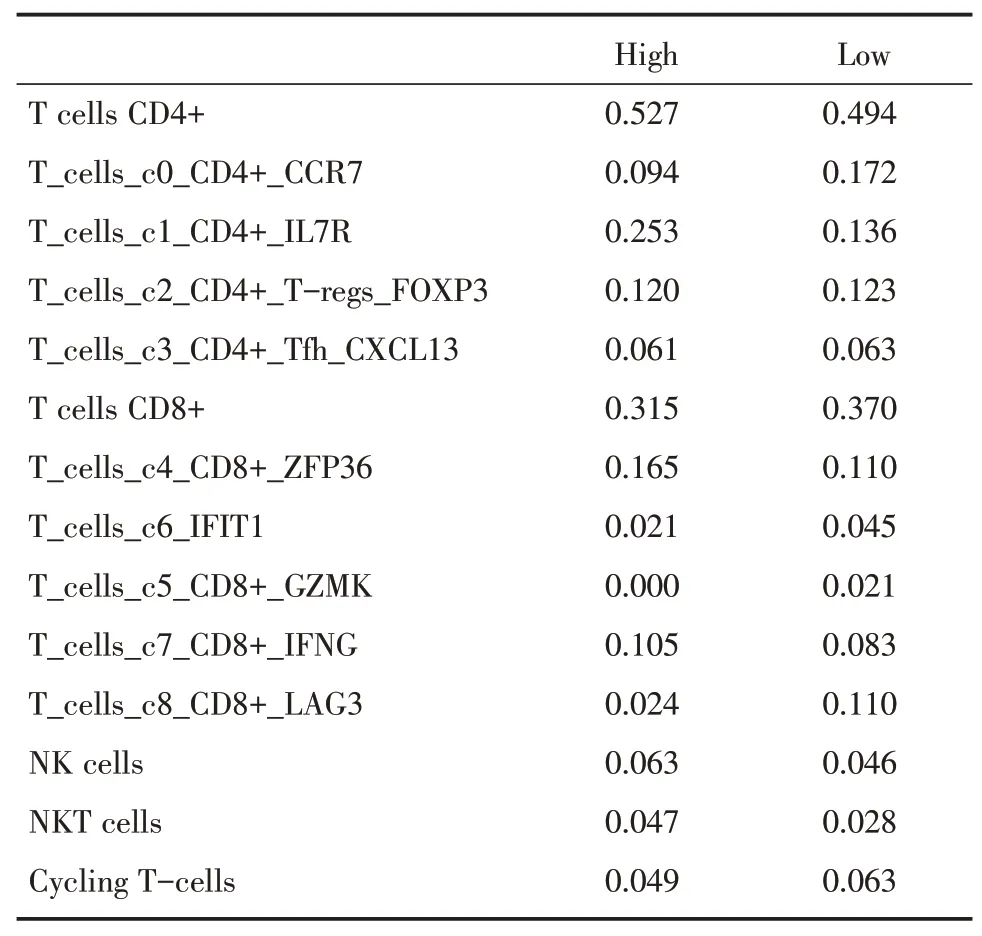
表3 GSE176078 亚精胺代谢high、low 两组的免疫浸润情况

图4 GSE176078 亚精胺代谢high、low 两组的免疫浸润情况 A:两组肿瘤组织细胞分类堆叠图;B:T 细胞亚群堆叠图;C:CD8+T 细胞亚群堆叠图;D:CD4+T 细胞亚群堆叠图
2.5 乳腺癌亚精胺代谢对CD8+T 细胞功能的影响
为了进一步验证上述发现,我们对CD8+T 细胞做进一步分析。首先对亚精胺代谢high、low 两组CD8+T 细胞的基因表达做差异分析,从而获得两组差异基因,以差异倍数>0.5,校正P值<0.05作为筛选阈值。如图5A 火山图所示,亚精胺代谢high 组有58 个基因上调,59 个基因下调,我们将上调基因予以标注,其中包括与T 细胞激活或效应功能相关的基因CD69、DUSP1、FOS、CXCR4[22],基因表达水平如图5C-F 所示。LAG3、PDCD1 是重要的免疫检查点,能够抑制免疫微环境[12,24],其在亚精胺代谢high 的肿瘤浸润CD8+T 细胞中表达量显著降低(图5G、H)。上述基因表达差异提示癌细胞的亚精胺代谢水平与肿瘤浸润CD8+T 细胞的激活和功能呈正相关。利用基因本体(gene ontology,GO)数据库富集亚精胺代谢high 组上调基因,发现与抗原处理与呈递(antigen process and presentation)、抗原受体介导的信号通路(antigen receptor-mediated signaling pathway)、T 细胞受体信号通路(T cell recepter signaling pathway)、IFN-γ 介导的信号通路(interferon-gamma-mediated signaling pathway)等适应性免疫功能相关通路有关,进一步证明癌细胞的亚精胺代谢增强肿瘤浸润CD8+T 细胞功能的作用。

图5 GSE176078 亚精胺代谢high、low 两组CD8+T 细胞的基因表达情况 A:差异基因火山图;B:基因本体(GO)富集分析;C~H:相关基因表达水平差异
3 讨 论
乳腺癌已经成为全球发病率最高的恶性肿瘤之一。新辅助化疗为乳腺癌患者的治疗带来了更多的选择和提高了患者预后。该术前化疗手段的临床获益也引发了研究人员思考除了直接杀伤肿瘤细胞外,化疗是否能重塑肿瘤微环境以增强抗肿瘤免疫。一直以来多胺,包括腐胺、精胺、亚精胺都被认为与免疫抑制形成相关[21]。但近几年,多胺对免疫更复杂的作用逐渐被揭示。例如对于抗肿瘤免疫中起关键作用的CD8+T 细胞,诺贝尔奖获得者Tasuku Honjo 团队[12]发现在衰老的小鼠体内补充亚精胺增强CD8+T 细胞的代谢能力产生更多ATP,外源补充亚精胺能实现抑制免疫细胞衰老并促进抗肿瘤免疫。然而Hibino 等[9]人的研究显示,肿瘤细胞产生的内源性亚精胺能够通过抑制TCR 聚集从而阻止其下游信号传导,多胺合成抑制剂能够增强CD8+T 细胞的功能。上述多胺对CD8+T 细胞功能影响的矛盾揭示了多胺代谢通过多种机制从不同方向上影响抗肿瘤免疫的复杂性,无论是外源补充多胺或是体内多胺代谢对于抗肿瘤免疫的调控都需要更多探索。而我们的研究揭示了,亚精胺代谢的激活与乳腺癌肿瘤免疫激活存在正相关,丰富了我们对多胺代谢与肿瘤免疫的理解。
既往分析肿瘤代谢与免疫微环境的串扰,因技术的局限只能从整个肿物中提取核酸或代谢物进行检测,随着单细胞测序技术的普及,我们可以分析癌细胞代谢通路变化对肿瘤浸润免疫细胞的调控。本研究发现化疗可以增强乳腺癌细胞的多胺代谢,并且与肿瘤微环境中浸润的淋巴细胞激活相关。我们猜想化疗诱导肿瘤死亡的过程中,可能引起了癌细胞多胺代谢增强并释放到环境引起淋巴细胞激活。本研究为开展后续体外实验提供生物信息学依据。受限于标本数量和肿瘤类型,我们的发现尚未做到多癌种分析。后续的研究我们将收集更多的人乳腺癌及其他癌种化疗前后的单细胞测序数据,并进一步开展功能实验。总之,本研究证明了化疗能促进乳腺癌细胞亚精胺代谢增强,同时癌细胞亚精胺代谢强与效应性淋巴细胞的浸润和激活呈现正相关。本研究的发现为乳腺癌新辅助治疗引起的癌细胞免疫原性死亡原理提供了理论支持。
