PA、Fg对食管鳞癌根治性放疗患者近期预后的预测价值
2024-01-01程欣宇周海汪晨宇张耀纪媛媛

[摘" "要]" "目的:分析前白蛋白(prealbumin,PA)、纤维蛋白原(fibrinogen,Fg)对食管鳞癌根治性放疗患者近期预后的预测价值。方法:食管鳞癌根治性放疗患者98例,根据近期预后分为预后良好组80例和预后不良组18例。比较两组患者的基线资料、放疗前血液PA、Fg、血管内皮生长因子(vascular endothelial growth factor,VEGF)、D-二聚体(D-dimer,D-D)及癌胚抗原(carcinoembryonic antigen,CEA)水平。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC),评估PA、Fg对食管鳞癌根治性放疗患者近期预后的预测价值。结果:预后不良组肿瘤低分化、分期为Ⅲ期、肿瘤最大径>5 cm患者的占比高于预后良好组(均P<0.05)。相较于预后良好组,预后不良组PA水平较低,Fg、VEGF、D-D、CEA水平较高(均P<0.05)。ROC曲线分析显示,放疗前PA、Fg水平预测食管鳞癌根治性放疗患者的近期预后有一定效能,AUC均>0.80,二者联合预测的AUC为0.920。绘制决策曲线,在阈值0.04~0.07、0.13~0.71和0.77~0.97范围内,PA和Fg联合预测食管鳞癌根治性放疗患者近期预后的净受益率优于PA和Fg。结论:PA、Fg对食管鳞癌根治性放疗患者的近期预后有较好的预测价值,联合预测价值更理想。
[关键词]" "食管鳞癌;根治性放疗;前白蛋白;纤维蛋白原;近期预后;预测
[中图分类号]" "R735.1 [文献标志码]" "B [DOI]" "10.19767/j.cnki.32-1412.2024.05.009
食管癌是食管上皮组织的恶性肿瘤,以鳞状细胞癌为主,多发生在食管的中段、下段[1],发病率、死亡率分别居我国恶性肿瘤的第六位和第四位。食管癌的病因较为复杂,除遗传因素、癌前疾病外,与不良饮食、生活习惯有关,如食用高温、高盐、霉变及粗糙食物、长期吸烟饮酒等。早期患者多无明显症状,随着疾病的进展逐渐出现吞咽异物感、吞咽困难、消瘦、营养不良等症状。目前临床治疗食管癌主要采用根治性切除、放化疗等方式,有相当一部分患者因年龄、合并症、病变部位等限制,无法手术或拒绝手术而选择根治性放疗,以改善病情和预后,但仍有部分患者的预后不理想[2]。因此,亟需找到能有效预测食管鳞癌根治性放疗后预后风险的指标。刘燕等[3]研究表明,存在营养风险的食管癌患者根治性放疗的预后较差,李攀等[4]研究表明,加强对食管癌患者凝血功能干预,有助于延缓病情进展,改善预后。前白蛋白(prealbumin, PA)和纤维蛋白原(fibrinogen,Fg)分别是评估患者营养状况、凝血功能指标,本研究重点探讨PA和Fg对食管鳞癌根治性放疗患者近期预后的预测价值。
1" "资料与方法
1.1" "一般资料" "选取2021年3月—2022年9月我院收治的98例食管鳞癌患者,男性58例,女性40例;年龄42~85岁,平均(65.71±8.02)岁;体质量指数(body mass index,BMI)17.7~23.6 kg/m2,平均(19.03±1.23)kg/m2;淋巴结转移29例,无淋巴结转移69例。纳入标准:(1)符合《食管癌诊疗规范(2018年版)》[5]中关于食管癌的诊断标准;(2)经病理组织学确认为鳞状细胞癌;(3)符合根治性放疗适应证。排除标准:(1)伴有其他恶性肿瘤;(2)伴有免疫性疾病、血液系统疾病、感染性疾病;(3)重要器官功能障碍;(4)患有精神疾病或沟通障碍者;(5)近1周内服用过影响凝血功能的药物。本研究经医院伦理委员会批准,患者及家属知情同意。
1.2" "研究方法
1.2.1" "资料收集:内容包括性别、年龄、BMI、吸烟史(连续或累计吸烟6个月及以上)、饮酒史(饮酒连续或累计90天及以上)、基础疾病、是否同步化疗、病变部位、肿瘤分化程度、肿瘤分期、肿瘤最大径等。
1.2.2" "实验室检测:采集患者入组时空腹肘静脉血3 mL,分别离心获取血浆和血清。采用Atellica CH Analyzer全自动生化分析仪[西门子医学诊断产品(上海)有限公司],双缩脲法测定血清PA水平;采用STA Compact Max全自动血凝分析仪(思塔高诊断股份有限公司),凝血酶凝固法检测血浆Fg水平;采用BK-EL10A酶联免疫分析仪[山东博冠生物技术有限公司],酶联免疫吸附法检测血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、血浆D-二聚体(D-dimer,D-D)水平;使用cobas 6000 e 601全自动化学发光免疫分析仪[罗氏诊断产品(上海)有限公司],电化学发光法测定血清癌胚抗原(carcinoembryonic antigen,CEA)水平。
1.2.3" "治疗方法:根据《中国食管癌放射治疗指南(2020年版)》[6]实施根治性放疗。患者在定位前及放疗前空腹服用200 mL清水或半流质食物(粥、酸奶等),取仰卧位,双臂伸直放在体侧或者双手抱肘置于额头,双腿自然并拢,全身放松,根据病变位置选择合适的器具(如头颈肩罩、体膜、发泡胶等)固定体位。使用SOMATOM Force双源CT机(德国西门子公司)扫描定位病灶,3 mm层厚,扫描双侧颈部锁骨上、双肺等部位,再行增强扫描或MRI定位,标记并勾画计划靶区、肿瘤区、临床靶区、危及区。95%计划靶区的处方剂量为60~64 Gy,分次剂量为1.8~2.0 Gy,1次/d,5次/周。
1.2.4" "近期预后评估方法:根据《食管癌诊疗规范(2018年版)》[5],于患者完成放疗2个月后评估治疗效果。完全缓解:肿瘤完全消失至少4周;部分缓解:肿瘤最大直径与最大垂直直径的乘积缩小≥50%,其他病变无增大,持续时间至少4周;病情稳定:病变两径乘积缩小<50%,增大<25%,持续时间至少4周;病情进展:病变两径乘积增大≥25%。将完全缓解和部分缓解视为预后良好,病情稳定和病情进展视为预后不良。
1.3" "观察指标" "(1)比较预后良好组与预后不良组患者的基线资料,入组时PA、Fg水平;(2)分析PA、Fg水平预测食管鳞癌根治性放疗后预后的价值。
1.4" "统计学处理" "应用SPSS 25.0统计学软件对数据进行分析处理。计量资料以±s表示,组间比较采用t检验;计数资料以频数和百分率表示,组间比较采用χ2检验;等级资料组间比较采用秩和检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC),评价PA、Fg对食管鳞癌根治性放疗患者近期预后的预测价值。AUC≤0.50无预测价值;0.50<AUC≤0.70预测价值较低;0.70<AUC≤0.90预测价值中等;AUC>0.90预测价值较高。采用R软件和rms程序包,以净受益率为纵坐标,高风险阈值为横坐标,绘制决策曲线,检验PA、Fg对近期预后的预测价值。P<0.05为差异具有统计学意义。
2" "结" " " 果
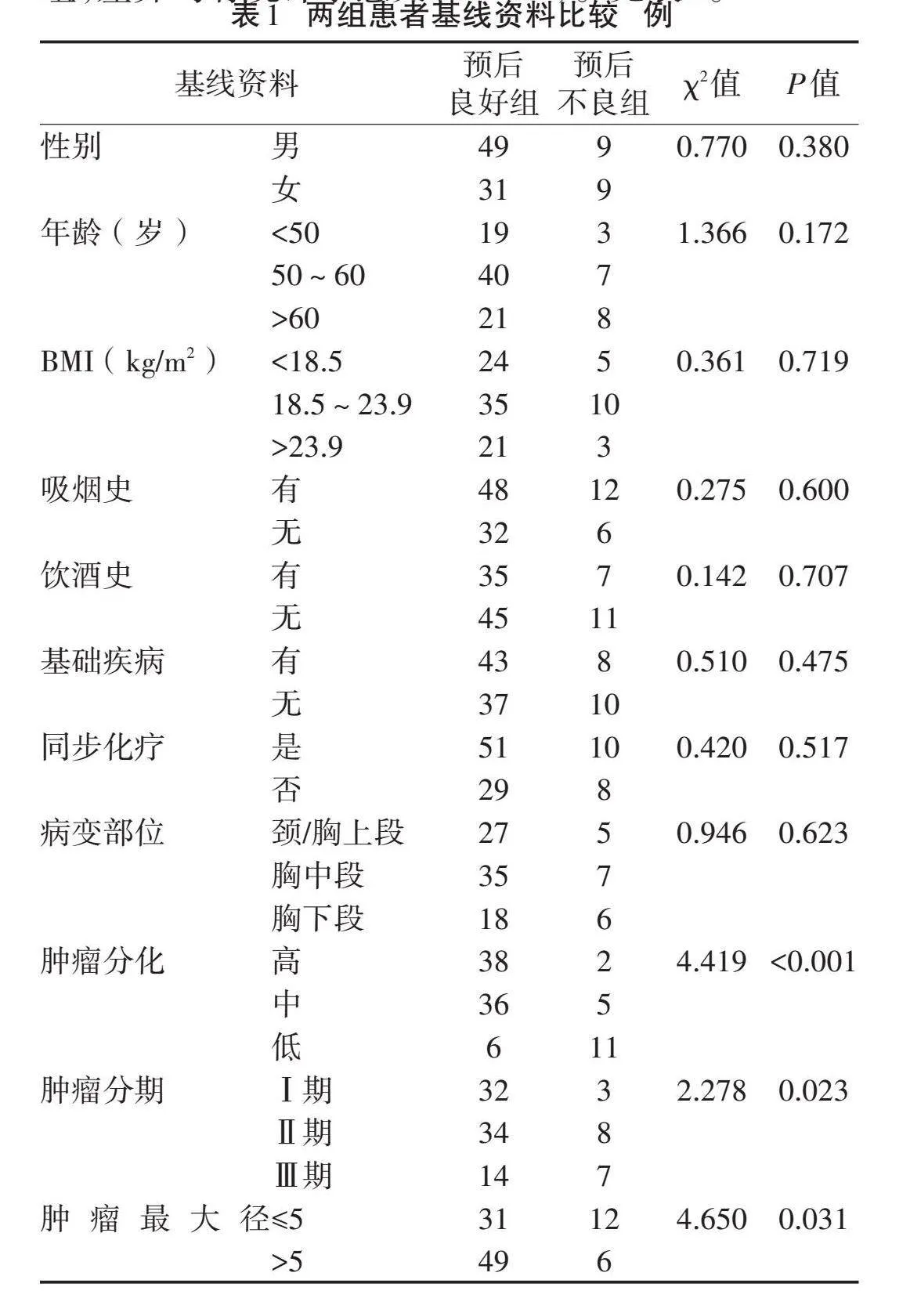
2.1" "两组患者基线资料比较nbsp; "98例患者均完成放疗后的随访,其中80例(包括完全缓解54例、部分缓解26例)设为预后良好组,18例(包括病情控制13例、病情进展5例)设为预后不良组。两组性别、年龄、体质量指数、吸烟史、同步化疗、病变部位比较,差异均无统计学意义(P>0.05)。预后不良组中肿瘤低分化、Ⅲ期、肿瘤最大径>5 cm患者的占比高于预后良好组,差异均有统计学意义(P<0.05)。见表1。
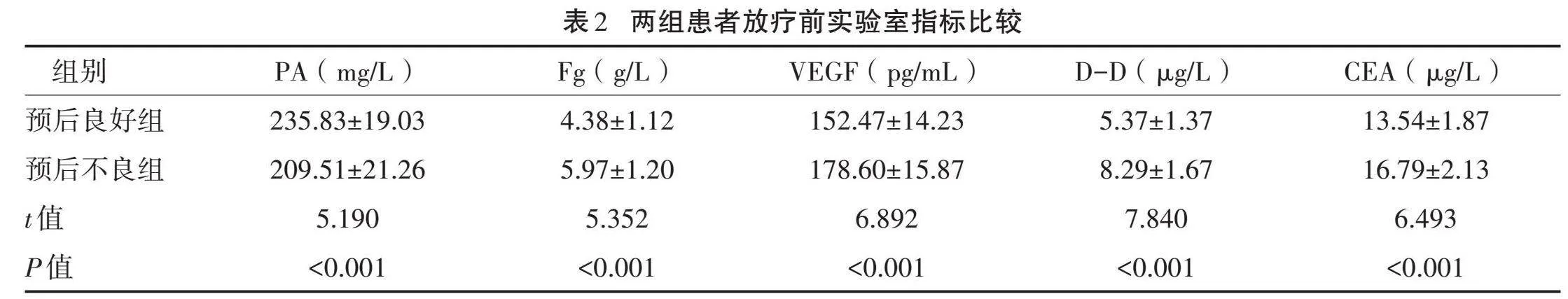
2.2" "两组患者放疗前实验室指标比较" "与预后良好组比较,放疗前预后不良组PA水平较低,Fg、VEGF、D-D、CEA水平较高,差异均有统计学意义(P<0.05)。见表2。
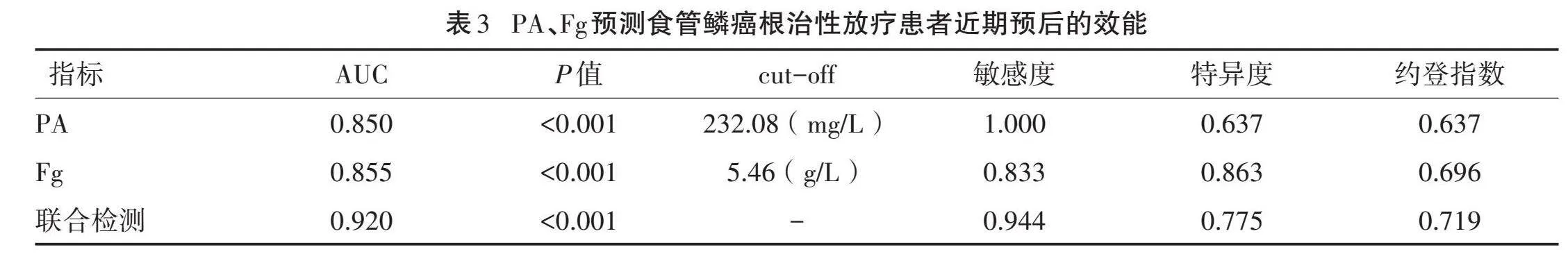
2.3" "预测效能分析" "以近期预后为状态变量(1=预后不良,0=预后良好),绘制ROC曲线,结果显示,放疗前PA、Fg水平预测食管鳞癌根治性放疗患者的近期预后有一定效能,AUC均>0.80,且二者联合预测的AUC为0.920。见图1、表3。
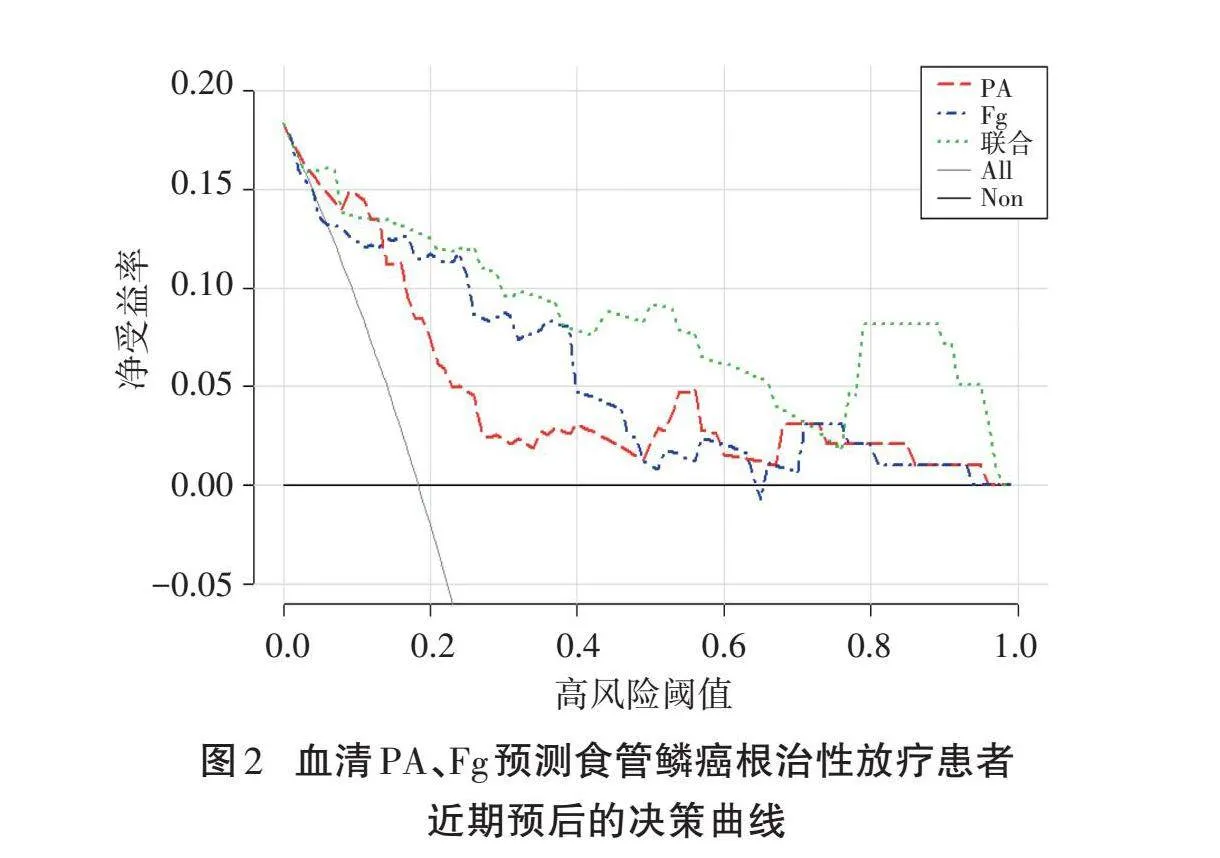
以净受益率为纵坐标,高风险阈值为横坐标,绘制决策曲线,其中高风险阈值设为(0,1)。PA与Fg联合预测中,当高风险阈值为0.00~1.00时,净受益率大于0,有临床意义,且最大净受益率为0.186;当阈值为0.04~0.07、0.13~0.71和0.77~0.97时,联合预测食管鳞癌根治性放疗患者近期预后的净受益率优于PA和Fg。见图2。
3" "讨" " " 论
根治性放疗是目前食管癌患者放射治疗的主要方式之一,陆艳荣等[7]研究显示,食管癌根治性放疗选择性淋巴引流区预防照射与累及野照射的有效率分别为85.4%和81.0%。本研究结果显示,食管鳞癌患者根治性放疗的预后良好率为81.63%,与上述结果接近,说明多数患者能获得理想效果,但仍有患者预后情况欠佳。刘伟等[8]研究表明,高龄食管癌患者的营养状态、放疗剂量均是影响预后的主要因素,郭孟刚等[9]研究表明,预后营养指数与食管癌患者术后预后有关。PA是由肝脏合成的蛋白质,在临床上多用于肝病、营养不良等疾病的评估和诊断。马韶慧等[10]研究表明,术前凝血指标凝血酶原时间、Fg与肝细胞癌患者的预后有关。陈璐等[11]研究表明,D-D、Fg是卵巢癌患者预后的影响因素。
本研究结果显示,与预后良好组相比,预后不良组PA水平较低、Fg水平较高;ROC曲线分析显示,放疗前PA、Fg水平预测食管鳞癌根患者近期预后的AUC>0.80,有中等效能,而二者联合预测的AUC为0.920,预测效能更高。PA水平较低意味着患者营养状态较差,食管癌患者长期吞咽困难,受疼痛、肿瘤消耗等困扰,大多伴有不同程度的营养不良,营养不良增加放疗并发症的风险,降低放疗敏感性,导致近期预后不良[12-13]。营养不良还会提高体内炎症因子水平,抑制免疫功能和肿瘤细胞凋亡,导致肿瘤复发和转移,进一步增加预后不良风险[14]。
研究表明,肿瘤患者多伴有凝血功能障碍,发生静脉血栓栓塞性疾病的风险较非肿瘤患者高4~7倍[15]。高凝状态不仅通过促血管生成为肿瘤细胞提供更多的氧、营养物质,还增加肿瘤细胞与血管内皮细胞间的相互作用,促进肿瘤的生长和迁移。高凝状态造成肿瘤周围形成微血栓,从而限制免疫细胞的进入,使得肿瘤细胞逃避免疫监视。高水平Fg提示体内存在高凝状态,高水平Fg通过促进肿瘤血管生成和肿瘤细胞生长,增加不良预后的风险[16]。决策曲线显示,在阈值0.04~0.07、0.13~0.71和0.77~0.97范围内,PA与Fg联合预测食管鳞癌根治性放疗患者近期预后的净受益率优于PA和Fg,预测价值更理想。
本研究结果还显示,相较于预后良好组,预后不良组中肿瘤低分化、分期Ⅲ期、肿瘤最大径>5 cm患者的占比较高,且预后不良组VEGF、D-D、CEA水平较高。分化程度越低、分期越高、肿瘤最大径越大说明肿瘤增殖、生长能力及侵袭性更强,放疗难度加大,肿瘤细胞对放疗抗性更强。抗性较高的肿瘤细胞会自行修复DNA损伤,从而降低放疗效果[17]。高水平VEGF促进肿瘤新生血管生成,增加肿瘤生长和侵袭能力,同时新生血管的异常结构可影响放疗效果,因此,预后不良的食管鳞癌患者的VEGF水平较高[18]。D-D是纤维蛋白的降解产物,高水平D-D食管癌患者提示存在血液高凝状态,不良预后风险增加[19]。患者体内出现恶性病变时,如食管鳞癌细胞增殖、生长等,CEA表达水平升高,当CEA水平较高时,患者的不良预后风险便会升高。但VEGF、D-D、CEA指标对肿瘤的预测价值已被证实,因此本研究未对其作进一步研究。
综上所述,PA、Fg对食管鳞癌根治性放疗患者的近期预后有较好的预测价值,且二者联合预测价值更理想。
[参考文献]
[1] CAO W,CHEN H D,YU Y W,et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J,2021,134(7):783-791.
[2] 路娜,王鑫,李晨,等. T1~2N0M0期食管癌根治性放疗的预后分析:泛京津冀食管肿瘤多中心协作组多中心回顾性研究(3JECROG R-01H)[J]. 中华肿瘤杂志,2020,42(2):139-144.
[3] 刘燕,吕茵,穆克代斯·伊力亚斯,等. 食管癌根治性放疗患者营养风险筛查的临床意义[J]. 新疆医科大学学报,2022,45(8):829-834.
[4] 李攀,徐焰,张广焕,等. 凝血功能指标、孕激素和脂联素分子受体3与食管癌疾病进展和预后的关系[J]. 癌症进展,2022,20(13):1353-1356.
[5] 国家卫生健康委员会. 食管癌诊疗规范(2018年版)[J]. 中华消化病与影像杂志(电子版),2019,9(4):158-192.
[6] 中国医师协会放射肿瘤治疗医师分会,中华医学会放射肿瘤治疗学分会,中国抗癌协会肿瘤放射治疗专业委员会.中国食管癌放射治疗指南(2020年版)[J]. 国际肿瘤学杂志,2021,48(1):1-10.
[7] 陆艳荣,瓦热斯江·衣不拉音,巴尔夏古丽·扎比胡拉. 食管癌根治性放疗选择性淋巴引流区预防照射与累及野照射的局部控制率、生存率比较分析[J]. 中国医刊,2018,53(5):573-576.
[8] 刘伟,薛旭东,罗文广,等. 不同放疗剂量治疗80岁以上高龄食管癌患者的预后分析[J]. 中国医学物理学杂志,2020,37(8):977-981.
[9] 郭孟刚,周海宁,杨绪全. 预后营养指数评估食管癌病人术后并发症及预后的临床价值[J]. 安徽医药,2021,25(5):898-902.
[10] 马韶慧,崔婵娟,高红军,等. 凝血相关指标基于576例肝细胞癌患者预后中的预测价值研究[J]. 肿瘤学杂志,2023,29(4):314-322.
[11] 陈璐,范菽卫,范希景. D-D二聚体和纤维蛋白原凝血功能指标在卵巢癌患者预后中的价值[J]. 中国卫生检验杂志,2022,32(6):727-729,734.
[12] CAO J,XU H,LI W,et al. Nutritional assessment and risk factors associated to malnutrition in patients with esophageal cancer[J]. Curr Probl Cancer,2021,45(1):100638.
[13] 于玲,赵佳佳,姜桂春. 老年食管癌患者术前PG-SGA评分与营养相关血液学指标的相关性研究[J]. 现代消化及介入诊疗,2020,25(11):1440-1444.
[14] 张艳华,李晓玲,李增宁. 国内恶性肿瘤患者营养不良影响因素Meta分析[J]. 中国临床保健杂志,2020,23(5):649-655.
[15] 中国临床肿瘤学会肿瘤与血栓专家委员会. 肿瘤相关静脉血栓栓塞症预防与治疗指南(2019版)[J]. 2019,46(13):653-660.
[16] 朱红艳,胡恩亮,白云,等. 血管内皮生长因子、凝血功能指标与食管癌患者预后的关系[J]. 癌症进展,2023,21(17):1922-1925.
[17] 郑森中,陈魏,牟吉,等. 术前系统免疫炎症指数和中性粒细胞/淋巴细胞比值与食管癌临床病理特征及预后的关系[J]. 中国卫生检验杂志,2019,29(7):818-822.
[18] 胡锋超,安秀英,张晶,等. CD137L、VEGF和E-cad在食管鳞癌组织中的表达及其与淋巴结转移、预后的相关性[J]. 中国急救复苏与灾害医学杂志,2021,16(8):902-906.
[19] 王彦,李佳龙,吴砚铭,等. 术前D-二聚体水平与中国食管癌患者预后关系的系统评价与Meta分析[J]. 中国胸心血管外科临床杂志,2020,27(6):689-692.
[收稿日期] 2024-03-22
(本文编辑" "赵喜)
