安赛蜜对大鼠的亚慢性毒性
2023-12-28郑思雨滕晶晶杨同金鲍军辉
郑思雨 滕晶晶 杨同金 王 岩 夏 新 鲍军辉
(安徽省疾病预防控制中心, 安徽 合肥 230601)
安赛蜜甜味纯正而强烈,为蔗糖的200倍,对光、热稳定,pH适用范围较广(pH为3~7)[1]。作为第4代合成甜味剂,安赛蜜在体内不代谢、不蓄积,可以单独使用,也可以与其他甜味剂混合使用并产生很强烈的协同效应,被认为是最有前途的甜味剂之一[2]。目前,普遍使用双乙烯酮和氨基磺酸合成安赛蜜,其原料来源广、生产成本低,适用于连续的工业化生产[3-4]。GB 2760—2014中规定了安赛蜜作为甜味剂允许使用的类别和最大使用量[5]。而食品中超范围、超限量使用甜味剂,滥用复合甜味剂等问题比较突出,已成为高度重视的社会问题[6]。
近年来,人们对食品添加剂的应用越来越重视,对安赛蜜在各食品中含量检测及其风险评估的研究也越来越多[7-10]。欧洲食品安全局(EFSA)及粮农组织/世卫组织食品添加剂联合专家委员会(JECFA)对安赛蜜作为食品添加剂的安全性已经过严格的风险评估,但中国对安赛蜜食用的安全性较少有报道,对其连续的、长期的食用安全性及相关毒理学评价也缺乏相应研究。随着安赛蜜生产工艺的不同及技术革新,安赛蜜的安全性及其与其他甜味剂的协同使用在长期食用下是否会对人体产生影响仍值得深究[11-12]。
研究拟依据GB 15193.13—2015《食品安全国家标准 90天经口毒性试验》,旨在通过大鼠的90 d经口毒性试验探讨安赛蜜作为食品添加剂的安全性以及得出未观察到有害作用剂量(NOAEL)值,以期为正确认识安赛蜜及食品添加剂提供依据。
1 材料与方法
1.1 主要试剂及仪器
健康离乳SD大鼠:4周龄,80只(雌雄各半),清洁级,动物质量合格证号20200812AaZZ0619000686(雌性)、20200812AaZZ0619000206(雄性),试验动物使用许可证号为SYXK(皖)2019-011,生产许可证号为苏饲证(2019)01008,浙江维通利华实验动物技术有限公司;
安赛蜜:≥99%,安徽维多食品配料有限公司;
生化分析仪试剂:美国贝克曼库尔特有限公司;
血常规分析试剂:日本Sysmex(希森美康)株式会社;
血凝仪试剂:南京瑞麦科技开发有限公司;
尿液分析试剂:桂林优利特医疗电子有限公司;
全自动生化分析仪:AU480型,美国贝克曼库尔特有限公司;
五分类血液分析仪:2000i型,日本Sysmex公司;
半自动血凝仪:AYW8001型,南京瑞麦科技开发有限公司;
尿液分析仪:330型,桂林优利特医疗电子有限公司;
多功能酶标仪:Spectramax M2e型,美国MD公司;
全封闭式组织脱水机:ASP200S型,德国Leica公司;
包埋机:BMJ-3型,中威电子仪器有限公司;
石蜡病理切片机:RM2126KT型,德国Leica公司;
显微镜:Eclips Ci型,日本Nikon公司;
电子天平:PB403-S/FACT型,瑞士Mettler Toledo公司。
1.2 方法
1.2.1 试验动物及分组 80只大鼠按性别、体重随机分成4组,每组20只,雌雄各半,单笼饲养于安徽省疾病预防控制中心动物房屏障环境中,温度20~25 ℃、湿度50%~70%。所有动物试验前进行适应性饲养5 d,试验期间大鼠单笼饲养,自由饮水和摄食。
1.2.2 受试物剂量选择及给予方式 分别设高、中、低3个剂量组,根据WHO联合食品添加剂专家委员会推荐的安赛蜜日均最大摄入量为15 mg/kg,以推荐摄入量的300倍,即4 500 mg/kg体重为高剂量组,中、低剂量分别为1 500,500 mg/kg体重(相当于人体推荐摄入量的100,33.3倍),另设一个阴性对照组,共4个剂量组。采用灌胃方式经口染毒,灌胃容量为10 mL/kg体重,每日定时染毒一次(每周灌胃6 d),持续90 d。
1.2.3 指标测定
(1) 一般观察:观察动物的一般表现和中毒体征等,试验期间,前4周每周称体重2次,之后每周称体重1次,每周称量一次饲料,计算饲料消耗和体重增长情况。
(2) 尿液测定:试验结束时,动物禁食16 h后称重,采集尿液,检测尿蛋白(PRO)、尿比重(SG)、酸碱度(pH)、葡萄糖(GLU)以及隐血(BLD)。
(3) 血液学测定:麻醉取血,检测红细胞数(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT)、白细胞数(WBC)及其分类计数(中性粒、淋巴、单核、嗜酸、嗜碱)、血小板计数(PLT)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)。
(4) 血液生化测定:采血进行生化指标检测,包括肌酐(Cr)、血糖(Glu)、总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三脂(TG)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、尿素、氯、钠及钾含量。
(5) 脏体比:肉眼观察大鼠体表、体腔及脏器,称量脑、心脏、胸腺、肾上腺、肝、肾、脾、睾丸、附睾、子宫与卵巢的绝对重量,计算脏器系数。
(6) 组织病理学检查:对脑、甲状腺、心脏、胸腺、肾上腺、肝、肾、脾、胃、十二指肠、结肠、胰、肠系膜淋巴结、卵巢、睾丸及膀胱等脏器做组织病理学检查。
1.3 数据处理
2 结果与分析
2.1 一般临床观察、动物体重增长量、总摄食量、总食物利用率
由表1可知,试验期间雌性阴性对照组大鼠及雄性中、高剂量组大鼠各死亡1只,各剂量组其余动物染毒期间未见明显中毒体征和其他方面改变。受试物以高、中、低剂量进行大鼠灌胃染毒90 d,各组动物体重增长量、总摄食量、总食物利用率与对照组相比差异均无统计学意义(P>0.05),认为安赛蜜喂养大鼠90 d对其体重增长、摄食量和食物利用率无影响。
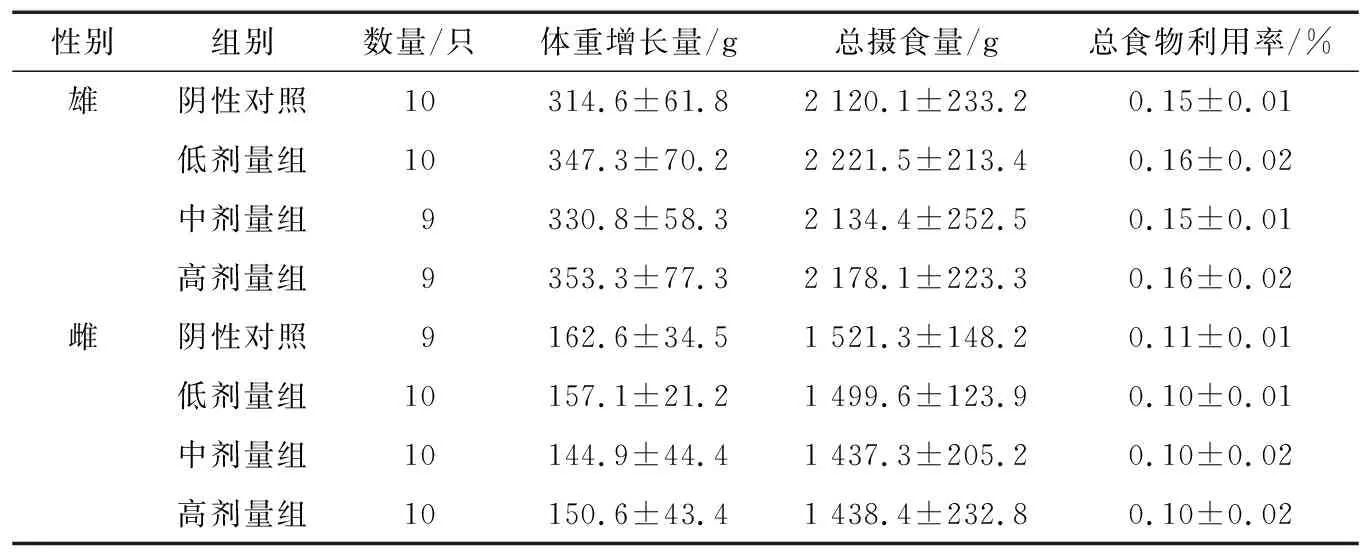
表1 安赛蜜对大鼠体重增长量、总摄食量、总食物利用率的影响
2.2 血液学检测
试验结束对各剂量组雌、雄大鼠的血液学指标进行检测,由表2可知,仅雄性大鼠低剂量组血红蛋白浓度和雌性中剂量组血小板计数与对照组相比具有显著性差异(P<0.05),各剂量组之间也未表现出明显的剂量—反应关系。其余各项指标与对照组相比差异均无统计学意义(P>0.05),认为安赛蜜对大鼠血液学指标无影响。
2.3 血生化指标检测
由表3可知,各剂量组雌、雄大鼠的血清生化指标结果仅雌性动物低剂量组总胆固醇与对照组比较具有显著性差异(P<0.05)。这可能是由于安赛蜜只提供甜味不提供能量,只在味觉上得到甜的感知,使得大鼠进一步增加饮食获得饱腹感,进而导致总胆固醇含量升高[13]。其余各项指标与对照组相比差异均不明显(P>0.05),各剂量组血生化指标均在正常范围内。
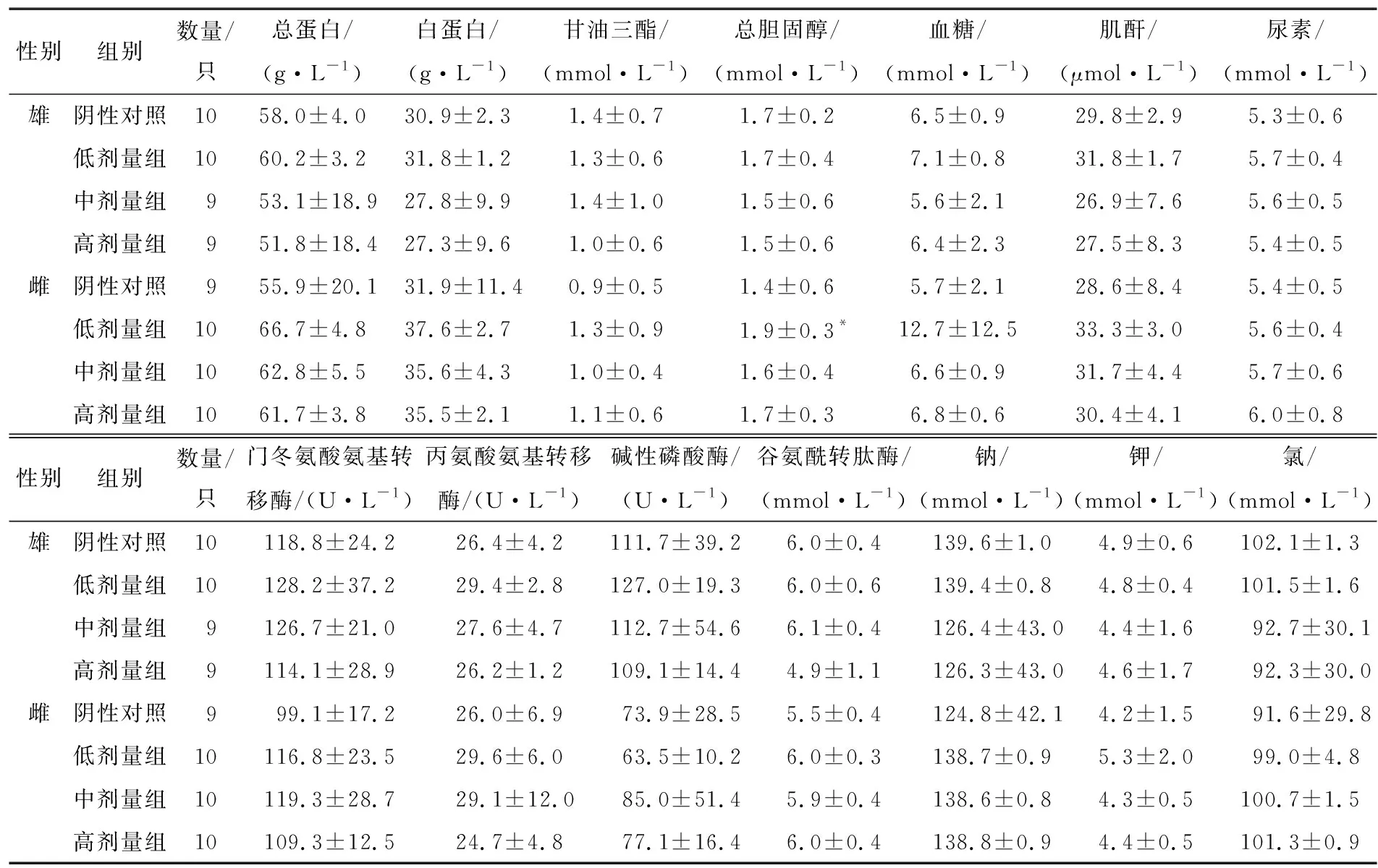
表3 安赛蜜对大鼠血生化指标的影响†
2.4 尿液检测
试验结束对大鼠尿液进行检测,由表4可知,各剂量组雌、雄大鼠的尿常规指标与对照组相比差异均无显著性差异(P>0.05),各项指标均在正常范围内,提示安赛蜜对大鼠尿常规无明显影响。
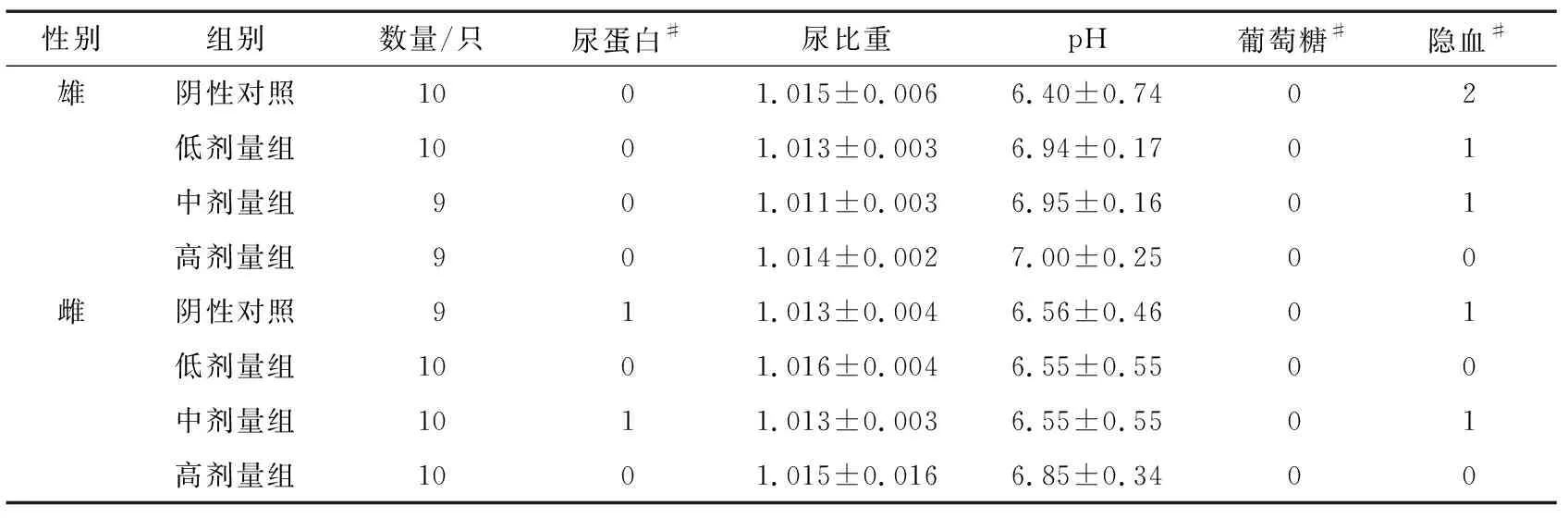
表4 安赛蜜对大鼠尿常规指标的影响†
2.5 大体解剖及组织学检查
2.5.1 大体解剖 由表5可知,所有大鼠大体解剖未发现心、肝、脾、肺、肾、睾丸、心脏、胸腺和肾上腺等脏器的异常。各剂量组脏器重量与对照组相比均无统计学意义(P>0.05)。雌性低、中剂量组肝脏系数与对照组具有极显著差异(P<0.01),雄性中剂量组心脏系数、肾脏系数、高剂量组心脏系数与对照组具有显著性差异(P<0.05)。有研究[14-15]表明,安赛蜜可增加小鼠肝脏脂肪的生成,诱导脂质异常从而加剧动脉粥样硬化,安赛蜜还可能引起小鼠肠道菌群的改变和体重增加。但这并未导致每个剂量组的指标发生改变,也未在体重增重及脏器重量上有所体现,考虑为单一剂量组的偶发现象。其余各项指标与对照组比较,差异均无统计学意义(P>0.05)。
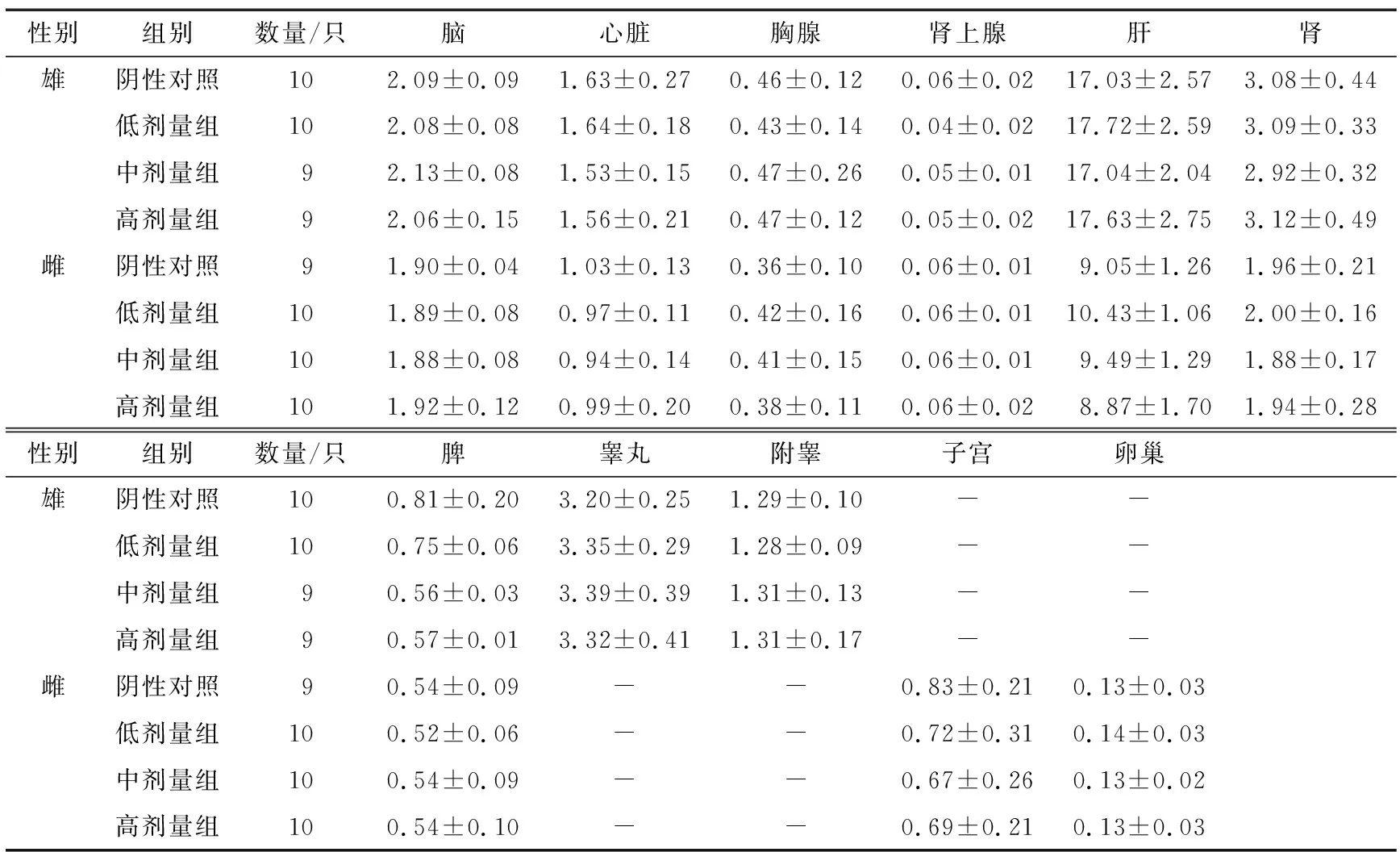
表5 安赛蜜对大鼠脏器重量的影响
2.5.2 组织病理学检查 由表6可知,试验结束,对高剂量组和阴性对照组所有大鼠的脑、甲状腺、胸腺、心脏、肝、肾、脾、肾上腺、胃、十二指肠、结肠、胰、肠系膜淋巴结、卵巢、睾丸和膀胱等做组织病理学检查,检查发现的主要病理改变见表7。但这些病理改变无特异性,也无剂量—反应关系,考虑为自发性病变,与受试物无关,未对其他剂量组进行组织病理学检查。
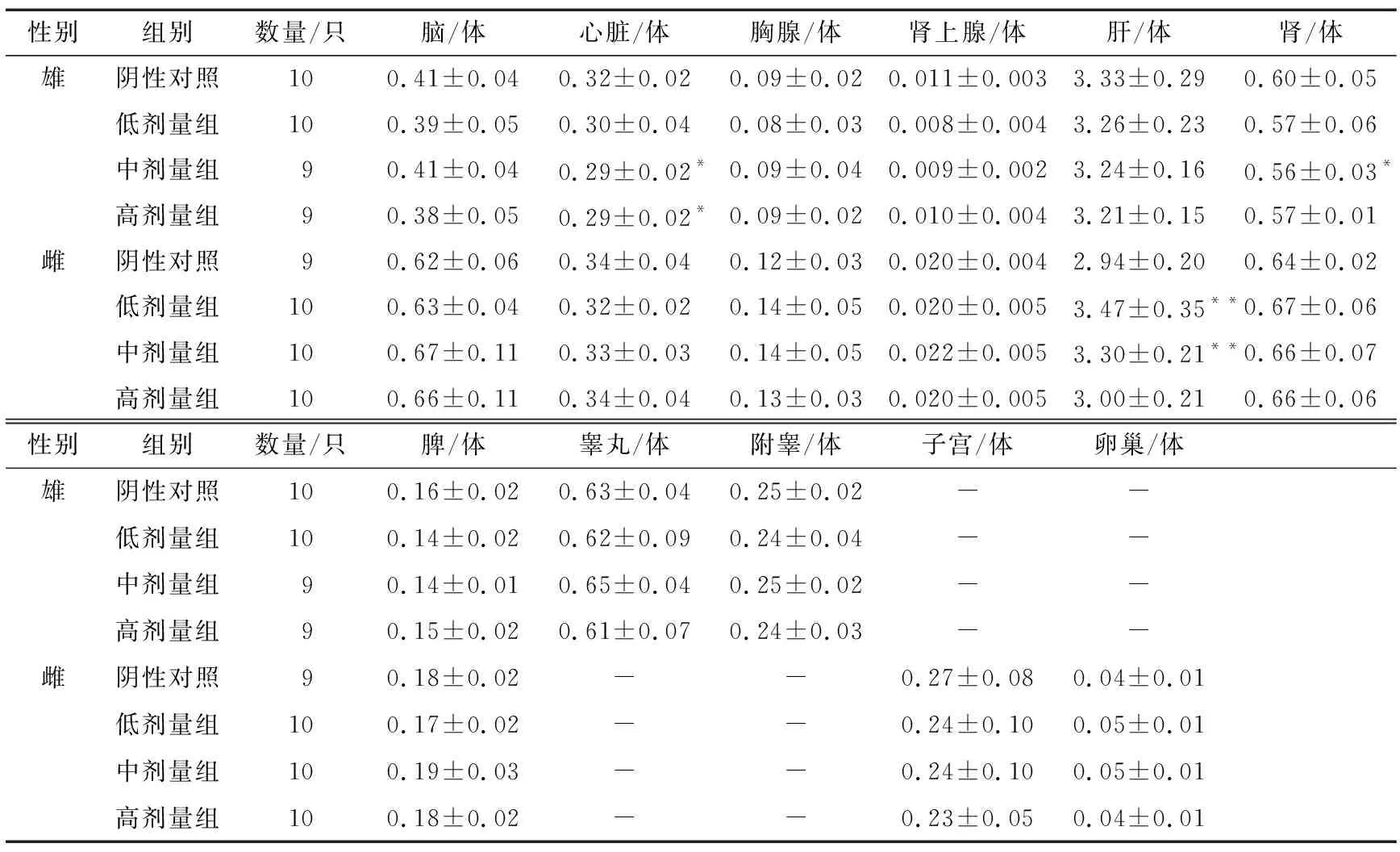
表6 安赛蜜对大鼠脏器系数的影响†
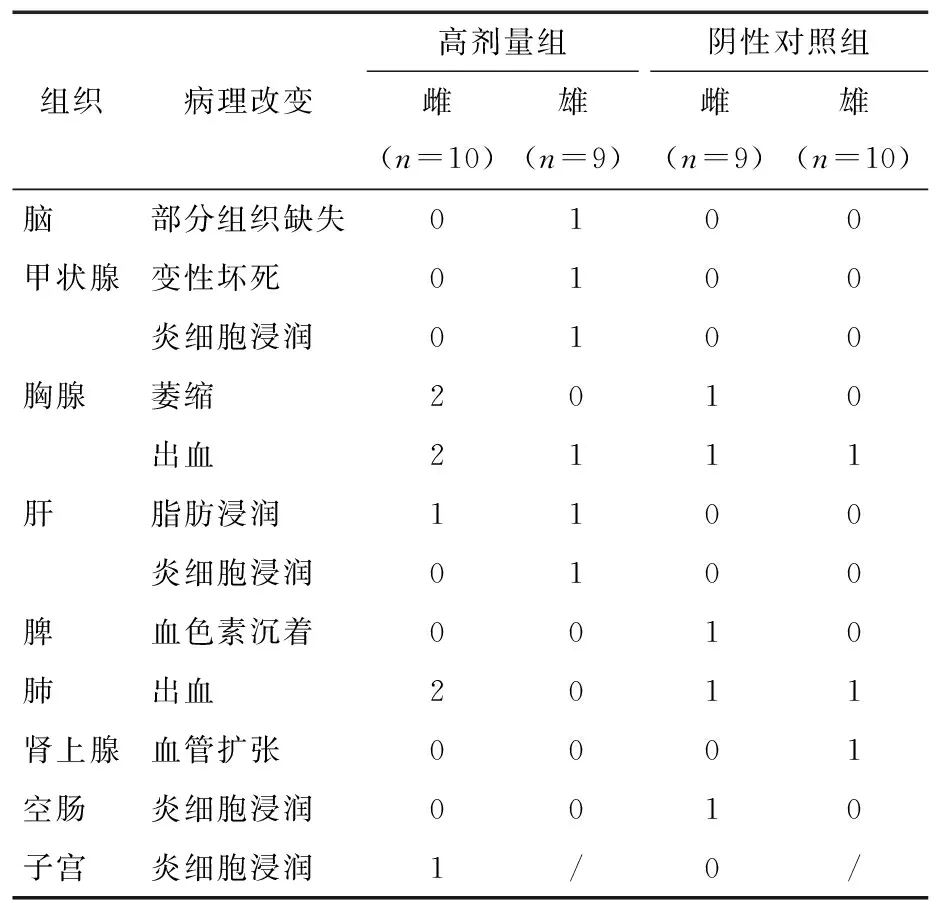
表7 大鼠脏器病理改变异常结果
3 结论
安赛蜜分别以4 500,1 500,500 mg/kg体重(相当于人体推荐摄入量的300,100,33.3倍)的剂量经口染毒90 d,雌、雄性大鼠的体重增长、摄食量、食物利用率均无明显异常;各剂量组的血液、血生化、尿常规指标、脏器重量、脏体比等虽出现了部分指标的异常改变,但无剂量—反应关系,并且异常指标均在参考范围之内,多考虑是偶发因素,无生物学意义;组织病理学检查中部分组织病理改变程度较轻且无组间差异,考虑与试验动物质量及动物自发性病变有关,与安赛蜜的影响无关;雌性大鼠的肝脏系数与对照组比较存在显著性差异,与文献[16]结果基本一致,安赛蜜对大鼠长期染毒导致体重及肝脏重量的变化,但组织病理学检查未发现异常改变,也未在高剂量组中得以验证,所以多考虑为单一组别的偶发现象。总体来说,在试验条件下以每天4 500 mg/kg体重剂量(相当于人体推荐摄入量的300倍),连续90 d对大鼠进行安赛蜜灌胃染毒,试验动物完全耐受,认为在推荐摄入量以内食用安赛蜜是安全的,大鼠90 d经口未观察到有害作用剂量值雌雄均为4 500 mg/kg体重。但是,安赛蜜作为一种新兴污染物存在于环境中对人类是否会产生影响仍是未来研究的重点探讨。
