新型鹅星状病毒ORF2蛋白纳米抗体的筛选及鉴定
2023-12-28王丹吉艳红梁世蕊杨洁朱启运
王丹,吉艳红,梁世蕊,杨洁,朱启运
新型鹅星状病毒ORF2蛋白纳米抗体的筛选及鉴定
王丹,吉艳红,梁世蕊,杨洁,朱启运
中国农业科学院兰州兽医研究所/动物疫病防控全国重点实验室,兰州 730046
【目的】由新型鹅星状病毒(novel goose astrovirus, nGAstV)引起的雏鹅痛风病对我国养鹅业造成了重大经济损失。通过构建nGAstV纳米抗体(nanobody, Nb)噬菌体展示文库,获得识别nGAstV ORF2蛋白的特异性Nb,可为建立nGAstV抗体检测方法及研究nGAstV ORF2蛋白结构和功能奠定基础。【方法】使用蔗糖密度梯度离心方法纯化在LMH细胞中增殖的nGAstV,RT-PCR鉴定nGAstV并通过细胞病变测定nGAstV滴度。用0.06%甲醛溶液灭活纯化的nGAstV作为免疫原,免疫两周岁羊驼。首次免疫时用灭活纯化的nGAstV与等量弗氏完全佐剂乳化后免疫,第2—5次免疫用灭活纯化的nGAstV与等量弗氏不完全佐剂乳化。每间隔两周免疫一次,每次免疫剂量均为50 μg。第5次免疫14 d后,通过间接ELISA方法测定羊驼血清中针对nGAstV的IgG抗体效价。待IgG抗体效价达到构建噬菌体抗体展示文库标准时,分离羊驼外周血淋巴细胞(peripheral blood lymphocyte, PBL),然后提取PBL总RNA将其反转录为cDNA,利用巢氏PCR方法扩增重链抗体重链可变区(variable domain of the heavy chain of heavy chain antibodies, VHH)基因,将其构建至pComb噬菌体载体并结合噬菌体展示技术构建nGAstV Nb噬菌体展示文库,计算该文库库容量并分析其多样性。nGAstV作为靶抗原,通过三轮富集淘选初步获得与nGAstV反应的重组噬菌体Nb阳性克隆,将其克隆至pcDNA3.1-Fc真核表达载体并进行测序分析,将测序成功且序列不同的质粒转染至HEK-293F细胞中表达,并通过聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定表达情况。以nGAstV为靶标抗原,利用间接ELISA方法和Western blot试验对表达成功的Nb进行特异性、反应活性验证,并以nGAstV ORF2蛋白为靶标抗原,利用间接ELISA方法对Nb进行亲和力验证,获得生物学活性较好的Nb。【结果】 RT-PCR结果显示,nGAstV增殖成功;Reed-Muench法分析nGAstV滴度达4.38 Log10TCID50/mL。羊驼经5次免疫nGAstV后,通过间接ELISA方法测得其血清中针对nGAstV的抗体效价达到1:64 000;利用巢氏PCR方法扩增出并成功构建库容量为3.8×108CFU/mL的nGAstV Nb噬菌体展示文库;遗传进化树分析显示,该噬菌体Nb库多样性良好。三轮富集淘选后,初步获得39株与nGAstV反应的重组噬菌体纳米抗体阳性克隆,其中有25株序列不同;SDS-PAGE鉴定结果显示,共有10株Nb在HEK-293F细胞中表达成功。通过ELISA、Western blot验证进一步获得8株与nGAstV ORF2蛋白特异性反应的Nb,且1株Nb生物学活性最好。【结论】首次筛选到与nGAstV ORF2蛋白特异性反应的Nb,为nGAstV的基础研究和检测方法提供材料。
新型鹅星状病毒;ORF2蛋白;纳米抗体;噬菌体展示技术
0 引言
【研究意义】星状病毒病是由星状病毒(astrovirus, AstV)引起的一种能感染哺乳动物和禽类的传染病,主要引起人、猪、牛等脑炎和胃肠炎[1-2]及禽类发育迟缓、肾炎、病毒性肝炎等症状[3],对人类健康和养殖业发展造成严重威胁。近年来,新型鹅星状病毒(novel goose astrovirus, nGAstV)成为危害我国养鹅业的重要病毒性传染病病原之一[4],感染后可导致3周龄内的雏鹅出现关节肿胀、腹泻及生长受限等临床症状,剖检可见肾脏肿胀、出血、关节及内脏器官尿酸盐沉积,病死率高达50%[5]。nGAstV引起的高致死性内脏痛风病已对我国部分地区商品雏鹅群造成巨大冲击,严重制约了养鹅业的发展。至今,nGAstV引致痛风病的防治不仅无商品化疫苗和临床药物,而且尚无市售商品化血清学检测试剂盒,缺乏有效的流行病学调查手段,常导致临床处置迟滞,造成经济损失不断扩大。1993年,HAMERS等首次报道了骆驼体内天然存在的一种新型抗体[6],该抗体缺失轻链、重链第一恒定区,被称为重链抗体(heavy chain antibody, HCAb)。研究发现,HCAb广泛存在于驼科动物体内,如骆驼、羊驼等[7]。此外,在一些软骨鱼类也发现了结构类似的HCAb,称为新抗原受体(new antigen receptor, NAR)[8]。通过克隆HCAb的重链可变区(variable domain of the heavy chain, VH)可以获得单域抗体,相对分子质量约15 kDa左右,因此又称为纳米抗体(nanobody, Nb)[9]。与常规抗体相比,Nb在驼科动物体内亲和成熟,对特异性靶抗原具有高亲和力,且在缺少轻链的情况下功能仍保持完整[10]。Nb因稳定、特异及易于改造等优点广泛应用于免疫诊断、靶向治疗及科学研究等众多领域[11-12]。Nb筛选多采用噬菌体展示技术,与常规抗体制备方法相比,该技术具有高通量、低成本、操作简单等优点[13-14]。目前,针对nGAstV Nb的相关研究尚未报道。【前人研究进展】 nGAstV于2016年在雏鹅病例中首次被发现,后被国际病毒分类委员会(The International Committee on Taxonomy of Viruses, ICTV)确定属于星状病毒科禽星状病毒属[15]。nGAstV基因组全长约7.0 kb,其结构包括两端的5′非编码区(UTR)和3′非编码区(UTR)、ORF1a,ORF1b和ORF2三个开放阅读框及多聚腺苷酸(Poly A)尾[16-17]。ORF1a编码非结构蛋白(non-structural protein, NSP),ORF1b编码病毒RNA依赖的RNA聚合酶(RNA dependent RNA polymerase, RdRp),二者存在的重叠区在RdRp的翻译中发挥作用[18]。ORF2阅读框编码的病毒衣壳蛋白,参与病毒的吸附和复制,可以刺激机体产生免疫应答[19]。因此,ORF2蛋白是理想的诊断靶标,孙敏等制备了nGAstV ORF2蛋白的单克隆抗体,建立的竞争ELISA检测方法虽然可用于nGAstV抗体的检测[20],但目前还未能开发出相应试剂盒。此外,研究nGAstV抗原表位是明确雏鹅痛风病致病机制、研发治疗药物和生物制品的基础,REN等制备的ORF2蛋白MAb鉴定出了部分抗原表位区域[21-22]。本研究将制备特异性识别ORF2蛋白的Nb,为进一步发现ORF2蛋白的隐匿抗原表位和研制nGAstV ORF2蛋白相关抗体药物及研发相应诊断试剂盒奠定基础。【本研究切入点】以nGAstV为研究对象,利用噬菌体展示技术构建nGAstV Nb噬菌体展示文库,筛选生物学活性较好的nGAstV Nb。【拟解决的关键问题】筛选出nGAstV Nb并鉴定其生物学活性,为后续nGAstV的研究和应用提供材料支持。
1 材料与方法
主要试验工作于2022年2—12月在中国农业科学院兰州兽医研究所动物疫病防控全国重点实验室完成。
1.1 质粒、细胞、病毒和实验动物
pComb噬菌体载体、pcDNA3.1真核表达载体、新型鹅星状病毒(nGAstV)、鸡肝癌细胞(LMH)和人胚胎肾细胞293F(HEK-293F)由中国农业科学院兰州兽医研究所动物病毒分子生态学创新团队保存;BL21和DH5α感受态细胞购于大连宝生物工程有限公司;ss320感受态细胞、M13辅助噬菌体购自NEB公司;羊驼购于甘肃省武威市。
1.2 主要试剂
高保真DNA聚合酶、限制性内切酶购于美国NEB公司;DNA Marker、预染蛋白质分子量标准和dNTP购于TaKaRa公司;琼脂糖购于Invitrogen公司;反转录酶M-MLV购于Promega公司;Protein A纯化介质购于伯格隆生物公司;RNA提取试剂盒、DNA胶回收试剂盒、质粒提取试剂盒、DNA纯化试剂盒购于OMEGA公司;外周血淋巴细胞分离试剂盒购于索莱宝公司;HRP标记的鼠抗M13抗体、HRP标记的羊抗人IgG-Fc抗体购于北京义翘神州科技股份有限公司;DMEM、293F培养基、胎牛血清和胰酶(0.05% EDTA)购于GIBCO公司。
1.3 nGAstV增殖及TCID50测定
使用含10%胎牛血清的DMEM培养LMH细胞,待细胞长至80%时,接种nGAstV培养3—5 d后,8 000 r/min离心10 min收集病毒上清。0.22 μm滤器无菌过滤病毒上清,与PEG8000溶液2﹕1混合,冰上静置1 h。静置后,将混合液2 000×,离心2 h,用适量PBS溶解沉淀。过滤除菌20%、30%、50%的蔗糖溶液,将重悬的病毒进行蔗糖密度梯度离心,并取部分病毒进行PCR鉴定,引物信息见表1。将LMH细胞接种于96孔细胞板,待细胞长至80%时,nGAstV按10-1—10-8进行倍比稀释后加入LMH细胞,每个稀释度做5个重复,每孔100 μL,感染72 h后观察细胞病变,计算TCID50。
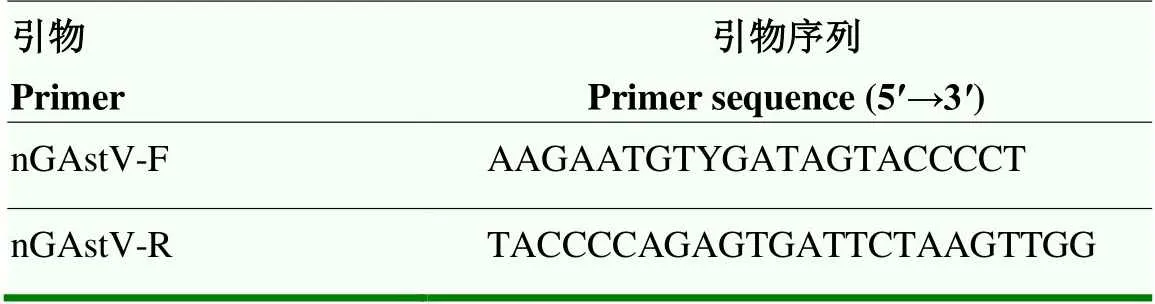
表1 鉴定引物
1.4 羊驼免疫及抗体效价检测
参考张春玲等[23]的方法,使用0.06%甲醛溶液灭活纯化的nGAstV作为免疫原,免疫两周岁雄性羊驼。首次免疫羊驼时,将50 μg灭活纯化的nGAstV与等量弗氏完全佐剂乳化。第2—5次免疫时,将50 μg灭活纯化的nGAstV与等量的弗氏不完全佐剂乳化。免疫方式均采取颈部皮下多点注射,免疫间隔为14 d。第五次免疫14 d后采血,分离血清作为检测抗体,纯化的nGAstV 100 ng/孔包被ELISA板,HRP标记的Goat Anti-Alpaca IgG作为酶标二抗,采用间接ELISA方法测定羊驼血清中nGAstV的抗体效价,通过阳性OD450nm值/阴性OD450nm值≥2.1(P/N≥2.1)判读为阳性。当抗体效价高于1﹕64 000,符合建库标准。
1.5 M13噬菌体抗体库构建及多样性测定
分离羊驼外周血淋巴细胞(peripheral blood lymphocyte, PBL),提取PBL总RNA将其反转录为cDNA,采用巢氏PCR方法扩增片段,引物信息见表2;将与pComb噬菌体载体通过同源重组连接,电转化至SS320感受态细胞,转入SOC培养基,220 r/min,37℃培养1 h,取部分培养物滴涂Amp-Kan平板,挑取12个单克隆进行PCR鉴定,引物信息见表3;将阳性克隆进行测序,分析抗体库的多样性并计算抗体库容量;剩余培养物转入Amp-Kan培养基扩大培养,使用PEG/NaCl浓缩获得原始抗体文库。
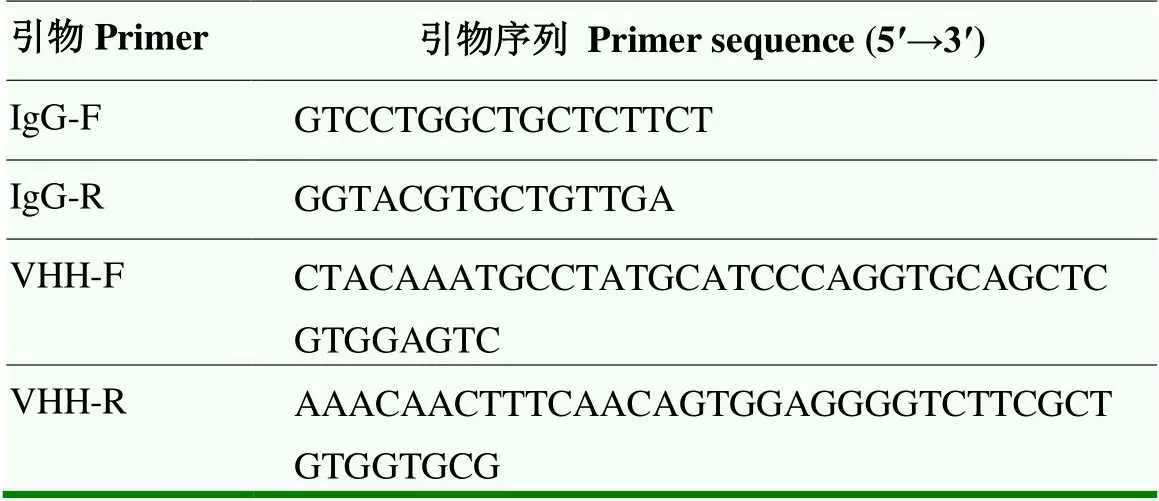
表2 巢式PCR引物

表3 鉴定引物
1.6 nGAstV特异性重组噬菌体的富集与淘选
用灭活纯化的nGAstV 1 μg/孔包被ELISA板,设置1%聚乙烯醇(1% PVA)为无抗原对照,每孔加入100 μL原始抗体库后室温孵育2 h,弃液;加入0.1 mol·L-1HCl洗脱5 min,等体积Tris-HCl中和;将洗脱液加入对数期NEB5aF’细菌中,200 r/min,37℃培养1 h,M13辅助噬菌体拯救1 h;取适量菌液10倍稀释并滴定平板;剩余菌液过夜培养,浓缩后获得第一轮噬菌体Nb展示文库;重复上述操作,共进行三轮淘选。选用第三轮噬菌体Nb库稀释涂板,37℃过夜培养,随机挑取90个单克隆,接种于Amp-Kan培养基,200 r/min,37℃过夜培养。将过夜培养菌液4 000×离心10 min,收集上清作为检测一抗,灭活纯化的nGAstV作为酶标抗原,100 ng/孔包被ELISA板,HRP标记的鼠抗M13抗体(1﹕6 000稀释)为酶标二抗,进行间接ELISA试验,通过阳性OD450nm值/阴性OD450nm值≥2.1(P/N≥2.1)判读为阳性,可以初步确定与nGAstV反应的阳性克隆。
1.7 重组Nb序列分析及表达
将上述反应为阳性的菌液进行PCR扩增,引物信息见表4,连接至pcDNA3.1-Fc真核表达载体,转化DH5α感受态细胞,涂布于Amp平板,随机挑取1—2个单菌落,提取质粒测序并分析序列。将序列不同的质粒转染至HEK-293F细胞表达,利用Protein A纯化目的抗体,进行SDS-PAGE电泳,分析结果。

表4 扩增引物
1.8 重组Nb的反应活性鉴定
用nGAstV包被酶标板,同时设置LMH细胞对照及空白对照,37℃孵育2 h,PBST洗涤3次;5%脱脂乳37℃封闭1 h,分别加入纯化的Nb(1﹕1 000稀释),37℃孵育2 h;加入HRP标记的羊抗人IgG-Fc(1﹕8 000稀释)37℃孵育0.5 h,PBST洗涤3次;加入TMB显色液,反应10 min;加入终止液后进行OD50nm值测定,通过阳性OD450nm值/阴性OD50nm值≥2.1(P/N≥2.1),判读为阳性,确定与nGAstV反应的Nb。
1.9 重组Nb的特异性鉴定
将nGAstV及nGAstV ORF2蛋白进行SDS-PAGE分析,分别设置灭活新城疫病毒(NDV)、灭活H9N2亚型禽流感病毒(H9N2 AIV)和NDV F蛋白为阴性对照,转膜结束后,用5%脱脂乳室温封闭1 h,将上述纯化的Nb(1﹕200稀释)作为检测一抗,HRP标记的羊抗人IgG-Fc(1﹕8 000稀释)作为酶标二抗,进行蛋白免疫印迹试验。
1.10 重组Nb的亲和力鉴定
用nGAstV ORF2蛋白包被酶标板,4℃孵育12 h,PBST洗涤3次;5%脱脂乳37℃封闭1 h,加入梯度稀释后的Nb,37℃反应2 h;加入HRP标记的羊抗人IgG-Fc(1﹕8 000稀释)37℃孵育0.5 h;PBST洗涤3次后,加入TMB显色液,反应10 min;加入终止液后进行OD450nm值测定,通过EC50Calculator软件计算EC50。
2 结果
2.1 nGAstV 纯化及增殖
提取纯化后病毒RNA,反转录为cDNA,以此为模板进行nGAstV PCR鉴定,目的条带约为1 000 bp,与预期目的片段大小一致(图1-A),证明nGAstV纯化成功;用nGAstV感染LMH细胞,72 h后观察到LMH细胞出现明显病变(图1-B),证明nGAstV增殖成功;根据Reed-Muench法计算TCID50数值:4.38 Log10TCID50/mL。

A:nGAstV PCR鉴定(M:DL2000 Marker;1:nGAstV);B:nGAstV感染LMH细胞病变结果
2.2 羊驼免疫血清抗体效价检测
使用间接ELISA检测方法,测得第五次免疫后羊驼血清中针对nGAstV产生的抗体效价达到1﹕64 000(图2),可以进行nGAstV Nb噬菌体展示文库的构建。
2.3 M13噬菌体抗体库构建鉴定
提取PBL总RNA反转录为cDNA,以此作为模板,第一轮PCR扩增得到约600 bp目的条带(图3-A),胶回收进行第二轮PCR扩增得到约400 bp目的条带(图3-B);将VHH基因克隆至pComb噬菌体载体获得原始抗体库,挑取12个单克隆PCR鉴定,获得约500 bp目的条带(图3-C),即连接效率为100%,原始抗体库库容量为3.8×108CFU/mL;进化树分析显示(图3-D),8个VHH序列均不相同,表明构建的Nb噬菌体展示文库多样性较好,可以进行下一步淘选。
2.4 特异性重组噬菌体的富集淘选
以nGAstV为靶标抗原进行3轮淘选,与无抗原对照相比(图4-A),在10-4处特异性重组噬菌体明显富集;随机挑取90个单克隆,培养后进行ELISA检测,设置无抗原对照,根据P/N≥2.1判读为阳性,共获得39个阳性克隆(图4-B)。

图2 羊驼血清抗体效价测定

A:第一轮PCR的结果(M:DNA分子质量标准;1:IgG);B:第二轮PCR的结果(M:DNA分子质量标准;1:VHH);C:PCR鉴定文库连接效率(M:DNA分子质量标准;1—12:原库质粒);D:进化树分析

A:nGAstV特异性噬菌体淘选;B:nGAstV特异性噬菌体富集 A: Panning of nGAstV specific phage; B: Enrichment of nGAstV specific phage
2.5 重组Nb序列分析及表达
选取2.4中P/N≥2.1的阳性单克隆进行菌液PCR,胶回收PCR产物克隆至pcDNA.3.1-Fc真核表达载体。每个平板随机挑取2—3个单克隆,共提取40个质粒进行测序。利用DNAMAN软件进行分析,结果表明25株Nb的序列不同(图5-A);将25株Nb进行表达,经SDS-PAGE分析,与预期条带大小一致,有10株Nb为可溶性表达(图5-B),分别为Nb1、Nb8、Nb12、Nb30、Nb31、Nb33、Nb34、Nb36、Nb38和Nb40。
2.6 重组Nb的反应活性检测
nGAstV包被ELISA板,同时设置LMH细胞对照及空白对照,加入纯化的10株Nb进行ELISA检测。结果如图6所示:根据P/N≥2.1,确定Nb1、Nb8、Nb12、Nb30、Nb31、Nb33、Nb36和Nb38共8株Nb与nGAstV特异性反应,其中Nb12与Nb30反应活性最好。
2.7 重组Nb特异性检测
纯化nGAstV,以灭活NDV、灭活H9N2 AIV阴性对照,与纯化的8株Nb作为一抗进行孵育,Western blot检测结果表明,8株Nb均与nGAstV发生特异性反应(图7-A);用8株Nb作为一抗与nGAstV ORF2蛋白孵育,以NDV F蛋白为阴性对照,通过Western blot检测后发现,8株Nb均与nGAstV ORF2蛋白发生特异性反应,与阴性对照不反应(图7-B)。
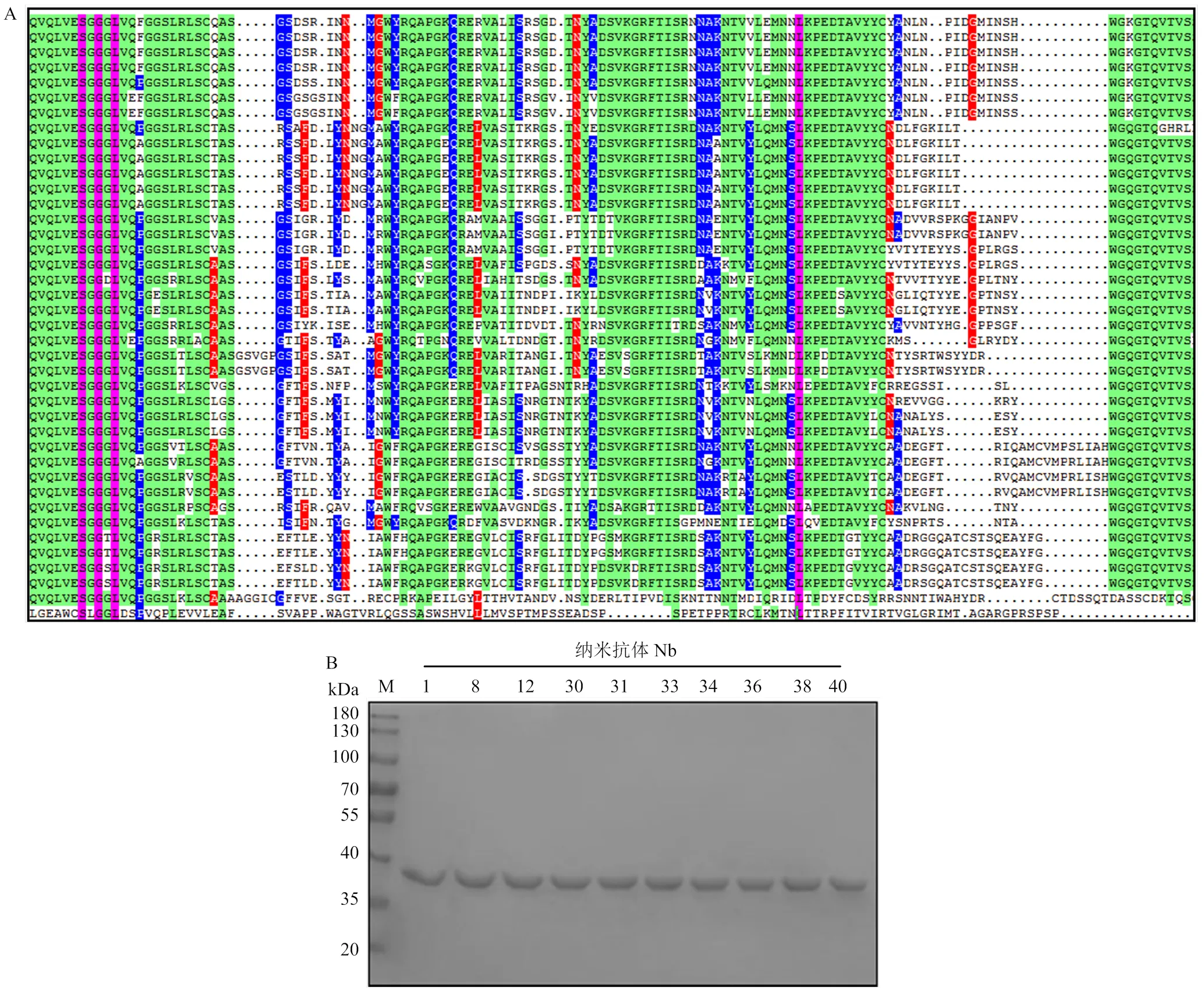
A:Nb氨基酸序列分析;B:Nb表达结果(M:蛋白质分子质量标准;2-11泳道:筛选的10株纳米抗体,数字为纳米抗体编号)

图6 ELISA验证重组Nb反应活性
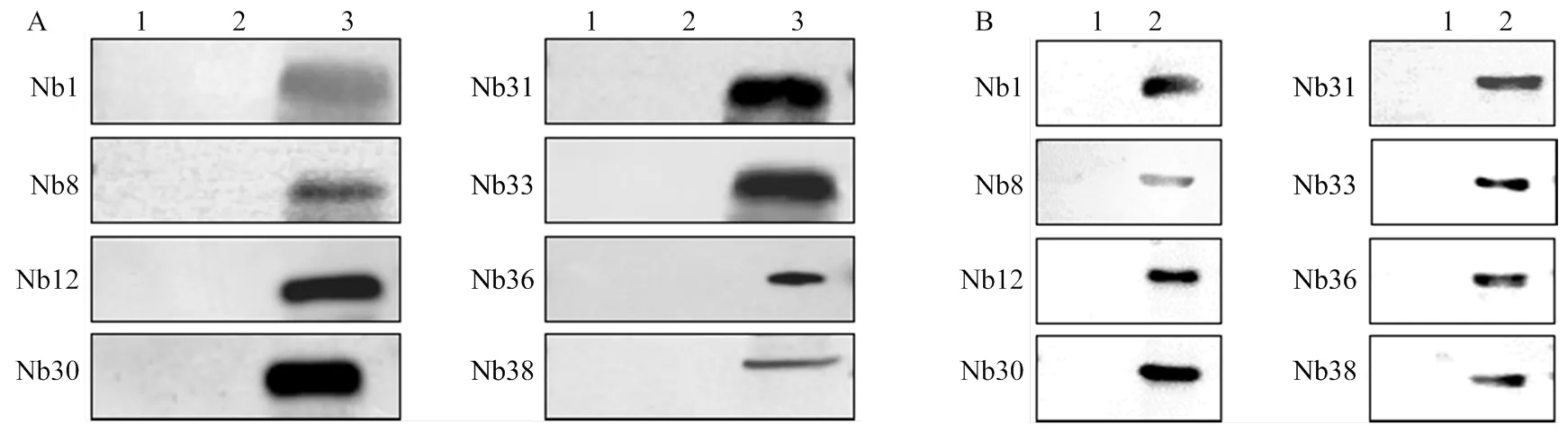
A:蛋白免疫印迹检测(1:NDV;2:H9N2 AIV;3:nGAstV)B:蛋白免疫印迹检测(1:NDV F蛋白;2:nGAstV ORF2蛋白)
2.8 重组Nb的亲和力检测
利用ELISA方法验证反应活性较好的8株Nb与nGAstV ORF2蛋白的亲和力,计算EC50值。结果表明,Nb12和Nb30亲和力最好(表5)。

表5 重组Nb亲和力鉴定
3 讨论
3.1 高效血清学检测技术是nGAstV病早期诊断的重要手段
近年来nGAstV在我国多省份蔓延流行呈现上升趋势,且存在不断变异和跨种传播的现象[24-26]。目前,不仅缺乏针对nGAstV有效的流行病学调查手段,且nGAstV的致病机制和免疫反应尚不明晰,欠缺有效防控nGAstV感染的生物制品。nGAstV常用检测方法包括电镜观察、病毒分离、分子生物学、血清学检测等[27-28],但电镜观察主观性较强、病毒分离培养困难、分子生物学检测对操作者专业素养要求较高,常导致现地应用困难;与之相比,血清学检测具有操作简单,灵敏度高和特异性强等优点,可以广泛应用于临床实践中。但目前缺乏基于nGAstV抗体的血清学检测方法的检测试剂盒。因此,有必要制备一种抗体用于nGAstV的流行病学调查和临床检测[29-30]。
3.2 噬菌体展示技术是筛选Nb的适宜方法
本研究利用噬菌体展示技术成功构建了库容量为3.8×108CFU/mL的nGAstV Nb噬菌体展示文库。但是,库容量大的文库容易筛选出相同序列的Nb,为了保证获得的Nb序列不同,笔者在前期筛选过程中有目的地获取了多个克隆进行测序分析。噬菌体筛选包括固相筛选、磁珠捕获物液态筛选和固液相结合筛选等方法[31]。由于固相筛选具有简单、快速等优点,所以本研究以nGAstV作为固相抗原进行首轮筛选时,给予了较小的筛选压力,避免了特异性噬菌体克隆丢失;在第二、三轮筛选过程中,通过逐步施加筛选压力,最终获得了Nb阳性克隆。哺乳动物细胞是抗体表达使用最为广泛的表达系统,能够有效促进正确的翻译后修饰。我们选用HEK-293F细胞成功表达了10株Nb,但存在生产成本高的缺点,为了克服这一问题,后续将利用酵母表达系统等方法进行Nb的表达。
3.3 nGAstV ORF2蛋白Nb具有良好的应用潜力
AstV ORF2基因是AstV种属划分的依据[16],通过分析该病毒ORF2基因序列,发现中国农业科学院兰州兽医研究所动物疫病防控全国重点实验室分离的nGAstV毒株与其他种属AstV代表毒株之间核苷酸和氨基酸同源性较低(未发表数据),因此羊驼在免疫纯化后的nGAstV可产生针对该毒株的特异性IgG抗体。nGAstV编码的ORF2蛋白是病毒的主要结构蛋白,包含病毒的主要抗原决定簇,具有良好的免疫原性和反应原性。研究结果显示,以nGAstV ORF2蛋白为靶标抗原,通过Western blot和ELISA试验获得8株与nGAstV ORF2蛋白反应活性较好的Nb,包括Nb12、Nb30和Nb31等。其中,具有高亲和力的Nb30可用于诊断试剂的研发。由于Nb具备易于改造的特点,后续可对Nb进行改造进一步提高其亲和力,为开发基于nGAstV ORF2蛋白Nb的诊断试剂提供生物材料[12]。在nGAstV的研究中,对ORF2阅读框编码结构蛋白的性质、数量和结构尚未确定。而在人星状病毒的研究中,一般认为ORF2主要编码3种衣壳蛋白,包括VP34、VP29和VP26蛋白;针对这些蛋白的抗体可以阻断病毒感染,提示星状病毒ORF2结构域可能携带中和表位[32-33]。为进一步了解nGAstV的抗原结构和免疫反应,本研究制备的针对nGAstV ORF2蛋白的Nb,不仅可以为检测临床样本中的nGAstV提供材料,而且因Nb的CDR3环凸起可能结合常规抗体无法结合的凹抗原位点,从而寻找隐藏的中和抗原表位,可更好地实现Nb中和活性作用机制的探究[34]。因此,后续将对获得的Nb进行深入地研究,以期为nGAstV引起的雏鹅痛风病提供新的解决方案。
4 结论
本研究利用噬菌体展示技术成功构建了新型鹅星状病毒纳米抗体噬菌体展示文库,获得了1株高亲和力的Nb30。该纳米抗体的获得不仅为ORF2蛋白结构和功能的研究奠定了基础,同时也为下一步研制血清学快速诊断试剂提供了材料。
[1] CORTEZ V, MELIOPOULOS V A, KARLSSON E A, HARGEST V, JOHNSON C, SCHULTZ-CHERRY S. Astrovirus biology and pathogenesis. Annual Review of Virology, 2017, 4(1): 327-348.
[2] REUTER G, PANKOVICS P, BOROS Á. Identification of a novel astrovirus in a domestic pig in Hungary. Archives of Virology, 2011, 156(1): 125-128.
[3] ZHANG F Y, LI Y, JIANG W M, YU X H, ZHUANG Q Y, WANG S C, YUAN L P, WANG K C, SUN S H, LIU H L. Surveillance and genetic diversity analysis of avian astrovirus in China. PLoS One, 2022, 17(2): e0264308.
[4] LIU C G, SUN M H, LIAO M. A review of emerging goose astrovirus causing gout. BioMed Research International, 2022, 2022: 1635373.
[5] YANG J, TIAN J J, TANG Y, DIAO Y X. Isolation and genomic characterization of gosling gout caused by a novel goose astrovirus. Transboundary and Emerging Diseases, 2018, 65(6): 1689-1696.
[6] HAMERS-CASTERMAN C, ATARHOUCH T, MUYLDERMANS S, ROBINSON G, HAMMERS C, SONGA E B, BENDAHMAN N, HAMMERS R. Naturally occurring antibodies devoid of light chains. Nature, 1993, 363(6428): 446-448.
[7] LIU Y X, YI L, LI Y X, WANG Z. Characterization of heavy-chain antibody gene repertoires in Bactrian camels. Journal of Genetics and Genomics, 2023, 50(1): 38-45.
[8] ROUX K H, GREENBERG A S, GREENE L, STRELETS L, AVILA D, MCKINNEY E C, FLAJNIK M F. Structural analysis of the nurse shark (new) antigen receptor (NAR): molecular convergence of NAR and unusual mammalian immunoglobulins. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(20): 11804-11809.
[9] TANG H P, GAO Y, HAN J Y. Application progress of the single domain antibody in medicine. International Journal of Molecular Sciences, 2023, 24(4): 4176.
[10] MUYLDERMANS S. Nanobodies: natural single-domain antibodies. Annual Review of Biochemistry, 2013, 82: 775-797.
[11] DE MEYER T, MUYLDERMANS S, DEPICKER A. Nanobody- based products as research and diagnostic tools. Trends in Biotechnology, 2014, 32(5): 263-270.
[12] MEI Y X, CHEN Y Z, SIVACCUMAR J P, AN Z Q, XIA N S, LUO W X. Research progress and applications of nanobody in human infectious diseases. Frontiers in Pharmacology, 2022, 13: 963978.
[13] LI Q L, ZHANG F Q, LU Y, HU H, WANG J, GUO C, DENG Q, LIAO C H, WU Q, HU T S, CHEN Z L, LU J H. Highly potent multivalent VHH antibodies against Chikungunya isolated from an alpaca naïve phage display library. Journal of Nanobiotechnology, 2022, 20(1): 231.
[14] BANNAS P, HAMBACH J, KOCH-NOLTE F. Nanobodies and nanobody-based human heavy chain antibodies As antitumor therapeutics. Frontiers in Immunology, 2017, 8: 1603.
[15] ZHU Q H, SUN D B. Goose astrovirus in China: a comprehensive review. Viruses, 2022, 14(8): 1759.
[16] 姚鑫炎, 杨惠湖, 李文俊, 曾繁聪, 黄淑坚, 车艺俊, 张雪莲. 鹅星状病毒病原学、流行病学及宿主免疫应答的研究进展. 中国家禽, 2022, 44(6): 107-113.
YAO X Y, YANG H H, LI W J, ZENG F C, HUANG S J, CHE Y J, ZHANG X L. Research progress on etiology, epidemiology and host immune response of goose astrovirus. China Poultry, 2022, 44(6): 107-113. (in Chinese)
[17] XU L H, JIANG B W, CHENG Y, HE Y, WU Z, WANG M S, JIA R Y, ZHU D K, LIU M F, ZHAO X X, YANG Q, WU Y, ZHANG S Q, HUANG J, MAO S, OU X M, GAO Q, SUN D, CHENG A C, CHEN S. Infection and innate immune mechanism of goose astrovirus. Frontiers in Microbiology, 2023, 14: 1121763.
[18] LI L L, SUN M H, ZHANG Y, LIAO M. A review of the emerging poultry visceral gout disease linked to avian astrovirus infection. International Journal of Molecular Sciences, 2022, 23(18): 10429.
[19] YKEMA M, TAO Y J. Structural insights into the human astrovirus capsid. Viruses, 2021, 13(5): 821.
[20] 孙敏. 新型鹅星状病毒的分离鉴定及其抗体竞争ELISA检测方法的建立[D]. 泰安: 山东农业大学, 2021.
SUN M. Isolation and identification of a novel goose astrovirus and establishment of competivive ELISA for antibody to goose astrovirus[D]. Taian: Shandong Agricultural University, 2021. (in Chinese)
[21] 魏天, 王成宇, 王凤杰, 李忠鹏, 张芳毓, 张守峰, 扈荣良, 吕礼良, 王永志. 非洲猪瘟病毒p30蛋白单克隆抗体制备及线性抗原表位定位. 中国农业科学, 2022, 55(15): 3062-3070.
WEI T, WANG C Y, WANG F J, LI Z P, ZHANG F Y, ZHANG S F, HU R L, LÜ L L, WANG Y Z. Preparation of monoclonal antibodies against the p30 protein of African swine fever virus and its mapping of linear epitopes. Scientia Agricultura Sinica, 2022, 55(15): 3062-3070. (in Chinese)
[22] REN D, LI T F, ZHANG W, ZHANG X Y, ZHANG X Y, XIE Q, ZHANG J J, SHAO H X, WAN Z M, QIN A J, YE J Q, GAO W. Identification of three novel B cell epitopes in ORF2 protein of the emerging goose astrovirus and their application. Applied Microbiology and Biotechnology, 2022, 106(2): 855-863.
[23] 张春玲, 赵本进, 曹昌健, 王瑞阳, 钱忠辉, 张俊平, 葛宇燕, 丁卫星. 三种不同灭活剂对猪细小病毒和猪圆环病毒的灭活效果研究. 上海农业学报, 2022, 38(6): 108-112.
ZHANG C L, ZHAO B J, CAO C J, WANG R Y, QIAN Z H, ZHANG J P, GE Y Y, DING W X. Inactivation effects of 3 different inactivators on porcine parvovirus and porcine circovirus. Acta Agriculturae Shanghai, 2022, 38(6): 108-112. (in Chinese)
[24] HE D L, WANG F F, ZHAO L M, JIANG X N, ZHANG S, WEI F, WU B R, WANG Y, DIAO Y X, TANG Y. Epidemiological investigation of infectious diseases in geese on mainland China during 2018-2021. Transboundary and Emerging Diseases, 2022, 69(6): 3419-3432.
[25] CHEN H, ZHANG B, YAN M, DIAO Y X, TANG Y. First report of a novel goose astrovirus outbreak in Cherry Valley ducklings in China. Transboundary and Emerging Diseases, 2020, 67(2): 1019-1024.
[26] FEI Z G, JIAO A Q, XU M L, WU J Q, WANG Y, YU J, LU L, JIANG W C, ZHU G W, SUN W B, CHEN Z, ZHANG Y Y, REN S F, LIU F, ZHANG L. Genetic diversity and evolution of goose astrovirus in the east of China. Transboundary and Emerging Diseases, 2022, 69(5): e2059-e2072.
[27] WANG Z, CHEN H Y, GAO S Y, SONG M Z, SHI Z C, PENG Z F, JIN Q Y, ZHAO L, QIAO H X, BIAN C Z, YANG X, ZHANG X Z, ZHAO J. Core antigenic advantage domain-based ELISA to detect antibody against novel goose astrovirus in breeding geese. Applied Microbiology and Biotechnology, 2022, 106(5/6): 2053-2062.
[28] DAI Y, LI M Z, HU X M, ZHAO R H, XIA L Z. Development and application of a multiplex PCR method for simultaneous detection of waterfowl parvovirus, duck enteritis virus and goose astrovirus. 3 Biotech, 2022, 12(9): 205.
[29] 赵丹丹, 杨国平, 刁有祥, 陈浩, 提金凤, 张璐, 张英, 李川川. 鸭瘟病毒单抗的制备及胶体金试纸条检测方法的建立. 中国农业科学, 2016, 49(14): 2796-2804.
ZHAO D D, YANG G P, DIAO Y X, CHEN H, TI J F, ZHANG L, ZHANG Y, LI C C. Preparation of monoclonal antibodies against DPV and development of colloidal gold strip for DPV detection. Scientia Agricultura Sinica, 2016, 49(14): 2796-2804. (in Chinese)
[30] 张冯禧, 肖琦, 朱家平, 尹力鸿, 赵霞玲, 严明帅, 徐晋花, 温立斌, 牛家强, 何孔旺. 非洲猪瘟病毒P30蛋白单克隆抗体制备、鉴定及阻断ELISA方法的建立. 中国农业科学, 2022, 55(16): 3256-3266.
ZHANG F X, XIAO Q, ZHU J P, YIN L H, ZHAO X L, YAN M S, XU J H, WEN L B, NIU J Q, HE K W. Preparation and identification of monoclonal antibodies to P30 protein and establishment of blocking ELISA to detecting antibodies against African swine fever virus. Scientia Agricultura Sinica, 2022, 55(16): 3256-3266. (in Chinese)
[31] ZHAO A Z, TOHIDKIA M R, SIEGEL D L, COUKOS G, OMIDI Y. Phage antibody display libraries: a powerful antibody discovery platform for immunotherapy. Critical Reviews in Biotechnology, 2016, 36(2): 276-289.
[32] BASS D M, UPADHYAYULA U. Characterization of human serotype 1 astrovirus-neutralizing epitopes. Journal of Virology, 1997, 71(11): 8666-8671.
[33] SANCHEZ-FAUQUIER A, CARRASCOSA A L, CARRASCOSA J L, OTERO A, GLASS R I, LOPEZ J A, SAN MARTIN C, MELERO J A. Characterization of a human astrovirus serotype 2 structural protein (VP26) that contains an epitope involved in virus neutralization. Virology, 1994, 201(2): 312-320.
[34] YAN J R, LI G H, HU Y H, OU W J, WAN Y K. Construction of a synthetic phage-displayed Nanobody library with CDR3 regions randomized by trinucleotide cassettes for diagnostic applications. Journal of Translational Medicine, 2014, 12: 343.
Screening and Identification of Nanobodies Against Novel Goose Astrovirus ORF2 Protein
WANG Dan, JI YanHong, LIANG ShiRui, YANG Jie, ZHU QiYun
State Key Laboratory for Animal Disease Control and Prevention/Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046
【Objective】 The gosling gout disease caused by the novel goose astrovirus (nGAstV) has brought significant economic losses to the goose industry. In this study, a nanobody phage display library for nGAstV was constructed to obtain the specific nanobodies (Nbs) that recognize the ORF2 protein of nGAstV, which could pave a way for the establishment of antibody-based detection methods and the study on the structure and function of nGAstV ORF2 protein. 【Method】 The proliferated nGAstV in LMH cells was purified by sucrose gradient centrifugation. nGAstV was identified by RT-PCR and the virus titer was determined by cytopathic effect. The two-year-old alpacas were immunized with purified nGAstV inactivated by 0.6% formaldehyde solution. For the first immunization, inactivated nGAstV was emulsified with an equal volume of Freund's complete adjuvant. For the second to fifth immunization, inactivated nGAstV was emulsified with an equal volume of Freund's incomplete adjuvant. The immunization was performed every two weeks with a dose of 50 μg. And the titer of IgG against nGAstV in alpaca serum collected at 14 days post the fifth immunization was determined by indirect ELISA. When the IgG titer reached the standard for constructing a library, the alpaca peripheral blood lymphocytes (PBL) were isolated. The total RNA of PBL was extracted and reverse-transcribed into cDNA. The variable region gene of the heavy chain was amplified by nested PCR. It was constructed into pComb phage vector and combined with phage display technology to construct nGAstV Nb phage display library. The capacity of the library was calculated and its diversity was analyzed. nGAstV was used as a target antigen for three rounds of enrichment and panning to obtain recombinant phage Nb positive clones. The positive clones were then cloned into pcDNA3.1-Fc eukaryotic expression vectors followed by sequencing analysis. The plasmids with different sequences were transfected into HEK-293F cells, and the expression level was identified by SDS-PAGE. The nGAstV was used as a target antigen to test the specificity and binding activity of the expressed Nb by ELISA and Western blot. The affinity of Nb was verified using indirect ELISA using nGAstV ORF2 protein as the target antigen and to screen Nbs with better biological activity. 【Result】 The results of RT-PCR showed that nGAstV was ready to be proliferated in LMH cells. The titer of nGAstV virus was 4.38 Log10TCID50/mL by calculated by the Reed-Muench method. The titer of nGAstV antibodies in alpaca serum reached over 1:64 000 after five immunizations. Thegene was amplified by nested PCR and a phage display library of nGAstV Nb with a library capacity of 3.8×108CFU/mL was successfully constructed. Phylogenetic tree analysis showed that the phage Nb library had an excellent diversity. 39 phage positive clones were acquired, which reacted with nGAstV post three rounds of enrichment and panning, including 25 Nbs with different sequences. The results of SDS-PAGE identification showed that a total of 10 Nbs were successfully expressed. Among them, 8 Nbs that reacted explicitly with nGAstV ORF2 protein were further confirmed by ELISA and western blot, among which one Nb showed the best biological activity. 【Conclusion】 In this study, Nbs that reacted specifically with nGAstV ORF2 protein were screened for the first time, which provided materials for basic research and developing nGAstV detection methods.
novel Goose Astrovirus; ORF2 Protein; nanobody; phage display

10.3864/j.issn.0578-1752.2023.24.013
2023-04-07;
2023-09-20
“十四五”国家重点研发计划(2022YFD1801003)、甘肃省科技重大专项计划(21ZD3NA001-13)、中央引导地方科技发展资金项目(23ZYQA295)、甘肃省陇原青年创新创业人才项目(202204190202)
王丹,E-mail:wangdan2622@163.com。通信作者朱启运,E-mail:zhuqiyun@caas.cn
(责任编辑 林鉴非)
