Lnc721靶向调控MMP9对牛骨骼肌卫星细胞增殖分化的影响
2023-12-28郭云鹏谭皓云郭宏符梦云李新胡德宝张林林丁向彬郭益文
郭云鹏,谭皓云,郭宏,符梦云,李新,胡德宝,张林林,丁向彬,郭益文
Lnc721靶向调控MMP9对牛骨骼肌卫星细胞增殖分化的影响
郭云鹏,谭皓云,郭宏,符梦云,李新,胡德宝,张林林,丁向彬,郭益文
天津农学院动物科学与动物医学学院/天津市农业动物繁育与健康养殖重点实验室,天津 300384
【背景】肌肉系统是维持动物体生存生长的重要基础,在哺乳动物肌肉中,将近一半的肌肉为骨骼肌,骨骼肌通过细胞繁育增殖到迁移融合,逐步形成了具有收缩能力的附着在骨骼上的成熟肌束。在机体内,骨骼肌不仅参与动物生长,也参与呼吸、代谢等生理活动。目前许多研究表明,lncRNA具有调控肌肉生长发育的作用,是影响骨骼肌功能、疾病的关键因子。但由于lncRNA作用机制复杂,方式多样,在物种间保守型很低,故不同种属动物 lncRNA之间作用关系不大,且大多数研究存在于人和小鼠等生物体内,而对牛肌肉生长影响的研究内容极少。近年来,人们发现lncRNA会与某些靶基因相互作用,进而调控肌肉细胞的发生过程。【目的】在前期采集不同月龄不同组织部位的牛肌肉,进行高通量测序,获得高表达差异的lncRNA,在对其调控成肌过程进行机制研究的基础上,探究长链非编码RNA lnc721与其靶基因MMP9的互作关系,以及MMP9对牛骨骼肌细胞生长发育的影响,以期为牛骨骼肌发育调控机制的研究提供参考。【方法】前期试验发现干扰lnc721对牛骨骼肌卫星细胞增殖具有正调控作用,且对其分化具有负调控作用。为了进一步探究lnc721 对牛肌肉发育的调控通路。分别在牛骨骼肌卫星细胞的分化期设置了3 个干扰lnc721牛骨骼肌卫星细胞组,与3个对照组采用 NGS 技术进行转录组测序,以期获得lnc721 差异靶基因,进一步研究lnc721 对牛骨骼肌发育的调控通路。根据筛选结果以及qRT-PCR的验证结果,试验选取MMP9作为lnc721的靶基因,并通过CatRAPID网站对lnc721与MMP9结合能力进行预测。设计并合成lnc721及MMP9干扰序列,转染至牛骨骼肌卫星细胞中,通过qRT-PCR、Western blot技术在mRNA水平与蛋白质水平分析下调lnc721对MMP9表达情况的影响。并且通过下调MMP9,采用qRT-PCR、Western blot与EdU技术检测增殖标志因子Ki67、Pax7以及分化标志因子MyHC与MyOG的表达情况,以反映下调MMP9对牛骨骼肌卫星细胞生长发育的影响。【结果】CatRAPID结果显示,lnc721与MMP9结合倾向为0.75,共有9个结合位点,二者存在互作结合。干扰lnc721之后,采用qRT-PCR分析,结果表明在细胞增殖期下调lnc721可以极显著抑制MMP9表达(<0.01),而在分化期则极显著促进MMP9的表达(<0.01),证实了MMP9为lnc721调控牛骨骼肌卫星细胞互作的靶基因。进而下调MMP9,检测对增殖期细胞的影响,发现Ki67的mRNA水平表达极显著上调(<0.01),Pax7蛋白表达量显著上调(<0.05),EdU观察下调MMP9后的阳性细胞率也明显升高。同样检测下调MMP9之后对细胞分化期的影响,发现下调MMP9后镜下观察发现下调MMP9会抑制肌管形成,同时MyHC的mRNA和蛋白表达量极显著下降(<0.01), MyoG蛋白表达量显著下调(<0.05)。【结论】lnc721与MMP9相互结合。在细胞增殖期干扰lnc721极显著抑制MMP9表达,而在分化期促进MMP9的表达,且干扰MMP9可促进细胞增殖并抑制分化。证明lnc721靶向MMP9调控牛骨骼肌卫星细胞的发育。
lnc721;MMP9;牛骨骼肌卫星细胞;增殖;分化
0 引言
【研究意义】牛骨骼肌作为人类优质蛋白质来源之一,其发生发育是一个极其精准且十分繁复的调控过程[1]。近年来有报道lncRNA会参与调控肌肉生长发育的过程,本文主要研究lncRNA对牛骨骼肌发生发育的调控机制,以期改善牛肉质量,为市场提供优质牛肉。【前人研究进展】Wang等[2]发现lncRNA Sirt1AS通过保护Sirt1 mRNA(细胞周期抑制剂的抑制因子)免受miR-34a介导的降解,促进成肌细胞增殖。同样的lncRNA Mir22hg在肌母细胞分化过程中显著上调,并在骨骼肌中高度表达。Li等[3]验证了Mir22hg在体外可以促进肌母细胞分化。并且在机制上发现Mir22hg可以抑制其靶基因组蛋白脱乙酰酶4(HDAC4),从而增加下游肌细胞增强因子2C(MEF2C),最终促进肌母细胞分化。【本研究切入点】本研究团队先前的研究已知,lnc721 的长度为 311 bp,在 NCBI 对比发现lnc721位于18号染色体,编号为OX344707.1,是一个未研究的 lncRNA。通过建立体外的lnc721干扰模型,并分析相关标志因子,发现干扰lnc721之后,肌肉细胞增殖期标志因子Pax7与Ki67表达水平均显著上调,而分化期标志因子MyHC与MyoG表达水平均极显著降低。证明lnc721参与调控了肌肉细胞的生长发育,但对其作用的分子机制并未探明。鉴于此,本研究选取前期研究的lnc721,通过抑制其表达后RNA测序获得差异基因,筛选出与肌肉发育相关的差异基因,随后根据剩余候选基因在测序结果中的差异表达倍数的高低,最终确定MMP9为最适基因。MMP9是MMPs家族明胶酶的成员中以被糖化的形式存在的酶[4-5]。基质金属蛋白酶(MMPs)是一个庞大的家族[6-7]。自1962年MMPs被发现开始[8],MMPs家族的28个成员[9]调控骨骼肌的功能被不断发掘出来。有研究表明,MMPs通过促进细胞迁移和融合,在成肌细胞融合中发挥着重要的作用[10]。MMP13[11]、MMP14[12]等MMPs家族的成员也被证实会影响成肌细胞的增殖分化。【拟解决的关键问题】本试验选取前期筛选的MMP9进行试验,在体外建立MMP9的干扰模型,观察MMP9对于骨骼肌卫星细胞增殖分化的影响,并探究MMP9与lnc721的互作结合关系,以期为研究MMP9在肌肉中发挥的作用提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞系 本研究所用的细胞样品为原代牛骨骼肌卫星细胞,细胞的分离培养冻存过程均由天津市农业动物繁育与健康养殖重点实验室完成。
1.1.2 试验时间及地点 试验地点为天津市农业动物繁育与健康养殖重点实验室,试验时间为2021年至2022年12月。
1.1.3 主要试剂及仪器 Magna RIP™ RNA-Binding Protein Immunoprecipitation Kit购自Sigma-Aldrich公司;PAGE凝胶快速制备试剂盒购自上海雅酶生物公司;MMP9抗体购自上海Abmart公司;Ribo™ ASO-lncRNA与Cell-Light™ EdU Apollo 567 In Vitro Kit均购自广州锐博生物科技有限公司;0.25%胰蛋白酶、DAPI溶液、4%多聚甲醛与PMSF均购自北京Solarbio公司;ECL超敏发光液购自上海生物工程有限公司;提RNA试剂盒购自北京艾德莱公司;Lipofectamine® 3000转染试剂购自Invitrogen公司;DMEM 高糖培养基购自Hyclone公司;Gel Extraction Kit、BCA 蛋白定量试剂盒与PBS 缓冲液均购自北京康为世纪公司;PrimeScript II 1st Strand cDNA Synthesis Kit购自大连Takara公司;正常山羊血清、鼠抗 MHC与鼠抗Pax7均购自DSHB公司;胎牛血清(FBS)、马血清(HS)与opti-MEM培养基均购自Gibco公司;鼠抗GAPDH购自北京中杉金桥公司;羊抗鼠二抗和羊抗兔二抗均购自北京中杉金桥公司;NE-PER Nuclear and CytoplasmicExtraction Reagents Kit与蛋白Marker均购自Thermo-Scientific公司;All-in-One™ qPCR Mix购自GeneCopoeia公司。
脱色摇床购自IKA公司;离心机购自Eppendorf公司;电泳仪购自PowerPac Basic公司;普通PCR仪与LightCycle 96 实时荧光定量PCR仪均购自Roche公司;二氧化碳培养箱购自SANYO公司;荧光显微镜购自Leica公司;高压灭菌锅购自TOMY公司;Nano-Drop ND 2000cSupectrophotometer购自Thermo公司;垂直电泳槽与ChemiDoc™ Imaging System均购自Bio-Rad公司;酶标仪购自Thermo- scientific公司。
1.2 方法
1.2.1 MMP9的生物信息学筛选 构建lnc721干扰模型文库,将原始数据进行分类统计,然后利用Cutadapt去除接头序列及低于Q20的Reads,并对碱基质量及含量进行评估。通过HTSeq将过滤后的序列与牛全基因组进行比对,统计比对到每一个基因上Read Count值,并最终还原出转录本序列,接下来与已知的mRNA和LncRNA转录本进行比较,通过FPKM将表达量进行标准化处理,进一步分析基因间表达水平相关性。使用DESeq软件包分析PCA主成分,通过绘制火山图进一步分析表达差异结果。根据测序结果以及qRT-PCR结果最终选取MMP9为候选差异基因,并采用catRAPID在线软件预测lnc721与MMP9的结合能力及结合位点。
1.2.2 培养基的制备 增殖培养基为10%胎牛血清(FBS)+10%DMEM,分化培养基为5%孕马血清+95%DMEM。
1.2.3 细胞培养及诱导分化 复苏原代细胞后使用增殖培养基进行原代、传代培养,待细胞密度适宜时进行转染处理,24 h后将培养基更换为分化培养基,每12 h观察一次,直至肌管形成。
1.2.4 细胞转染 待增殖期与分化期细胞密度约为60%时即可开始转染,分别将3个合成的干扰序列与对照转染至细胞当中,每组设置3个生物学重复,3条si-MMP9与一条lnc721干扰序列均由广州瑞博生物技术有限公司设计并合成:si-bta-MMP9_001(si-1):5′-AAGAAAUGCAAGCGGUUCC-3′;si-bta-MMP9_002(si-2):5′-AUGUCGUGCGUGCUAAUGG-3′;si-bta- MMP9_003(si-3):5′-UUGUCUUUGUCGAAGUUGG -3′;ASO-bta-lnc721_001:5′-TTTCAAGCAGCCAGAC AAAG-3′。
1.2.5 细胞总RNA的提取与cDNA的合成 分别收取增殖期(GM)与分化第一天(DM1)、第二天(DM2)、第三天(DM3)4个时期的细胞总RNA,利用HiFiScript cDNA Synthesis Kit进行cDNA第一链的合成,反应条件为 42 ℃ 15 min,84 ℃ 5 min。反应结束后,加无酶水稀释5倍,装入袋中标记批次及样品,置于-20 ℃冰箱保存备用,为后续使用qRT-PCR技术提供原材料。
1.2.6 qRT-PCR 采用qRT-PCR技术检测lnc721表达水平、MMP9表达水平得到干扰效率并检测增殖期和分化期标志因子(Pax7、Ki67与MyHC、MyoG)的mRNA表达水平。引物序列(表1)均在NCBI中查询得到,PCR反应体系共20 μL:2×All-in-One™ qPCR Mix 10.0 μL;Forward primer (F) 0.5 μL;Reverse primer (R) 0.5 μL;cDNA template 2.0 μL;RNase Free dH2O 7.0 μL,PCR程序:预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,共40个循环。结果采用2-△△Ct方法计算。
1.2.7 RIP 采用Magna RIP™ RNA-Binding Protein Immunoprecipitation Kit 进行RIP 试验。将细胞培养至分化第3天,加入预混的RIP裂解液冰上孵育5 min后-80 ℃保存。磁珠处理及免疫沉淀按照说明书操作后用Trizol法提RNA。
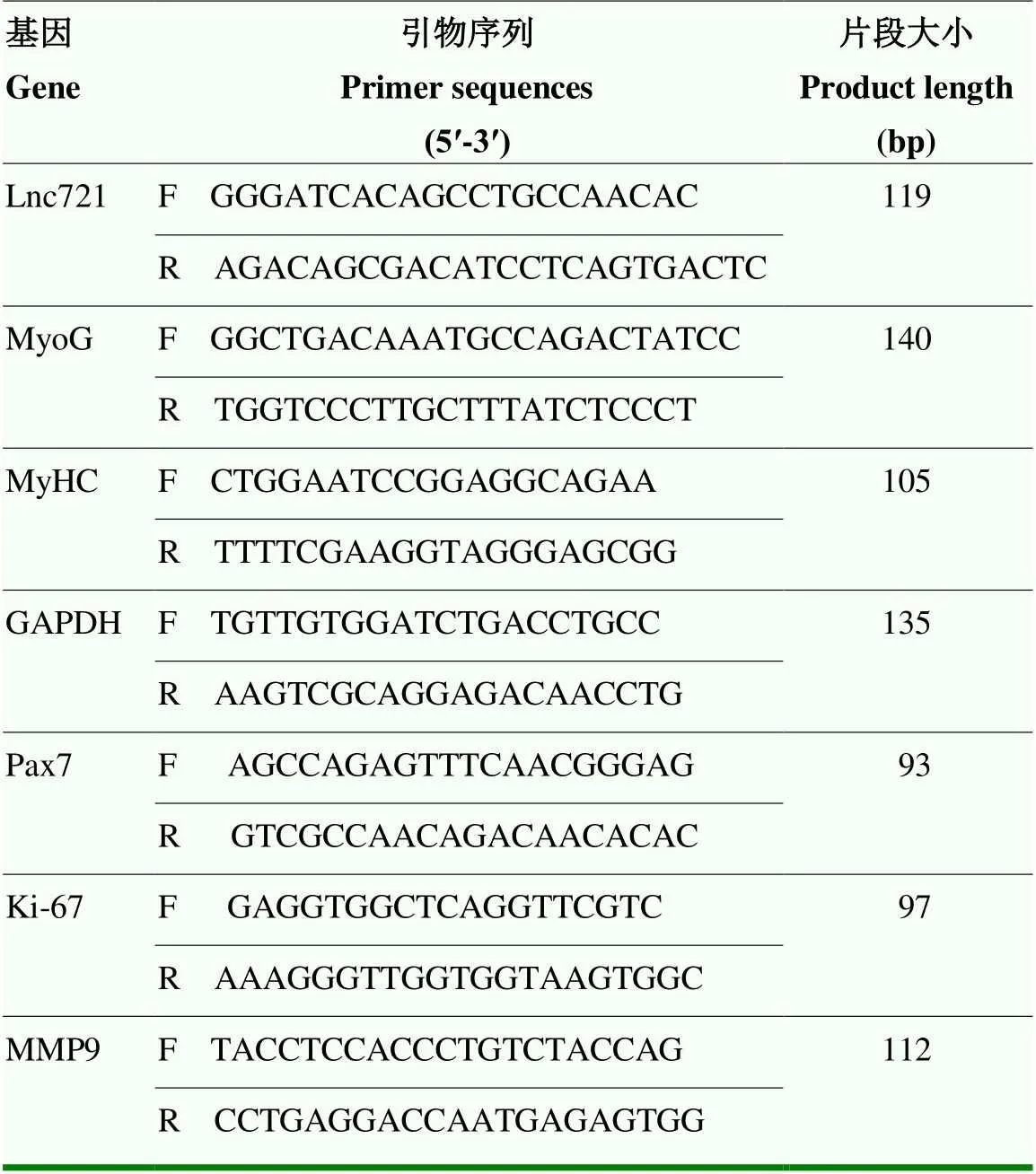
表1 qRT-PCR 引物序列
1.2.8 EdU检测 试验操作按照Cell-Light™ EdU Apollo 567 In Vitro Kit说明书进行,接种至96孔板的细胞分为试验组与空白组并设置3个生物学重复。在荧光显微镜下观察拍照并计数。
1.2.9 Western blotting检测 前期使用RIPA蛋白裂解液处理细胞,提取细胞蛋白后采用BCA法通过酶标仪测量蛋白浓度。采用Western blotting分别检测内参与增殖期标志因子(Pax7、Ki-67)和分化期标志因子(MyHC、MyoG)。SDS-PAGE参数设定为80V 30 min,120V 45 min;转膜参数设置为300mA 2 h。转膜后在适宜位置裁剪条带,于4℃冰箱中孵育一抗,12 h后使用TBST清洗3次后孵育相应二抗,1 h后使用TBST清洗3次,上机滴加ELC发光液曝光。
1.2.10 统计分析 采用SPSS 17.0软件进行统计分析。EdU阳性细胞率用卡方检验分析,qRT-PCR采用GAPDH 作为内参,2-ΔΔCt方法计算基因相对表达水平,t检验做差异显著性分析。<0.01表示差异极显著(**),<0.05表示差异显著(*),>0.05表示差异不显著(N.S.),Western blotting条带的量化采用Image J 软件分析。
2 结果
2.1 lnc721基因特点
CPC网站预测lnc721编码潜能为-1.33129(图1-A)。核质分离试验表明lnc721主要定位于细胞质内(图1-B)。并且通过qRT-PCR技术验证lnc721组织表达,发现其在3月龄胎牛、6月龄胎牛、9月龄胎牛及成年牛体内的各种组织中均有表达(图2),在6月龄胎牛组织中表达量相对较低(图2-B),而在9月龄初生牛犊肌肉组织内表达量较高(图2-C)。表明lnc721主要在9月龄胎牛肌肉组织中高表达。
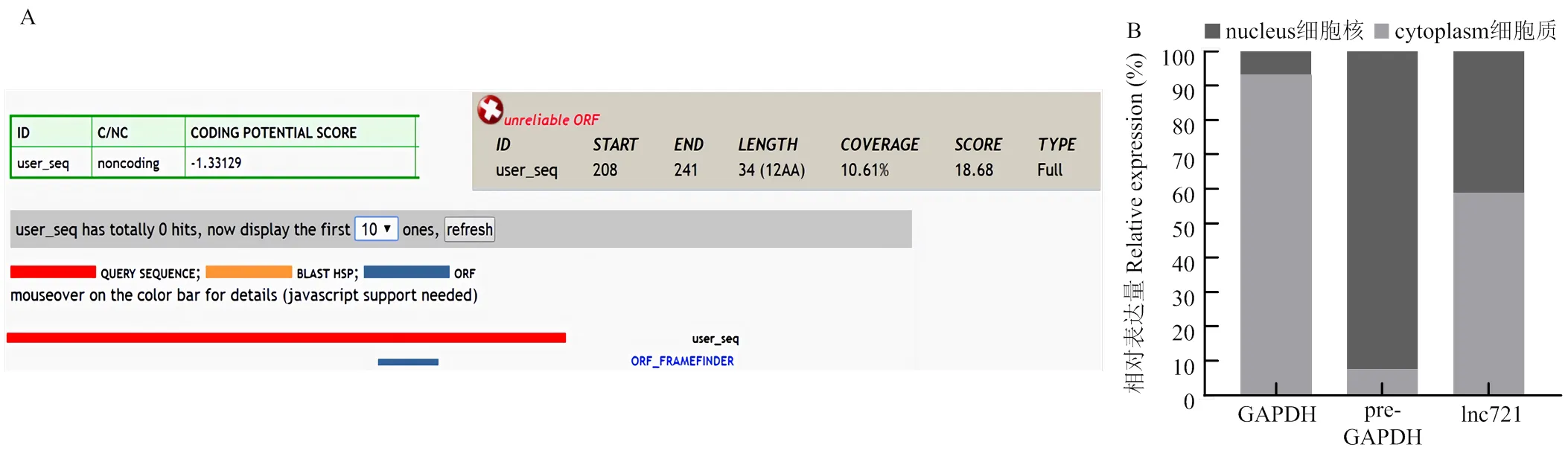
A:CPC 网站蛋白编码能力预测;B:lnc721 亚细胞定位检测 A: Prediction of CPC website protein coding ability; B: Subcellular localization detection of lnc721
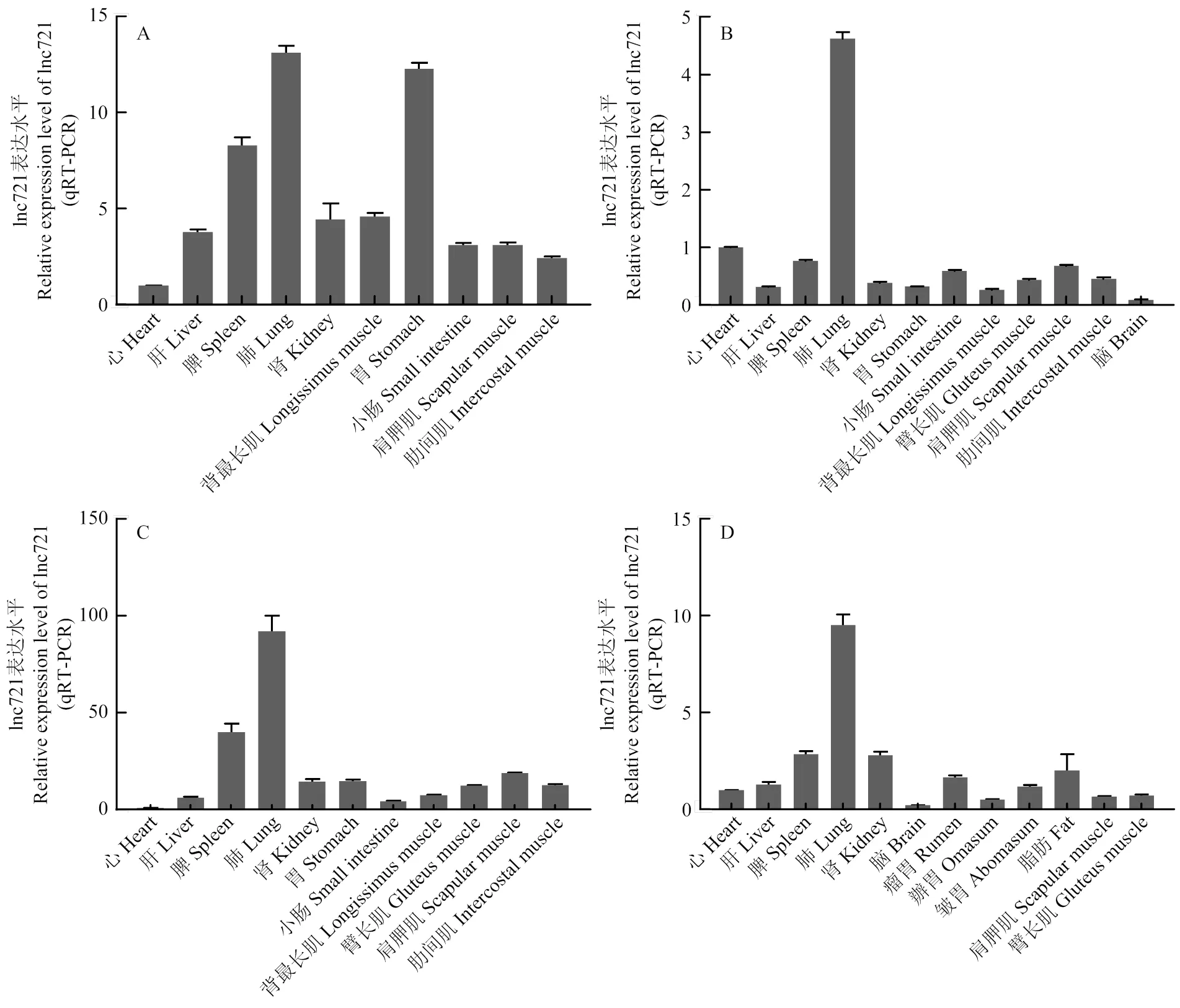
A:3月龄胎牛;B:6月龄胎牛;C:9月龄胎牛;D:成年牛 A: 3-month-old fetus; B: 6-month-old fetus; C: 9-month-old fetus; D: Adult cattle
2.2 lnc721下游靶基因的筛选
实验室前期已研究发现干扰lnc721对牛骨骼肌卫星细胞增殖具有正调控作用且对其分化具有负调控作用。为了进一步探究lnc721对牛肌肉发育的调控机制,通过对干扰lnc721后转录组测序结果进行过滤、质量评估、表达量以及表达差异分析,以|log2(Flodchange)| ≥1以及<0.05为筛选条件筛选出差异基因并作出火山图。采用NGS转录组测序,寻找lnc721调控的下游靶基因。结果发现,共有499个上调表达的差异基因,93个下调表达的差异基因(图3)。
为验证测序结果的准确性,在表达倍数较高的基因中选取了5个上调与4个下调差异基因,采用qRT-PCR技术对其mRNA水平进行验证,结果如图4所示,检测9个差异基因,其中7个基因差异显著且与测序结果一致,有2个基因差异不显著,表明测序数据的可靠性。进一步对验证的差异靶基因加以分析,并根据文献及基因功能分析筛选出与肌肉发育相关的差异基因,根据基因差异表达倍数的高低,最终筛选MMP9为lnc721候选靶基因。
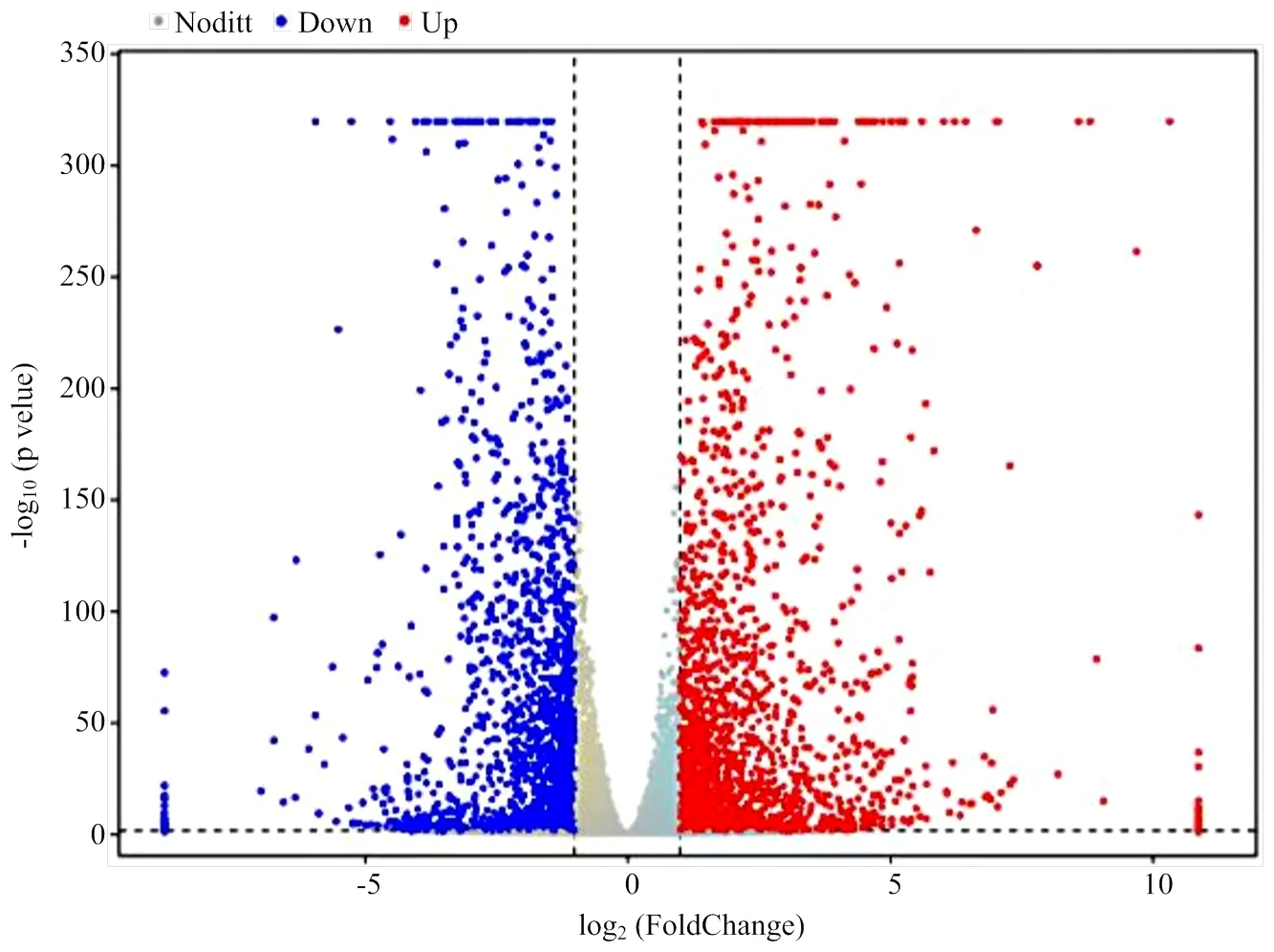
图3 转录组测序基因表达差异分析火山图
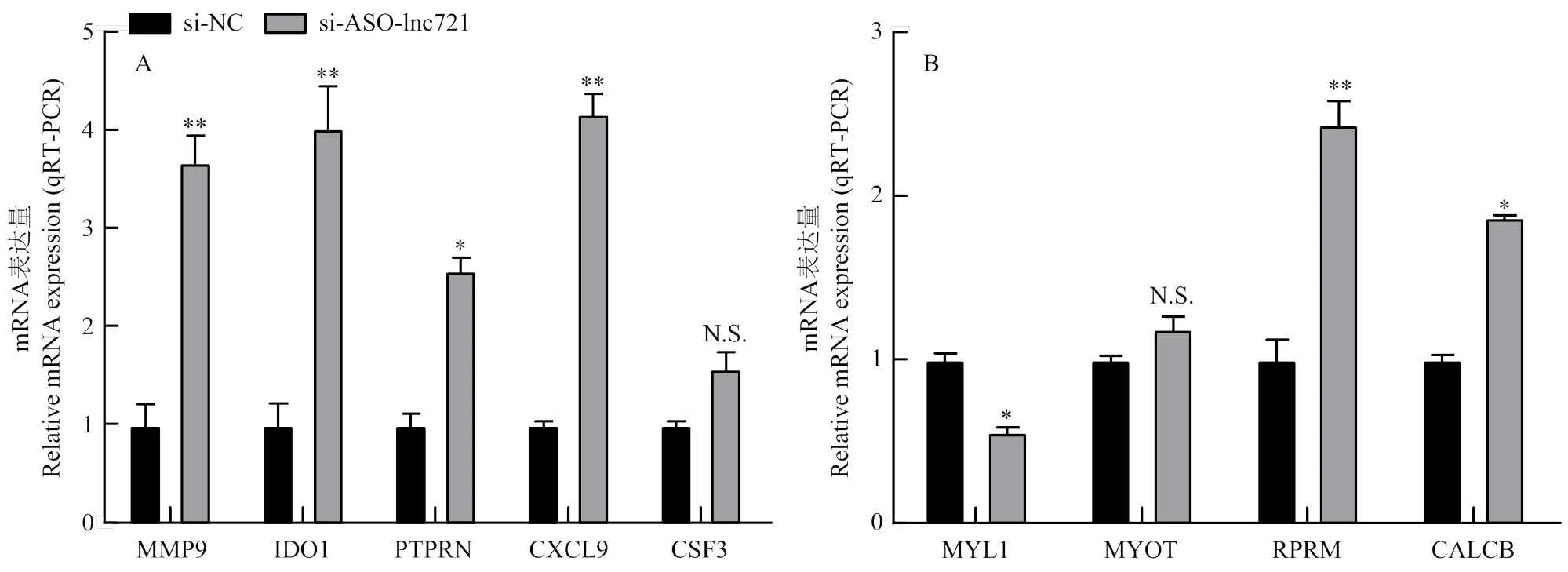
A:上调表达基因的qRT-PCR检测;B:下调表达基因的qRT-PCR检测
2.3 lnc721与候选基因结合的预测与验证
网络数据计算预测lnc721与MMP9的结合能力,结果指出lnc721与MMP9共有9个结合位点,结合倾向(RBP propensity)为0.75,(图5),这一结果证实了差异高表达基因MMP9可作为lnc721互作蛋白进行后续功能性研究分析。

图5 catRAPID预测lnc721与MMP9的结合位点
通过RIP测定MMP9免疫沉淀物上lnc721的富集程度来证明二者的结合关系。以10% input为阳性对照,以与MMP9一抗同种属的IgG为阴性对照进行实验。如图6所示,lnc721富集于MMP9免疫沉淀物中,证明了lnc721与MMP9存在互作结合关系。

图6 RIP检测MMP9与lnc721相互关系
2.4 lnc721对MMP9表达的影响
经过上述试验已经确定lnc721与MMP9存在互作关系,为了进一步研究二者的关系,干扰lnc721检测MMP9的表达情况。将lnc721特异的siRNA序列转染至细胞中,收取增殖期和分化期的mRNA与蛋白质,分别采用qRT-PCR与Western blotting技术检测MMP9的表达情况。结果发现在下调lnc721之后,qRT-PCR结果显示出在增殖期MMP9的表达被极显著抑制(<0.01),而分化期截然相反,MMP9的表达被极显著促进(<0.01)(图7);Western blotting结果表明下调lnc721之后,对于MMP9在增殖期与分化期表达情况的影响均不显著,这可能与不同时期蛋白翻译水平变化相关(图7-B、C)。
2.5 干扰MMP9对牛骨骼肌卫星细胞增殖的影响
为了探究MMP9对牛骨骼肌生长发育的影响,设计合成3条干扰序列转染到细胞中,培养至增殖期收取RNA,筛选出最佳干扰序列(图8-A),qRT-PCR结果表明3条干扰序列均极显著降低了MMP9的表达量(<0.01),证明3条干扰序列均构建成功。由于si-1干扰效果最佳,因此后续将si-1转染进细胞中检测增殖期标志因子Pax7和Ki67的表达情况。结果如图8-B、D所示,干扰MMP9后Ki67的mRNA表达极显著上调(<0.01),而Pax7蛋白表达量没有显著变化。下调MMP9后采用EdU技术观察阳性细胞,发现干扰组阳性细胞率也显著高于对照组(图8-C)。
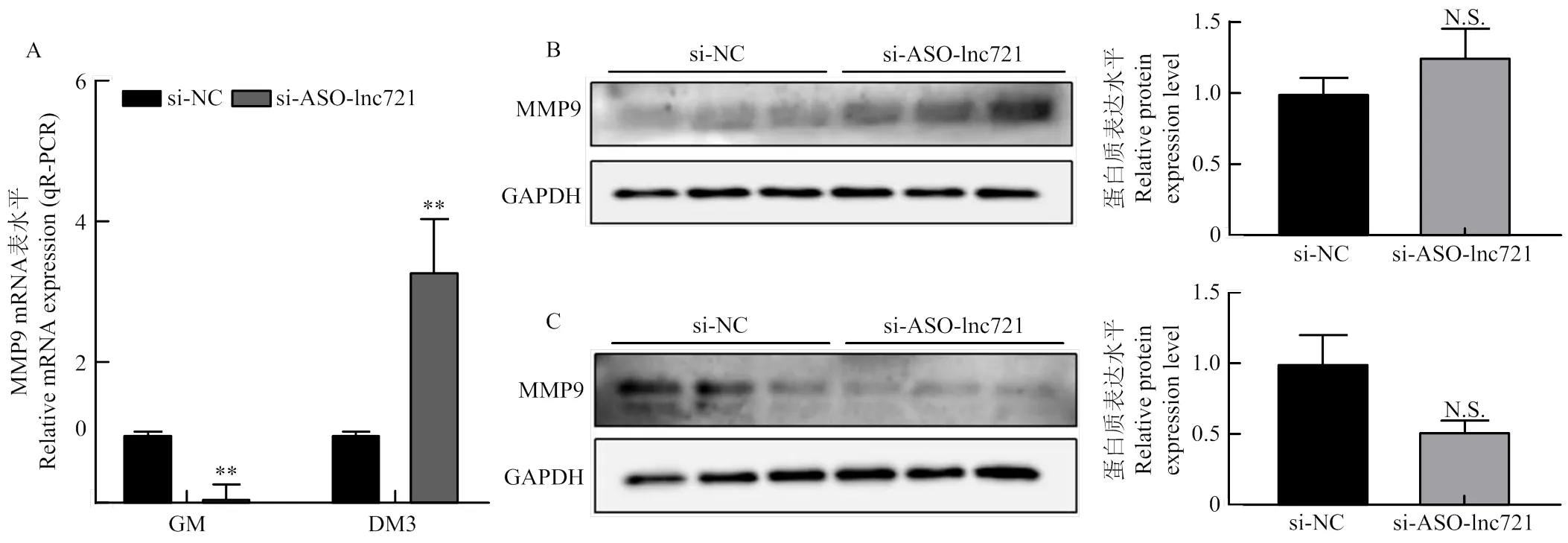
A:下调lnc721后MMP9增殖期与分化期mRNA水平变化;B:增殖期下调lnc721,MMP9蛋白表达水平检测;C:分化期下调lnc721, MMP9蛋白表达水平检测
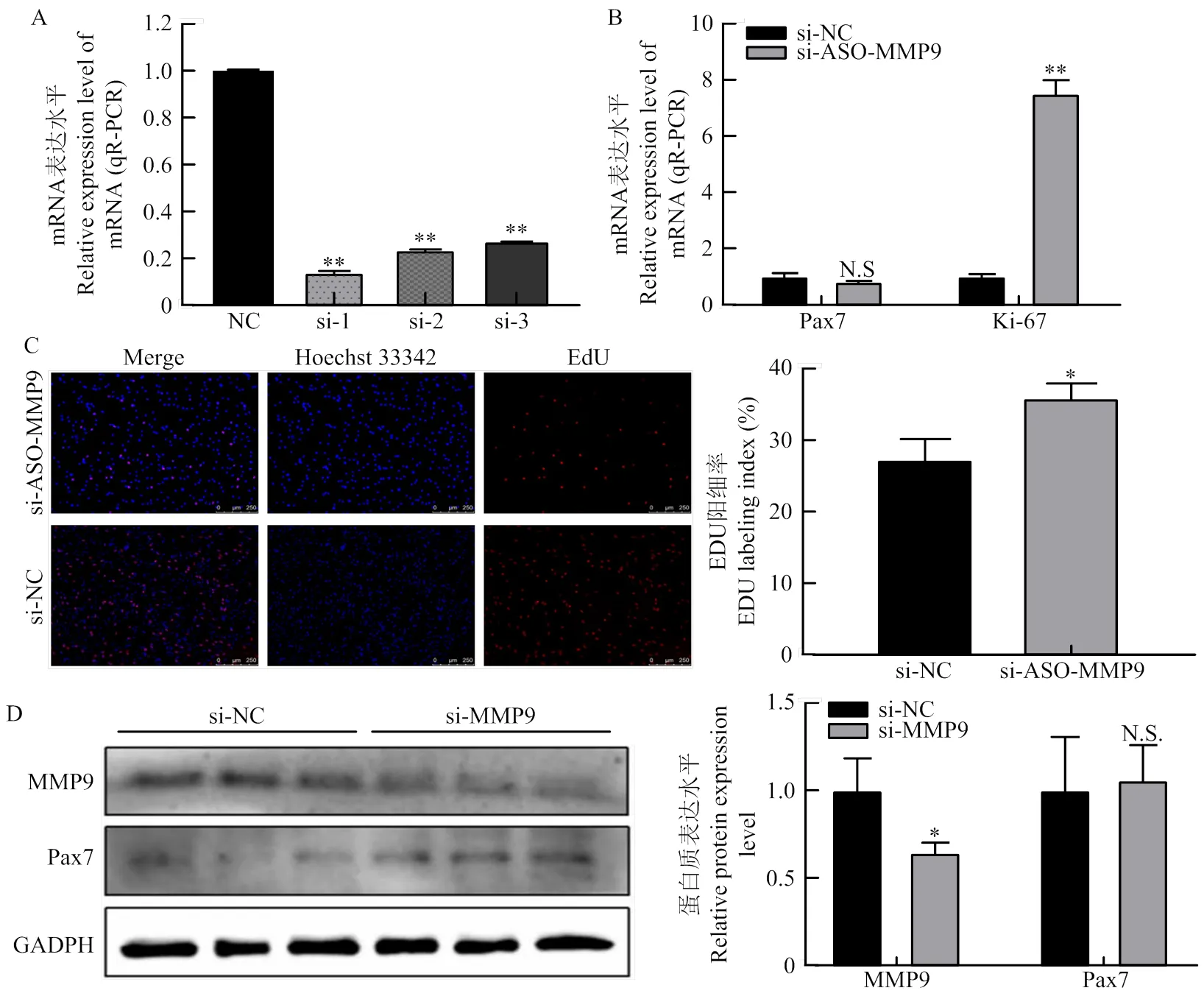
A:定量PCR筛选牛骨骼肌卫星细胞中MMP9干扰siRNA;B:qRT-PCR检测增殖标志因子在mRNA表达水平;C:EdU染色增殖阳性细胞数 D:Western blotting检测增殖标志因子 Pax7蛋白表达量
2.6 干扰MMP9对牛骨骼肌卫星细胞分化的影响
将MMP9的干扰序列转染进细胞中,收取细胞分化3d(DM3)的RNA和蛋白质,收取前镜下观察发现下调MMP9会抑制肌管形成(图9-A)。检测分化期标志因子MyHC和MyoG的mRNA与蛋白质表达情况。下调MMP9后,MyHC的mRNA水平表达量显著下降(<0.01)(图9-B),MyHC的蛋白表达量极显著下降(<0.01),MyoG蛋白表达量显著下调(<0.05)(图9-C)。
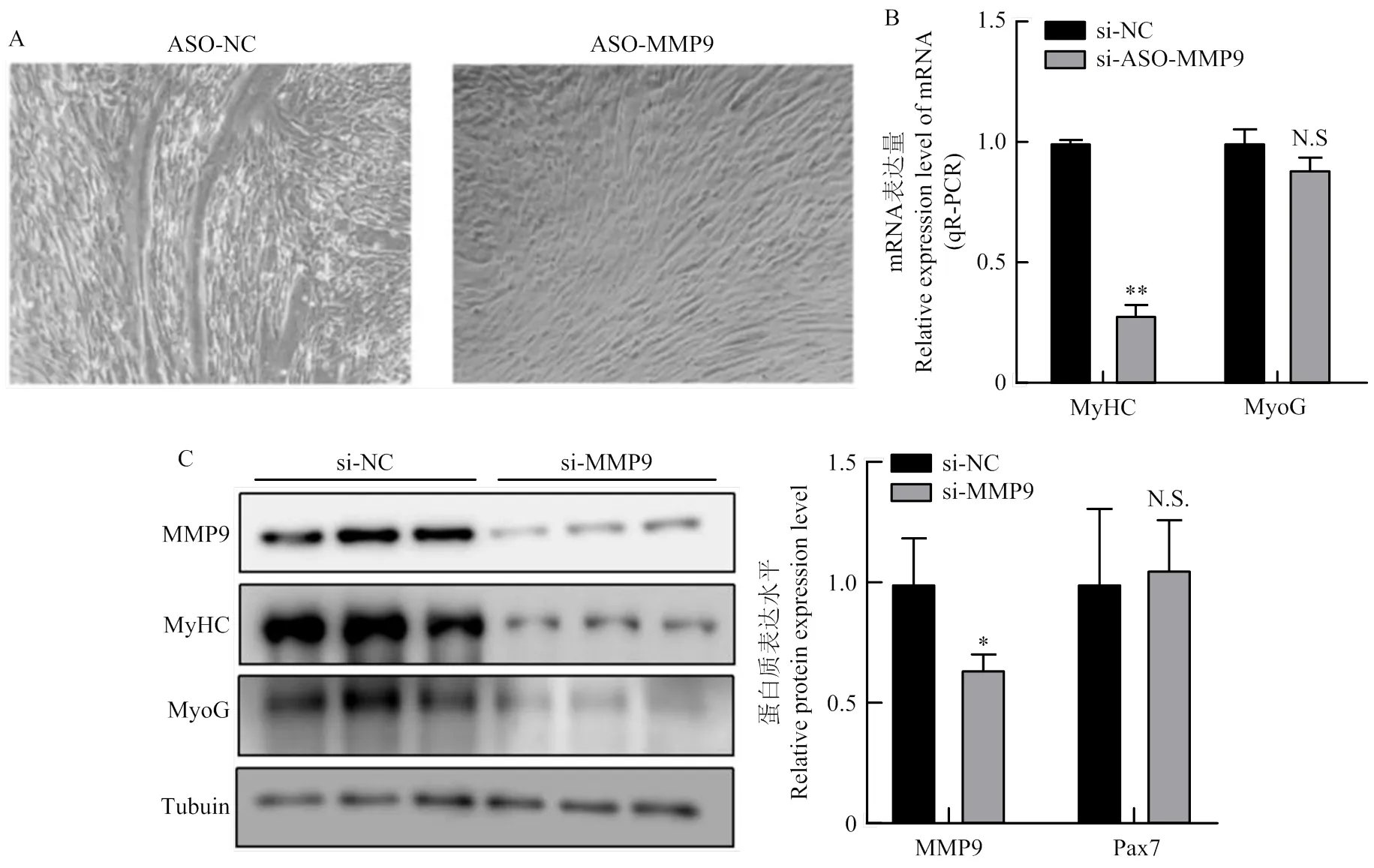
A:转染ASO-MMP9后,倒置显微镜观察分化期细胞生长状态(200×);B:细胞分化标志因子mRNA表达水平;C:Western blotting检测分化标志因子
3 讨论
3.1 mRNA和蛋白质表达水平不一致
一般mRNA和蛋白质的表达水平应该有一定的比例关系,但是二者不一定完全一致,这可能与mRNA翻译过程的调控与蛋白质的降解有关。真核生物的翻译包括起始、延伸和终止[13-14],翻译的起始主要通过m7GpppN以帽盖依赖的形式发生[15],但是某些胞内核糖体会绕过该结构直接结合在起始密码子上[16],即KOZAK序列[17]。影响翻译起始的因素有几个,例如,核糖体可以与位于mRNA 5'UTR中的上游开放阅读框(uorf)结合,并以竞争的方式改变主要开放阅读框的翻译水平;二级结构也通过减慢核糖体的传代来影响翻译,而次优的Kozak序列会对起始产生负面影响;翻译延伸过程中三种主要的伸长因子(eEF1A, eEF1B和eEF2)在响应多种刺激时通过磷酸化/去磷酸化进行调节[18]。延伸率还受到起始速率的变化、密码子的选择以及相应的tRNA丰度的影响。再有蛋白质降解也有可能导致二者表达水平不一致,蛋白质降解是高度特异性和严格调控的,它包括两个主要系统。溶酶体降解和泛素介导的内吞作用、胞饮作用、吞噬作用和自噬作用[19]。本试验中干扰lnc721之后,在增殖期与分化期检测了MMP9的表达水平,qRT-PCR结果显示增殖期MMP9的mRNA表达水平极显著降低(<0.01),分化期MMP9的mRNA表达水平极显著升高(<0.01),然而Western blotting结果却显示干扰lnc721之后MMP9的蛋白质水平却没有显著的变化。同样的干扰MMP9之后。分化期标志因子MyOG的mRNA表达量没有显著变化而蛋白质水平显著下调(<0.05)。前者有可能是mRNA发生了转录后修饰,而后者发生了蛋白质的降解。
3.2 LncRNA通过靶蛋白调控肌肉生长发育
随着学者对骨骼肌生长发育调控方式的深入研究,越来越多的lncRNA与靶蛋白的协同调控机理被发掘出来。Wang等[20]发现lnccDLEU2的过表达会促进SEPP1mRNA与蛋白水平,来抑制肌肉分化和再生。同样的,Cai等[21]发现过表达lncORA可以抑制肌肉分化,并且lncORA可以与IGF2BP2相互作用,抑制肌肉生长发育。CHEN等[22]发现被敲低干扰和过表达lncKBTBD10,均会抑制牛骨骼肌卫星细胞的增殖和分化。同时检测lncKBTBD10的邻近基因KBTBD10是否参与肌生成,发现,无论 lncKBTBD10 被敲低还是过表达,KBTBD10 的蛋白水平均降低。研究认为lncKBTBD10可以抑制KBTBD10,进而影响牛骨骼肌的生成[23]。本研究前期发现lnc721正向调控骨骼肌的增殖,负调控牛骨骼肌的分化。在此基础上,通过lnc721转录组测序锁定了候选下游基因MMP9,并通过RIP实验验证了lnc721与MMP9相互结合。通过qRT-PCR检测干扰lnc721对MMP9的影响,结果发现在细胞分化期干扰lnc721后显著促进了MMP9的表达,推测lnc721可能通过MMP9影响肌卫星细胞生长发育。
3.3 MMP9对肌肉细胞增殖分化具有显著调节作用
MMP9是最复杂的基质金属蛋白酶形式之一。MMP9具有降解细胞外基质(ECM)成分的能力,在病理生理功能中具有重要作用,MMP9的过表达和失调与各种疾病有关[24]。比如心力衰竭[25]、胃癌[26]、肝癌[27]等。研究发现过表达肿瘤坏死因子相关的弱凋亡诱导剂(TWEAK)会增加基质金属蛋白酶(MMP)在骨骼肌细胞肌管中的表达。TWEAK转基因小鼠的肌纤维中MMP9的水平也较高。TWEAK增加了核因子-kappaB(NF-kappaB)信号通路的激活。干扰NF-kappaB 活性阻止了TWEAK诱导的肌管中 MMP9 的产生。此外,据大量研究报道,MMP9对骨骼肌发育也具有调控作用[28]。LI等[29]已在mdx小鼠中研究了MMP9在肌肉功能中的合作相互作用,其中MMP9活性的抑制导致骨骼肌结构恶化,坏死和纤维化减少,并对骨骼肌再生具有补救作用。同样的,KHERIF等[30]在肌营养不良蛋白缺陷MDX小鼠的骨骼肌中观察到MMP9的上调。此外,据报道,MMP9能够处理β-肌营养不良聚糖,并通过DMD和肌糖病患者骨骼肌中的肌营养不良聚糖复合物破坏ECM与细胞膜之间的连接,从而干扰肌肉细胞的生长发育[31-32]。CHENETTE等[33]研究敲除小鼠auf1基因后,骨骼肌会随小鼠年龄的增长而萎缩,在auf1敲除小鼠中阻断MMP9活性可恢复骨骼肌修复。ZIMOWSKA等[34]在挤压损伤大鼠SOL模型中证实了MMP9抑制对肌肉再生正向调节的作用,特别是对减少纤维化的正向调节作用。本研究重点关注MMP9与骨骼肌生长发育之间的关系,进一步验证MMP9是否对牛骨骼肌卫星细胞具有调控作用。使用MMP9的siRNA干扰MMP9后,qRT-PCR结果与WB结果均显示显著促进了细胞的增殖,并抑制细胞分化,此结果与lnc721下调会使细胞分化受阻结果相一致。故而lnc721与MMP9对牛肌卫星细胞调控趋势一致,lnc721可以结合MMP9蛋白,共同作用对细胞增殖有正向调控的作用,对细胞分化过程具有负向调控的作用。综合前期研究结果,本试验证明了lnc721与MMP9结合参与了肌肉细胞发育初期的调控,揭示了lnc721调控牛肌卫星细胞增殖分化的机制。
4 结论
干扰lnc721在细胞增殖期极显著抑制MMP9表达,而在分化期促进MMP9的表达,且干扰MMP9可升高增殖期标志因子Pax7与Ki67D的表达水平并下调分化标志因子MyHC与MyoG的表达水平。证明了MMP9具有可负向调控细胞增殖并正向调控细胞分化的作用。结合lnc721与MMP9的调控关系,可以得出结论lnc721促进MMP9的表达进而对细胞的增殖起到抑制作用,对细胞分化起到促进作用,lnc721与MMP9互作结合共同调控牛骨骼肌卫星细胞的发育。
[1] 王灵站, 王立群, 王俊梅, 于广海, 毕伏龙. 二甲双胍经线粒体及内质网对骨骼肌减少症干预作用的研究进展. 解剖学杂志, 2018, 41(2): 220-224.
WANG L Z, WANG L Q, WANG J M, YU G H, BI F L. Advance in the research on the treatment of sarcopenia with metformin via mitochondria and endoplasmic reticulum. Chinese Journal of Anatomy, 2018, 41(2): 220-224. (in Chinese)
[2] WANG G Q, WANG Y, XIONG Y, CHEN X C, MA M L, CAI R,
GAO Y, SUN Y M, YANG G S, PANG W J. Sirt1 AS lncRNA interacts with its mRNA to inhibit muscle formation by attenuating function of miR-34a. Scientific Reports, 2016, 6: 21865.
[3] LI R Y, LI B J, CAO Y, LI W J, DAI W L, ZHANG L L, ZHANG X, NING C B, LI H Q, YAO Y L, TAO J L, JIA C, WU W J, LIU H L. Long non-coding RNA-derived miR-22-3p promotes skeletal muscle differentiation and regeneration by inhibiting HDAC4. Molecular Therapy - Nucleic Acids, 2021, 24: 200-211.
[4] PITTAYAPRUEK P, MEEPHANSAN J, PRAPAPAN O, KOMINE M, OHTSUKI M. Role of matrix metalloproteinases in photoaging and photocarcinogenesis. International Journal of Molecular Sciences, 2016, 17(6): 868.
[5] CHENG Z Y, LIMBU M H, WANG Z, LIU J, LIU L, ZHANG X Y, CHEN P S, LIU B C. MMP-2 and 9 in chronic kidney disease. International Journal of Molecular Sciences, 2017, 18(4): 776.
[6] NILAND S, RISCANEVO A X, EBLE J A. Matrix metalloproteinases shape the tumor microenvironment in cancer progression. International Journal of Molecular Sciences, 2021, 23(1): 146.
[7] CAREY P, LOW E, HARPER E, STACK M S. Metalloproteinases in ovarian cancer. International Journal of Molecular Sciences, 2021, 22(7): 3403.
[8] GROSS J, LAPIERE C M. Collagenolytic activity in amphibian tissues: a tissue culture assay. Proceedings of the National Academy of Sciences of the United States of America, 1962, 48(6): 1014-1022.
[9] WANG X, KHALIL R A. Matrix metalloproteinases, vascular remodeling, and vascular disease. Advances in Pharmacology, 2018, 81: 241-330.
[10] DAS A, MONTEIRO M, BARAI A, KUMAR S, SEN S. MMP proteolytic activity regulates cancer invasiveness by modulating integrins. Scientific Reports, 2017, 7(1): 14219.
[11] LEI H Q, LEONG D, SMITH L R, BARTON E R. Matrix metalloproteinase 13 is a new contributor to skeletal muscle regeneration and critical for myoblast migration. American Journal of Physiology-Cell Physiology, 2013, 305(5): C529-C538.
[12] SNYMAN C, NIESLER C U. MMP-14 in skeletal muscle repair. Journal of Muscle Research and Cell Motility, 2015, 36(3): 215-225.
[13] MARINTCHEV A, WAGNER G. Translation initiation: Structures, Mechanisms and Evolution. Quarterly Reviews of Biophysics, 2004, 37(3/4): 197-284.
[14] KAPP L D, LORSCH J R. The Molecular Mechanics of Eukaryotic Translation. Annual Review of Biochemistry, 2004, 73: 657-704.
[15] HERNÁNDEZ G. On the Origin of the Cap-Dependent Initiation of Translation in Eukaryotes. Trends in Biochemical Sciences, 2009, 34(4): 166-175.
[16] GRABER T E, HOLCIK M. Cap-Independent Regulation of Gene Expression in Apoptosis. Molecular Biosystems, 2007, 3(12): 825-834.
[17] KOZAK M. The Scanning Model for Translation: An Update. Journal of Cell Biology, 1989, 108(2): 229-241.
[18] BROWNE G J, PROUD C G. Regulation of Peptide-Chain Elongation In Mammalian Cells. European Journal of Biochemistry, 2002, 269(22): 5360-5368.
[19] CIECHANOVER A. Intracellular protein degradation from a vague idea through the lysosome and the ubiquitin-proteasome system and on to human diseases and drug targeting: Nobel lecture, december 8, 2004. Annals of the new york academy of sciences, 2007, 1116(1): 1-28.
[20] WANG Y, ZHAO Z J, KANG X R, BIAN T, SHEN Z M, JIANG Y, SUN B, HU H B, CHEN Y S. lncRNA DLEU2 acts as a miR-181a sponge to regulate SEPP1 and inhibit skeletal muscle differentiation and regeneration. Aging, 2020, 12(23): 24033-24056.
[21] CAI R, ZHANG Q, WANG Y Q, YONG W L, ZHAO R, PANG W J. Lnc-ORA interacts with microRNA-532-3p and IGF2BP2to inhibit skeletal muscle myogenesis. Journal of Biological Chemistry, 2021, 296: 100376.
[22] CHEN M M, LI X, ZHANG X J, LI Y, ZHANG J X, LIU M H, ZHANG L L, DING X B, LIU X F, GUO H. A novel long non-coding RNA, lncKBTBD10, involved in bovine skeletal muscle myogenesis. In Vitro Cellular & Developmental Biology - Animal, 2019, 55(1): 25-35.
[23] LI Z H, CAI B L, ALI ABDALLA B, ZHU X N, ZHENG M, HAN P G, NIE Q H, ZHANG X Q. LncIRS1 controls muscle atrophy via sponging miR-15 family to activate IGF1-PI3K/AKT pathway. Journal of Cachexia, Sarcopenia and Muscle, 2019, 10(2): 391-410.
[24] MONDAL S, ADHIKARI N, BANERJEE S, AMIN S A, JHA T. Matrix metalloproteinase-9 (MMP-9) and its inhibitors in cancer: a minireview. European Journal of Medicinal Chemistry, 2020, 194: 112260.
[25] NANDI S S, KATSURADA K, SHARMA N M, ANDERSON D R, MAHATA S K, PATEL K P. MMP9 inhibition increases autophagic flux in chronic heart failure. American Journal of Physiology Heart and Circulatory Physiology, 2020, 319(6): H1414-H1437.
[26] FU C K, CHANG W S, TSAI C W, WANG Y C, YANG M D, HSU H S, CHAO C Y, YU C C, CHEN J C, PEI J S, BAU D T. The association ofpromoter Rs3918242 genotype with gastric cancer. Anticancer Research, 2021, 41(7): 3309-3315.
[27] XUE J C, ZHOU H Y, YU L S Y, WU Y Y. Effect of IL-8 on hepatocellular carcinoma-associated metastasis by targeting MMP9 in mice. Translational Cancer Research, 2022, 11(7): 2050-2060.
[28] KUMAR L, BISEN M, KHAN A, KUMAR P, PATEL S K S. Role of matrix metalloproteinases in musculoskeletal diseases. Biomedicines, 2022, 10(10): 2477.
[29] LI H, MITTAL A, MAKONCHUK D Y, BHATNAGAR S, KUMAR A. Matrix metalloproteinase-9 inhibition ameliorates pathogenesis and improves skeletal muscle regeneration in muscular dystrophy. Human Molecular Genetics, 2009, 18(14): 2584-2598.
[30] KHERIF S, LAFUMA C, DEHAUPAS M, LACHKAR S, FOURNIER J G, VERDIÈRE-SAHUQUÉ M, FARDEAU M, ALAMEDDINE H S. Expression of matrix metalloproteinases 2 and 9 in regenerating skeletal muscle: a study in experimentally injured andMuscles. Developmental Biology, 1999, 205(1): 158-170.
[31] YAMADA H, SAITO F, FUKUTA-OHI H, ZHONG D, HASE A, ARAI K, OKUYAMA A, MAEKAWA R, SHIMIZU T, MATSUMURA K. Processing of beta-dystroglycan by matrix metalloproteinase disrupts the link between the extracellular matrix and cell membrane via the dystroglycan complex. Human Molecular Genetics, 2001, 10(15): 1563-1569.
[32] MATSUMURA K, ZHONG D, SAITO F, ARAI K, ADACHI K, KAWAI H, HIGUCHI I, NISHINO I, SHIMIZU T. Proteolysis of β-dystroglycan in muscular diseases. Neuromuscular Disorders, 2005, 15(5): 336-341.
[33] CHENETTE D M, CADWALLADER A B, ANTWINE T L, LARKIN L C, WANG J H, OLWIN B B, SCHNEIDER R J. Targeted mRNA decay by RNA binding protein AUF1regulates adult muscle stem cell fate, promoting skeletal muscle integrity. Cell Reports, 2016, 16(5): 1379-1390.
[34] ZIMOWSKA M, OLSZYNSKI K H, SWIERCZYNSKA M, STREMINSKA W, CIEMERYCH M A. Decrease of MMP-9 activity improves soleus muscle regeneration. Tissue Engineering Part A, 2012, 18(11/12): 1183-1192.
LNC721 Targeted Regulation MMP9 Affects Bovineskeletal Muscle Satellite Cell Proliferation and Differentiation
GUO YunPeng, TAN HaoYun, GUO Hong, FU MengYun, LI Xin, HU DeBao, ZHANG LinLin, DING XiangBin, GUO YiWen
School of Animal Science and Animal Medicine, Tianjin Agricultural College/Tianjin Key Laboratory of Agricultural Animal Breeding and Healthy Husbandry, Tianjin 300384
【Background】The muscular system is an important basis for maintaining the survival and growth of the animal body. In the mammalian muscle, nearly half of the muscle is skeletal muscle, skeletal muscle through cell multiplication to migration fusion, and gradually formed a mature muscle bundle attached to the bone with contractile ability. In the animal body, skeletal muscle is not only involved in animal growth, but also in physiological activities, such as respiration and metabolism. At present, many studies have shown that lncRNA had the effect of regulating muscle growth and development, and was a key factor affecting skeletal muscle function and diseases. However, due to the complex mechanism of action of lncRNA, the variety of methods, and the very low conservation type between species, the relationship between lncRNAs of different species is not large, and most of the studies exist in organisms such as humans and mice, and there are few studies on the effect on bovine muscle growth. In recent years, it has been discovered that lncRNAs interact with certain target genes to regulate the process of muscle cell genesis. In the early stage of this experiment, the high-throughput sequencing was performed by collecting bovine muscles of different tissues of different months, the lncRNA with high expression difference was obtained, and the mechanism of its regulation of the myogenic process was studied. 【Objective】This study aimed to explore the interaction between long non-coding RNA lnc721 and its target gene MMP9, and the effects of MMP9 on the growth and development of bovine skeletal muscle cells, in order to provide a reference for the study of the regulatory mechanism of bovine skeletal muscle development.【Method】 The previous experiments showed that interference with lnc721 had a positive regulatory effect on the proliferation of bovine skeletal muscle satellite cells and negatively regulated its differentiation. Three groups of interfering lnc721 bovine skeletal muscle satellite cells and three control groups were set up to sequence transcriptome using NGS technology in the differentiation stage of bovine skeletal muscle satellite cells, in order to obtain the lnc721 differential target gene and to further study the regulatory pathway of lnc721 on bovine skeletal muscle development. According to the screening results and the verification results of qRT-PCR, MMP9 was selected as the target gene of lnc721, and the binding ability of lnc721 and MMP9 was predicted through the CatRAPID website. The interference sequences of lnc721 and MMP9 were designed and synthesized, transfected into bovine skeletal muscle satellite cells, and the effect of lnc721 on MMP9 expression was down-regulated by qRT-PCR and Western blot technology at the mRNA level and protein level. After down-regulation of MMP9, qRT-PCR, Western blot and EdU were used to detect the expression of proliferation marker factors Ki67 and Pax7 and differentiation marker factors MyHC and MyOG, so as to reflect the effect of down-regulation of MMP9 on the growth and development of bovine skeletal muscle satellite cells. 【Result】 MMP9 was identified as a target gene for lnc721 to regulate the interaction of bovine skeletal muscle satellite cells. They were found to interact and bind to each other by RIP. After interfering with lnc721, qRT-PCR analysis showed that down-regulation of lnc721 significantly inhibited MMP9 expression (<0.01) during the proliferative phase, while it significantly promoted MMP9 expression (<0.01) during the differentiation phase. Downregulation of MMP9 resulted in a highly significant upregulation of Ki67 mRNA level expression in proliferating cells (<0.01) and the Pax7 protein expression (˂0.05). As also, it could significant increase the positive cell rate of EdU labled cells. At the stage of cell differentiation, the downregulation of MMP9 could inhibit muscle myotube formation. On the other hand, the mRNA and protein expressions of MyHC were significantly decreased (<0.01); MyoG protein expression was significantly down-regulated (<0.05). 【Conclusion】 lnc721 could bind to MMP9. Interfering with lnc721 was significantly inhibited MMP9 expression during the proliferative phase of cells, while promoting MMP9 expression during the differentiation phase. MMP9 inhibition could promoted cell proliferation and inhibited differentiation. This study demonstrated that lnc721 targeting MMP9 regulated the development of bovine skeletal muscle satellite cells.
lnc721; MMP9; bovine skeletal muscle satellite cells; proliferation; differentiation

10.3864/j.issn.0578-1752.2023.24.012
2023-05-06;
2023-07-04
天津市农业动物繁育与健康养殖重点实验室开放基金课题、天津市自然基金(20JCQNJC00640)、天津市教委科研计划项目(2020KJ089)
郭云鹏,E-mail:guoyunpeng1225@163.com。通信作者郭益文,E-mail:yiwenguo33@163.com
(责任编辑 林鉴非)
