氧酰基载体蛋白还原酶基因FgOAR1对禾谷镰孢生长、发育和致病的影响
2023-12-28宫安东雷银玉吴楠楠刘景榕宋梦鸽张艺美杨光杨鹏
宫安东,雷银玉,吴楠楠,刘景榕,宋梦鸽,张艺美,杨光,杨鹏
氧酰基载体蛋白还原酶基因对禾谷镰孢生长、发育和致病的影响
宫安东,雷银玉,吴楠楠,刘景榕,宋梦鸽,张艺美,杨光,杨鹏
信阳师范大学生命科学学院,河南信阳 464000
【背景】禾谷镰孢()是引起小麦赤霉病(Fusarium head blight)的主要病原真菌,侵染后导致作物品质和产量下降,同时产生多种真菌毒素,严重危害粮食生产和人类健康。氧酰基载体蛋白还原酶(3-oxoacyl ACP reductase,OAR1)催化羧酰基载体蛋白还原成氧酰基载体蛋白,在脂肪酸的生物合成过程中具有重要作用。【目的】构建基因缺失突变体,研究其表型、显微结构、孢子产量、有性生殖和致病力等的变化,探究的生物学功能,揭示其对禾谷镰孢生长、发育和致病的影响,为新型抑菌作用靶点的筛选及小麦赤霉病的防控提供科学依据。【方法】以禾谷镰孢野生型菌株PH-1为材料,应用Split-Marker基因敲除技术,构建基因缺失突变体(Δ),Gap-repair技术获得缺失基因的回补突变体(Δ-C);将PH-1、Δ和Δ-C菌株分别接种到常规培养基,观察菌落表型变化并测定脂肪酸含量差异;接种到含刚果红(Congo-Red)、SDS、NaCl和H2O2的压力筛选培养基中,观察菌丝在压力培养条件下的生长状况;接种CMC培养基,比较分生孢子产量差异;接种胡萝卜培养基,观察有性生殖及孢子性状;分别进行小麦胚芽鞘和穗部接种,统计发病率和毒素产量,比较突变体与野生型菌株的致病力差异。【结果】与野生型PH-1菌株相比,在PDA、YEG和CM培养基中Δ突变体未呈现明显表型变化,在0.7 mol·L-1NaCl、0.03% H2O2、0.01% SDS和300 μg·mL-1Congo-Red等压力培养条件下,突变体菌落直径显著低于野生型PH-1,表明与禾谷镰孢细胞膜和细胞壁的合成相关;Δ突变体在液体培养基中的分生孢子产量(8.1×105个/mL)显著低于PH-1(1.26×106个/mL),接种小麦胚芽鞘和麦穗后,Δ突变体的致病力显著低于野生型菌株PH-1。【结论】禾谷镰孢中参与脂肪酸的生物合成,对细胞膜合成具有重要作用,该基因缺失导致突变体抗逆性降低,分生孢子产量下降,且致病力显著降低,对禾谷镰孢的生长、发育和致病具有重要作用。
禾谷镰孢;小麦赤霉病;基因敲除;;致病力
0 引言
【研究意义】由禾谷镰孢()侵染引起的小麦赤霉病(Fusarium head blight,FHB)是一种危害严重的真菌病害[1-3],在全球范围内普遍存在[4]。在我国,赤霉病的暴发区主要集中在长江中下游地区,近年来,随着气候变暖,赤霉病呈现出向北蔓延的趋势[5]。此外,禾谷镰孢还产生多种镰孢菌毒素,对人体危害严重[6]。目前,针对小麦赤霉病的防治主要依靠化学杀菌剂,但杀菌剂的大量使用对环境造成一定影响,并引起病原菌耐药性的增强[7]。因此,开发新型、高效抑菌剂是病害防控的重要任务[8]。开展基因功能研究,明确基因在病原菌侵染和致病过程中的生物学功能,将有助于鉴定核心作用位点,对抑菌剂的研发和赤霉病防控具有重要意义。【前人研究进展】脂肪酸是细胞膜的重要组成成分,对磷脂、脂多糖和脂蛋白的形成至关重要[9],同时,对病原真菌的生长、发育和致病具有重要作用。已有研究表明,稻瘟病菌()中超长链脂肪酸的合成可影响侵入钉的形成,当超长链脂肪酸的合成受抑制后,侵入钉的形成受阻,病原菌致病力降低。HE等筛选到一种可抑制超长碳链脂肪酸合成酶活性的化合物,并抑制侵染钉的形成和病原菌的侵染,为真菌病害的防治提供新材料[10]。禾谷镰孢中脂肪酸的生物合成由脂肪酸合成酶(fatty acid synthase,FAS)催化[11],该酶由分布在两条链上的6个酶活性中心及一个酰基载体蛋白(acetyl carrier protein,ACP)组成,以乙酰辅酶A为底物,经酰基转移酶催化生成乙酰ACP,与丙二酸单酰ACP结合,历经缩合、还原、脱水、还原4步反应,生成丁酰乙酰ACP,重复上述4步反应,每重复一次增加2个碳单位,经多轮循环后合成长链脂肪酸,用于脂蛋白和细胞膜等的生成。编码氧酰基载体蛋白还原酶,又称-酮脂酰-ACP还原酶,参与脂肪酸生物合成的第二次“还原”反应,以NADPH为辅因子,将乙酰乙酰ACP还原成-羟丁酰ACP,在脂肪酸的生物合成过程中具有重要作用。鲍曼不动杆菌()中发现一种高分子量OAR1酶,在营养丰富的条件下,该酶可维持细菌的生长、运动和膜合成,当基因缺失后,突变体在富营养培养基中的生长受抑制,因此对鲍曼不动杆菌的生长和发育具有重要作用[12]。在野油菜黄单胞菌(pv.)中发现2个氧酰基载体蛋白还原酶,分别为Fab G1和Fab G3,Fab G1是脂肪酸生物合成与细菌生长所必需的,该基因缺失会导致细菌死亡;Fab G3缺失后,未影响脂肪酸合成和细菌生长,但影响次级代谢产物菌黄素的产生,菌黄素可保护病原菌免受光氧化损伤,突变体无法合成菌黄素,细胞的光氧化损伤增大,导致病原菌毒力降低[13]。酿酒酵母()中敲除后,突变体在以甘油为唯一碳源的培养基上无法正常生长,且线粒体呼吸减弱,表明缺失导致脂肪酸合成受阻,无法与甘油分子合成脂类物质,导致细胞生长受阻[14]。【本研究切入点】在植物病原真菌中,针对的生物学功能,以及该基因对真菌生长、发育和致病的影响等,尚未有研究揭示。【拟解决的关键问题】以禾谷镰孢野生型菌株PH-1为研究对象,构建基因缺失突变体,分析突变体在表型、显微结构、压力培养、无性生殖、有性生殖和致病力等方面与野生型菌株的差异,探究在禾谷镰孢生长、发育和致病过程中的重要作用,为新型抑菌剂的研发以及赤霉病防控提供新的作用靶点。
1 材料与方法
试验于2019年6月至2022年3月在信阳师范大学生命科学学院应用与环境微生物学实验室完成。
1.1 材料
1.1.1 质粒、菌株 含有潮霉素抗性基因的pCB1003质粒;含有G418、氨苄青霉素抗性、I酶切位点的pFL2质粒;禾谷镰孢野生型菌株PH-1(NRRL 31084)、Δ突变体、Δ-C回补突变体;大肠杆菌菌株DH5;色氨酸缺陷酵母菌株XK1-25。均由本实验室保存。
1.1.2 试剂、酶及培养基 几丁质酶、崩溃酶、溶菌酶购于Sigma公司(Sigma-Aldrich,St Louis,MO);r-Taq DNA聚合酶、dNTPs、PCR Buffer、2×Taq Mix等购于大连宝生物公司;I限制性内切酶(Thermo Fisher Scientific,Cleveland,OH,USA)。
PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂15 g,ddH2O定容至1 L)用于真菌培养;CM培养基(葡萄糖3 g,蛋白胨0.6 g,酵母提取物0.3 g,酸水解酪蛋白0.3 g,NaNO31.8 g,KCl 0.15 g,MgSO40.15 g,KH2PO40.45 g,琼脂4.5 g,ddH2O定容至300 mL)用于禾谷镰孢的胁迫试验;CMC培养基(羧甲基纤维素钠6 g,酵母提取物0.4 g,KH2PO40.4 g,NH4NO30.4 g,MgSO40.1 g,ddH2O定容至400 mL)用于禾谷镰孢分生孢子制备;胡萝卜培养基(胡萝卜40 g,琼脂粉4 g,ddH2O定容至200 mL)用于有性生殖试验。
1.1.3 引物设计 在Ensemble Fungi真菌数据库(http://fungi.ensembl.org/index.html)下载编码序列,并保留及其上下游2 000 bp碱基序列,根据目的基因序列及潮霉素磷酸转移酶基因()序列,利用primer 5.0软件,设计基因敲除引物、回补突变体构建引物和检测引物,所有引物由天一华煜基因科技有限公司合成,引物序列见表1。
1.2 方法
1.2.1的同源性比对 在NCBI和Ensembl Fungi数据库以禾谷镰孢基因组为研究对象,检索OAR1氨基酸编码序列,将所得序列在NCBI-BLAST中进行序列同源性比对,得到不同病原真菌中OAR1氨基酸序列。挑选不同病原真菌OAR1氨基酸序列在Clustal W软件中进行多重序列比对处理,在GENEDOC软件绘制多重序列图谱。
1.2.2基因敲除突变体和回补突变体的构建 运用同源重组基因敲除法构建Δ突变体,以PH-1基因组DNA为模板,以成对引物FgOAR1_1F/2R及FgOAR1_3F/4R分别特异性扩增目的基因的上、下游同源片段a和b;以pCB1003质粒DNA为模板,以HYG/F和HY/R及YG/F和HYG/R为引物特异性扩增的H1和H2片段。a和H1片段,b和H2片段进行overlap-PCR得到融合片段aH1和bH2,琼脂糖凝胶电泳检测条带大小。aH1和bH2融合片段用于原生质体的转化。
回补载体正向引物OAR1_hbF位于目的基因自身启动子的上游,反向引物OAR1_hbR在目的基因终止密码子前20个碱基左右位置上,不包含OAR1基因编码区的终止密码子。分别在互补引物FgOAR1_hb/F和FgOAR1_hb/R的5′端增加36 bp的PFL2同源片段,以PH-1基因组DNA为模板,特异性扩增互补片段,将互补片段与I酶切线性化后的pFL2载体,在酵母细胞内进行同源重组,构建回补载体,使用检测引物insert_F/R进行PCR检测,PCR产物送天一华煜基因科技有限公司进行测序。
1.2.3 菌株的压力筛选 将PH-1、Δ突变体和Δ-C回补突变体菌株接种到PDA培养基上培养3 d,用0.5 cm打孔器在菌丝边缘打孔,并接种在终浓度分别为0.7 mol·L-1NaCl、0.03% H2O2、0.01% SDS和300 μg·mL-1刚果红的CM培养基上进行压力筛选[15-17],每处理3个重复,25 ℃培养箱培养3 d,用十字交叉法测量菌落直径,并拍照记录。

表1 本试验所用引物序列
1.2.4 分生孢子萌发与有性生殖 为检测无性孢子的产生与萌发状况,将PH-1、Δ和Δ-C接种PDA培养基培养3 d,用打孔器打取含新鲜菌丝的菌饼,接种在50 mL CMC培养基中,振荡摇培5 d,用无菌尼龙滤布过滤收集分生孢子,接种相同浓度的孢子液于50 mL的YEPD培养基中,25 ℃和175 r/min摇培8 h后,显微镜观察各菌株分生孢子的萌发情况。试验重复3次,每处理统计30个孢子,计算孢子萌发率,以及萌发产生的芽管长度,并比较3个菌株间的差异。
为检测突变体的有性生殖情况,将活化的PH-1、Δ和Δ-C菌丝块接种于胡萝卜培养基上,25 ℃培养6 d;待菌丝长满培养皿后加入1 mL 0.1%的Tween 20,用无菌药匙压倒菌丝使其融合,放在25 ℃培养箱黑暗处理(黑暗12 h,黑光灯12 h),培养8 d观察子囊壳的产生,解剖镜下观察子囊孢子的释放。
1.2.5 脂肪酸含量测定 将新鲜的PH-1、Δ突变体孢子液(1×105个/mL)分别涂布PDA培养基,培养4 d后收集表面菌丝,用于脂肪酸的提取[18]。菌丝研磨处理,分别取100 mg置于玻璃瓶中,加入1.5 mL溶解液(氯仿﹕甲醇=2﹕1,v/v),涡旋处理10 min,4 ℃和12 000 r/min条件下离心10 min,静置后取1 mL上清液于新的玻璃管中,加入0.2 mL KCl(0.75%,w/v),涡旋10 min后静置分层,取下层液体400 μL于新的玻璃管中,加入2 mL浓缩硫酸和甲醇混合液(5/95,v/v),95 ℃酯化处理1.5 h。向反应体系中加入1 mL超纯水和1 mL正己烷,混匀后静置10 min分层。取上层提取液进行脂肪酸测定。
1.2.6 菌株的致病力和产毒分析小麦苗期胚芽鞘接种和花期麦穗接种均选用赤霉病高感小麦品种安农8455。选取大小均匀一致的小麦籽粒,种子进行表面消毒,于25 ℃保湿催芽3 d,待胚芽鞘长出3 cm左右,剪去胚芽鞘尖端造成斜面损伤。收集不同菌株的分生孢子,调整孢子液浓度至1×105个/mL,将2.5 μL分生孢子悬液接种至胚芽鞘尖端,每处理12个重复,相对湿度保持在80%,25 ℃黑暗培养24 h后,每天光照处理12 h,继续培养7 d,测量小麦基部褐色病斑长度。试验重复3次,每组10个处理,统计每株幼苗病斑长度后取平均值进行比对。
收集分生孢子,调整浓度至1×105个/mL,将10 μL分生孢子悬液接种至扬花期麦穗中部小花,套袋保湿。每处理12个重复,14 d后统计发病情况,记录发病麦穗数量,计算病穗率(发病麦穗数/接种总麦穗数);统计接种小穗中发病小花数量,计算发病率(发病小花数/每穗总小花数)。
小麦成熟后,收集发病麦穗并剥离籽粒,分别研磨成粉末,进行毒素测定。每组取1 g粉末样品,加入4 mL提取液(乙腈/水=84/16,v/v),充分混匀后静置10 min,取上清,重复进行二次抽提,混合上清液,浓缩后重溶于1 ml甲醇中,进行DON毒素测定[19]。每处理重复3次,取平均值,比较突变体与野生型菌株产毒差异。
1.2.7 不同侵染阶段的基因表达分析 为了解在禾谷镰孢不同生长、侵染阶段的表达情况,查阅已发表的转录组测序结果,比对禾谷镰孢在YEPD培养基中生长12、24、36、48 h的表达量,以及接种小麦穗部24、48、72 h的基因表达量,分析在不同阶段的表达差异。
1.2.8 统计学分析 采用SPSS17.0软件对试验数据进行统计分析,统计结果为2—3次重复数据的平均值,采用独立性T检验进行方差分析,计算标准差并分析差异显著性(<0.05)。
2 结果
2.1 FgOAR1预测
在NCBI禾谷镰孢数据库和Ensembl Fungi数据库中进行BLAST氨基酸序列分析,筛选到一个,ID为FGSG_03438。生物信息学分析显示,该基因不含内含子、信号肽和跨膜区,CDS编码区长839 bp。对禾谷镰孢、稻瘟病菌、黄曲霉()和酿酒酵母中该酶的氨基酸序列进行同源性比对,结果显示OAR1蛋白氨基酸序列长度在不同真菌中相对稳定(263—278 AA),且氨基酸组成存在多个高度保守区(图1)。

Fg:禾谷镰孢F. graminearum;Af:黄曲霉A. flavus;Mg:稻瘟病菌M. oryzae;Sc:酿酒酵母S. cerevisiae
2.2 FgOAR1基因敲除和回补
运用同源重组基因敲除法构建Δ突变体。以PH-1基因组DNA为模板,扩增的上游同源片段a,长度为701 bp,下游同源片段b,长度为695 bp,以pCB1003质粒DNA为模板,扩增潮霉素编码基因前段H1片段,长度为764 bp,后段H2片段,长度为930 bp。a和H1片段,b和H2片段进行overlap-PCR扩增,得到aH1长度1 464 bp,bH2长度为1 625 bp,琼脂糖凝胶电泳检测目的条带大小,与理论值一致(图2-A),表明基因敲除载体构建成功。
同源片段转化PH-1原生质体获得转化子,用4对引物检测阳性转化子,FgOAR1_5F/6R引物扩增目的基因编码区,无阳性条带,表明转化子中目的基因已被替换,h850/h852引物扩增aH1与bH2的overlap融合区,检测条带大小为750 bp,表明转化子中两个片段成功融合;引物FgOAR1_7F/h855R和h856F/ FgOAR1_8R分别扩增上游同源区与潮霉素编码基因的overlap融合区,潮霉素编码基因与下游同源片段的overlap融合区,片段大小分别为1 038和1 042 bp,表明潮霉素成功插入上下游同源片段之间,实现目的基因替换,扩增目的条带大小与理论值符合(图2-B),突变体构建成功。
同时,以PH-1基因组为模板,引物FgOAR1_hbF/ R扩增目的基因全长1 643 bp,利用Gap repair方法进行回补载体构建,引物insert_F/R和FgOAR1_5F/6R进行PCR验证,扩增目的片段长度1 915和614 bp,符合试验预期(图2-C)。扩增产物纯化后,送公司测序,测序结果与原序列一致,没有突变,表明回补载体构建成功。回补载体转化突变体原生质体,构建回补突变株Δ-C,提取基因组DNA,进行PCR鉴定,1.0%琼脂糖凝胶电泳检测条带大小与理论值一致(图2-D)。

A:FgOAR1基因敲除载体构建Construction the FgOAR1 gene deletion vector。M:Marker 5000;a:FgOAR1上游同源片段FgOAR1 upstream homologous fragment (701 bp);b:FgOAR1下游同源片段FgOAR1 downstream homologous fragment (695 bp);H1:hph抗性基因上端The upper end of the hph resistance gene (764 bp);H2:hph抗性基因下端The lower end of the hph resistance gene (930 bp);aH1:a片段和H1片段进行Overlap的产物Overlap of a fragment and H1 fragment (1464 bp);bH2:b片段和H2片段Overlap后的产物Overlap of b fragment and H2 fragment (1625 bp)。B:转化子的PCR检测PCR detection of transformants。M:Marker 5000;CK:假阳性转化子false positive transformants;1:引物h850/h852扩增条带Amplification band of primer h850/h852 (750 bp);2:引物FgOAR1_5F/6R扩增,无条带Amplification of primer FgOAR1_5F/6R, no band;3:引物FgOAR1_7F/h855R扩增条带Amplification band of primer FgOAR1_7F/h855R (1038 bp);4:引物h856F/FgOAR1_8R扩增条带Amplification band of primer h856F/FgOAR1_8R (1042 bp)。C:回补片段扩增与连接Amplification of complementary fragment。M:Marker 2000,1:引物insert_F/R扩增片段Amplification band of primer insert_F/R (1915 bp);2:引物FgOAR1_5F/6R扩增片段Amplification band of primer FgOAR1_5F/6R (614 bp)。D:回补突变体的鉴定PCR identification of complementary mutant。M:Marker 5000;1:引物h850/h852扩增片段Amplification band of primer h850/h852 (750 bp);2:引物FgOAR1_hbF/R扩增片段Amplification band of primer FgOAR1_hbF/R (1643 bp)
2.3 菌落形态以及生长速度的测定
在PDA、5×YEG、CM基础培养基上接种PH-1、Δ和Δ-C菌株,培养3 d后,Δ与PH-1菌株相比菌落形态、菌落边缘、气生菌丝的疏密程度以及色素产生情况均无明显差异(图3)。检测菌落生长直径,计算生长速率显示,野生型菌株PH-1在PDA培养基上的生长速率最快,为1.20 cm·d-1,Δ的生长速率为1.19 cm·d-1,与PH-1相比,无显著差异(表2)。此外,PH-1菌株与突变体在5×YEG和CM培养基上生长速率相近,未呈现显著差异。表明在基本培养基中,对禾谷镰孢的生长无显著影响。
2.4 菌株在不同压力胁迫培养条件下的生长测定
在含有0.7 mol·L-1NaCl、0.03% H2O2、0.01% SDS和300 μg·mL-1Congo-Red的CM平板上分别接种PH-1、Δ和Δ-C,培养后观察菌丝形态。结果显示在0.7 mol·L-1NaCl胁迫条件下,PH-1生长速率为0.98 cm·d-1,Δ的生长速率0.62cm·d-1,比PH-1菌株降低36.7%,差异显著;在300 μg·mL-1Congo-Red和0.01% SDS压力胁迫下,Δ的菌丝生长速率分别为0.81和0.37 cm·d-1,PH-1的菌丝生长速率分别为1.15和0.54 cm·d-1,Δ相比PH-1分别显著降低29.6%和31.5%;在0.03% H2O2胁迫下,Δ的生长速率相比PH-1也显著降低20.0%(表3)。在4种压力胁迫条件下,突变体菌丝的生长速率显著低于野生型菌株,表明在不同压力培养条件下,具有更强的生物功能,可促进胁迫条件下菌丝的生长和发育(图4)。

图3 PH-1、ΔFgOAR1和ΔFgOAR1-C菌株的菌落形态

表2 3个菌株的生长速率测定

图4 PH-1、ΔFgOAR1及ΔFgOAR1-C菌株在不同胁迫条件下的菌落形态
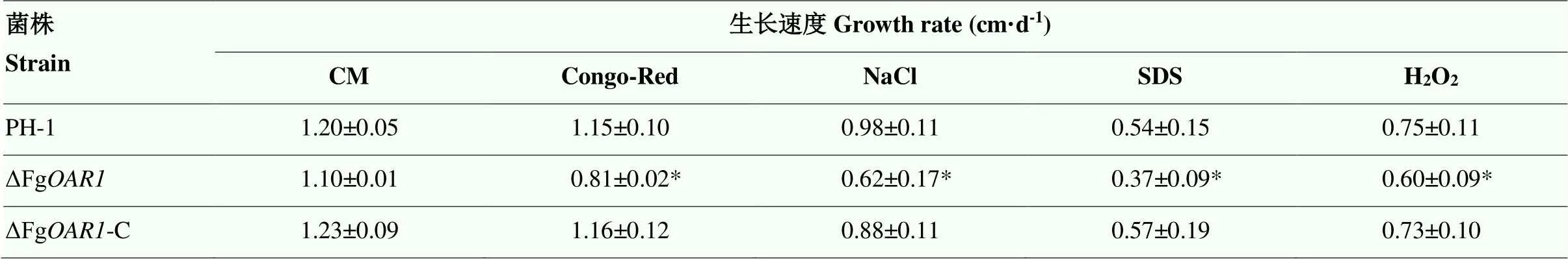
表3 PH-1、ΔFgOAR1和ΔFgOAR1-C菌株在不同胁迫下的生长速率
*:差异显著Significant difference (<0.05)。下同The same as below
2.5 脂肪酸含量测定
在禾谷镰孢pH-1和Δ菌株中,均检出4种类型的脂肪酸,分别为十六烷酸(软脂酸)、十八烷酸(硬脂酸)、顺-9-十八碳一烯酸甲酯(油酸)、十八二烯酸(亚油酸),其中以亚油酸的相对含量最为丰富,达到43.34%,硬脂酸最少,为3.82%,软脂酸(11.78%)和油酸(14.87%)居于二者之间。Δ与pH-1菌株相比,4种脂肪酸的含量均无显著差异(图5),表明在基础培养基培养过程中,对脂肪酸的合成无明显影响。
2.6 FgOAR1对分生孢子产生和萌发的影响
CMC培养基中培养pH-1、Δ和Δ-C进行分生孢子定量分析,发现Δ、pH-1和Δ-C分生孢子浓度分别为0.81×106、1.26×106和1.15×106个/mL,与pH-1相比,Δ产孢量显著降低(图6-A),表明在分生孢子的形成过程中具有重要作用。
pH-1、Δ和Δ-C的分生孢子均为镰刀状,孢子形态均匀,每个孢子有5—7个隔膜,孢子表型无明显差异。孢子萌发后显微观察萌发状态,3个菌株孢子萌发率均高于95%,无显著差异。进一步测定孢子萌发8 h后形成的菌丝长度,PH-1产生菌丝的平均长度为362 µm,与突变体(353 µm)相比,二者无显著差异(图6-B)。缺失导致禾谷镰孢无性生殖过程分生孢子产量显著降低,但孢子形态和萌发状况无明显变化,表明该基因在孢子的生成过程中具有重要作用。

C16:0:十六烷酸(软脂酸)hexadecyclic acid;C18:0,十八烷酸(硬脂酸)octadecanoic acid;C18:1n9c:顺-9-十八碳一烯酸甲酯(油酸)octadecenoic acid;C18:2n6c:十八二烯酸(亚油酸)octadecadienoic acid

标尺bar =200 µm
2.7 突变体的有性生殖
黑光灯诱导培养8 d后,Δ可产生黑色颗粒状的子囊壳,且子囊壳的大小、形态和数量与PH-1菌株无明显差异。子囊壳成熟后,顶端可见喷发的子囊孢子。压开子囊壳,呈现花簇状子囊,每个子囊内含8个子囊孢子,子囊孢子一般含3个隔膜、4个细胞,Δ产生的子囊及子囊孢子数量与pH-1相比无明显变化(图7)。因此,对禾谷镰孢有性生殖过程中子囊壳、子囊孢子的释放以及子囊孢子形成无影响。

图7 PH-1、ΔFgOAR1及ΔFgOAR1-C菌株的有性生殖
2.8 FgOAR1在侵染过程中的作用
新鲜孢子接种小麦胚芽鞘7 d后,观察发病情况。PH-1侵染小麦胚芽鞘发病严重,病斑长度为5.5 cm,Δ也可侵染,但发病较轻,病斑长度为1.5 cm,Δ-C发病状况与PH-1相近,病斑长度5.0 cm,表明在小麦苗期生长阶段,缺失导致禾谷镰孢致病力降低(图8-A、8-B)。
在小麦扬花期进行穗部接种,PH-1和Δ均可侵染麦穗,导致小麦发病,二者病穗率均为100%。从致病程度而言,PH-1发病严重,接种后更多小花被侵染,小花发病率98.6%。但Δ发病率仅为38.6%(图8-C、8-D)。表明缺失后,禾谷镰孢对成株期小麦致病力显著降低。小麦籽粒成熟后进行毒素测定,结果显示接种PH-1和Δ的小麦DON毒素含量分别为431.03和421.05 µg·kg-1,二者无显著差异,表明在侵染小麦过程中,缺失对毒素的产生无影响。
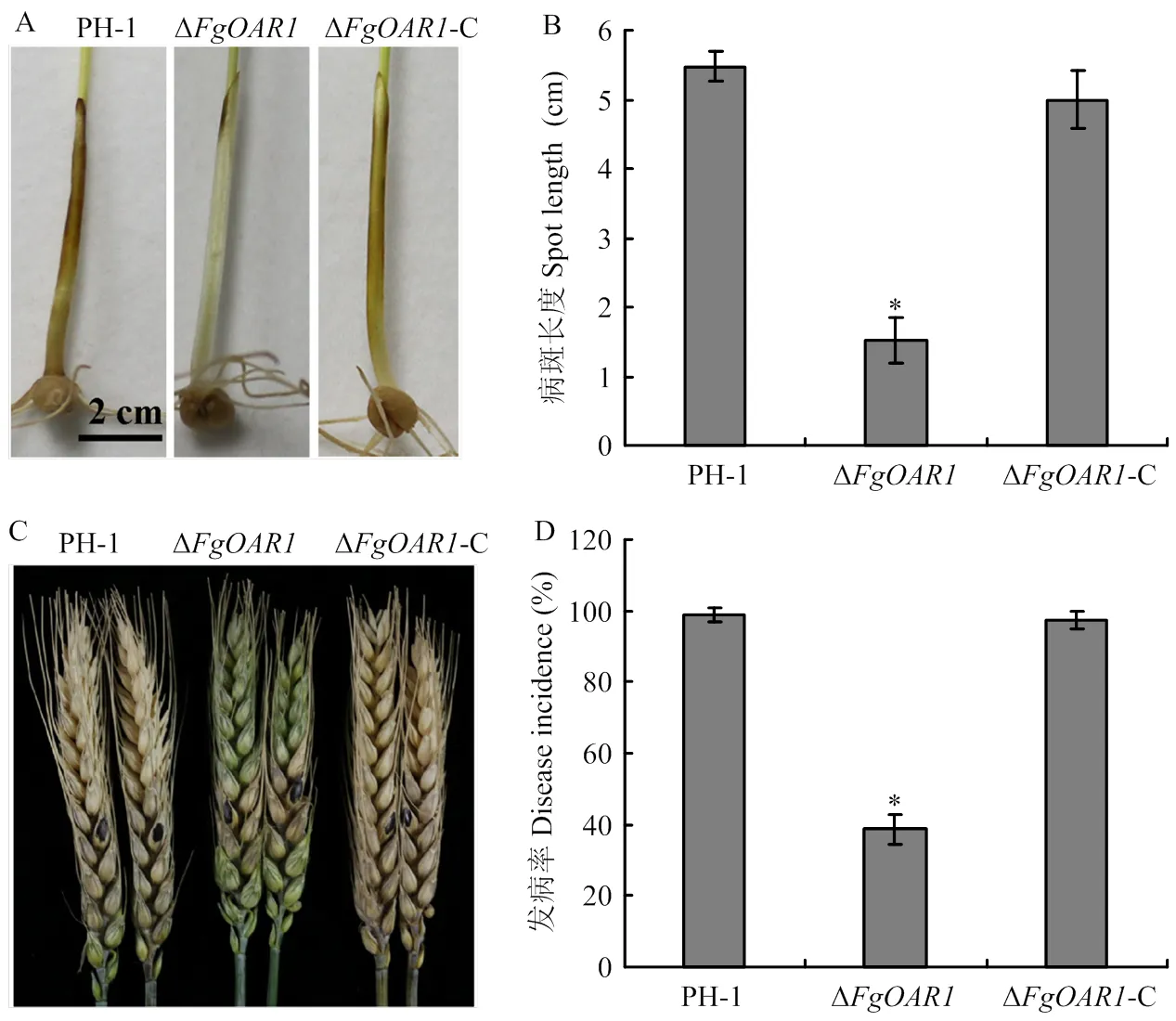
A:小麦胚芽鞘的侵染发病The infection on wheat coleoptile;B:病斑长度Spot length;C:对麦穗的侵染The infection on wheat spikelet;D:发病率统计Incidence statistics
2.9 FgOAR1在不同阶段的表达
在菌丝生长阶段和侵染小麦阶段的表达量明显不同[20-21]。在无胁迫培养基培养条件下,禾谷镰孢菌丝中的表达量很低,TPM(Transcript per Kilobase per Million mapped reads)均低于1,在36 h时达到最大值0.46。当接种到麦穗后,的表达量明显增高,接种48 h时TPM值为115.93,随侵染时间的延长,表达量也逐渐升高,到72 h时TPM值最高达141.18(图9)。表明在禾谷镰孢侵染小麦过程中,的表达受到诱导,表达量始终维持在高水平。
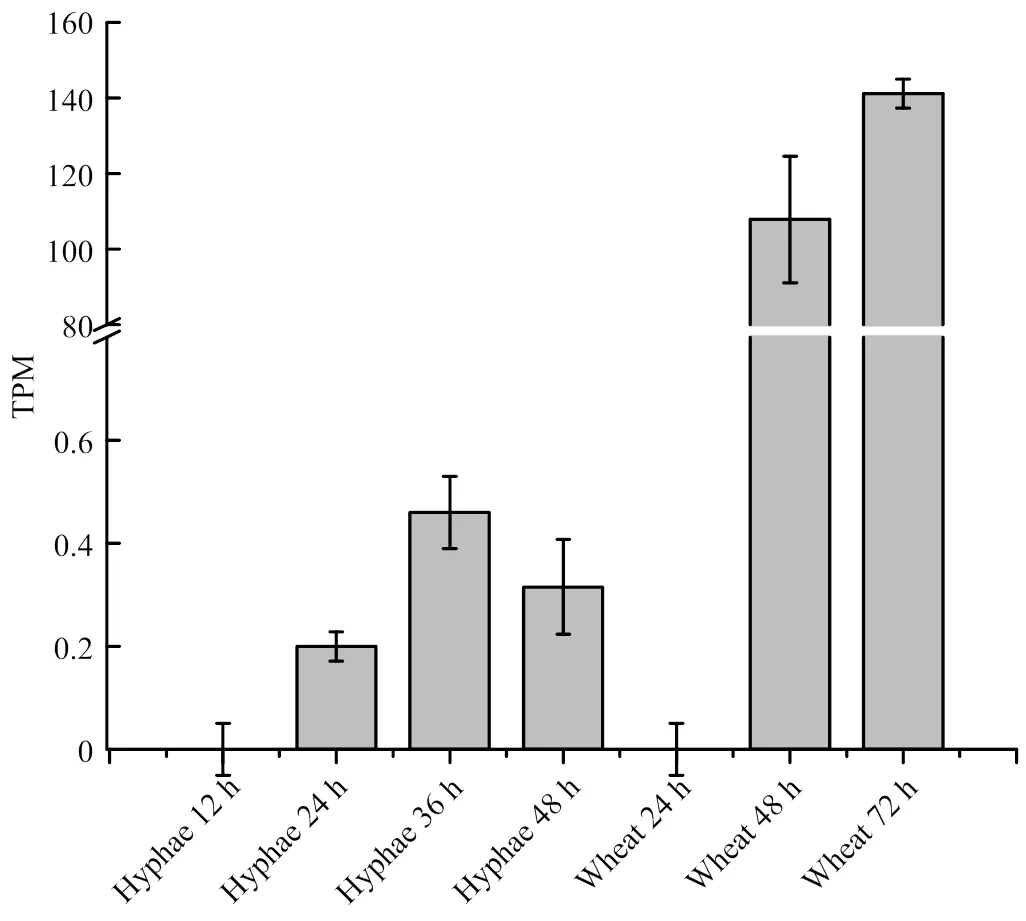
Hyphae 12 h, 24 h, 36 h, 48 h:PH-1接种到YEPD培养基上培养12、24、36、48 h时FgOAR1的表达量The expression level of FgOAR1 of PH-1 cultured in YEPD medium for 12, 24, 36, 48 h, respectively;Wheat 24 h, 48 h, 72 h:PH-1接种小麦麦穗24、48、72 h时FgOAR1的表达量The expression level of FgOAR1 of PH-1 inoculated on wheat spikelet for 24, 48, 72 h, respectively
3 讨论
3.1 脂肪酸的合成对禾谷镰孢生长具有重要作用
禾谷镰孢是一种兼性寄生菌,可侵染小麦、玉米、大麦、水稻、燕麦等多种禾谷类作物,造成严重的经济损失[22]。禾谷镰孢的侵染和致病受到众多基因调控,许多基因已被证明对禾谷镰孢的侵染和致病具有重要作用,其编码蛋白也被认定为赤霉病防控的潜在靶位点[23-24]。脂肪酸是真菌细胞中磷脂、脂多糖和脂蛋白的重要组成部分,对细胞膜的形成、病原真菌的生长、发育和致病等具有重要作用。本研究对禾谷镰孢脂肪酸合成途径的氧酰基载体蛋白还原酶OAR1开展研究,构建缺失突变体与回补突变体,揭示该基因对禾谷镰孢生长、发育和致病的影响,明确其生物学功能,可为新型抑菌剂的研发及作用靶点的筛选提供理论依据。
3.2 在胁迫条件下,FgOAR1对禾谷镰孢的生长具有更强的促进作用
Δ突变体菌株在常规PDA、CM、YEG培养基上,菌丝直径、生长速率与野生型菌株无显著差异,表明在常规培养条件下,缺失后,对菌丝的生长无影响。在禾谷镰孢的基因组中,存在7个同源基因,基因编号分别为FGSG_03438、FGSG_03838、FGSG_09169、FGSG_11198、FGSG_ 04045、FGSG_06029、FGSG_06455,对所有基因均进行敲除,发现前4个基因为微效基因,缺失后对禾谷镰孢生长和侵染的影响较小,后3个基因为主效基因(致死基因),缺失后禾谷镰孢无法生长。因此,禾谷镰孢脂肪酸合成途径中,氧酰基载体蛋白还原酶存在多个同源基因,本研究敲除的(FGSG_03438)为微效基因,该基因缺失后,其同源基因存在功能补偿,故常规培养条件下无表型变化。
与常规培养下的无表型变化相比,Δ突变体菌株在NaCl、H2O2、SDS和Congo-Red压力胁迫条件下,菌丝生长速率显著低于野生型菌株。在胁迫因子的影响下,同源基因的补偿作用不足,可能发挥更为重要的作用,故该基因缺失后,突变体菌株生长速率显著降低。SDS是一种阴离子表面活性剂,可以干扰细胞膜的生物合成[25],当敲除后,突变体对SDS的响应更敏感,细胞膜形成受抑制,菌丝生长减慢,生长速率显著低于野生型。参与的脂肪酸合成与细胞膜形成直接相关,缺失影响细胞膜的合成,而细胞膜表面含有多种蛋白酶和调控因子,细胞膜的合成受阻对禾谷镰孢的生长发育各方面均产生影响。禾谷镰孢细胞壁的主要组成成分是几丁质[26],其生物合成必须依赖于细胞膜,当细胞膜合成受阻后,也导致突变体在Congo-Red(几丁质合成抑制剂,破坏细胞壁完整性)[27-30]的胁迫下,菌丝的生长速度显著降低。同时,细胞膜的合成受抑制,也引起细胞对氧化应激和渗透压的响应性降低,因此突变体菌株在H2O2、NaCl的协迫作用下[31],生长速率也显著低于野生型菌株。
3.3 FgOAR1对禾谷镰孢的侵染和致病具有重要作用
在禾谷镰孢侵染小麦试验中,突变体菌株的致病力显著低于野生型菌株,表明在禾谷镰孢的侵染和致病过程中也发挥重要作用。在病原菌侵染植物过程中,病原菌与植物间存在复杂的互作机制,植物通过自身的免疫防御系统,能够识别病原菌的入侵,激活防御系统,抵御病原菌的侵染和危害[32],而植物的防御反应对于病原菌而言,同样是一种胁迫刺激。在胁迫因子的作用下,被激活,发挥更重要的作用。因此当敲除时,禾谷镰孢对胁迫刺激的响应丧失,无法发挥作用,禾谷镰孢侵染能力减弱导致致病力显著降低。在禾谷镰孢侵染小麦过程中,的表达量受诱导后显著提高,在禾谷镰孢的侵染和致病过程中具有重要作用,因此缺失后,突变体的致病力显著降低。后续将进一步借助多组学分析技术,探究的具体功能,进一步揭示禾谷镰孢响应逆境胁迫诱导的分子机制。
4 结论
参与脂肪酸的生物合成,对菌丝细胞膜的形成具有重要作用。该基因在胁迫因子诱导条件下能发挥更重要的作用,有利于胁迫条件下禾谷镰孢的菌丝生长,以及侵染小麦过程中致病力的提升。综上,对禾谷镰孢的生长、发育和致病具有重要影响,可作为潜在的赤霉病防控靶点,用于新型抑菌剂的研发。
[1] ZHANG J B, LI H P, DANG F J, QU B, XU Y B, ZHAO C S, LIAO Y C. Determination of the trichothecene mycotoxin chemotypes and associated geographical distribution and phylogenetic species of theclade from China. Mycological Research, 2007, 111(8): 967-975.
[2] 陆维忠, 程顺和, 王裕中. 小麦赤霉病研究. 北京: 科学出版社, 2001: 2-39.
LU W Z, CHENG S H, WANG Y Z. The study on wheat scab. Beijing: Science Press, 2001: 2-39. (in Chinese)
[3] 徐雍皋, 陈利锋. 小麦赤霉病防治理论研究与实践. 南京: 江苏科学技术出版社, 1993.
XU Y G, CHEN L F. Theoretical research and practice of wheat Scab control. Nanjing: Jiangsu Science and Technology Press, 1993. (in Chinese)
[4] BAI G H, SHANER G. Management and resistance in wheat and barley to Fusarium head blight. Annual Review of Phytopathology, 2004, 42: 135-161.
[5] MCMULLEN M, JONES R, GALLENBERG D. Scab of wheat and barley: a re-emerging disease of devastating impact. Plant Disease, 1997, 81(12): 1340-1348.
[6] PESTKA J J. Deoxynivalenol: mechanisms of action, human exposure, and toxicological relevance. Archives of Toxicology, 2010, 84(9): 663-679.
[7] MAGAN N, HOPE R, COLLEATE A, BAXTER E S. Relationship between growth and mycotoxin production byspecies, biocides and environment. European Journal of Plant Pathology, 2002, 108(7): 685-690.
[8] 宫安东, 韩萌真, 孔宪巍, 魏彦博, 王磊, 程琳. 茶树内生菌的应用性研究进展. 信阳师范学院学报(自然科学版), 2017, 30(1): 168-172.
GONG A D, HAN M Z, KONG X W, WEI Y B, WANG L, CHENG L. Application analysis of endophytic microbes in. Journal of Xinyang Normal University (Natural Science Edition), 2017, 30(1): 168-172. (in Chinese)
[9] GÜNENC A N, GRAF B, STARK H, CHARI A. Fatty acid synthase: structure, function, and regulation. Sub-Cellular Biochemistry, 2022, 99: 1-33.
[10] HE M, SU J, XU Y P, CHEN J H, CHERN M, LEI M L, QI T, WANG Z K, RYDER L S, TANG B Z,. Discovery of broad-spectrum fungicides that block septin-dependent infection processes of pathogenic fungi. Nature Microbiology, 2020, 5(12): 1565-1575.
[11] SMITH S, AGRADI E, LIBERTINI L, DILEEPAN K N. Specific release of the thioesterase component of the fatty acid synthetase multienzyme complex by limited trypsinization. Proceedings of the National Academy of Sciences of the United States of America, 1976, 73(4): 1184-1188.
[12] CROSS E M, ADAMS F G, WATERS J K, ARAGAO D, EIJKELKAMP B A, FORWOOD J K. Insights intofatty acid synthesis 3-oxoacyl-ACP reductases. Scientific Reports, 2021, 11(1): 7050.
[13] YU Y H, MA J R, GUO Q Q, MA J C, WANG H H. A novel 3-oxoacyl-ACP reductase (FabG3) is involved in the xanthomonadin biosynthesis ofpv.. Molecular Plant Pathology, 2019, 20(12): 1696-1709.
[14] SCHNEIDER R, BRORS B, BÜRGER F, CAMRATH S, WEISS H. Two genes of the putative mitochondrial fatty acid synthase in the genome of. Current Genetics, 1997, 32(6): 384-388.
[15] WANG C F, ZHANG S J, HOU R, ZHAO Z T, ZHENG Q, XU Q J, ZHENG D W, WANG G H, LIU H Q, GAO X L, MA J W, KISTLER H C, KANG Z S, XU J R. Functional analysis of the kinome of the wheat scab fungus. PLoS pathogens, 2011, 7(12): e1002460.
[16] QIN J X, WU M C, ZHOU S Y. FgEaf6 regulates virulence, asexual/sexual development and conidial septation in. Current Genetics, 2020, 66: 517-529.
[17] ZHANG Y M, GAO X L, SUN M L, LIU H Q, XU J R. The FgSRP1 SR-protein gene is important for plant infection and pre-mRNA processing in. Environmental microbiology, 2017, 19(10): 4065-4079.
[18] 梁海东, 乔有明, 裴海昆, 段中华, 全小龙. 不同前处理分析植物脂肪酸的气相色谱-质谱法研究. 分析科学学报, 2015, 31(4): 525-528.
LIANG H D, QIAO Y M, PEI H K, DUAN Z H, QUAN X L. Comparison of different pre-processing methods to identify fatty acids in plants by gas chromatography-mass spectrometry. Journal of analytical science, 2015, 31(4): 525-528. (in Chinese)
[19] GONG A D, LI H P, YUAN Q S, SONG X S, YAO W, HE W J, ZHANG J B, LIAO Y C. Antagonistic mechanism of iturin A and plipastatin A fromS76-3 from wheat spikes against. PloS one, 2015, 10(2): e0116871.
[20] JIANG C, CAO S L, WANG Z Y, XU H J, LIANG J, LIU H Q, WANG G H, DING M Y, WANG Q H, GONG C, FENG C J, HAO C F, XU J R. An expanded subfamily of G-protein-coupled receptor genes inrequired for wheat infection. Nature microbiology, 2019, 4(9): 1582-1591.
[21] LIU H Q, WANG Q H, HE Y, CHEN L F, HAO C F, JIANG C, LI Y, DAI Y F, KANG Z S, XU J R. Genome-wide A-to-I RNA editing in fungi independent of ADAR enzymes. Genome research, 2016, 26(4): 499-509.
[22] DEAN R, VAN KAN J A L, PRETORIUS Z A, HAMMOND- KOSACK K E, DI PIETRO A, SPANU P D, RUDD J J, DICKMAN M, KAHMANN R, ELLIS J, FOSTER G D. The top 10 fungal pathogens in molecular plant pathology. Molecular Plant Pathology, 2012, 13(4): 414-430.
[23] SHARMA T, SRIDHAR P S, BLACKMAN C, FOOTE S J, ALLINGHAM J S, SUBRAMANIAM R, LOEWEN M C.Ste3 G-protein coupled receptor: a mediator of hyphal chemotropism and pathogenesis. mSphere, 2022, 7(6): e0045622.
[24] LI T, KIM D, LEE J. NADPH oxidase gene,, plays a critical role in development and virulence in. Frontiers in microbiology, 2022, 13: 822682.
[25] CHAYAKULKEEREE M, SORRELL T C, SIAFAKAS A R, WILSON C F, PANTARAT N, GERIK K J, BOADLE R, DJORDJEVIC J T. Role and mechanism of phosphatidylinositol-specific phospholipase C in survival and virulence of. Molecular Microbiology, 2008, 69(4): 809-826.
[26] ZHANG Y Z, CHEN Q, LIU C H, LIU Y B, YI P, NIU K X, WANG Y Q, WANG A Q, YU H Y, PU Z E, JIANG Q T, WEI Y M, QI P F, ZHENG Y L. Chitin synthase gene FgCHS8 affects virulence and fungal cell wall sensitivity to environmental stress in.Fungal biology, 2016, 120(5): 764-774.
[27] DING M Y, LI J, FAN X Y, He F, YU X Y, CHEN L, ZOU S S, LIANG Y C, YU J F. Aquaporin1 regulates development, secondary metabolism and stress responses in.Current Genetics, 2018, 64(5): 1057-1069.
[28] ZHU Q L, SUN L, LIAN J J, GAO X L, ZHAO L, DING M Y, LI J, LIANG Y C. The phospholipase C (FgPLC1) is involved in regulation of development, pathogenicity, and stress responses in. Fungal Genetics and Biology, 2016, 97: 1-9.
[29] BERMEJO C, RODRÍGUEZ E, GARCÍA R, RODRÍGUEZ-PENA J M, RODRÍGUEZ DE LA CONCEPCIÓN M L, RIVAS C, ARIAS P, NOMBELA C, POSAS F, ARROYO J. The sequential activation of the yeast HOG and SLT2 pathways is required for cell survival to cell wall stress. Molecular Biology of the Cell, 2008, 19(3): 1113-1124.
[30] RONCERO C, DURÁN A. Effect of calcofluor white and congo red on fungal cell wall morphogenesis:activation of chitin polymerization. Journal of Bacteriology, 1985, 163(3): 1180-1185.
[31] YANG K L, QIN Q P, LIU Y H, ZHANG L M, LIANG L L, LAN H H, CHEN C H, YOU Y C, ZHANG F, WANG S H. Adenylate cyclase acyA regulates development, aflatoxin biosynthesis and fungal virulence in. Frontiers in Cellular and Infection Microbiology, 2016, 6: 190.
[32] YUAN M H, JIANG Z Y, BI G Z, NOMURA K, LIU M H, WANG Y P, CAI B Y, ZHOU J M, HE S Y, XIN X F. Pattern-recognition receptors are required for NLR-mediated plant immunity. Nature, 2021, 592(7852): 105-109.
The effect of 3-oxyacyl ACP reductase geneon the growth, development and pathogenicity of
GONG AnDong, LEI YinYu, WU NanNan, LIU JingRong, SONG MengGe, ZHANG YiMei, YANG Guang, YANG Peng
College of Life and Science, Xinyang Normal University, Xinyang 464000, Henan
【Background】is the main pathogenic fungus which can infect wheat and result in Fusarium head blight. The infection ofleads to huge reduction in crop quality and yield, and produces different types of mycotoxins that endanger grain production and human health. 3-oxoacyl ACP reductase (OAR1), catalyzing carboxyacyl carrier protein to oxyacyl carrier protein, which plays an important role in the fatty acid biosynthesis of【Objective】To reveal the biological functionof, thedeletion mutants were constructed. The phenotype, cell structure, conidia concentration, sexual reproduction and pathogenicity of mutant were analyzed and compared with wild-type strain PH-1. The results will uncover the function of, and provide scientific evidences for the identification of novel antifungal target and control of Fusarium head blight.【Method】Wild-type strainPH-1 was used as material in this study. Split-Marker gene knockout technology was conducted to construct the Δmutants. The Δ-C reverting strain was obtained by the Gap-repair method. All strains were individually inoculated in common media (PDA, CM, YPG), and the stress selection medium containing Congo-Red, SDS, NaCl and H2O2, respectively. The mycelium phenotypes and fatty acid content were recorded. The strains were inoculated in CMC medium to analyze the conidia concentration. The carrot culture-medium was used to analyze the sexual reproduction of each strain. All strains were individually inoculated to the wheat coleoptile and spikelet to analyze the pathogenicity and mycotoxin content, respectively. The disease incidence of mutant strains was calculated and compared with PH-1 strain.【Result】Compared with the wild-type strain PH-1, the growth of Δmutant showed no difference in PDA, YEG and CM media. Whereas, under the pressure of 0.7 mol·L-1NaCl, 0.03% H2O2, 0.01% SDS and 300 μg·mL-1Congo-Red, the growth of Δmutant was significantly reduced compared with PH-1. The evidence demonstrated thatis related to the cell membrane and cell wall formation in. In CMC medium, the conidia concentration of Δmutant (8.1×105conidia/mL) was less than PH-1 (1.26×106conidia/mL) with significant difference; The pathogenicity analysis further demonstrated that the disease incidence of Δmutant was significantly lower than PH-1 in wheat coleoptile and spikelet inoculation tests.【Conclusion】participates in the fatty acid biosynthesis, and plays an important role in cell membrane formation of. The deletion ofresulted in the reduced resistance to pressures, decreased conidia production and pathogenicity. Therefore,is important for the growth, development and pathogenicity process of.
; Fusarium head blight; gene knockout;; pathogenicity

10.3864/j.issn.0578-1752.2023.24.005
2023-07-28;
2023-09-29
国家自然科学基金(31701740)、河南省自然科学基金(222300420519,222301420111)、河南省教育厅高等学校重点科研项目(24A210025)、河南省科技攻关项目(232102110202)、南湖学者奖励计划
宫安东,E-mail:gongad@xynu.edu.cn。通信作者张艺美,E-mail:xynuym@163.com
(责任编辑 岳梅)
