环境胁迫对锈赤扁谷盗呼吸速率及线粒体编码基因表达水平的影响
2023-12-28陈二虎袁国庆孙晟源唐培安
陈二虎,袁国庆,孙晟源,唐培安
环境胁迫对锈赤扁谷盗呼吸速率及线粒体编码基因表达水平的影响
陈二虎,袁国庆,孙晟源,唐培安
南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023
【背景】线粒体是生物体内一种重要细胞器,是细胞消耗氧和产生能量物质三磷酸腺苷(ATP)的主要场所,在生物体抵抗逆境过程中发挥重要作用。锈赤扁谷盗()是一种世界性储粮害虫,具有极强的环境适应性。【目的】分析锈赤扁谷盗呼吸速率及线粒体编码基因对不同环境胁迫的响应,探究线粒体在锈赤扁谷盗抗逆境胁迫中的应激反应。【方法】根据锈赤扁谷盗线粒体基因组数据鉴定获得线粒体编码基因,并设计相应实时荧光定量PCR(RT-qPCR)引物。通过生物测定方法得出锈赤扁谷盗对熏蒸剂(甲酸乙酯)、植物源杀虫剂(鱼藤酮)和储粮保护剂(阿维菌素)的毒力回归方程及LC30,并用该浓度对试虫进行后续药剂胁迫处理。利用RT-qPCR技术解析锈赤扁谷盗线粒体编码基因的时空(不同发育阶段和幼虫不同组织)表达模式。最后,使用CO2检测仪和RT-qPCR技术研究锈赤扁谷盗在高温(35和40 ℃)、甲酸乙酯、鱼藤酮、阿维菌素、饥饿等逆境胁迫下呼吸速率的变化以及线粒体编码基因的表达模式。【结果】共设计12个线粒体编码基因(除)的定量引物。RT-qPCR结果显示这些线粒体编码基因在3龄幼虫阶段均具有较高表达水平,且线粒体基因在3龄幼虫马氏管中特异性高表达。此外,高温胁迫下锈赤扁谷盗呼吸速率呈现显著上升趋势,线粒体编码基因及表达水平显著上升,而及则呈现显著下调趋势。甲酸乙酯熏蒸胁迫下锈赤扁谷盗呼吸速率显著降低,12个线粒体编码基因均显著下调表达,其中和的表达水平仅为对照组的3.48%和1.91%。鱼藤酮和阿维菌素胁迫下锈赤扁谷盗呼吸速率均显著降低,且除外的线粒体编码基因表达量均显著下调。饥饿胁迫下锈赤扁谷盗呼吸速率显著降低,且随着胁迫时间增加,线粒体编码基因表达水平下调愈加显著。【结论】锈赤扁谷盗呼吸代谢速率以及线粒体编码基因表达水平在不同逆境条件下均发生显著变化,暗示线粒体在锈赤扁谷盗适应高温、药剂和饥饿胁迫过程中发挥重要作用。
锈赤扁谷盗;环境胁迫;呼吸速率;线粒体编码基因
0 引言
【研究意义】锈赤扁谷盗()是一种世界性储粮害虫,主要分布于温带和热带地区,在农产品储运过程中一旦局部发生便会造成重大经济损失,其危害范围广,成虫和幼虫均可对破碎或受损伤的原粮造成破坏,如稻谷、豆类、油料和麦类等农产品及其加工产品[1-2]。线粒体作为独立拥有遗传信息的细胞器,其在昆虫适应环境变化的过程中起着重要的调节作用[3-6]。开展锈赤扁谷盗应答逆境胁迫时呼吸速率变化以及线粒体编码基因表达模式的研究,阐释线粒体在锈赤扁谷盗抗逆反应中的重要作用,可揭示试虫在不同环境条件下暴发成灾的潜在分子机制,进而为储粮害虫的防控提供理论依据。【前人研究进展】当昆虫处于逆境胁迫时,会通过多种机制来抵御外界环境对自身造成的不利影响[7]。例如热激蛋白在生物体抵御高温胁迫过程中发挥重要作用[8],同时体内会合成大量的抗氧化酶来缓解高温胁迫所造成的氧化压力[9]。而昆虫抗药性机制与多个基因有关,包括多种解毒代谢酶如细胞色素P450[10]、谷胱甘肽-转移酶[11]等。线粒体是生物体物质代谢的主要场所,线粒体会根据外界环境的变化迅速改变其氧化磷酸化过程、呼吸代谢水平与ATP(adenosine triphosphate)的生成速率[12-13]。呼吸速率是表征生命体代谢强度的重要参数,呼吸链由线粒体内膜上5个线粒体复合体组成,其在能量代谢过程中进行氧化磷酸化并产生ATP,且研究表明昆虫可能通过控制呼吸链复合体关键基因的表达水平来控制其呼吸代谢水平[14-15]。昆虫抵御高温时,作为细胞能量工厂的线粒体会参与生命体的呼吸和抗氧化代谢,如高温条件下龟纹瓢虫()的呼吸代谢强度显著提高[16]。此外,高温会提高昆虫体内活性氧(reactive oxygen species,ROS)的含量,ROS含量的提高会对线粒体的功能造成影响,例如高温下红头丽蝇()的肌肉组织线粒体功能受到损伤[17]。研究表明,昆虫还会通过调节线粒体基因的表达水平来应对高温胁迫,例如,灰飞虱()的和均受到低温选择的影响[18];三色书虱()的线粒体编码基因和在高温胁迫下其表达水平显著上调,表明线粒体基因表达水平与昆虫适应高温环境密切相关[19]。与高温相比,线粒体更易受到药剂胁迫的影响,会提高生物体ROS的含量,ROS对线粒体的损伤可导致氧化磷酸化功能的减弱,从而影响机体生命活动乃至寿命[20],同时会对线粒体的形态和膜结构造成影响[21]。线粒体抑制剂则会直接作用于电子呼吸链,例如埃及伊蚊()在氨基腈(线粒体复合体Ⅰ抑制剂)胁迫下,琥珀酸脱氢酶和细胞色素C氧化酶活性均上升,而过氧化氢酶被抑制,造成ROS的产生,最终因氧化胁迫而死亡[22]。熏蒸剂对昆虫的线粒体复合体也会造成影响,玉米象()的线粒体复合体Ⅰ和Ⅳ会受到辣根素的显著影响[23-24]。【本研究切入点】上述研究表明线粒体代谢强度随外界环境变化的调节能力与该物种对环境的适应能力具有一定的相关性,包括温度适应性、抗药性等[25-27]。而目前关于昆虫抗逆性机制的研究主要集中在核编码基因,有关昆虫纲线粒体编码基因的研究仍较为匮乏。【拟解决的关键问题】以我国储粮发生危害严重的锈赤扁谷盗为研究对象,分析不同逆境胁迫下锈赤扁谷盗呼吸速率变化以及线粒体编码基因响应逆境胁迫的表达模式,解析昆虫呼吸代谢反应以及线粒体相关基因在锈赤扁谷盗适应逆境胁迫过程中的作用。
1 材料与方法
试验于2022年7月至2023年7月在南京财经大学食品科学与工程学院储粮害虫防治实验室完成。
1.1 供试昆虫
供试锈赤扁谷盗采自湖南省岳阳市湘阴县长康镇长康油脂实业有限公司,并已在南京财经大学粮食储运国家工程实验室以人工饲料(全麦粉﹕酵母粉﹕小麦粒﹕燕麦碎=5﹕1﹕1﹕3)培养数代,培养期间未接触任何药剂。饲养环境为恒温(30±1)℃、相对湿度75%±5%、无光照。
1.2 生物信息学分析及线粒体编码基因引物设计
依据锈赤扁谷盗完整的线粒体基因组(GenBank登录号:MH475917)获得13个线粒体编码基因序列,通过引物设计软件Primer Premier设计用于荧光定量PCR技术(RT-qPCR)的引物,由于无法设计出合格的定量引物,因此本文研究了除外的12个锈赤扁谷盗线粒体编码基因,相关引物由南京金斯瑞生物科技有限公司合成。锈赤扁谷盗12个线粒体编码基因的特异性RT-qPCR引物如表1所示,以和为内参基因[28]。
1.3 锈赤扁谷盗对不同药剂敏感性测定
甲酸乙酯(品牌:阿拉丁;纯度:有效成分含量99%):将羽化后两周的锈赤扁谷盗成虫放于容量为1 L的广口瓶中,将不同浓度梯度甲酸乙酯滴在熏蒸盒底部的滤纸上,然后迅速用尼龙纱布将盒子包好,置于广口瓶内,盖上瓶盖,并用保鲜膜将瓶口密封。将广口瓶置于30 ℃的培养箱内全黑暗条件下进行熏蒸,每个处理供试成虫60头,熏蒸6h后散气,放入正常饲料中饲养24 h,并设空白对照。每个浓度设置3个生物学重复,24 h后统计试虫死亡率。
阿维菌素(品牌:索莱宝;纯度:有效成分含量95%)和鱼藤酮(品牌:阿拉丁;纯度:有效成分含量95%):使用丙酮溶解并稀释储粮保护剂阿维菌素和植物源杀虫剂鱼藤酮,将滤纸平铺在直径为6cm的一次性塑料培养皿中,用移液枪吸取稀释后的药剂300 μl均匀滴加在一次性滤纸上,取60头羽化后两周的锈赤扁谷盗成虫放在滤纸药膜上,待试虫自由爬行3min后,将试虫取出,放入正常饲料中饲养24h,对照组用相同体积的丙酮处理,统计试虫死亡率。
判断试虫死亡的标准是用小毛笔触碰试虫的躯体,如果试虫不动,干瘪,则视为试虫死亡,根据预试验结果,选定5个浓度梯度,使试虫死亡率范围达到16%—84%。根据不同浓度梯度下试虫校正死亡率,用SPSS 26.0软件分析试验数据,计算锈赤扁谷盗对甲酸乙酯、阿维菌素和鱼藤酮的毒力回归方程和LC30。
1.4 锈赤扁谷盗不同逆境胁迫的处理
高温处理:随机选取羽化后两周的锈赤扁谷盗成虫30头,置于恒温培养箱中,培养箱的温度分别设置为30℃(正常饲养温度)、35和40℃(高温胁迫温度),每个温度处理时间分别为0、2、4、6、12、24、36及48h,相对湿度均设置为75%±5%。不同药剂胁迫处理:根据1.3计算得到锈赤扁谷盗对不同药剂(甲酸乙酯、阿维菌素和鱼藤酮)的LC30,随机选取羽化后两周的锈赤扁谷盗成虫30头,并采取1.3描述的方法利用不同药剂的LC30浓度对试虫进行药剂胁迫处理。饥饿胁迫处理:随机选取羽化后两周的锈赤扁谷盗成虫30头,在无饲料的情况下置于恒温培养箱中,培养箱的温度设置为30℃,相对湿度设置为75%±5%,分别处理0、1、2和3 d,其中0 d为对照。
1.5 不同逆境胁迫下锈赤扁谷盗呼吸速率检测
挑选不同逆境胁迫(高温、药剂和饥饿胁迫)下的锈赤扁谷盗10头,置于50ml的玻璃虫室中,塞紧塞子使之密闭,根据GB/T29890—2013《粮油储藏技术规范》中的要求检查气密性,置于相应的环境下使用便携式CO2检测仪(B1010,深圳市沃赛特科技有限公司)监测密闭虫室内的CO2含量,试虫放入气室后需要10 min左右的时间才能进入稳定的呼吸状态,待稳定后每组生物学重复测量30 min,每隔3 min记录一次数据,重复3次。呼吸速率以每头锈赤扁谷盗每分钟释放的CO2(μL·l-1·min-1)表示。
1.6 不同发育阶段和组织线粒体编码基因表达模式分析
选取同一批发育状态良好的卵、1—4龄幼虫、预蛹、蛹(5日龄蛹)以及羽化两周后的成虫各30头,选取完毕后的试虫立即放入-80 ℃液氮中冷冻备用,每组样本均设置3个生物学重复。此外,选取同一批发育状态良好的3龄锈赤扁谷盗幼虫120头,分别解剖获得表皮、肠道、脂肪体、马氏管等不同组织,并于-80 ℃液氮中冷冻备用,且每个组织样本设置3个生物学重复。用Trizol法提取上述各样品总RNA(RNA浓度为500—600 ng·μl-1),利用RQ1 RNase-Free DNase清除基因组DNA。通过核酸浓度测定仪进行样本RNA浓度和纯度测定,同时使用琼脂糖凝胶电泳对样品RNA完整性进行检测。通过反转录试剂盒HiScript®II 1st Strand cDNA Synthesis Kit(+gDNA wiper)(南京诺唯赞生物科技有限公司,中国)合成第一链cDNA,所获得的目标产物于-20 ℃冰箱中进行保存,以备后续使用。采用ChamQTM SYBR® qPCR Master Mix(Low Rox Premixed)712试剂盒,使用ABI 7500 PCR系统(Applied Biosystems,USA)进行实时荧光定量PCR反应,对锈赤扁谷盗线粒体编码基因相对表达量进行分析,试验中的每个样品设置3次生物学重复和3次技术性重复,利用2-∆∆Ct方法进行定量数据分析[29]。
1.7 线粒体编码基因响应不同逆境胁迫表达模式分析
挑选不同逆境胁迫(高温、药剂和饥饿胁迫)下的锈赤扁谷盗试虫,参照1.6的方法对不同逆境胁迫处理的昆虫样品进行总RNA提取、cDNA合成、RT-qPCR以及定量数据分析,计算获得线粒体编码基因响应不同逆境胁迫的表达模式,且每组样本均设置3个生物学重复。
1.8 数据统计与分析
使用Origin 2021作图,SPSS 26.0分析试验数据,高温和饥饿胁迫下的呼吸速率和基因相对表达量采用单因素方差分析(one-way ANOVA)进行均值多重比较,并利用图基检验法(Tukey’s test)进行显著性分析(<0.05)。药剂胁迫下的呼吸速率和线粒体编码基因表达水平采用独立样本检验进行差异显著性分析(*<0.05,**<0.01,***<0.001)。
2 结果
2.1 锈赤扁谷盗对不同药剂的敏感性
采用熏蒸剂甲酸乙酯、植物源杀虫剂鱼藤酮和储粮保护剂阿维菌素对锈赤扁谷盗进行药剂胁迫(LC30)处理,锈赤扁谷盗对上述3种药剂的敏感性测定结果如表2所示,LC30分别为8.3μL·l-1(甲酸乙酯)、1 696.7 mg·l-1(鱼藤酮)和2.6 mg·l-1(阿维菌素)。

表2 锈赤扁谷盗对不同杀虫剂的敏感性
2.2 锈赤扁谷盗线粒体编码基因不同发育阶段和组织表达模式
锈赤扁谷盗线粒体编码基因在不同发育阶段的表达模式如图1所示,12个线粒体基因在试虫不同发育阶段均有所表达,其中在3龄幼虫时期均具有较高表达水平,而在4龄幼虫及预蛹阶段表达量处于较低水平。
由于线粒体基因均在锈赤扁谷盗3龄幼虫阶段呈现较高表达水平,因此进一步解析了上述基因在该发育阶段不同组织的表达模式。如图2所示,线粒体基因在锈赤扁谷盗3龄幼虫的不同组织均有所表达,其中在幼虫脂肪体和表皮组织中表达水平较低,且除外,11个线粒体编码基因均在幼虫马氏管中显著高表达。
2.3 锈赤扁谷盗响应高温胁迫呼吸速率变化和线粒体编码基因表达模式
30℃(正常饲养温度)条件下,锈赤扁谷盗呼吸速率和线粒体编码基因处于稳定状态(图3-A、3-B)。高温胁迫下,锈赤扁谷盗呼吸速率处于逐渐上升的趋势(图3-A),在持续胁迫48 h过程中,和未出现显著性差异表达(≥0.05),及的表达量随胁迫时间的增加呈显著性上调趋势,而及的表达量随胁迫时间的增加呈显著性下调趋势(<0.05)(图3-C、3-D),且上述基因在高温胁迫下具有时间效应。
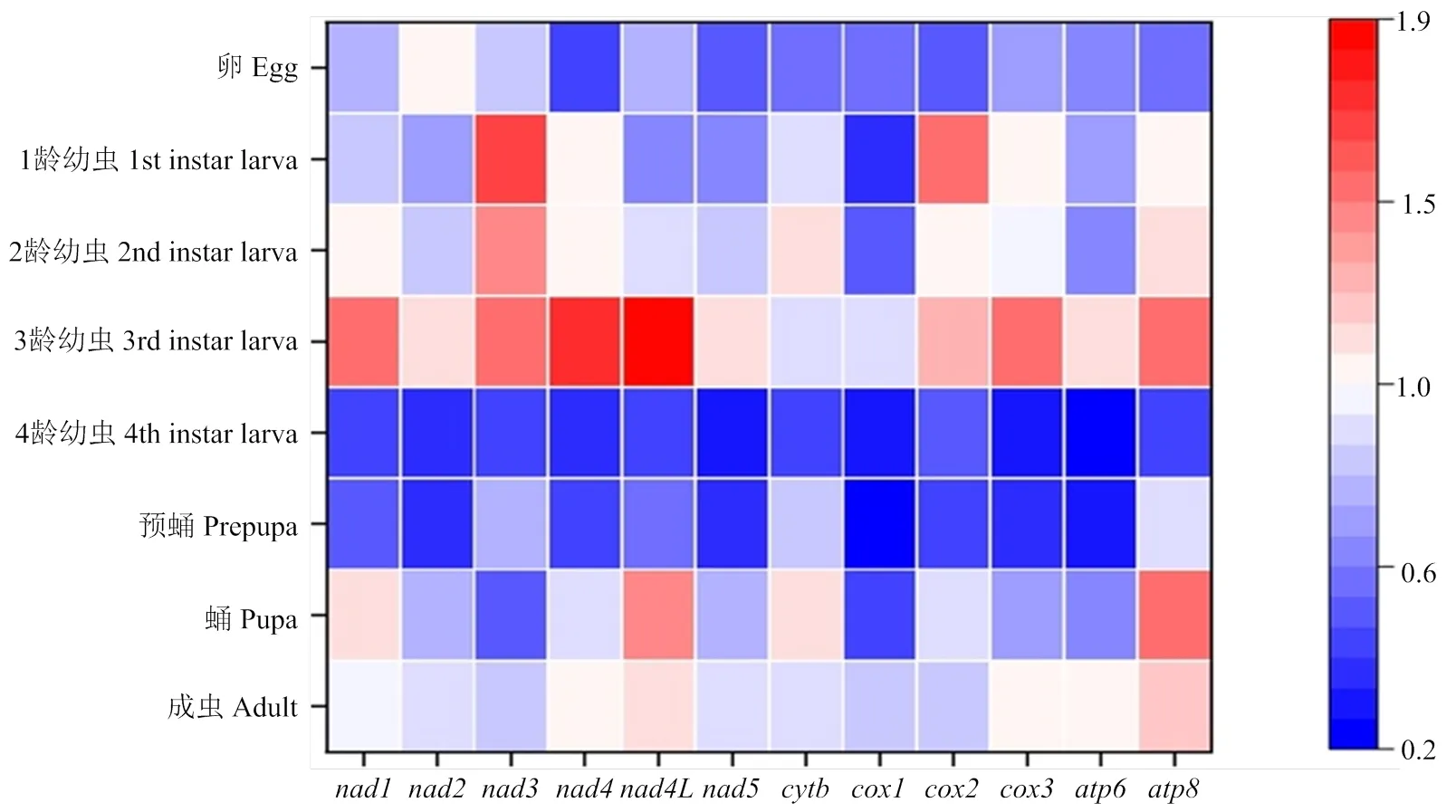
线粒体基因表达水平用热图进行表示,红色代表高表达,蓝色代表低表达The expression levels of mitochondrial protein-coding genes are represented as a heat map with red indicating high expression and blue indicating low expression。图2同The same as Fig. 2

图2 锈赤扁谷盗线粒体编码基因幼虫不同组织表达模式
2.4 锈赤扁谷盗响应熏蒸剂甲酸乙酯胁迫呼吸速率变化和线粒体编码基因表达模式
锈赤扁谷盗经甲酸乙酯胁迫后呼吸速率显著降低(<0.001)(图4-A);甲酸乙酯胁迫下,除外的11个线粒体编码基因表达量均显著下调(<0.05),和表达量下调最为显著(<0.001),尤其是和,表达量仅为对照组的3.48%和1.91%(图4-B)。
2.5 锈赤扁谷盗响应鱼藤酮和阿维菌素胁迫呼吸速率变化和线粒体编码基因表达模式
鱼藤酮和阿维菌素胁迫下锈赤扁谷盗呼吸速率均显著降低(<0.001)(图5-A、5-B)。鱼藤酮胁迫下,12个线粒体编码基因表达量均显著下调(<0.05),其中及表达量下调更为显著(<0.001)(图5-C),仅为对照组(丙酮处理)的40.81%、39.36%、43.00%、37.79%和51.16%。阿维菌素胁迫下,除外,其他11个线粒体编码基因表达量均显著下调(<0.05),其中和表达量下调更为显著(<0.01)(图5-D)。

图中数据为平均值±标准差,差异显著性分析采用独立样本t-test Data are mean±SD, and independent sample t test was used to analyze the significance of the difference (* P<0.05, ** P<0.01, *** P<0.001)。图5同The same as Fig. 5
2.6 锈赤扁谷盗响应饥饿胁迫呼吸速率变化和线粒体编码基因表达模式
锈赤扁谷盗的呼吸速率随着饥饿胁迫时间的延长呈现降低趋势(图6-A)。12个线粒体编码基因的表达量同时随着饥饿胁迫时间的延长呈现下调趋势,其中在饥饿胁迫2 d后显著下调,在饥饿胁迫3 d后显著下调,其余10个线粒体编码基因均在饥饿胁迫1 d后显著下调(<0.05)(图6-B)。
3 讨论
3.1 锈赤扁谷盗线粒体编码基因具有发育阶段和组织表达特异性
昆虫线粒体编码基因具有时空表达模式的特异性[14]。类似地,本研究发现锈赤扁谷盗12个线粒体编码基因在3龄幼虫中相对高表达(图1),暗示其在3龄幼虫时期的发育过程中起到关键作用。3龄幼虫可能通过上调线粒体编码基因表达水平响应代谢需求的提升,如埃及伊蚊()的线粒体编码基因的表达量在其1、2龄达到峰值,从而保证其正常生长发育[30]。在4龄幼虫和预蛹时期线粒体编码基因相对低表达,相关研究证明线粒体是蜕皮激素的靶标位点,而该阶段正是锈赤扁谷盗幼虫蜕皮与蛹期形成的过渡阶段,试虫蜕皮激素含量提升,进而抑制线粒体基因的表达[31]。王磊研究表明线粒体编码基因在橘小实蝇()中肠和脂肪体组织中显著高表达[14],本研究发现除外的11个线粒体编码基因在幼虫马氏管中高表达。马氏管是昆虫的主要排泄器官[32],且与中肠和脂肪体共同组成昆虫的代谢中心,承担着昆虫解毒代谢反应,根据线粒体编码基因的组织特异性,推测线粒体可能对昆虫解毒代谢反应过程中的能量供应发挥重要作用。
3.2 锈赤扁谷盗响应高温胁迫呼吸速率变化和线粒体编码基因表达模式
线粒体在昆虫抵御温度胁迫中发挥重要作用,昆虫通常会通过呼吸代谢和抗氧化代谢两种机制来适应极端温度胁迫。本研究发现高温胁迫下试虫呼吸速率显著变化(图3-A),表明高温环境对锈赤扁谷盗呼吸代谢反应造成巨大影响,其呼吸速率不断升高,暗示锈赤扁谷盗体内代谢水平处于逐渐上升状态。类似地,研究发现亚洲小车蝗()[33]、点蜂缘蝽()[34]、西伯利亚蝗()[35]等昆虫在不同温度胁迫下,呼吸代谢相关酶活性发生显著变化,进一步证实了昆虫可通过调整其呼吸代谢强度来提高自身对高温环境的适应性。同时,高温胁迫对线粒体编码基因表达水平影响显著,高温处理下和表达量显著上调(图3),这与昆虫应对高温胁迫时其不断增加的呼吸代谢水平和能量需求相吻合。然而,本研究同样发现及均随高温持续胁迫其表达量显著下调(图3)。线粒体是细胞的能量工厂,也是ROS的主要生产场所[36],高温条件下线粒体产生更多的能量以满足自身需求,同样会产生更多的ROS,ROS的积累会引起机体氧化应激甚至死亡。和是NADH氧化还原酶即线粒体复合体Ⅰ的关键基因,是细胞色素C氧化酶即线粒体复合体Ⅳ的重要基因,则是ATP合成酶即线粒体复合体Ⅴ的关键基因,进而推测锈赤扁谷盗可能通过降低线粒体复合体关键基因的表达以减少由于高温导致的氧化应激反应,增强试虫的高温适应能力。如在40 ℃胁迫下,橘小实蝇通过下调线粒体编码基因和的表达量以抵御氧化应激[14]。

A:鱼藤酮胁迫下呼吸速率的变化the changes of respiratory rate under rotenone stress;B:阿维菌素胁迫下呼吸速率变化the changes of respiratory rate under avermectin stress;C:鱼藤酮胁迫下线粒体编码基因相对表达量变化The relative expression changes of mitochondrial protein-coding genes under rotenone stress;D:阿维菌素胁迫下线粒体编码基因相对表达量变化The relative expression changes of mitochondrial protein-coding genes under avermectin stress

A:饥饿胁迫下呼吸速率变化The changes of respiratory rate under starvation stress;B:饥饿胁迫下线粒体编码基因相对表达量变化The relative expression changes of mitochondrial protein-coding genes under starvation stress
3.3 锈赤扁谷盗响应药剂胁迫呼吸速率变化和线粒体编码基因表达模式
目前,由于储粮行业对传统熏蒸剂磷化氢的长期过度使用,储粮害虫已对其产生较高抗性,严重影响储粮行业的健康发展[37-39]。本研究生测结果显示,甲酸乙酯对锈赤扁谷盗具有较好的熏蒸杀虫效果,表明其在储粮害虫防治方面具有较大的应用潜力。陈艳研究发现,磷化氢处理后锈赤扁谷盗呼吸速率与线粒体编码基因表达量均显著下调[40],本研究与之结果一致,甲酸乙酯胁迫处理后试虫呼吸速率显著降低且伴随线粒体编码基因表达量显著下降(图4)。据此推测,锈赤扁谷盗面对不同熏蒸剂时表现出相同的响应机制,一方面熏蒸剂磷化氢和甲酸乙酯均主要利用昆虫呼吸作用进入虫体内,当锈赤扁谷盗处于药剂熏蒸环境时,可通过调节线粒体和呼吸代谢相关基因的表达水平,降低呼吸速率,减少熏蒸剂的吸收,进而适应熏蒸胁迫的逆境[41];另一方面,推断线粒体呼吸链可能是熏蒸剂的靶标系统,熏蒸胁迫会造成该系统的崩溃,产生级联效应而抑制线粒体相关功能,进而降低呼吸速率和线粒体基因表达水平。
鱼藤酮广泛分布于鱼藤属植物的根皮部,是一种植物源杀虫剂,该药剂胁迫下,锈赤扁谷盗呼吸速率和线粒体编码基因表达量呈现下调趋势(图5-A、5-C)。其中及的表达量显著下调,上述基因是NADH氧化还原酶即线粒体复合体Ⅰ的基因。且已有研究表明鱼藤酮作用靶标为线粒体复合体Ⅰ,通过促进线粒体活性氧的产生进而诱导细胞的凋亡,如鱼藤酮使大鼠线粒体内ATP合成能力减弱,线粒体内ATP酶活性降低,并诱导大鼠肝细胞线粒体发生氧化应激损伤[42]。鱼藤酮胁迫导致猪的活性线粒体与总线粒体的比例降低,增加了ROS的产生,并减少了ATP的产生[43]。同时本研究发现线粒体ATP合成酶的基因和的表达量显著下调,表明试虫ATP含量可能会降低,从而进一步增强线粒体氧化损伤程度。
储粮保护剂阿维菌素是一种具有较高毒性的天然产物[44],由表2可见低浓度阿维菌素即可对锈赤扁谷盗产生致死作用。阿维菌素是一种神经毒素,对昆虫的神经传导具有抑制作用,本研究发现在该药剂胁迫下,锈赤扁谷盗呼吸速率和线粒体编码基因表达量均显著降低(图5-B、5-D),暗示试虫体内氧化代谢水平被显著抑制。氟虫腈与阿维菌素均为神经毒素类杀虫剂,研究发现氟虫腈会抑制大鼠的氧消耗率、线粒体自噬、线粒体质量、线粒体膜电位、ATP生成以及线粒体转录反应,对线粒体的各方面机能造成损伤[45]。笔者推测,线粒体组织可能是阿维菌素重要的靶标位点,在阿维菌素胁迫条件下锈赤扁谷盗线粒体受到诱导损伤,进而造成昆虫呼吸代谢速率降低,且抑制线粒体编码基因表达。此外,阿维菌素胁迫下锈赤扁谷盗线粒体ATP合成酶基因和的表达量显著下调,可以推测阿维菌素作用机理可能与鱼藤酮类似,均会抑制锈赤扁谷盗线粒体膜电位和ATP含量。
3.4 锈赤扁谷盗响应饥饿胁迫呼吸速率变化和线粒体编码基因表达模式
饥饿胁迫下,锈赤扁谷盗呼吸速率呈现降低趋势(图6),暗示锈赤扁谷盗体内氧化代谢水平降低,推测饥饿状态下锈赤扁谷盗通过降低能量代谢以维持自身平衡。有研究表明饥饿胁迫会影响克氏锥虫()线粒体结构,丧失线粒体重塑与自噬功能[46]。秀丽隐杆线虫()在饥饿胁迫期间线粒体DNA(mtDNA)拷贝数减少以及饥饿引起发育停止期间DNA损伤的累积,线粒体功能也因饥饿而受损[47];根据以上结果可以推测,饥饿胁迫导致锈赤扁谷盗线粒体功能障碍,试虫通过降低线粒体编码基因表达量以保证线粒体的稳定性。
4 结论
锈赤扁谷盗12个线粒体编码基因具有时空表达特异性,表明线粒体编码基因在锈赤扁谷盗生长发育过程和组织中发挥重要作用。高温胁迫下,锈赤扁谷盗可能通过提升呼吸代谢速率和特定线粒体编码基因表达量来响应高温逆境,同时通过降低一部分线粒体复合体关键基因的表达以应对高温导致的氧化应激;熏蒸剂甲酸乙酯胁迫下,锈赤扁谷盗可能通过降低呼吸速率和线粒体编码基因表达量来减少甲酸乙酯吸入量;鱼藤酮胁迫导致锈赤扁谷盗呼吸速率和线粒体编码基因表达量显著降低;锈赤扁谷盗呼吸速率和线粒体编码基因积极响应阿维菌素胁迫,推测线粒体可能也是阿维菌素的作用靶标;饥饿胁迫下,由呼吸速率变化可以看出锈赤扁谷盗通过降低能量代谢水平维持自身平衡,同时会下调线粒体编码基因表达量来保证线粒体的稳定性。综上,锈赤扁谷盗呼吸代谢和线粒体编码基因对高温、药剂和饥饿胁迫呈现显著的应激反应,且试虫呼吸速率和线粒体基因表达量均表现出较为一致的响应规律。
[1] JIAN F, JAYAS D S, WHITE N D G. Optimal environmental search and scattered orientations during movement of adult rusty grain beetles,(Stephens), in grain bulks-suggested movement and distribution patterns. Journal of Stored Products Research, 2009, 45(3): 177-183.
[2] FLINN P W, HAGSTRUM D W. Distribution of(Coleoptera: Cucujidae) in response to temperature gradients in stored wheat. Journal of Stored Products Research, 1998, 34(2/3): 107-112.
[3] JARMUSZKIEWICZ W, DOMINIAK K, GALGANSKI L, GALGANSKA H, KICINSKA A, MAJERCZAK J, ZOLADZ J A. Lung mitochondria adaptation to endurance training in rats. Free Radical Biology and Medicine, 2020, 161: 163-174.
[4] YANG Y X, XU S X, XU J X, GUO Y, YANG G. Adaptive evolution of mitochondrial energy metabolism genes associated with increased energy demand in flying insects. PLoS One, 2014, 9(6): e99120.
[5] ZHANG Q L, YANG X Z, ZHANG L, FENG R Q, ZHU Q H, CHEN J Y, YUAN M L. Adaptive evidence of mitochondrial genomes in(Hemiptera: Pentatomidae) to divergent altitude environments. Mitochondrial DNA Part A, DNA Mapping Sequencing and Analysis, 2019, 30(1): 9-15.
[6] LI X D, JIANG G F, YAN L Y, LI R, MU Y, DENG W A. Positive selection drove the adaptation of mitochondrial genes to the demands of flight and high-altitude environments in grasshoppers. Frontiers in Genetics, 2018, 9: 605.
[7] MA C S, MA G, Pincebourde S. Survive a warming climate: insect responses to extreme high temperatures. Annual Review of Entomology, 2021, 66: 163-184.
[8] KANG D, SHIM S K. Early heat exposure effect on the heat shock proteins in broilers under acute heat stress. Poultry Science, 2021, 100(3): 100964.
[9] FU D, LIU J, PAN Y N, ZHU J Y, XIAO F, LIU M, XIAO R. Three heat shock protein genes and antioxidant enzymes protect(Araneae: Lycosidae) from high temperature stress. International Journal of Molecular Sciences, 2022, 23(21): 12821.
[10] YANG T, LI T, FENG X C, LI M, LIU S K, LIU N N. Multiple cytochrome P450 genes: conferring high levels of permethrin resistance in mosquitoes,. Scientific Reports, 2021, 11(1): 9041.
[11] ZHANG J Q, MA W, YIN F, PARK Y, ZHU K Y, ZHANG X Y, QIN X M, LI D Q. Evaluations of two glutathione S-transferase epsilon genes for their contributions to metabolism of three selected insecticides inPesticide Biochemistry and Physiology, 2022, 183: 105084.
[12] ZHAO R Z, JIANG S, ZHANG L, YU Z B. Mitochondrial electron transport chain, ROS generation and uncoupling. International Journal of Molecular Medicine, 2019, 44(1): 3-15.
[13] CAITO S W, ASCHNER M. Mitochondrial redox dysfunction and environmental exposures. Antioxidants and Redox Signaling, 2015, 23(6): 578-595.
[14] 王磊. 桔小实蝇线粒体编码基因转录表达及和的抗逆性功能[D]. 重庆: 西南大学, 2022.
WANG L. The expression profiles of mitochondrial genes and the functions ofandunderlying environmental stresses in the oriental fruit fly,(Hendel)[D]. Chongqing: Southwest University, 2022. (in Chinese)
[15] Signes A, Fernandez-Vizarra E. Assembly of mammalian oxidative phosphorylation complexes I-V and super complexes. Essays in Biochemistry, 2018, 62(3): 255-270.
[16] 高峰, 苏建伟, 戈峰, 吴刚, 刘向辉. 温度对龟纹瓢虫呼吸代谢的影响. 湖北农业科学, 2007, 46(4): 562-564.
GAO F, SU J W, GE F, WU G, LIU X H. Effect of temperature on the respiration and metabolism of ladybeetles,. Hubei Agricultural Sciences, 2007, 46(4): 562-564. (in Chinese)
[17] BOWLER K, KASHMEERY A M S. Effects ofheating of blowflies on the oxidative capacity of flight muscle sarcosomes: a differential effect on glycerol 3-phosphate and pyruvate plus proline respiration. Journal of Thermal Biology, 1981, 6(1): 11-18.
[18] Sun J T, Duan X Z, Hoffmann A A, Liu Y, Garvin M R, Chen L, Hu G, Zhou J C, Huang H J, Xue X F, Hong X Y. Mitochondrial variation in small brown planthoppers linked to multiple traits and probably reflecting a complex evolutionary trajectory. Molecular Ecology, 2019, 28(14): 3306-3323.
[19] 郎宁. 辣根素熏蒸处理下三色书虱线粒体相关基因表达研究[D]. 重庆: 西南大学, 2019.
LANG N. Expression of mitochondrial associated genes inunder allyl isothiocyanate fumigation[D]. Chongqing: Southwest University, 2019. (in Chinese)
[20] BALABAN R S, NEMOTO S, FINKEL T. Mitochondria, oxidants, and aging. Cell, 2005, 120(4): 483-495.
[21] 张同梅. 中国常用农药对蛋白酶体和线粒体的影响[D]. 长沙: 中南大学, 2011.
ZHANG T M. Effects of pesticides commonly used in China on the proteasome and mitochondria[D]. Changsha: Central South University, 2011. (in Chinese)
[22] BORRERO LANDAZABAL M A, CARRENO OTERO A L, KOUZNETSOV V V, DUQUE Luna J E, MENDEZ-SANCHEZ S C. Alterations of mitochondrial electron transport chain and oxidative stress induced by alkaloid-like alpha-aminonitriles onlarvae. Pesticide Biochemistry and Physiology, 2018, 144: 64-70.
[23] ZHANG C, Ma Z, ZHANG X, Wu H. Transcriptomic alterations inin response to allyl isothiocyanate fumigation. Pesticide Biochemistry and Physiology, 2017, 137: 62-70.
[24] ZHANG C, WU H, ZHAO Y, MA Z Q, ZHANG X. Comparative studies on mitochondrial electron transport chain complexes oftreated with allyl isothiocyanate and calcium phosphide. Pesticide Biochemistry and Physiology, 2016, 126: 70-75.
[25] LI X C, PERIS D, HITTINGER C T, SIA E A, Fay J C. Mitochondria-encoded genes contribute to evolution of heat and cold tolerance in yeast. Science Advances, 2019, 5(1): eaav1848.
[26] AW W C, GARVIN M R, Melvin R G, Ballard J W O. Sex-specific influences of mtDNA mitotype and diet on mitochondrial functions and physiological traits in. PLoS One, 2017, 12(11): e0187554.
[27] LLOPART A, HERRIG D, BRUD E, STECKLEIN Z. Sequential adaptive introgression of the mitochondrial genome inand. Molecular Ecology, 2014, 23(5): 1124-1136.
[28] TANG P A, DUAN J Y, WU H J, JU X R, YUAN M L. Reference gene selection to determine differences in mitochondrial gene expressions in phosphine-susceptible and phosphine-resistant strains of, using qRT-PCR. Scientific Reports, 2017, 7: 7047.
[29] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[30] ZHAO L, PRIDGEON J W, BECNEL J J, CLARK G G, LINTHICUM K J. Mitochondrial gene cytochrome b developmental and environmental expression in(Diptera: Culicidae). Journal of Medical Entomology, 2009, 46(6): 1361-1369.
[31] VAFOPOULOU X. Ecdysteroid receptor (EcR) is associated with microtubules and with mitochondria in the cytoplasm of prothoracic gland cells of(Hemiptera). Archives of insect biochemistry and physiology, 2009, 72(4): 249-262.
[32] FARINA P, BEDINI S, CONTI B. Multiple functions of malpighian tubules in insects: A review. Insects, 2022, 13(11): 1001.
[33] 郭娜, 高书晶, 王宁, 韩海斌, 徐林波, 董瑞文, 娜仁满都呼, 娜布其亚.温度对亚洲小车蝗成虫体内呼吸代谢相关酶和抗氧化酶活性的影响. 昆虫学报, 2020, 63(11): 1358-1365.
GUO N, GAO S J, WANG N, HAN H B, XU L B, DONG R W, NARENMANDUHU, NABUQIYA. Effects of temperature on the activities of respiratory metabolism-related and antioxidant enzymes in adults of(Orthoptera: Acridoidea). Acta Entomologica Sinica, 2020, 63(11): 1358-1365. (in Chinese)
[34] 陈菊红, 崔娟, 张金平, 毕锐, 高宇, 徐伟, 史树森. 温度胁迫对点蜂缘蝽成虫呼吸代谢关键酶活性的影响. 昆虫学报, 2018, 61(9): 1003-1009.
CHEN J H, CUI J, ZHANG J P, BI R, GAO Y, XU W, SHI S S. Effects of temperature on the activities of key enzymes related to respiratory metabolism in(Hemiptera: Coreidae) adults. Acta Entomologica Sinica, 2018, 61(9): 1003-1009. (in Chinese)
[35] 钱雪, 王月莹, 谢欢欢, 窦洁, 李占武, JASHENKO R, 季荣.温度对西伯利亚蝗呼吸代谢关键酶活性的影响. 昆虫学报, 2017, 60(5): 499-504.
QIAN X, WANG Y Y, XIE H H, DOU J, LI Z W, JASHENKO R, JI R. Effects of temperature on the activities of key enzymes related to respiratory metabolism in adults of(Orthoptera: Acrididae). Acta Entomologica Sinica, 2017, 60(5): 499-504. (in Chinese)
[36] WANG H W, ZHANG Y, TAN P P, JIA L S, CHEN Y, ZHOU B H. Mitochondrial respiratory chain dysfunction mediated by ROS is a primary point of fluoride-induced damage in Hepa1-6 cells. Environmental Pollution, 2019, 255(3): 113359.
[37] Nayak M K, Holloway J C, Emery R N, Pavic H, Bartlet J, Collins P J. Strong resistance to phosphine in the rusty grain beetle,(Stephens) (Coleoptera: Laemophloeidae): its characterisation, a rapid assay for diagnosis and its distribution in Australia. Pest Management Science, 2013, 69(1): 48-53.
[38] Agrafioti P, Athanassiou C G, Nayak M K. Detection of phosphine resistance in major stored-product insects in Greece and evaluation of a field resistance test kit. Journal of Stored Products Research, 2019, 82: 40-47.
[39] 陈二虎, 沈丹蓉, 杜文蔚, 孟宏杰, 唐培安. 表皮蛋白基因参与锈赤扁谷盗磷化氢抗性形成. 中国农业科学, 2023, 56(9): 1696-1707. doi: 10.3864/j.issn.0578-1752.2023.09.007.
CHEN E H, SHEN D R, DU W W, MENG H J, TANG P A.Cuticle protein genes are involved in phosphine resistance of. Scientia Agricultura Sinica, 2023, 56(9): 1696-1707.doi: 10.3864/j.issn.0578-1752.2023.09.007. (in Chinese)
[40] 陈艳. 基于呼吸速率的锈赤扁谷盗监测模型建立及呼吸调控机理研究[D].南京: 南京财经大学,2022.
CHEN Y. Establishment of a monitoring model for thebased on respiration rate and research on the mechanism of respiration regulation[D].Nanjing: Nanjing University of Finance and Economics,2022. (in Chinese)
[41] 段锦艳. 基于线粒体基因的锈赤扁谷盗磷化氢抗性机理研究[D]. 南京: 南京财经大学, 2017.
DUAN J Y. Study on the mechanisms of phosphine resistance in(Stephens) based on mitochondrial gene[D]. Nanjing: Nanjing University of Finance and Economics,2017. (in Chinese)
[42] WANG H, HUO M H, JIN Y Z, WANG Y, WANG X W, YU W H, JIANG X W. Rotenone induces hepatotoxicity in rats by activating the mitochondrial pathway of apoptosis. Toxicology Mechanisms and Methods, 2022, 32(7): 510-517.
[43] HEO G, SUN M H, JIANG W J, LI X H, LEE S H, GUO J, ZHOU D J, CUI X S. Rotenone causes mitochondrial dysfunction and prevents maturation in porcine oocytes. PLoS One, 2022, 17(11): e0277477.
[44] BAI S H, OGBOURNE S. Eco-toxicological effects of the avermectin family with a focus on abamectin and ivermectin. Chemosphere, 2016, 154: 204-214.
[45] SOUDERS C L, RUSHIN A, SANCHEZ C L, TOTH D, ADAMOVSKY O, MARTYNIUK C J. Mitochondrial and transcriptome responses in rat dopaminergic neuronal cells following exposure to the insecticide fipronil. Neurotoxicology, 2021, 85: 173-185.
[46] PEDRA-REZENDE Y, FERNANDES M C, MESQUITA- RODRIGUES C, STIEBLER R, BOMBAÇA A C S, PINHO N, CUERVO P, DE CASTRO S L, MENNA-BARRETO R F S. Starvation and pH stress conditions induced mitochondrial dysfunction, ROS production and autophagy inepimastigotes. Biochimica et Biophysica Acta-Molecular Basis of Disease, 2021, 1867(2): 166028.
[47] HIBSHMAN J D, LEUTHNER T C, SHOBEN C, MELLO D F, SHERWOOD D R, MEYER J N, BAUGH L R. Nonselective autophagy reduces mitochondrial content during starvation in. American journal of physiology. Cell physiology, 2018, 315(6): 781-792.
The Effect of Environmental Stress on Respiratory Rate and Expression Level of Mitochondrial Protein-Coding Genes in
CHEH ErHu, YUAN GuoQing, SUN ShengYuan, TANG PeiAn
College of Food Science and Engineering/Collaborative Innovation Center for Modern Grain Circulation and Safety of Jiangsu Province/Key Laboratory of Grains and Oils Quality Control and Processing of Jiangsu Province, Nanjing University of Finance and Economics, Nanjing 210023
【Background】Mitochondria is an important organelle in the organism, which is the primary site for cellular oxygen consumption and the production of the energy substance adenosine triphosphate (ATP), playing a significant role in the organism’s resistance to adversity. The rusty grain beetle () is a type of global stored grain pest, possessing extremely strong environmental adaptability.【Objective】The objective of this study is to analyze the respiratory rate ofand the response of mitochondrial protein-coding genes to different environmental stresses, and to investigate the stress response of mitochondria in the adversity resistance of.【Method】Mitochondrial protein-coding genes were identified based on the mitochondrial genome data of, and corresponding real-time fluorescence quantitative PCR (RT-qPCR) primers were designed. The toxicity regression equation and LC30ofto fumigants (ethyl formate), botanical insecticides (rotenone), and stored grain protectants (avermectin) were determined by using bioassay methods, and these concentrations were used for subsequent drug stress treatment on the test insects. The spatial and temporal expression patterns (different developmental stages and different tissues of larvae) of mitochondrial protein-coding genes inwere analyzed by using RT-qPCR technology. Finally, the changes in the respiratory rate ofunder various adversity stresses such as high temperatures (35 and 40 ℃), ethyl formate, rotenone, avermectin, and starvation, as well as the expression patterns of mitochondrial protein-coding genes, were studied by using a CO2detector and RT-qPCR technology, respectively.【Result】Twelve mitochondrial protein-coding genes (excluding) quantitative primers were designed. RT-qPCR results showed that these mitochondrial protein-coding genes had a higher expression level at the 3rd instar larval stage, and mitochondrial genes were specifically highly expressed in the malpighian tubules of 3rd instar larvae. Moreover, under high-temperature stress, the respiratory rate ofsignificantly increased, and the expression levels of mitochondrial protein-coding genes,, andincreased significantly, while,,, andshowed a significant downregulation trend. Under ethyl formate fumigation stress, the respiratory rate ofsignificantly decreased, and all 12 mitochondrial protein-coding genes were significantly downregulated. Among them, the expression levels ofandwere only 3.48% and 1.91% of the control group, respectively. Under rotenone and avermectin stress, the respiratory rate ofsignificantly decreased, and the expression levels of mitochondrial protein-coding genes, except for, were significantly downregulated. Under starvation stress, the respiratory rate ofsignificantly decreased, and as the stress duration increased, the downregulation of mitochondrial encoded gene expression levels became more pronounced.【Conclusion】The respiratory metabolism rate and mitochondrial protein-coding gene expressions ofchanged significantly under different environmental stresses, indicating that the mitochondria plays an important role in the adaption to high temperature, pesticides, and starvation stress in.
; environmental stress; respiratory rate; mitochondrial protein-coding gene

10.3864/j.issn.0578-1752.2023.24.006
2023-08-14;
2023-09-09
国家重点研发计划(2021YFD2100604)、江苏省重点研发计划(BE2022377)、国家自然科学基金(32001915,32272388)、江苏高校优势学科建设工程资助项目(YXK2103)、江苏省研究生科研与实践创新计划(KYCX23_1894)
陈二虎,E-mail:erhuchen1104@163.com。通信作者唐培安,E-mail:tangpeian@163.com
(责任编辑 岳梅)
