广东省蒲瓜病毒种类鉴定及多重RT-PCR检测方法的建立
2023-12-28苏琦汤亚飞佘小漫蓝国兵于琳吴正伟李正刚何自福
苏琦,汤亚飞,佘小漫,蓝国兵,于琳,吴正伟,李正刚,何自福
广东省蒲瓜病毒种类鉴定及多重RT-PCR检测方法的建立
苏琦1,2,汤亚飞2,佘小漫2,蓝国兵2,于琳2,吴正伟1,李正刚2,何自福2
1广东海洋大学滨海农业学院,广东湛江 524088;2广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广州 510640
【目的】探明侵染广东省蒲瓜的病毒种类,建立一种可以同时检测多种蒲瓜病毒的RT-PCR检测方法,提高蒲瓜病毒种类鉴定效率,为蒲瓜病毒病的精准监测与防控提供依据。【方法】2018—2022年间,从广东省广州市、惠州市、清远市、汕头市和湛江市的蒲瓜主要种植区采集蒲瓜病毒病疑似样品78份,对采集的样品按照地区和症状进行分类,提取每份样品的总RNA,将一个地区具有相同症状样品的RNA等量混合后进行小RNA深度测序分析。根据小RNA深度测序分析结果,设计特异引物进行RT-PCR验证,从而明确侵染广东省蒲瓜的病毒种类。挑选6种检出率高、危害严重的蒲瓜病毒,根据GenBank数据库设计多重PCR检测引物,通过优化反应体系和反应条件,建立同时检测6种蒲瓜病毒的多重RT-PCR方法。【结果】从采集的78份蒲瓜疑似病毒病样品中,共检测到12种病毒,按照检出率从高到低分别为葫芦内源RNA病毒(alphaendornavirus,LSEV)(64.1%)、黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)(62.8%)、小西葫芦虎纹花叶病毒(zucchini tigre mosaic virus,ZTMV)(51.3%)、西瓜绿斑驳花叶病毒(watermelon green mottle mosaic virus,WGMMV)(43.6%)、西瓜病毒A(watermelon virus A,WVA)(32.1%)、番木瓜环斑病毒(papaya ringspot virus,PRSV)(19.2%)、小西葫芦黄花叶病毒(zucchini yellow mosaic virus,ZYMV)(9.0%)、瓜类蚜传黄化病毒(cucurbit aphid-borne yellows virus,CABYV)(7.7%)、中国南瓜曲叶病毒(squash leaf curl China virus,SLCCNV)(7.7%)、瓜类褪绿黄化病毒(cucurbit chlorotic yellows virus,CCYV)(5.1%)、瓜类黄矮失调病毒(cucurbit yellow stunting disorder virus,CYSDV)(3.8%)、甜瓜黄斑病毒(melon yellow spot virus,MYSV)(1.3%)。78份样品中,复合侵染率高达80.8%,其中2、3、4、5、6和7种病毒复合侵染的检出率分别为14.1%、16.7%、23.1%、17.9%、7.7%和1.3%。在多重RT-PCR体系中先加入WVA+CCYV+ZTMV+PRSV引物,12个反应后再加入CGMMV+WGMMV引物,引物体积依次为WVA 0.5mL、CCYV 0.5mL、CGMMV 0.4mL、WGMMV 0.4mL、ZTMV 0.6mL、PRSV 0.6mL,从而确立了一种同时扩增6种病毒的多重RT-PCR检测方法。【结论】危害广东省蒲瓜的主要病毒有12种,其中CGMMV、ZTMV、WGMMV、WVA为优势病毒;复合侵染现象较普遍,以3、4和5种病毒的复合侵染形式占比较高;研发出一种同时检测蒲瓜上6种病毒的多重RT-PCR检测技术,提高了蒲瓜病毒种类鉴定效率。
蒲瓜;病毒病;小RNA深度测序;RT-PCR检测;多重PCR方法
0 引言
【研究意义】蒲瓜()属葫芦科葫芦属一年生蔓性草本植物,又名葫芦、瓠瓜等,是葫芦科主要栽培作物之一,在我国浙江、广东、福建等长江以南地区广泛种植[1]。病毒病是蒲瓜生产上的主要病害之一,在世界各主要种植区均有发生,严重制约着蒲瓜的安全生产。病毒病造成蒲瓜出现叶片黄化、斑驳、畸形、植株矮小、果实花皮与畸形等症状,鉴定侵染蒲瓜的病毒种类,对于监测病毒病发生及制定精准防控措施具有重要的指导意义。【前人研究进展】世界范围内侵染葫芦科作物的病毒超过100种[2],在中国已发现可以侵染葫芦科作物的病毒约35种,其中已知能侵染蒲瓜的病毒有17种,包括小西葫芦黄花叶病毒(zucchini yellow mosaic virus,ZYMV)、小西葫芦虎纹花叶病毒(zucchini tigre mosaic virus,ZTMV)、西瓜花叶病毒(watermelon mosaic virus,WMV)、番木瓜环斑病毒(papaya ringspot virus,PRSV)、黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)、甜瓜黄斑病毒(melon yellow spot virus,MYSV)、瓜类蚜传黄化病毒(cucurbit aphid-borne yellows virus,CABYV)、甜瓜蚜传黄化病毒(melon aphid-borne yellows virus,MABYV)、瓜类褪绿黄化病毒(cucurbit chlorotic yellows virus,CCYV)、中国南瓜曲叶病毒(squash leaf curl China virus,SLCCNV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、葫芦内源RNA病毒(alphaendornavirus,LSEV)、西瓜银灰斑驳病毒(watermelon silver mottle virus,WSMoV)、西瓜绿斑驳花叶病毒(watermelon green mottle mosaic virus,WGMMV)、西瓜病毒A(watermelon virus A,WVA)、甜瓜坏死斑点病毒(melon necrotic spot virus,MNSV)、小西葫芦绿斑驳花叶病毒(zucchini green mottle mosaic virus,ZGMMV)[2-10]。目前植物病毒的检测方法有生物学检测、血清学检测、RT-PCR检测和核酸杂交检测等[11],梁智玲等通过血清学和RT-PCR相结合的方法对蒲瓜上的CGMMV和ZGMMV进行检测[4]。生物学方法费时费力且结果易受人为因素影响;血清学方法受制于抗体原因容易出现假阳性[12];RT-PCR检测只能针对已知目标病毒进行检测,无法检测到未知病毒,而小RNA深度测序弥补了这一缺陷。通过小RNA深度测序可以分析出样品中所有的病毒种类,再通过RT-PCR对每个样品中包含的病毒种类进行逐一验证,已逐渐成为国内外常见的病毒检测方法[5]。彭斌等通过小RNA深度测序和RT-PCR检测相结合的方法,对我国部分地区葫芦科作物感染的病毒种类进行了检测[7-8]。对于多种病毒复合侵染以及需要对大量样品进行检测时,单一引物的PCR检测方法仍费时费力。Chamberian等于1988年提出多重RT-PCR检测的方法[13],大大提高了检测效率,已在生命科学领域广泛使用[12-15]。胡新喜等建立了同步检测辣椒上4种病毒的多重RT-PCR检测技术[12];代玥等建立了同步检测4种大豆镰孢菌根腐病病原的多重PCR检测技术[16];多重PCR技术在葫芦科病毒的检测也有应用,李莉等建立了可以同步检测5种西瓜病毒的多重RT-PCR检测技术[17]。【本研究切入点】对于蒲瓜病毒病种类鉴定已有报道,但未见对侵染蒲瓜的病毒进行全面鉴定及复合侵染检测,也没有建立针对蒲瓜病毒种类的快速检测方法。【拟解决的关键问题】探明侵染危害广东省蒲瓜的病毒种类及优势病毒,建立蒲瓜病毒种类快速鉴定方法,为蒲瓜病毒病监测及防控提供科学依据。
1 材料与方法
1.1 样品来源
2018—2022年,从广东省广州市、惠州市、清远市、汕头市和湛江市5个蒲瓜主要种植区采集疑似蒲瓜病毒病样品78份,其中广州市9份、惠州市55份、清远市10份、湛江市1份、汕头市3份。样品在田间采集后即放入干冰中,之后保存于实验室-80 ℃超低温冰箱中。
1.2 RNA提取
田间样品利用Trizol(TaKaRa公司)法提取总RNA,提取后的总RNA经NanoDrop超微量紫外分光光度计测定浓度后,置于-80 ℃超低温冰箱保存。
1.3 小RNA深度测序
将上述采集的蒲瓜样品按地点和症状进行分类,然后再将同一地点症状相似样品的总RNA进行等量混合,小RNA测序质检和测序由生工生物工程(上海)股份有限公司完成。之后将测序数据通过Virus Detect(http://virusdetect.feilab.net/cgi-bin/virusdetect/ index.cgi)进行拼接组装及Blast比对。
1.4 RT-PCR检测
反转录试剂盒购自TaKaRa公司。根据小RNA深度测序结果设计特异引物(表1)进行RT-PCR验证。引物由生工生物工程(上海)股份有限公司合成。
1.5 多重RT-PCR特异引物设计
在NCBI数据库中查找WVA、CCYV、CGMMV、WGMMV、ZTMV、PRSV 6种蒲瓜病毒的全长序列,在保守区域设计特异检测引物,既保证能区分不同属病毒,又保证区分同属之间的不同病毒种。引物由生工生物工程(上海)股份有限公司合成。
1.6 多重RT-PCR检测
引物序列以及体积见表2,首先将WVA、CCYV、PRSV、ZTMV引物加入到反应体系中,反应总体系(30mL):cDNA 2.5mL;正向引物F 0.4—0.6mL;反向引物R 0.4—0.6mL;2×T5 Super PCR Mix 15mL;5×Enhancer Buffer 5mL;DEPC-H2O 1.5mL。以98 ℃3 min;98 ℃10 s;55 ℃15 s;72 ℃30 s;72 ℃5 min;12 ℃∞的程序进行12个循环,再加入CGMMV、WGMMV的引物,以98 ℃3 min;98 ℃10 s;55 ℃15 s;72 ℃30 s;72 ℃5 min;12 ℃∞进行27个循环。2×T5 Super PCR Mix试剂购自擎科生物科技有限公司。使用2%的琼脂糖凝胶进行电泳检测,DNA Marker(GL DNA Marker 100 Ladder)购自艾科瑞生物公司。
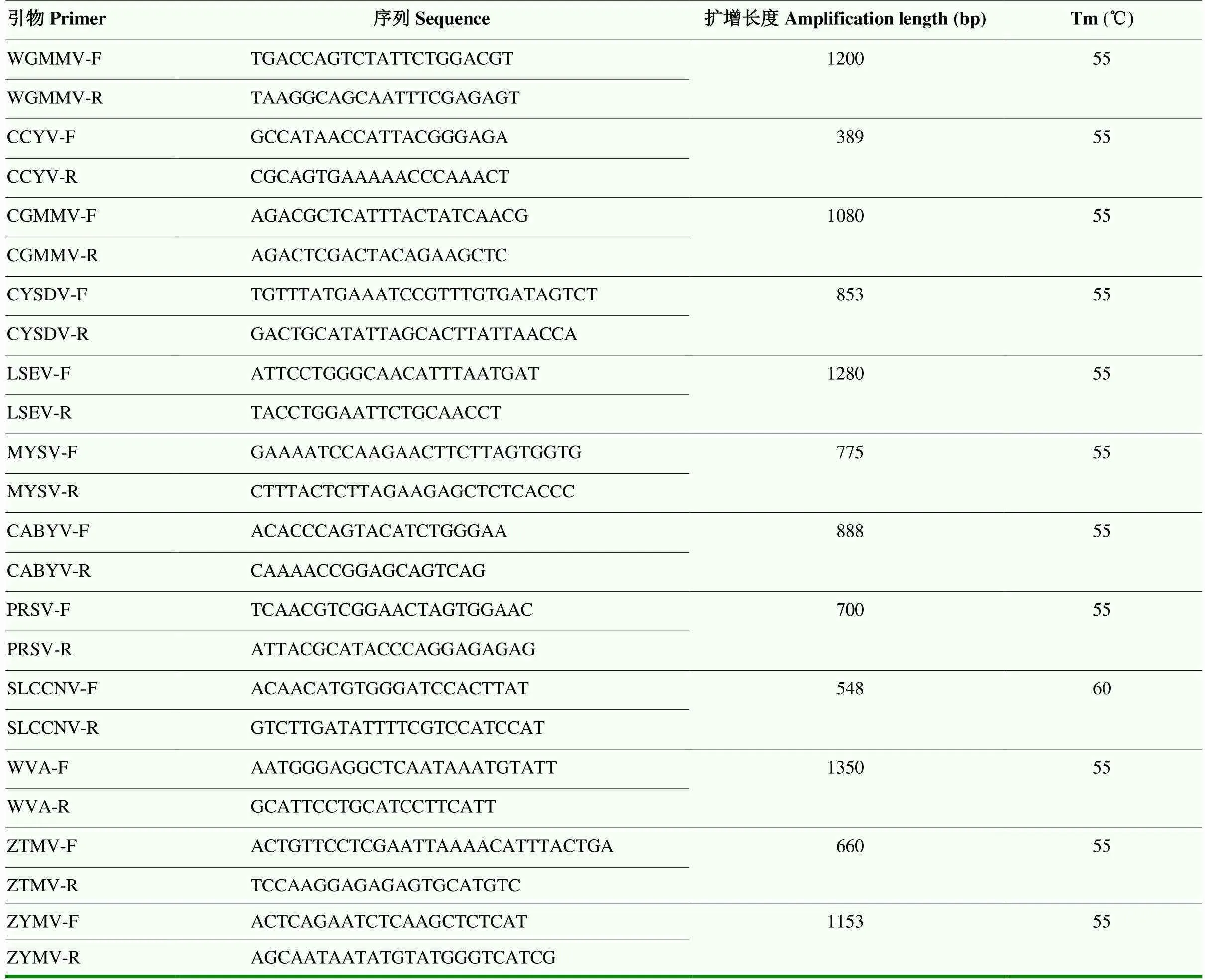
表1 常规PCR检测所用引物

表2 多重RT-PCR检测引物
2 结果
2.1 广东省蒲瓜病毒病田间调查情况
2018—2022年,对广东省广州市、惠州市、清远市、汕头市和湛江市主要蒲瓜种植区进行了调查监测,蒲瓜病毒病田间发病率一般在3%—41%,严重的可达80%,甚至100%。主要症状为泡状、皱缩、褪绿、黄化、卷叶、果实变色和果实畸形等(图1)。

A—C:田间蒲瓜叶片泡状、皱缩、斑驳等发病症状Bottle gourd leaves showing bubble, wrinkle, and mottle symptoms in the fields;D:田间蒲瓜植株整体发病症状Overall symptoms of diseased bottle gourd plants in the fields;E、F:田间蒲瓜果实斑驳、畸形等发病症状mottled and deformed bottle gourd fruits in the fields
2.2 小RNA深度测序结果及RT-PCR验证
在田间采集典型病毒病样品78份,带回实验室提取总RNA。将从每个地方采集的样品按症状进行分类,并将相似症状样品的RNA等量混合成一管进行小RNA深度测序分析。为验证小RNA测序结果,用RT-PCR方法检测每个样品中包含的病毒种类。根据小RNA测序结果,设计了12种病毒的特异性引物,进行RT-PCR验证,共鉴定出12种病毒(表3),分属于8个属,分别为正番茄斑萎病毒属()的MYSV,毛形病毒属()的CCYV和瓜类黄矮失调病毒(cucurbit yellow stunting disorder virus,CYSDV),菜豆金黄花叶病毒属()的SLCCNV,马铃薯卷叶病毒属()的CABYV,西瓜病毒A属()的WVA,马铃薯Y病毒属()的PRSV、ZTMV和ZYMV,甲型内源病毒属()的LSEV,烟草花叶病毒属()的CGMMV和WGMMV。
表3 78份蒲瓜样品中检测到的病毒
2.3 广东省蒲瓜病毒的检出率及分布范围分析
检测到的12种病毒检出率分别为LSEV(64.1%)、CGMMV(62.8%)、ZTMV(51.3%)、WGMMV(43.6%)、WVA(32.1%)、PRSV(19.2%)、ZYMV(9.0%)、CABYV(7.7%)、SLCCNV(7.7%)、CCYV(5.1%)、CYSDV(3.8%)、MYSV(1.3%)(图2-A)。不同地区病毒种类有所差异,惠州市检测到以上全部12种病毒;广州市检测到CGMMV、ZTMV、WGMMV、WVA、LSEV 5种病毒;清远市检测到CGMMV、WVA、ZTMV、ZYMV 4种病毒;汕头市仅检测到CGMMV;湛江市检测到WVA、LSEV、ZTMV 3种病毒。所检测到的(+) ssRNA病毒主要属于5个属,(-) ssRNA病毒为属,dsRNA病毒为属,以及ssDNA病毒为属。其中8个属的病毒检出率分别为(82.1%)、(64.1%)、(59.0%)、(32.1%)、s(7.7%)、(7.7%)、(5.1%)、(1.3%)(图2-B)。
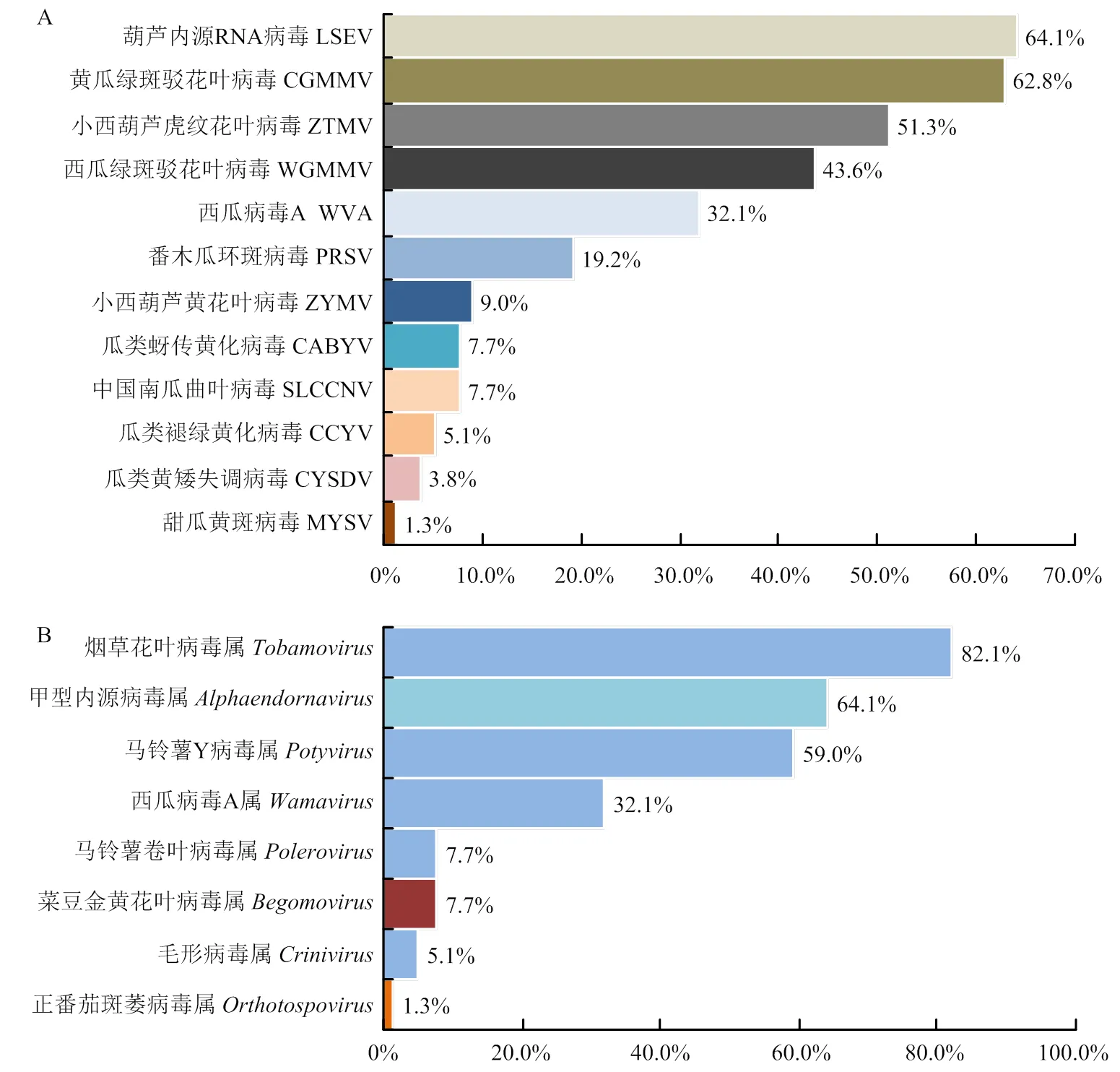
A:78份蒲瓜样品中12种病毒的检出率,病毒的检出率从上到下逐渐降低The infection rate of 12 viruses in 78 samples of bottle gourd. From top to bottom, the infection rate is gradually lower;B:78份蒲瓜样品中12种病毒对应的8个属的检出率,检出率从上到下逐渐降低The infection rate of 12 viruses corresponding to 8 genera in 78 samples of bottle gourd. From top to bottom, the infection rate is gradually lower
2.4 广东省蒲瓜病毒复合侵染分析
广东省蒲瓜存在多种类型的病毒复合侵染情况(表4)。在78份病样中,一种病毒侵染的仅有9份,其余感染情况均为复合侵染,2种病毒感染的有11份,占14.1%;3种病毒感染的有13份,占16.7%;4种病毒感染的有18份,占23.1%;5种病毒感染的有14份,占17.9%;6种病毒感染的有6份,占7.7%;7种病毒感染的有1份,占1.3%(图3)。其中占比较高的组合,2种感染类型的为CGMMV+WVA、CGMMV+WGMMV;3种感染类型的为CGMMV+ LSEV+ZTMV、LSEV+WGMMV+ZTMV;4种感染类型的为CGMMV+WVA+LSEV+WGMMV、WGMMV+ CGMMV+LSEV+ZTMV;5种感染类型的为CGMMV+ WVA+LSEV+ZTMV+WGMMV、ZTMV+LSEV+PRSV+ WGMMV+CGMMV、CGMMV+LSEV+WGMMV+ ZTMV+CABYV(表4)。
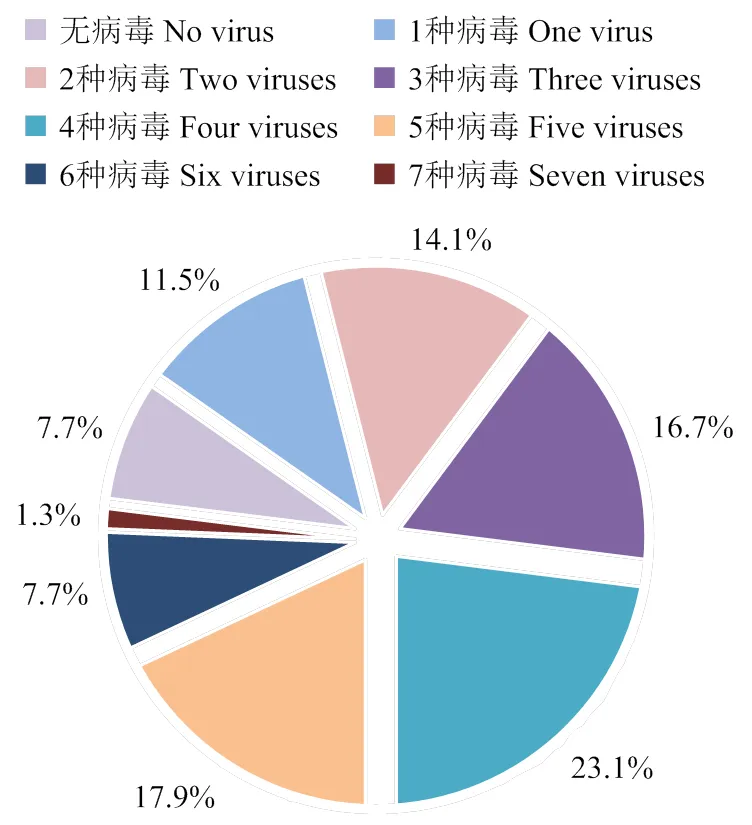
图3 78份样品中不同种类病毒复合侵染比例
2.5 多重RT-PCR
挑选检出率较高的6种病毒WVA、CCYV、CGMMV、WGMMV、ZTMV、PRSV,建立蒲瓜病毒多重RT-PCR快速检测体系。LSEV为内源病毒,可侵染植物、真菌甚至卵菌,也可以种传,但在植物上一般不造成典型病毒症状,因此未将其列为重点检测对象。ZYMV在2018与2019年检出率较高,近年来在蒲瓜上少有发现,而CCYV在蒲瓜上近年来有逐渐升高的趋势,因此将其列为重点检测病毒之一。从NCBI数据库中查找以上6种病毒的全长序列,并设计扩增不同片段长度的引物(表2)。从78份蒲瓜样品中,挑选了8个蒲瓜发病样品进行测试,通过对反应条件的不断优化,最终确定在多重RT-PCR体系中先加入WVA+CCYV+ZTMV+PRSV引物,12个反应后再加入WGMMV+CGMMV引物,引物体积依次为,WVA 0.5mL、CCYV 0.5mL、CGMMV 0.4mL、WGMMV 0.4mL、ZTMV 0.6mL、PRSV 0.6mL。结果显示,在阳性对照样品中可以同时扩出6条大小不一的条带,对应6种病毒,其他样品也可以扩增到不同长度的目的条带(图4-A)。为验证多重RT-PCR检测准确性,利用单一病毒引物对8个蒲瓜样品进行逐一检测,结果显示与多重RT-PCR检测结果一致(图4-B)。
3 讨论
3.1 侵染蒲瓜的病毒
本文通过小RNA深度测序和RT-PCR两种方法相结合,对广东省内的蒲瓜病毒种类进行检测,共鉴定出12种病毒,分别为LSEV、CGMMV、ZTMV、WGMMV、WVA、PRSV、ZYMV、CABYV、SLCCNV、CCYV、CYSDV和MYSV。LSEV、CGMMV、ZTMV、WGMMV和WVA这5种病毒检出率均在30%以上,其中,LSEV检出率最高,但研究发现LSEV属于内源RNA病毒,一般是潜伏侵染,感染的植株没有任何发病症状[18]。虽然不能引起植株的表型变化,但是检测时发现LSEV多为种子带毒,属于侵染蒲瓜的一种病毒,在与其他病毒共同侵染蒲瓜时可能存在相互作用,对蒲瓜生长影响未知,所以将其列入复合侵染统计之内。CGMMV、ZTMV、WGMMV、WVA在4个市蒲瓜主产区都有分布,是目前广东省危害蒲瓜较严重和较普遍的病毒,为优势病毒。前人对广东省蒲瓜病毒有相关报道,分别检测到WGMMV、CCYV、CGMMV、LSEV、PRSV、SLCCNV、WSMoV、WVA、ZTMV、ZYMV和MYSV,并认为广东省蒲瓜上的优势病毒为WGMMV、CGMMV[3,6]。
本研究的蒲瓜样品中,除WSMoV未检测到外,其余已发现的病毒均可检测到,同时还新检测到CABYV和CYSDV两种病毒。CABYV属于黄症病毒科()马铃薯卷叶病毒属()[19],可以侵染多种葫芦科作物,于1992年在法国首次被发现[20],2006年在我国9种葫芦科作物上检测到该病毒[21]。CABYV属于韧皮部局限病毒,主要以棉蚜()和桃蚜()进行循回、持久、非增殖型的传播[22]。CYSDV属于长线形病毒科()毛形病毒属(),包含两条正义单链RNA,通过烟粉虱()以半持久非循回型的方式进行传播[23]。CYSDV是韧皮部发生病毒[24],可以侵染葫芦科作物、一些杂草以及莴苣和苜蓿[25],1982年首次发现于阿拉伯联合酋长国,之后在中东、地中海和北美地区也有发现,并且研究表明该病毒造成的危害逐年加重,甚至在一些瓜类作物上造成80%以上的经济损失[26]。
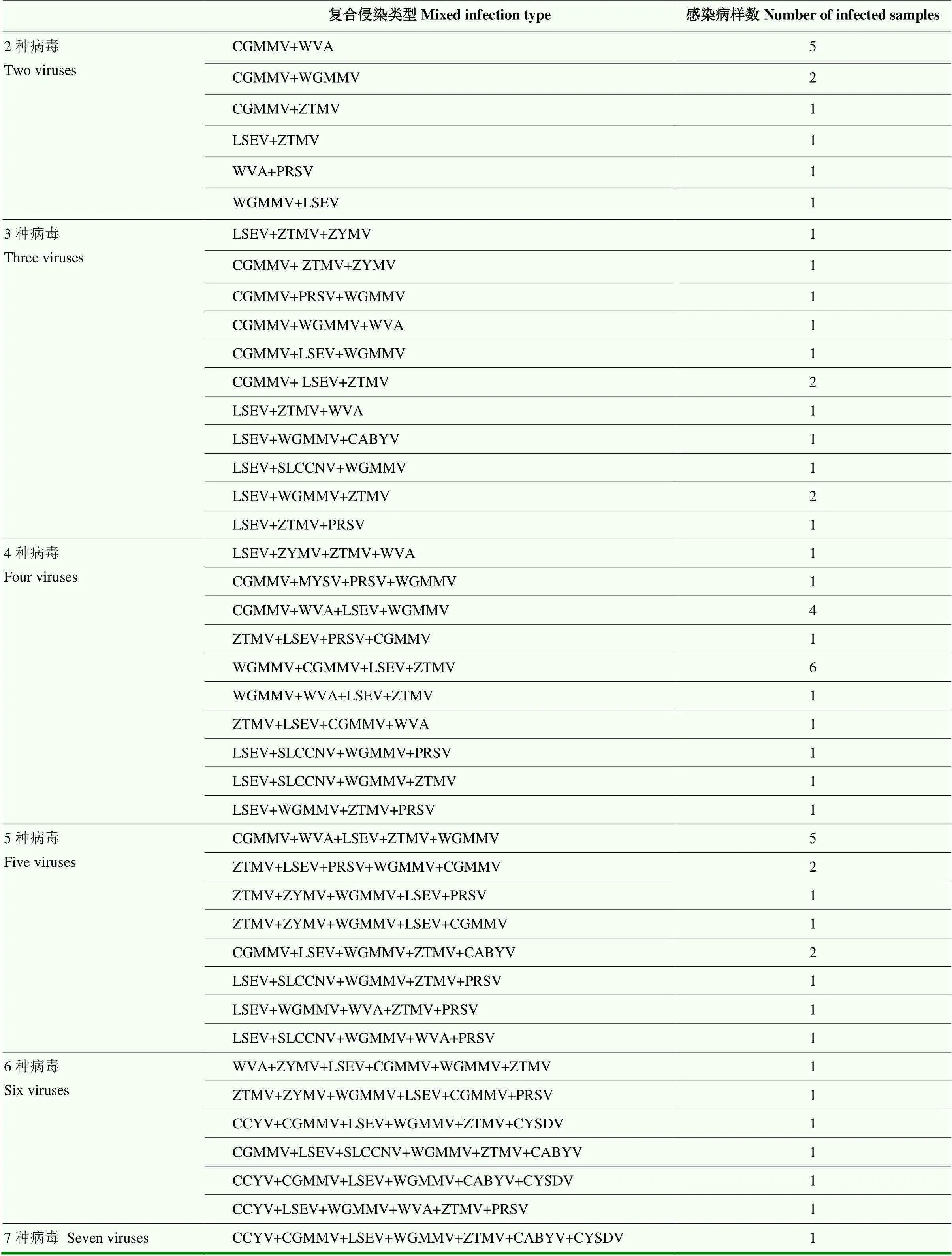
表4 病毒复合侵染的类型及数量
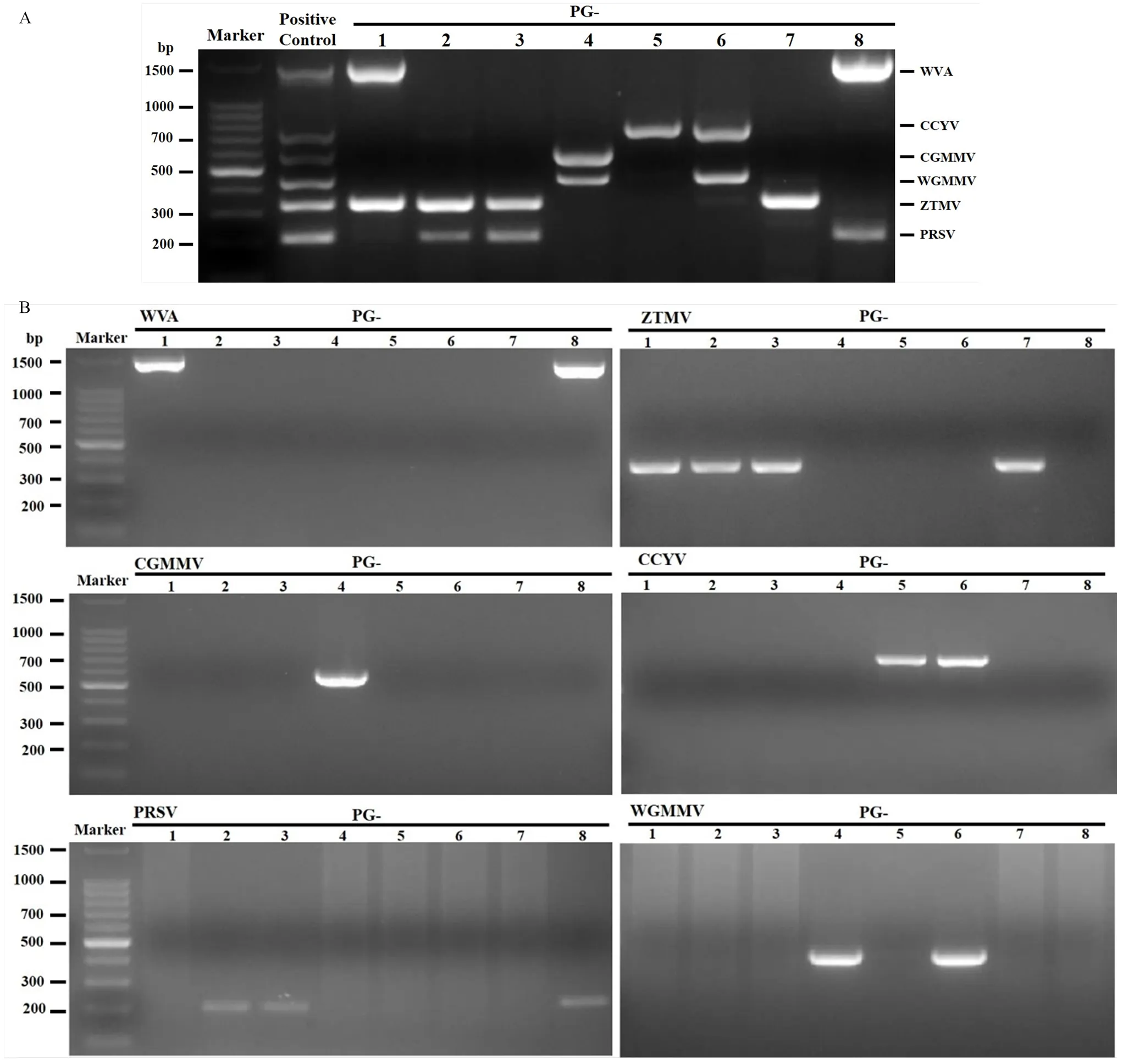
Marker:100 Ladder;Positive control:含6种病毒的阳性对照positive control containing six viruses;PG 1—8:从78份蒲瓜样品挑选的样品samples selected from a total of 78 bottle gourd samples。A:多重PCR混合引物检测结果Detection result of multiplex PCR with mixed primer pairs;B:单一引物检测结果Detection result with single primer pair
各地葫芦科作物感染病毒种类不尽相同,蒲瓜病毒种类也有所差异,但复合侵染现象普遍存在。江苏省的葫芦科蔬菜中共检测出9种病毒,检出率从高到低依次为ZYMV、WMV、CABYV、PRSV、CMV、CCYV、CGMMV、SqMV和TMV,危害较为严重的主要为马铃薯Y病毒属病毒[9],复合侵染率为32.96%,同时在蒲瓜上发现了WMV+CMV的侵染组合。山东省也检测到9种病毒,检出率由高到低依次为TMV、CMV、ZYMV、WMV、CGMMV、SqMV、MYSV、CCYV、MNSV,危害较为严重的主要为烟草花叶病毒属和黄瓜花叶病毒属病毒,也存在复合侵染情况[27]。河南省葫芦科作物发现9种病毒,分别为ZYMV、WMV、CMV、CABYV、MABYV、MNSV、CLCV、ZTMV和PLDMV,危害较为严重的主要为马铃薯Y病毒属病毒,复合侵染率达48.8%[8]。在陕西省检测到TMV、ZYMV、CMV、CGMMV、PRSV和WMV,CMV和ZYMV是葫芦科作物主要发生病毒,复合侵染现象普遍存在[28]。本文并未在广东省蒲瓜的病毒检测中发现WMV、SqMV、TMV、MABYV、CLCV、PLDMV和MNSV,且广东省蒲瓜病毒的复合侵染率高达80.8%,复合侵染率远高于有数据报道的其他省份。
3.2 植物病毒多重RT-PCR技术
对于大批量病毒检测及多种病毒复合侵染的检测,多重RT-PCR方法更为便捷、省时且快速。在多重RT-PCR检测中,由于引物之间的相互影响,很有可能形成二级结构,对检测结果产生影响,从而无法检测出目标病毒或是出现非目标条带[29]。多重RT-PCR的灵敏度一直是制约其检测的主要问题之一[17,30-32],影响其灵敏度的因素较多。研究中发现,不同引物的浓度和用量对检测结果有直接影响,增加引物用量并不能提高目标条带的亮度,甚至较高的引物用量会导致目标条带消失,适当的引物浓度和用量才可以提高多重RT-PCR的灵敏度。同时,退火温度对灵敏度也有着直接影响,探索合理的退火温度对于提高灵敏度也尤为重要,另外样品中病毒的含量、检测试剂和检测体系等因素对多重RT-PCR灵敏度也存在一定的影响。
本研究将设计的6对多重RT-PCR检测引物混合加入到反应体系中,通过调整6对引物的不同添加顺序,扩增出包含WVA、CCYV、CGMMV、WGMMV、ZTMV和PRSV 6种病毒的目的条带,同时每个田间样品也都检测到符合预期的目的条带,且大小准确、条带明显。笔者发现引物添加顺序对检测结果有直接影响,在尝试了多种引物添加顺序后最终确定了“两步法”引物添加方法,检测特异性和扩增效率均较好,为蒲瓜病毒的种类鉴定提供了一种便捷、高效且准确的方法。
4 结论
鉴定出危害广东省蒲瓜的病毒12种,分别为LSEV、CGMMV、ZTMV、WGMMV、WVA、PRSV、ZYMV、CABYV、SLCCNV、CCYV、CYSDV、MYSV;其中CGMMV、ZTMV、WGMMV和WVA是危害广东省蒲瓜的优势病毒;复合侵染普遍,以3、4和5种病毒复合侵染为主要形式;建立了一种同时检测6种蒲瓜病毒的多重PCR检测技术体系,可用于田间蒲瓜样品的快速检测。
[1] 韦海忠, 吴新义, 吴晓花, 杨新琴, 徐沛, 鲁忠富, 余晓虹, 李国景. 干热和药剂处理对瓠瓜种子CGMMV的抑制效果. 浙江农业科学, 2017, 58(6): 942-944.
WEI H Z, WU X Y, WU X H, YANG X Q, XU P, LU Z F, YU X H, LI G J. The inhibitory effects of dry heat and chemical treatment on cucumber green mottle mosaic virus (CGMMV) of bottle gourd seeds. Journal of Zhejiang Agricultural Sciences, 2017, 58(6): 942-944. (in Chinese)
[2] LI Z, YANG S, QIN B, XIE H, CUI L, SU Q, CAI J, GU Q. First report of natural infection of zucchini green mottle mosaic virus on bottle gourd in Guangxi, China.Plant Disease, 2018, 102(11): 2384.
[3] LI Z G, NONG Y, FAROOQ T, TANG Y F, SHE X M, YU L, LAN G B, ZHOU X P, HE Z F. Small RNA deep sequencing reveals the presence of multiple viral infections in cucurbit crops in Guangdong, China. Journal of Integrative Agriculture, 2022, 21(5): 1389-1400.
[4] 梁智玲, 刘美, 亓芳芳, 康保珊, 古勤生, 彭斌. 小西葫芦绿斑驳花叶病毒生物学特性及传播方式. 植物病理学报, 2022, 52(1): 68-76.
LIANG Z L, LIU M, QI F F, KANG B S, GU Q S, PENG B. Biological characteristics and transmission modes of zucchini green mottle mosaic virus. Acta Phytopathologica Sinica, 2022, 52(1): 68-76. (in Chinese)
[5] 刘勇, 李凡, 李月月, 张松柏, 高希武, 谢艳, 燕飞, 张安盛, 戴良英, 程兆榜, 等. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势. 中国农业科学, 2019, 52(2): 239-261. doi: 10.3864/j.issn.0578- 1752.2019.02.005.
LIU Y, LI F, LI Y Y, ZHANG S B, GAO X W, XIE Y, YAN F, ZHANG A S, DAI L Y, CHENGZ B,. Identification, distribution and occurrence of viruses in the main vegetables of china. Scientia Agricultura Sinica, 2019, 52(2): 239-261. doi: 10.3864/j.issn.0578- 1752.2019.02.005. (in Chinese)
[6] 农媛. 侵染广东葫芦科作物病毒种类鉴定及重要病毒特征分析[D]. 广州: 华南农业大学, 2020.
NONG Y. Identification of viruses infecting cucurbit crops in guangdongprovince and analysis of important virus characteristics[D]. Guangzhou: South China Agricultural University, 2020. (in Chinese)
[7] 彭斌. 中国葫芦科作物病毒的分布、多样性及进化研究[D]. 武汉: 华中农业大学, 2019.
PENG B. Distribution, diversity and evolution of cucurbit viruses in China[D]. Wuhan: Huazhong Agricultural University, 2019. (in Chinese)
[8] 彭斌, 古勤生. 应用sRNA测序技术检测河南省葫芦科作物病毒病的发生//河南省植物保护学会第十一次、河南省昆虫学会第十次、河南省植物病理学会第五次会员代表大会暨学术讨论会, 2017: 34.
PENG B, GU Q S. Application of sRNA sequencing technology to detect the occurrence of virus diseases in Cucabitaceae in Henan province//member congress and academic symposium of the 11th Henan plant protection society, the 10th Henan entomological society, and the fifth Henan plant pathology society, 2017: 34. (in Chinese)
[9] 杨柳, 况佳颖, 任春梅, 缪倩, 陆芳, 季英华, 程兆榜. 江苏省主要葫芦科作物病毒种类及分布. 江苏农业学报, 2022, 38(1): 65-72.
YANG L, KUANG J Y, REN C M, MIAO Q, LU F, JI Y H, CHENG Z B. Variety and distribution of major viruses infecting Cucurbitaceae crops in Jiangsu province. Jiangsu Journal of Agricultural Sciences, 2022, 38(1): 65-72. (in Chinese)
[10] 郑棚峻, 张宇, 张松柏, 刘勇, 张德咏. 葫芦科作物重要种传病毒研究进展. 江苏农业科学, 2017, 45(3): 5-9.
ZHENG P J, ZHANG Y, ZHANG S B, LIU Y, ZHANG D Y. Research progress on important seed-borne viruses of Cucurbitaceae crops. Jiangsu Agricultural Sciences, 2017, 45(3): 5-9. (in Chinese)
[11] 任春梅, 程兆榜, 周益军. 两步法检测葫芦科作物多种病毒的多重RT-PCR方法及其专用引物组: CN104357580A[P]. (2015-02-18) [2023-08-04].
REN C M, CHENG Z B, ZHOU Y J. Two-step detection of multiple viruses in Cucurbitaceae crops using a multiplex RT-PCR method and its dedicated primer set: CN104357580A[P]. (2015-02-18) [2023-08- 04]. (in Chinese)
[12] 胡新喜, 汪沛, 熊兴耀. 一种四重RT-PCR同时检测多种辣椒病毒的方法及其应用: CN105755177A[P]. (2016-07-13) [2023-08-04].
HU X X, WANG P, XIONG X Y. A method for simultaneous detection of multiple pepper viruses by quadruplex RT-PCR and its application: CN105755177A[P]. (2016-07-13) [2023-08-04]. (in Chinese)
[13] CHAMBERLAIN J S, GIBBS R A, RANIER J E, NGUYEN P N, CASKEY C T. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification. Nucleic Acids Research, 1988, 16(23): 11141-11156.
[14] DAI J, CHENG J L, HUANG T, ZHENG X, WU Y F. A multiplex reverse transcription PCR assay for simultaneous detection of five tobacco viruses in tobacco plants.Journal of Virological Methods, 2012, 183(1): 57-62.
[15] UGA H, TSUDA S. A one-step reverse transcription-polymerase chain reaction system for the simultaneous detection and identification of multiple tospovirus infections. Phytopathology, 2005, 95(2): 166-171.
[16] 代玥, 闫伟棋, 姜雪, 杨新宇. 多重PCR技术检测4种大豆镰孢菌根腐病病原. 中国油料作物学报, 2021, 43(2): 307-313.
DAI Y, YAN W Q, JIANG X, YANG X Y. Establishment of a multiplex PCR for detection of fourpathogens of soybean root rot disease. Chinese Journal of Oil Crop Sciences, 2021, 43(2): 307-313. (in Chinese)
[17] 李莉, 冯耿, 王锡锋, 刘文文. 一种同步检测5种西瓜病毒的多重RT-PCR方法及其应用: CN106702029B[P]. (2020-01-17) [2023-08-04].
LI L, FENG G, WANG X F, LIU W W. A multiplex RT-PCR method for simultaneous detection of five watermelon viruses and its application: CN106702029B[P]. (2020-01-17) [2023-08-04]. (in Chinese)
[18] 彭小琴. 两种新内源RNA病毒的鉴定及相关特性研究[D]. 荆州: 长江大学, 2019.
PENG X Q. Identification and related characteristics study of two novel endornaviruses[D]. Jingzhou: Yangtze University, 2019. (in Chinese)
[19] 刘莉铭, 任倩, 彭斌, 吴会杰, 康保珊, 古勤生. 南瓜蚜传黄化病毒侵染性克隆的构建. 植物保护学报, 2022, 49(3): 784-791.
LIU L M, REN Q, PENG B, WU H J, KANG B S, GU Q S. Construction of an infectious clone of cucurbit aphid-borne yellows virus. Journal of Plant Protection, 2022, 49(3): 784-791. (in Chinese)
[20] LECOQ H, BOURDIN D, WIPF-SCHEIBEL C, BON M, LOT H, LEMAIRE O, HERRBACH E. A new yellowing disease of cucurbits caused by a luteovirus, cucurbit aphid-borne yellows virus. Plant Pathology, 1992, 41(6): 749-761.
[21] XIANG H Y, SHANG Q X, HAN C G, LI D W, YU J L. First report on the occurrence of cucurbit aphid-borne yellows virus on nine cucurbitaceous species in China. Plant Pathology, 2008, 57(2): 390.
[22] GRAY S, CILIA M, GHANIM M. Circulative, “nonpropagative” virus transmission: an orchestra of virus-, insect-, and plant-derived instruments.Advances in Virus Research, 2014, 89: 141-199.
[23] GRAY S M, BANERJEE N. Mechanisms of arthropod transmission of plant and animal viruses. Microbiology and Molecular Biology Reviews, 1999, 63(1): 128-148.
[24] CÉLIX A, LÓPEZ-SESÉ A, ALMARZA N, GÓMEZ-GUILLAMÓN M L, RODRÍGUEZ-CEREZO E. Characterization of cucurbit yellow stunting disorder virus, a-transmitted closterovirus. Phytopathology, 1996, 86(12): 1370-1376.
[25] WINTERMANTEL W M, HLADKY L L, CORTEZ A A, NATWICK E T. A new expanded host range of cucurbit yellow stunting disorder virus includes three agricultural crops. Plant Disease, 2009, 93(7): 685-690.
[26] BROWN J K, GUERRERO J C, MATHERON M, OLSEN M, IDRIS A M. Widespread outbreak of cucurbit yellow stunting disorder virus in melon, squash, and watermelon crops in the Sonoran desert of Arizona and Sonora, Mexico. Plant Disease, 2007, 91(6): 773.
[27] 孙晓辉, 王树森, 高利利, 乔宁, 刘永光, 赵静, 竺晓平. 山东葫芦科蔬菜上病毒病种类检测及黄瓜花叶病毒分离物的亚组鉴定. 华北农学报, 2016, 31(2): 211-217.
SUN X H, WANG S S, GAO L L, QIAO N, LIU Y G, ZHAO J, ZHU X P. Detection of viruses infecting cucurbit vegetables in Shandong and identification of subgroup of the cucumber mosaic virus isolates. Acta Agriculturae Boreali-Sinica, 2016, 31(2): 211-217. (in Chinese)
[28] 李茹. 陕西葫芦科蔬菜病毒病发生与防控. 西北园艺, 2017(6): 43-44.
LI R. Occurrence and prevention and control of Cucurbitaceae vegetable virus disease in Shaanxi province. Northwest Horticulture, 2017(6): 43-44. (in Chinese)
[29] 任春梅, 程兆榜, 杨柳, 缪倩, 周益军. 江苏省葫芦科作物6种病毒的多重RT-PCR方法及应用. 江苏农业学报, 2015, 31(4): 756-763.
REN C M, CHENG Z B, YANG L, MIAO Q, ZHOU Y J. Establishment and application of multiplex RT-PCR assays for simultaneous detection of six viruses on cucurbit crops in Jiangsu province. Jiangsu Journal of Agricultural Sciences, 2015, 31(4): 756-763. (in Chinese)
[30] 李莉, 冯耿, 王锡锋, 刘文文. 一种同步检测4种辣椒病毒的多重PCR方法: CN106755597B[P]. (2020-06-02) [2023-08-04].
LI L, FENG G, WANG X F, LIU W W. A multiplex PCR method for simultaneous detection of four pepper viruses: CN106755597B[P]. (2020-06-02) [2023-08-04]. (in Chinese)
[31] 苏静, 陈佰鸿, 毛娟, 左存武, 胡紫璟, 王凯. 酿酒葡萄4种病毒多重RT-PCR检测体系的建立. 果树学报, 2017, 34(5): 632-638.
SU J, CHEN B H, MAO J, ZUO C W, HU Z J, WANG K. Establishment of multiplex RT-PCR detection system for four viruses in the cultivars of wine grape. Journal of Fruit Science, 2017, 34(5): 632-638. (in Chinese)
[32] 杨会房, 青玲, 王春艳, 刘陈晨, 孙现超. 一种同步检测5种植物病毒的方法: CN103540681B[P]. (2015-04-22) [2023-08-04].
YANG H F, QING L, WANG C Y, LIU C C, SUN X C. A method for the simultaneous detection of five plant viruses: CN103540681B[P]. (2015-04-22) [2023-08-04]. (in Chinese)
Identification of viruses infecting Bottle gourd in Guangdong Province and establishment of multiplex RT-PCR Detection method
SU Qi1,2, TANG YaFei2, SHE XiaoMan2, LAN GuoBing2, YU Lin2, WU ZhengWei1, LI ZhengGang2, HE ZiFu2
1College of Coastal Agricultural Sciences, Guangdong Ocean University, Zhanjiang 524088, Guangdong;2Plant Protection Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou 510640
【Objective】The objective of this research is to determine the various viruses that infect bottle gourd, establish a multiplex RT-PCR detection method that can simultaneously detect multiple bottle gourd viruses, so as to enhance the efficiency of identifying bottle gourd virus species, and provide a foundation for accurate prevention and control of bottle gourd viral diseases.【Method】From 2018 to 2022, 78 bottle gourd samples of suspected virus infection were collected from the main planting areas of bottle gourd in Guangdong province, including Guangzhou, Huizhou, Qingyuan, Shantou, and Zhanjiang. The collected samples were sorted by region and symptom, and the total RNA of each sample was extracted. The RNA samples with similar symptoms from each region were mixed for small RNA deep sequencing analysis. According to the results of small RNA deep sequencing analysis, specific primers were designed for RT-PCR verification to identify the specific virus species infecting bottle gourd in Guangdong province. six viruses with higher incidence and more losses were selected, and multiplex PCR detection primers based on the GenBank database were designed. After optimizing the reaction system and conditions, a method for simultaneous detection of all six viruses via multiplex RT-PCR was established.【Result】A total of 12 viruses were detected in 78 bottle gourd samples of suspected virus infection. These viruses were ranked in order of infection rate, from highest to lowest:alphaendornavirus (LSEV) (64.1%), cucumber green mottle mosaic virus (CGMMV) (62.8%), zucchini tigre mosaic virus (ZTMV) (51.3%), watermelon green mottle mosaic virus (WGMMV) (43.6%), watermelon virus A (WVA) (32.1%), papaya ringspot virus (PRSV) (19.2%), zucchini yellow mosaic virus (ZYMV) (9.0%), cucurbit aphid-borne yellows virus (CABYV) (7.7%), squash leaf curl China virus (SLCCNV) (7.7%), cucurbit chlorotic yellows virus (CCYV) (5.1%), cucurbit yellow stunting disorder virus (CYSDV) (3.8%), melon yellow spot virus (MYSV) (1.3%). It was found that 80.8% of the 78 samples were infected with multiple viruses. The types of mixed infection included 2 viruses (14.1%), 3 viruses (16.7%), 4 viruses (23.1%), 5 viruses (17.9%), 6 viruses (7.7%) and 7 viruses (1.3%), respectively. The WVA+CCYV+ZTMV+PRSV primers were added firstly in the multiplex RT-PCR system, followed by the WGMMV+ CGMMV primers after 12 reaction cycles. The volumes of primers were used: WVA 0.5 μL, CCYV 0.5 μL, CGMMV 0.4 μL, WGMMV 0.4 μL, ZTMV 0.6 μL, and PRSV 0.6 μL. Thus, a multiplex RT-PCR assay capable of simultaneously amplifying six viruses was established.【Conclusion】There are 12 primary viruses that infect bottle gourd in Guangdong Province. Among them, CGMMV, ZTMV, WGMMV, and WVA are the most predominant viruses. Mixed infection is a commonly observed phenomenon, with three, four, and five viruses’ co-infection being the most prevalent types. A multiplex RT-PCR detection method has been developed to simultaneously identify six viruses in bottle gourd, which improves the detection efficiency of virus species in bottle gourd.
bottle gourd; virus disease; small RNA deep sequencing; RT-PCR detection; multiplex PCR method

10.3864/j.issn.0578-1752.2023.23.010
2023-08-04;
2023-08-27
国家自然科学基金(32272509)、广东省农业科学院农业优势产业学科团队建设项目(202103TD,202105TD)、广州市科技计划(202102020504)、广州市青年科技人才托举项目(QT-2023-040)、广东省农业科学院科技人才培养专项(R2023PY-JX011)、广东省农业科学院协同创新中心项目(XT202210)
苏琦,E-mail:sq1827266@163.com。通信作者何自福,E-mail:hezf@gdppri.com。通信作者李正刚,E-mail:lizhenggang@gdppri.com
(责任编辑 岳梅)
