月饱食度对草鱼幼鱼生长性能、体组成、免疫能力及水质的影响
2023-12-25郭薇汪敏杨慧君莫爱杰袁勇超
郭薇 汪敏 杨慧君 莫爱杰 袁勇超


月飽食度对草鱼幼鱼生长性能、体组成、免疫能力及水质的影响
(华中农业大学水产学院/农业动物遗传育种与繁殖教育部重点实验室/农业农村部淡水生物繁育重点实验室,武汉 430070)
摘要:为探讨月饱食度对草鱼(Ctenopharyngodon idellus)幼鱼的摄食、生长、免疫能力和养殖水体水质的影响,选取初始体重(18.10±0.09) g的草鱼幼鱼为试验对象,试验期为60 d。设计4个月饱食度,分别为月饱食量的70%、80%、90%和100%。结果表明,①试验鱼的增重率和特定生长率与月饱食度呈显著性正相关,月饱食度为100%的处理组表现出最佳的特定生长率(2.02%/d),但与月饱食度90%的处理组之间无显著差异(P>0.05);试验鱼的饲料系数与月饱食度呈显著性负相关,月饱食度为90%的处理组饲料系数最低(1.16±0.04),而月饱食度为70%的处理组饲料系数最高(1.43±0.07)。②不同月饱食度对试验鱼的存活率和形态学指标有一定的影响,其中月饱食度为100%的处理组存活率最低,但其肝体比和肥满度最高。③不同月饱食度对试验鱼肌肉营养组成成分无显著影响(P>0.05),而随着月饱食度的增加,全鱼粗脂肪含量越高(P<0.05)。④养殖水体氨氮、硝态氮和磷酸盐含量与试验鱼的月饱食呈显著性正相关(P<0.05),但养殖水体的亚硝态氮和试验鱼的血清抗氧化指标不受月饱食度变化的影响而显著性变化(P>0.05)。
关键词:草鱼(Ctenopharyngodon idellus)幼鱼;月饱食度;生长性能;免疫;水质
中图分类号:S965.112 文献标识码:A
文章编号:0439-8114(2023)11-0106-07
DOI:10.14088/j.cnki.issn0439-8114.2023.11.019 开放科学(资源服务)标识码(OSID):
Effects of monthly satiation degree on growth performance, body composition, immunity and water quality of juveniles grass carp
GUO Wei, WANG Min, YANG Hui-jun, MO Ai-jie, YUAN Yong-chao
(College of Fisheries, Huazhong Agricultural University/Key Lab of Agricultural Animal Genetics, Breeding and Reproduction of Ministry of Education /Key Lab of Freshwater Animal Breeding, Ministry of Agriculture and Rural Affairs, Wuhan 430070, China)
Abstract: In order to explore the effects of monthly satiation degree on the feeding, growth, immunity of juvenile grass carp (Ctenopharyngodon idellus) and the water quality index of farmed aquatic fish ponds, juvenile grass carp with body weight of (18.10 ± 0.09) g was selected as the test subjects for a period of 60 days. The juveniles were fed at four levels of 70%, 80%, 90% and 100% of monthly satiation degree. The results showed that: ① The weight gain rate and specific growth rate of the test fish were significantly positively correlated with the monthly satiety, and the treatment group with monthly satiation degree of 100% showed the best specific growth rate (2.02%/d), but had no obvious difference compared with the treatment group with monthly satiation degree of 90% (P>0.05); the feed coefficient of the test fish was significantly negatively correlated with the monthly satiety, the test fish with monthly satiation degree of 90% had the lowest feed coefficient (1.16±0.04), while the test fish with monthly satiation degree of 70% had the highest feed coefficient (1.43±0.07). ② Different monthly satiation degrees had a certain impact on the survival rate and morphological indicators of the test fish, among which the test fish with monthly satiation degree of 100% had the lowest survival rate, but their hepotasomatic index and condition factor were the highest. ③ The difference in the muscle nutrient composition of the test fish under different monthly satiety levels was not significant (P>0.05), while the crude fat content in the whole fish nutrient content was significantly positively correlated with the monthly satiation degree (P<0.05). ④During the test period, the contents of ammonia nitrogen, nitrate nitrogen and phosphate in the cultured water bodies increased significantly with the increase of monthly satiety (P<0.05), but the monthly satiety had no significant effect on the nitrogen nitrite nitrogen in the cultured waters and the serum antioxidant index of the test fish (P>0.05).
Key words: grass carp (Ctenopharyngodon idellus) juvenile; monthly satiation degree; growth performance; immunity; water quality
2020年中国水产品总产量6 549.02万t,其中水产养殖总产量5 224.20万t,投喂性养殖品种约占养殖总产量的68%,约为3 552.46万t[1]。鱼类投饵养殖模式的饲料成本占总成本比例较大(50%~80%),依据品种特性建立的配套投喂策略是提高饲料利用率、减少饲养成本的有效途径[2]。饲料投喂既要满足养殖对象生长的营养需求,同时又要避免长期饱食投喂导致养殖对象代谢负荷过大继而诱发代谢综合征等问题。当前,养殖鱼类的投饲策略主要还是依据人工经验定量投饲,每次投喂量的偏差累积会较大地影响到整个养殖周期的经济效益[3]。因此,科学合理的投喂策略能有效减少饲养成本,提高养殖效益。饲养鱼类的摄食量因品种、生长阶段、养殖季节以及水环境的不同而存在差异。目前,虽然有大量研究者通过研究养殖对象的饲喂水平和饲喂频率来提高饲料效率以及减少水产养殖业对环境的污染,但是往往单一的降低饲喂水平会造成营养供给失衡等问题而引起养殖对象生长性能下降。
水产动物在生长过程中有时会受到短期的饥饿胁迫,经过短期饥饿再恢复摄食后,如果其体重能达到正常摄食时的水平,则获得补偿生长。但也有研究显示,一些受饥饿胁迫的养殖动物最终体重未能达到正常摄食时的水平,未获得补偿生长[4]。周期性喂食是指在一定时期内、在一定程度上,可以通过连续3 d投喂停食1 d循环,或连续6 d投喂停食1 d循环。研究表明,定期饥饿再投喂能減少建鲤(Cyprinus carpio var. Jian)的全鱼脂肪含量,而不会对其他营养元素含量产生明显的影响[5];虽然该方法对罗非鱼(Oreochromis niloticus)的饲料转化没有影响,但对提高罗非鱼的取食效果却是十分显著[6]。而研究表明,牙鲆(Paralichthys olivaceus)幼鱼在不同周期性投喂模式下,鱼体特定生长率、摄食率和饲料转化率存在差异[7]。研究表明,循环投喂模式会促进鱼体生长、提高饲料利用率、降低水体污染、节约成本[8-11]。
草鱼(Ctenopharyngodon idellus)属鲤形目鲤科雅罗鱼亚科草鱼属,因富含多种维生素、蛋白质和不饱和脂肪酸,骨刺较少,因而深受群众们的喜爱。作为中国重要的经济鱼类,草鱼产量一直位于淡水鱼类总产量之首[12]。草鱼食欲强、摄食量大,养殖户为了追求其生长速度和养殖产量,长期饱食投喂可能会导致其代谢超负荷而引发代谢综合征等问题。关于草鱼不同月饱食度条件下的生长研究十分缺乏,月饱食度条件不同,草鱼在短期饥饿胁迫后的生长能力可能存在差异,因此有必要更清楚地了解草鱼在短期饥饿后饱食投喂继续生长的特点,探讨能否利用这些特性来改变草鱼的饲养投喂方式,达到减少投喂量或投喂总次数的目的。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕和菜粕等为主要蛋白质源,大豆油为主要脂肪源,麦麸和面粉为糖源,根据草鱼幼鱼营养需求,配制饲料(表1)。饲料原料经过60目筛分,经分级配比后,通过制粒机加工成粒径1.5 mm的颗粒状饲料,干燥后置于-20 ℃贮存。
1.2 试验用鱼与养殖管理
试验用鱼由湖北省黄冈市百容水产良种有限公司提供,采用规格整齐、体表无外伤、体质健壮的幼鱼,将符合要求的360尾体质量为(18.10±0.09) g的草鱼随机分组于12个水缸中养殖,水缸为长1.5 m、宽0.8 m,在水缸中暂养7 d以适应封闭循环水养殖环境。
在饲养过程中,以饱食喂饲方式喂饲幼鱼,投喂时间点分别为8:00、12:00和16:00,注意观察幼鱼的摄食情况,保证每次投喂试验鱼达到饱食状态,每1 h后用虹吸法吸去残饵,烘干称重并作记录,投饲质量与残饵质量的差值为草鱼的实际摄食量。试验期间,水温在25~30 ℃,利用自然光并保持持续充气。
1.3 试验设计
饱食量是以30条幼鱼在暂养7 d内的平均饱食量为基础,根据鱼种的摄食情况、天气、水质等因素进行适当调节。设置4个月饱食度水平,分别为月饱食量的70%、80%、90%和100%,每组3个平行,月饱食度70%是指按照每隔3 d饱食投喂后停食1 d,共投喂42 d;月饱食度80%是指按照每隔4 d饱食投喂后停食1 d,共投喂48 d;月饱食度90%是指每隔9 d饱食投喂后停食1 d,共投喂54 d;月饱食度100%是指每天投喂,共投喂60 d(表2)[13-15]。
[月饱食度 投喂时间 70% 每隔3 d饱食投喂后停食1 d,共投喂42 d 80% 每隔4 d饱食投喂后停食1 d,共投喂48 d 90% 每隔9 d饱食投喂后停食1 d,共投喂54 d 100% 每天投喂,共投喂60 d ]
1.4 指标测定与计算
1.4.1 常规营养指标的测定 水分:采用恒温烘干失水法(GB6435—86),100~105 ℃烘干至恒重;粗蛋白质:采用凯氏定氮法(GB6432—86);粗脂肪:采用索氏抽提法(GB6533—86);灰分:采用灼烧法(GB6438—86),550~600 ℃灰化至恒重。
1.4.2 免疫指标的测定 试验鱼饥饿24 h后,每组各取3尾试验鱼,用200 mg/L MS-222麻醉,进行尾静脉取血,3 000 r/min离心15 min,取上清液于离心管中并于-20 ℃保存。总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、溶菌酶(LZM)活力和丙二醛(MDA)含量的测定采用南京建成生物工程研究所生产的试剂盒。
1.4.3 生长性能指标的计算 试验鱼的日摄食率(Feeding rate,FR)、体重增加率(Weight gain rate,WGR)、特定生长率(Specific growth rate,SGR)、饲料系数(Feed coefficient,FCE)分别用以下公式进行计算:
FR=100%×Id/[(M2+M1)/2]/[T×n];
WGR=(M2-M1)/M1×100%;
SGR=(InM2-InM1)×100%/t;
FCE=Id/(M2-M1)×100%
式中,Id为累计食物消耗量,M1为初始鱼体重,M2为试验结束时鱼体重,t为试验天数,T为各组实际投喂天数,n为试验鱼尾数。
1.4.4 水质指标的测定 在试验第1天和第11天进行水质指标的测定。测定水质的当天,投喂时间改为8:00和16:00,取每次投喂饲料后4 h的水样作为测定的水样,测量其氨氮、亚硝态氮、磷酸盐和硝态氮等水质指标。
将饲喂后4 h的水质指标增加量针对体重和时间进行换算,结果称为氨氮相对浓度[mg/(kg·d)],表示单位体重草鱼幼鱼单位时间对应的氨氮含量。同时水质原始测定浓度称为氨氮绝对浓度(mg/L)。
氨氮相对浓度=(C11-C1)×V/Wt
式中,C1、C11分别指饲喂前、饲喂4 h后氨氮绝对浓度(mg/L),V指水体体积(L),W指处理组中鱼总重(kg)。亚硝态氮、硝态氮和磷酸盐相对浓度计算公式与氨氮相同。
1.5 数据分析
试验数据以平均值±标准差(Mean±S.D.)表示,并使用SPSS 17.0软件对数据进行单因素方差分析(One Way ANOVA),显著性水平设为α=0.05,然后进行组间差异的多重比较分析(Duncans)。
2 结果与分析
2.1 月饱食度对草鱼幼鱼摄食、生长和饲料利用的影响
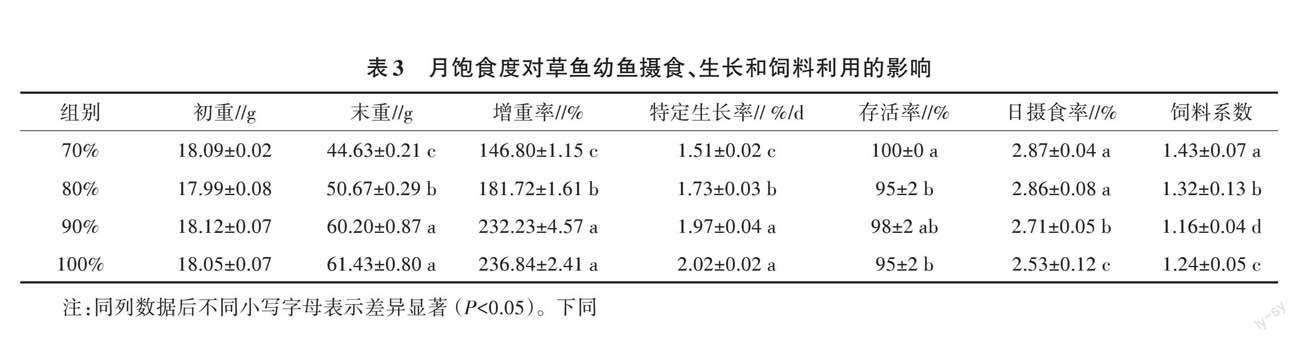
由表3可知,各试验组的特定生长率随月饱食度增加而增加;90%月饱食度处理组的特定生长率显著高于70%和80%月饱食度处理组(P<0.05),其特定生长率为1.97%/d。而月饱食度为100%时,草鱼幼鱼特定生长率比90%月饱食度处理组增加了0.05个百分点/d,两组的特定生长差异不明显(P>0.05)。由表3可知,90%月饱食度投喂组的饲料系数最低,且草鱼幼鱼日摄食率与月饱食度呈负相关(P<0.05)。
由表4可知,月饱食度与肝体比呈正相关,其中100%月饱食度处理组肝体比显著高于其他3组(P<0.05),70%和80%月饱食度处理组肝体比无显著差异(P>0.05)。各试验组幼鱼脏体比无显著差异(P>0.05)。在90%和100%月饱食度组中,肥满度显著高于其他两组(P<0.05)。
2.2 月饱食度对草鱼幼鱼鱼体、肌肉和肝脏组成成分的影响
由表5可以看出,各组鱼体含水量在71.39%~72.06%,试验鱼粗蛋白质、粗脂肪、粗灰分含量分别为14.01%~14.91%、8.43%~11.08%、2.92%~3.03%。不同试验组肌肉营养成分含量无显著差异(P>0.05),而全魚粗脂肪含量与月饱食度呈显著正相关,且随月饱食程度的增加而增加(P<0.05)。
各组鱼肝脏含水量为69.23%~69.71%,粗蛋白质、粗脂肪、灰分含量分别为12.36%~13.88%、10.53%~12.51%、1.63%~1.65%。各试验组含水量和灰分含量无显著差异(P>0.05)。而各试验组粗蛋白质含量与月饱食度呈正相关(P<0.05)。肝脏粗脂肪变化规律相同,月饱食度越高,肝脏粗脂肪含量越高(P<0.05)。
2.3 月饱食度对草鱼幼鱼养殖水体水质的影响
由表6可以看出,不同月饱食度对水体中亚硝态氮(NO2-N)含量没有显著影响(P>0.05),但月饱食度对氨氮(NH3-N)含量有显著影响(P<0.05),月饱食度越高,养殖水体中氨氮(NH3-N)含量也越高(P<0.05)。硝态氮(NO3-N)和磷酸盐(PO4-P)含量变化规律与之相同,与月饱食度呈正相关(P<0.05)。
2.4 月饱食度对草鱼幼鱼免疫和抗氧化指标的影响
从表7可以看出,不同月饱食度对试验鱼血清溶菌酶、过氧化氢酶和总超氧化物歧化酶活性及丙二醛含量均无显著性影响(P>0.05)。不同月饱食度处理条件下试验鱼血清溶菌酶活性变化范围为3.41~3.42 U/mL,过氧化氢酶的活性变化范围为6.72~6.77 U/mL,总超氧化物歧化酶的活性变化范围为94.08~95.60 U/mL,丙二醛的含量变化范围为9.42~9.45 nmoL/mL。
3 讨论
3.1 月饱食度对草鱼幼鱼生长性能和饲料利用的影响
大多数鱼类经过短期饥饿再投喂处理后都具有不同程度的补偿生长能力[5,16,17],以月饱食度为基准进行投喂处理,通过对草鱼在短期饥饿状态下的补偿生长特征研究,为实际饲养中改善饲料方式提供新的思路。研究结果显示,对建鲤(Cyprinus carpio var. Jian)、牙鲆幼鱼和半滑舌鳎(Cynoglossus semilaevis)进行周期性饥饿再投喂,均未见明显的增重率变化(P>0.05)[5,7,18]。卵形鲳鲹限食20%、40%、60%投喂,限时投喂12 d后恢复投喂28 d,增重率与持续投喂处理组无显著差异(P>0.05)[19]。奥尼罗非鱼(Oreochromisniloticus×O.aureus)饥饿1 d后连续投喂6 d,其增重率、特定生长率与对照组无显著性差异,出现完全补偿生长[20]。本试验中草鱼幼鱼的增重率和特定生长率随月饱食度的增加而增加,90%月饱食度与100%月饱食投喂组间生长差异不明显(P>0.05),且90%月饱食度组草鱼幼鱼出现完全补偿生长。70%和80%月饱食度处理组摄食量明显降低且饲料系数较高,由于长期饥饿,累积摄食量下降,造成仔鱼生长缓慢,而90%月饱食度处理组的饲料系数要比100%月饱食度处理组的低。本试验表明90%月饱食度处理组的日投喂量高于100%月饱食度处理组,也就是说与100%月饱食度处理组相比,90%月饱食度可以实现完全补偿生长,可能是短期饥饿促使试验鱼食欲增加和饲料转化效率共同提高的结果,这与长丝异鳃鲶和异育银鲫的研究结果一致[21,22]。Chatzifotis等[23]研究表明,饥饿后再投喂的欧洲舌齿鲈(Dicentrarchus labrax)食欲显著上升,对锦鲤(Cryprinus carpiod)[24]、豹纹鳃棘鲈(Plectropomusleopardus)[25]的研究也出现了类似的结果。
3.2 月饱食度对草鱼幼鱼鱼体、肌肉和肝脏组成成分的影响
研究表明,长期饱食或过量投喂会引起鱼类机体代谢的变化,进而促进脂肪异常沉积[26-30]。肝脏组织作为鱼类机体中脂肪合成代谢的重要器官之一,在长期摄入大量营养物质之后导致冗余营养物质在机体代谢中易转化为脂肪沉积于腹腔、头盖腔、皮下、肝脏以及肌肉等组织[31-33]。脂肪在肝细胞中沉积过多,会导致细胞的形态、功能发生变化,从而对机体健康产生不利的影响。目前,已有研究显示,异育鲤鱼的脂肪优先在内脏中沉积[34,35],但是斑马鱼(Danio rerio)仔鱼的脂肪优先在除内脏的肌肉、皮下和心包区等其他部位进行沉积[36]。幼鱼的月饱食度和肝体比之间存在着显著正相关,表明100%月饱食度投喂会对鱼体的肝脏代谢造成一定的影响,从而影响鱼体的正常形态。随着月饱食度的提高,鱼肝中脂肪含量显著提高,鱼类在短时间内会先消化蛋白质补充能量,在能量耗尽后再利用脂肪来补充能量[37],月饱食度的提高会导致饲料中脂肪的积累。短期饥饿对全鱼和肌肉的常规营养组成没有产生显著性影响,说明草鱼全鱼鱼体和肌肉组成不会受到短期饥饿处理而产生显著性变化。
3.3 月饱食度对草鱼幼鱼养殖水体水质的影响
在养殖过程中,氮、磷是影响养殖水体质量的主要因素。水体中磷元素含量的增长主要来自于鱼体内的直接排泄和排泄物的分解,以正磷酸盐(PO4-P)为主要存在形式[38,39]。氨氮、亚硝态氮是影响鱼类生长发育和毒性的重要物质[40-42]。已有研究显示,在淡水硬骨鱼类中,氮的排泄量为90%[43]。水中的分子态氨氮等离子含量太高,就会对鱼类的生长造成影响甚至会导致鱼类的死亡[44]。
研究表明,丁鱥(Tinca tinca)幼鱼排泄氨氮物相应地较多[45]。鲮鱼(Cirrhinus mrigala)[46]、黑鲷(Acanthopagrus schlegeli)[47]、褐牙鲆(Paralichthys olivaceus)[48]的研究结果相似,其摄食水平越高,氨氮排泄率就越高,鱼体蛋白质代谢中除生长所需蛋白质外,过剩的营养物质多分解为其他各种代谢产物并排出体外[49];瓦氏黄颡鱼(Pelteobagrus vachelli)摄食代谢峰值随着取食量的增加而增大[50]。本研究中不同月饱食度对草鱼幼鱼的氨氮和磷酸盐排泄有显著的影响且与月饱食度成正比,在100%月饱食度处理组下,草鱼幼鱼的摄食量和水体氨氮和磷酸盐含量均达到最大值。该现象的产生与鱼类摄入量的增长有关,因为鱼类摄入量的提高会促使它们的新陈代谢活动,而摄入食物中多余的营养成分则会被代谢活动分解到体外。亚硝态氮(NO2-N)是一种非稳定的生物物质,在一定的环境下可以被氧化为硝态氮,也可以被还原为氨态氮。结果表明,不同月饱食度处理的鱼类,其亞硝态氮含量无显著性差异,而随着月饱食度的提高,水体中硝态氮含量也升高,这是由于养殖水体中的溶氧量较高,能够及时将NO2-N转换为NO3-N。100%月饱食度对养殖水体的污染负荷影响明显大于其他3个处理组。
3.4 月饱食度对草鱼幼鱼免疫和抗氧化指标的影响
鱼体的免疫功能在很大程度上依赖于非特异性免疫[51,52]。大西洋鲑(Salmo salar)的免疫功能在饱食、限饲和饥饿时均有不同程度的变化,饥饿组的存活率较高,饱食组的存活率较低[53]。另外,限制喂食对欧洲鲈鱼(Perca fluviatilis)感染隐孢子虫的机率有明显的影响,降低发病率[54]。本研究结果显示不同月饱食度对草鱼幼鱼血液免疫功能无明显影响,其主要原因是月饱食度饥饿处理时间(1 d)短,对其免疫功能没有不良影响,或试验周期太短。
综上所述,在生长和饲料利用率方面,70%、80%月饱食度处理组明显低于90%、100%月饱食度处理组。从水质健康、免疫、抗氧化功能等方面分析,90%月饱食度处理组对降低饲料成本、维持养殖水体环境具有重要意义,认为草鱼幼鱼的最佳投喂的月饱食度为90%。
参考文献:
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.中国渔业统计年鉴2021[M].北京:中国农业出版社,2021.
[2] 马长震,谌志新,汤涛林,等.基于超声探测技术的深水网箱剩余饵料监测系统[J].微计算机信息,2012,28(4):39-40.
[3] 俞国燕,张宏亮,刘皞春,等. 水产养殖中鱼类投喂策略研究综述[J]. 渔业现代化,2020, 47(1):1-5.
[4] 杨严鸥,姚 峰,何文平.长吻鮠、异育银鲫和草鱼补偿生长的比较研究[J].中国水产科学,2005,12(5):575-579.
[5] 乔秋实,蒋广震,刘文斌,等.周期性饥饿再投喂对建鲤(Cyprinus carpio var. Jian)生长、体组成、消化酶的影响[J].海洋与湖沼,2011,42(3):367-373.
[6] 李 建,王 琨,陈建春,等.不同循环饥饿投喂模式对尼罗罗非鱼补偿生长的影响[J].水产学报,2014,38(6):869-876.
[7] 姜海波,姜志强.周期性饥饿-再投喂对牙鲆幼鱼生长和饲料利用的影响[J].大连水产学院学报,2007,22(3):231-233
[8] MACLEAN A, METCALFE N B. Social status, access to food, and compensatory growth in juvenile Atlantic salmon [J]. Journal of fish biology, 2001, 58(5): 1331-1346.
[9] EROLDO[G]AN O T, TA?BOZAN O, TABAKO[G]LU S. Effects of restricted feeding regimes on growth and feed utilization of juvenile gilthead sea bream, Sparus aurata[J]. Journal of the world aquaculture society, 2008, 39(2): 267-274.
[10] HUANG G, WEI L, ZHANG X, et al. Compensatory growth of juvenile brown flounder Paralichthys olivaceus (Temminck & Schlegel) following thermal manipulation[J]. Journal of fish biology, 2008, 72(10): 2534-2542.
[11] BLANQUET I, OLIVA-TELES A. Effect of feed restriction on the growth performance of turbot (Scophthalmus maximus L.) juveniles under commercial rearing conditions[J]. Aquaculture research, 2010, 41(8): 1255-1260.
[12] 徐樂俊,吴反修. 2019 中国渔业统计年鉴[J]. 北京:中国农业出版社,2019.
[13] 黄大宏,余 海.半滑舌鳎工厂化养殖技术的初步研究[J].现代渔业信息,2007,22(8):17-20.
[14] 李 勇,王美琴,高婷婷.封闭循环水养殖半滑舌鳎蛋白质的生态营养需要量[J].水产学报,2010,34(11):1720-1727.
[15] 王美琴,李 勇,车向荣.蛋白质与饱食度对工厂化养殖半滑舌塌生长与免疫的影响[J].渔业科学进展,2009,30(4):27-37.
[16] DOBSON S H, HOLMES R M. Compensatory growth in the rainbow trout, Salmo gairdneri Richardson[J]. J Fish Biol, 1984, 25: 649-656.
[17] 王海芳,刘 霞,徐亚娟.饥饿再投喂对“甘肃金鳟”幼体生长和肌肉组分的影响[J].甘肃农业大学学报,2014,49(5):37-42
[18] 柳 阳,李 勇,王 华,等.投喂方式对工业化养殖半滑舌鳎生长、摄食、免疫及水质的影响[J].水产科学,2015,34(8):469-475.
[19] 江 华.限食比例和饥饿时间对卵形鲳鲹幼鱼补偿生长的影响[D].广东湛江:广东海洋大学,2014.
[20] 韩春艳,郑清梅,陈桂丹,等.不同投喂模式对奥尼罗非鱼生长及体内脂类代谢的影响[J].广东农业科学,2014,41(16):120-124.
[21] LUQUET P, OTEME Z J, CISSE A. Evidence for compensatory growth and its utility in the culture of Heterobranchus longifilis[J]. Oceanographic literature review, 1996, 7(43): 718.
[22] QIAN X, CUI Y, XIONG B, et al. Compensatory growth, feed utilization and activity in gibel carp, following feed deprivation[J]. J Fish Biol, 2000, 56, 228-232.
[23] CHATZIFOTIS S, PAPADAKI M, DESPOTI S, et al. Effect of star-vation and re-feeding onreproductive indices, bodyweight, plasma metabolites and oxidative enzymes of seabass(Dicentrarchus labrax)[J]. Aquaculture, 2011, 316: 53-59.
[24] 杨志强,李潇轩,许郑超.锦鲤幼鱼循环饥饿后的补偿生长和体成分变化[J]. 渔业研究,2017,39(6):463-468.
[25] 刘龙龙,唐贤明,付成冲,等.周期性饥饿-再投喂处理对豹纹鳃棘鲈幼鱼生长和饲料利用的影响[J].安徽农业科学,2018, 46(6):77-79,129.
[26] ELLIS S C, REIGH R C. Effects of dietary lipid and carbohydrate levels on growth and body composition of juvenile red drum, Sciaenops ocellatus[J]. Aquaculture, 1991, 97:383-394.
[27] HELLAND S, GRISDALE-HELLAND B. Growth, feed utilization and body composition of juvenile Atlantic halibut (Hippoglossus hippoglossus) fed diets differing in the ratio between the macronutrients[J]. Aquaculture, 1998, 166: 49-56.
[28] NANTON D, LALL S, MCNIVEN M A. Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock, Melanogrammus aeglefinus L [J]. Aquaculture research, 2001, 32: 225-234.
[29] WANG J T, LIU Y J, TIAN L X, et al. Effect of dietary lipid level on growth performance, lipid deposition, hepatic lipogenesis in juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2005, 249: 439-447.
[30] MARTINS D A, VALENTE L M, LALL S P. Effects of dietary lipid level on growth and lipid utilization by juvenile Atlantic halibut (Hippoglossus hippoglossus L.)[J]. Aquaculture,2007, 263: 150-158.
[31] ZHOU S, ACKMAN R G, MORRISON C. Adipocytes and lipid distribution in the muscle tissue of Atlantic salmon (Salmo salar) [J]. Canadian journal of fisheries and aquatic sciences, 1996, 53: 326-332.
[32] TOUSSAINT C, FAUCONNEAU B, M?DALE F, et al. Description of the heterogeneity of lipid distribution in the flesh of brown trout (Salmo trutta) by MR imaging[J]. Aquaculture, 2005, 243: 255-267.
[33] TOCHER D R. Metabolism and functions of lipids and fatty acids in teleost fish[J]. Reviews in fisheries science, 2003, 11: 107-184.
[34] 王愛民,吕 富,杨文平,等.饲料脂肪水平对异育银鲫生长性能、体脂沉积、肌肉成分及消化酶活性的影响[J].动物营养学报,2010,22(3):625-633.
[35] 张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J].中国水产科学,2013(1):108-115.
[36] FLYNN E J, TRENT C M, RAWLS J F. Ontogeny and nutritional control of adipogenesis in zebrafish (Danio rerio)[J]. Journal of lipid research, 2009, 50: 1641-1652.
[37] 谢小军,邓 利,张 波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-189.
[38] 阮景荣.三种鱼的磷排泄及其在微型生态系统磷再循环中的作用[J].水生生物学报,2005,29(1):55-60.
[39] BRABRAND A, FAAFENG B A, NILSSEN J P M. Relative importance of phosphorus supply to phytoplankton production: fish excretion versus external loading[J]. Can J Fish Aquat Sci, 1990, 47(2): 364-372.
[40] JOBLING M. Some effects of temperature, feeding and body weight on nitrogenous excretion in young plaice Pleuronectes platessa L[J]. Journal of fish biology, 1981, 18: 87-96.
[41] BRAFIELD A. Laboratory studies of energy budgets[A]. TYTLER P,CALOW P. Fish energetics: New perspectives[C].London:CroomHelm, 1985:257-281.
[42] DOSDAT A, SERVAIS F, METAILLER R, et al. Comparison of nitrogenous losses in five teleost fish species[J]. Aquaculture, 1996, 141(1-2): 107-127.
[43] BRETT J R, GROVES T D D. Physiological energetics[J]. Fish physiology, 1979, 8(6): 280-352.
[44] MEADE J W. Allowable ammonia for fish culture[J]. The progressive fish-culturist, 1985, 47: 135-145.
[45] ZAKERS Z, DEMSKA Z K, JAROCKI P, et al. The effect of feeding on oxygen consumption and ammonia excretion of juvenile tench Tinca tinca (L.) reared in a water recirculating system[J]. Aquaculture international, 2006, 14(1-2): 127-140.
[46] KHAN MA, AHMED I. Effect of ration size on growth, food conversion efficiency and body composition of figerling mrigal, Cirrhinus mrigala (Hamilton)[J]. Aquaculture nutrition,2004, 10(1): 47-54.
[47] 孙 耀,郑 冰,张 波.日粮水平和饵料种类对黑鲷能量收支的影响[J].海洋水产研究,2002,23(1):5-10.
[48] 线薇薇,朱鑫华.摄食水平对褐牙鲆幼鱼能量收支的影响[J].青岛大学学报(自然科学版),2001,31(5):695-700.
[49] LEGROW S M, BEAMISH F W H. Influence of dietary protein and lipid on apparent heat increment of rainbow trout, Salmo gairdneri[J]. Canadian journal of fisheries and aquatic sciences, 1986, 43(1): 19-25.
[50] 李秀明,曹振東,付世建.摄食水平对瓦氏黄颡鱼餐后代谢特征的影响[J].动物学杂志,2009,44(6):10-16.
[51] WHYTE S K. The innate immune response of finfish-a review of current knowledge[J]. Fish & shellfish immunol, 2007, 23(6): 1127-1151.
[52] RAIDA M K, BUCHMANN K. Innate immune response in rainbow trout (Oncorhynchus mykiss) against primary and secondary infections with Yersinia rucher[J]. Dev Comp Immunol, 2009, 33(1): 35-45.
[53] DAMSGARD B, SORUM U, UGELSTAD I, et al. Effect of feeding regime on susceotibility of Atlantic salmon (Salmo salar) to cold water vibriosis[J]. Aquaculture, 2004, 239: 37-46.
[54] SITJA-BOBADILLA A, ALVAREZ-PELLITERO P. Experimental transmission of Cryptosporidium molnari (Apicomplexa: Coccidia) to gilthead sea bream (Sparus aurata L.) and European sea bass (Dicentrarchus labrax L.)[J]. Parasitology research, 2003, 91(3): 209-214.
