美拉德反应优化藜麦多肽抗氧化活性的研究
2023-12-25郭浩彬李敏杰张陆燕章银良
郭浩彬 李敏杰 张陆燕 章银良
摘要:通过美拉德反应修饰藜麦多肽,以期获得抗氧化活性更高的藜麦多肽美拉德产物(QP-MRPs)。通过单因素试验,考察了QP-MRPs对DPPH自由基(DPPH·)和羟基自由基(·OH)的清除能力。运用电子顺磁共振(electron paramagnetic resonance,EPR)波谱技术,更加直接、准确地研究QP-MRPs的抗氧化活性。结果表明,4种糖(核糖、木糖、葡萄糖、果糖)的美拉德产物均有抗氧化活性,核糖、木糖生成的QP-MRPs的DPPH·和·OH清除率较高,选择木糖进行工艺优化。运用均匀试验设计法对条件进行优化,得到最佳工艺条件:肽糖比为1.5∶1,反应pH为10,反应温度为140 ℃,反应时间为240 min。以优化所得到的最佳条件进行验证试验,QP-MRPs的DPPH·清除率和·OH清除率分别为76.11%和71.57%。使用木糖在最优条件下修饰藜麦多肽,可生产抗氧化活性高的QP-MRPs。
关键词:美拉德反应;均匀试验;电子顺磁共振技术;抗氧化活性
中图分类号:TS201.2 文献标志码:A 文章编号:1000-9973(2023)12-0059-10
Optimization of Antioxidant Activity of Quinoa Polypeptides by Maillard Reaction
GUO Hao-bin, LI Min-jie, ZHANG Lu-yan, ZHANG Yin-liang*
(College of Food and Biological Engineering, Zhengzhou University of Light Industry, Zhengzhou 450001, China)
Abstract: Quinoa polypeptides are modified through Maillard reaction to obtain quinoa polypeptide Maillard reaction products (QP-MRPs) with higher antioxidant activity. The scavenging capacity of QP-MRPs on DPPH free radical (DPPH·) and hydroxyl free radical (·OH) are investigated by single factor test. The antioxidant activity of QP-MRPs is studied more directly and accurately by electron paramagnetic resonance (EPR) spectroscopy. The results show that the Maillard reaction products of four kinds of carbohydrates (ribose, xylose, glucose, fructose) all have antioxidant activity. The scavenging rates of QP-MRPs produced by ribose and xylose on DPPH· and ·OH are higher, so xylose is selected for process optimization. Uniform test design method is used to optimize the conditions, and the optimal process conditions are obtained as follows: the polypeptide-carbohydrate ratio is 1.5∶1, reaction pH is 10, reaction temperature is 140 ℃, and reaction time is 240 min. The verification test is carried out under the optimal conditions, the DPPH· and ·OH scavenging rates of QP-MRPs are 76.11% and 71.57% respectively. Using xylose to modify quinoa polypeptides under the optimal conditions can produce QP-MRPs with high antioxidant activity.
Key words: Maillard reaction; uniform test; electron paramagnetic resonance technology; antioxidant activity
藜麥(Chenopodium quinoa Willd.)产于南美洲,种植历史大于5 000年,是一种一年生草本开花植物[1]。伪谷物是双子叶植物的可食用种子,类似于谷物,由于其相似的形态外观和高淀粉含量,也用于食品,藜麦属于伪谷物中的一种[2]。藜麦含有丰富的蛋白质(13%~20%)、碳水化合物(60%~69%)、脂质(4%~10%)、矿物质(3%~4%)、维生素(硫胺素、核黄素、叶酸、烟酸或视黄醇)和膳食纤维,且含有所有人体必需的氨基酸,被认为是营养丰富、健康的食物[3-4]。藜麦已被证明是一种功能性食品,具有促进健康的作用,因为其含有的类黄酮、植物甾醇、类胡萝卜素和多酚等生物活性成分具有抗氧化活性,可以预防退行性和炎症性疾病、癌症、过敏,并可能降低患心血管疾病的风险[5-6]。
抗氧化剂可以通过将其氢提供给自氧化初始阶段形成的自由基或通过抑制自由基链增长阶段有效地抑制氧化过程的发生,二丁基羟基甲苯(BHT)、丁基羟基茴香醚(BHA)和特丁基对苯二酚(TBHQ)是最常用的合成酚类抗氧化剂,具有抗氧化活性高、成本低、效益高的特点,但可能对人体具有潜在的健康危害:BHT在油炸过程中不稳定,并有研究人员发现BHT的短期过量摄入对肝脏具有毒害作用;BHA摄入过量会给人体带来健康问题,如成人过敏和儿童多动症;TBHQ在氧化后可能会产生有毒物质,高剂量的TBHQ会损害免疫细胞和免疫功能,导致胃肿瘤和肝损伤,而天然抗氧化剂可能具有更好的安全性,因此天然抗氧化剂受到了研究人员的关注,成为热门的研究方向之一[7-10]。
自由基是一种含有一个或多个不成对电子、极不稳定的高反应性有机和无机分子(高活性中间体),可以从其周围的分子中提取电子,并诱导底物的氧化分解[11]。自由基的种类繁多,包括超氧阴离子(O2-·)、单线态氧(1O2)、羟基自由基(·OH)、烷基自由基(R·)、烷过氧自由基(ROO·)、烷氧自由基(RO·)等,自由基可導致食品的品质下降,还可导致细胞氧化应激,造成细胞损伤,对人体健康不利,可能引发心血管疾病、癌症、阿尔茨海默症等疾病[12]。
电子顺磁共振(electron paramagnetic resonance,EPR)波谱技术通常在存在外部磁场的情况下探测低激发能级的磁偶极子跃迁,是一种可以检测特定氧化态的顺磁性物质,例如有机自由基、无机自由基和过渡金属[13]的技术。目前抗氧化活性的检测方法很多,但大多数方法都是依靠吸光度的变化来完成检测的,而EPR技术可直接检测自由基,与吸光度无关,抗干扰能力强。
美拉德反应被认为是含有碳水化合物和蛋白质或肽的食品在加热过程中最常见的反应之一[14]。美拉德反应是一种绿色修饰方法,因为在反应过程中可以不添加催化剂和有机溶剂,美拉德反应修饰对于修饰对象的性质具有较大的影响,包括提高溶解性、抗氧化活性和增强风味等[15-16]。
利用美拉德反应对蛋白、多肽类物质进行修饰,可以产生高抗氧化活性的产物,目前已有一些关于美拉德修饰多肽的研究,Jiang等[17]使用果糖对蟹壳肽进行修饰,并对其组分按分子大小进行分离,发现2~5 kDa组分抗氧化活性较强。赵谋明等[18]发现,在草鱼肽中加入木糖可以有效提高草鱼肽的抗氧化活性,经美拉德反应修饰后的草鱼肽,对氧自由基的吸收能力明显高于单独草鱼肽加热的产物。钱森和等[19]通过美拉德反应对芝麻多肽进行修饰,结果表明芝麻多肽的抗氧化活性显著提高,DPPH·和·OH的清除率分别提高了81.2%和103.2%。
1 材料与设备
1.1 材料与试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)、D-核糖、D-木糖、D-葡萄糖、D-果糖、抗坏血酸(均为分析纯):上海麦克林生化科技股份有限公司;黑藜麦:深圳市海尚国际贸易有限公司;硫酸亚铁(分析纯):天津市化学试剂三厂;双氧水、30%过氧化氢:烟台市双双化工有限公司;盐酸(hydrochloric acid,HCl)、氢氧化钠(sodium hydroxide,NaOH)、无水乙醇(均为分析纯):天津市永大化学试剂有限公司。
1.2 仪器设备
E-scan电子顺磁共振波谱仪 美国布鲁克(北京)科技有限公司;T6紫外可见分光光度计 北京普析通用仪器有限责任公司;FE 20实验室pH计、XLS移液枪 瑞士梅特勒-托利多公司;SQP电子天平 赛多利斯科学仪器(北京)有限公司;500Y粉碎机 铂欧五金制品有限公司;F-7000荧光光度计 日本日立公司;TG16台式离心机 湖南湘仪实验室仪器开发有限公司;HH-1智能型数显恒温油浴槽、HH-S2恒温水浴锅 巩义市予华仪器有限责任公司。
1.3 试验方法
1.3.1 藜麦多肽美拉德产物(QP-MRPs)的制备
1.3.1.1 糖种类的选择
将藜麦多肽配制为20 mg/mL的溶液,用1 mol/L NaOH或1 mol/L HCl 调节pH至8,分别加入核糖、果糖、木糖、葡萄糖,肽糖比为2∶1,在120 ℃下反应120 min,取出后用冰水快速冷却,然后离心(4 500 r/min,8 min)后,测定上清液的抗氧化指标。
1.3.1.2 肽糖比的选择
将藜麦多肽配制为20 mg/mL的溶液,用1 mol/L NaOH或1 mol/L HCl调节pH至8,肽糖比分别为1∶3、1∶2、1∶1.5、1.5∶1、2∶1、3∶1,在120 ℃下反应120 min,取出后用冰水快速冷却,然后离心(4 500 r/min,8 min)后,测定上清液的抗氧化指标。
1.3.1.3 pH值的选择
将藜麦多肽配制为20 mg/mL的溶液,用1 mol/L NaOH或1 mol/L HCl分别调节pH为6,7,8,9,10,11,肽糖比为2∶1,在120 ℃下反应120 min,取出后用冰水快速冷却,然后离心(4 500 r/min,8 min)后,测定上清液的抗氧化指标。
1.3.1.4 温度的选择
将藜麦多肽配制为20 mg/mL的溶液,用1 mol/L NaOH或1 mol/L HCl调节pH至8,肽糖比为2∶1,分别在90,100,110,120,130,140 ℃下反应120 min,取出后用冰水快速冷却,然后离心(4 500 r/min,8 min)后,测定上清液的抗氧化指标。
1.3.1.5 时间的选择
将藜麦多肽配制为20 mg/mL的溶液,用1 mol/L NaOH或1 mol/L HCl调节pH至8,肽糖比为2∶1,在120 ℃下分别反应40,80,120,160,200,240 min,取出后用冰水快速冷却,然后离心(4 500 r/min,8 min)后,测定上清液的抗氧化指标。
1.3.2 QP-MRPs紫外吸收光谱的测定
1.3.2.1 294 nm紫外吸收光谱的测定
在10 mL离心管中加入200 μL QP-MRPs。加入去离子水7.8 mL,混匀后采用紫外分光光度计检测其在294 nm处的吸光度。以去离子水作为空白组。
1.3.2.2 420 nm紫外吸收光谱的测定
在10 mL离心管中加入200 μL QP-MRPs。加入去离子水5.8 mL,混匀后采用紫外分光光度计检测其在420 nm处的吸光度。以去离子水作为空白组。
1.3.3 QP-MRPs内源荧光光谱的测定
将QP-MRPs稀释50倍,使用荧光分光光度计测定QP-MRPs的内源荧光光谱,以去离子水作为空白组。测定参数:扫描方式为扫描发射,激发波长设定为290.0 nm,发射波长范围为300.0~450.0 nm。激发狭缝宽度为2.5 nm,发射狭缝宽度为2.5 nm,扫描速度为2 400 nm/min,光电管负高压为700 V,响应速度为0.1 s。
1.3.4 QP-MRPs清除DPPH·能力的测定
在5 mL离心管中加入200 μL稀释30倍的QP-MRPs,以去离子水作为空白组。加入1 mL 0.5 mmol/L 的DPPH溶液,混匀后检测30 min,用WINEPR-Processing计算积分值(积分区间:3 450.0~3 525.0 G),DPPH自由基清除率计算公式如下:
DPPH自由基清除率(%)=Ac-AsAc×100%。
式中:Ac为空白组的积分值;As为试验组的积分值。
1.3.5 QP-MRPs清除·OH能力的測定
在1.5 mL离心管中加入20 μL DMPO、420 μL水、20 μL 10 mmol/L 硫酸亚铁、20 μL稀释30倍的QP-MRPs,空白组为去离子水。加入20 μL 50 mmol/L H2O2,混匀后检测30 min,用WINEPR-Processing计算积分值(积分区间:3 450.0~3 525.0 G),·OH清除率计算方法同上。
1.3.6 均匀试验因素水平设计
以肽糖比、反应pH、反应温度、反应时间为因素,以DPPH·清除率为考察指标。均匀试验表见表1。
2 结果与分析
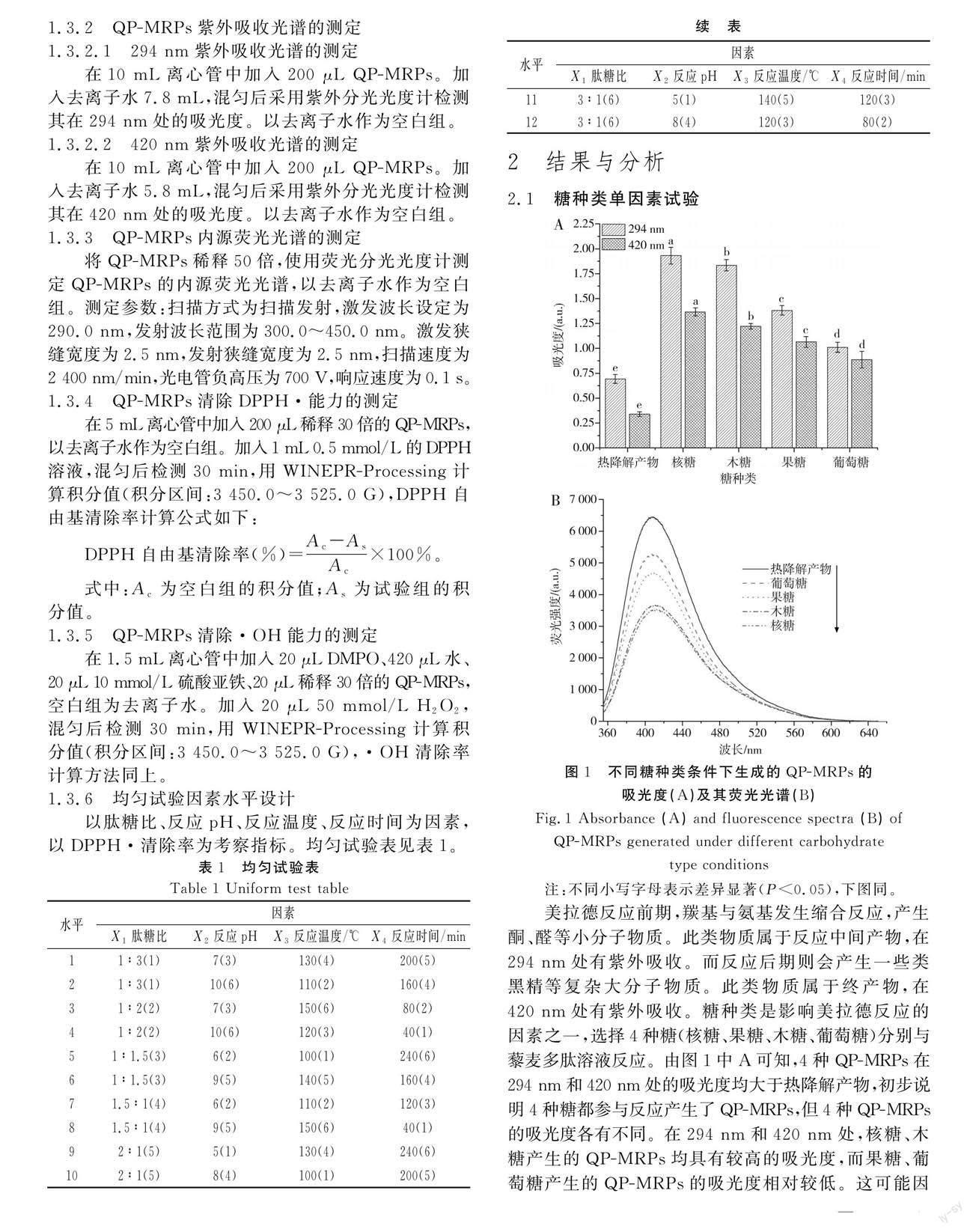
2.1 糖种类单因素试验
美拉德反应前期,羰基与氨基发生缩合反应,产生酮、醛等小分子物质。此类物质属于反应中间产物,在294 nm处有紫外吸收。而反应后期则会产生一些类黑精等复杂大分子物质。此类物质属于终产物,在420 nm处有紫外吸收。糖种类是影响美拉德反应的因素之一,选择4种糖(核糖、果糖、木糖、葡萄糖)分别与藜麦多肽溶液反应。由图1中A可知,4种QP-MRPs在294 nm和420 nm处的吸光度均大于热降解产物,初步说明4种糖都参与反应产生了QP-MRPs,但4种QP-MRPs的吸光度各有不同。在294 nm和420 nm处,核糖、木糖产生的QP-MRPs均具有较高的吸光度,而果糖、葡萄糖产生的QP-MRPs的吸光度相对较低。这可能因为是木糖、核糖为五碳糖,碳链与果糖、葡萄糖相比更短,反应位阻更小,导致反应速度更快,形成更多中间产物和类黑精等大分子物质[20]。由图1中B可知,修饰后得到的QP-MRPs的荧光强度低于热降解产物,木糖和核糖的修饰产物的荧光强度相比果糖和葡萄糖的要低。可能是具有荧光的多肽、氨基酸被修饰后形成了大分子物质,其荧光信号被阻断,导致产物的荧光强度下降[21]。
由图2可知,在EPR波谱图中,热降解产物的DPPH·和·OH的波谱信号最强,说明热降解产物对DPPH·和·OH的清除率最低。4种糖反应产生的QP-MRPs对DPPH·和·OH的清除率都比热降解产物的高,在EPR波谱图中呈现较弱的DPPH·和·OH波谱信号,说明4种QP-MRPs中都含有更多的抗氧化性物质。其中木糖和核糖反应产生的QP-MRPs,其DPPH·和·OH的波谱信号显著弱于果糖和葡萄糖反应产生的QP-MRPs,说明木糖和核糖修饰的QP-MRPs对DPPH·和·OH具有较强的清除作用,强于果糖和葡萄糖产生的QP-MRPs。有研究表明木糖参与美拉德反应可生成较多具有抗氧化性的杂环类产物,因此采用木糖进行后续单因素试验[22]。
2.2 肽糖比单因素试验
美拉德反应会受到底物浓度的影响,适合的肽糖比有利于糖和多肽分子之间碰撞反应[23]。
由图3中A可知,提高肽糖比,QP-MRPs的吸光度也上升,当肽糖比在1∶3~1∶1.5之间时,提高肽糖比,QP-MRPs的吸光度上升较快。当肽糖比提高到1.5∶1后,提高肽糖比,吸光度上升速度减缓,当肽糖比为2∶1和3∶1时差异较小,可能是底物浓度逐渐饱和,参与反应的多肽不再大幅增加,再提高多肽比例对反应的影响相对较小[24]。由图3中B可知,荧光强度随肽糖比的提高而下降,肽糖比为1∶3时,荧光强度最高,肽糖比提高至1∶2后荧光强度大幅下降,继续提高肽糖比,荧光强度则有不同程度的下降。
由图4可知,反应体系中肽糖比在1∶3~1.5∶1区间内,随着肽糖比的提高,DPPH·和·OH的波谱信号逐渐减弱,表明QP-MRPs对DPPH·和·OH的清除率也随之提高,说明提高体系中多肽的比例有利于糖和多肽之间碰撞发生羰氨缩合,促进美拉德反应,并生成抗氧化性物质[25]。
2.3 pH单因素试验
由图5中A可知,反应体系pH上升,反应速度加快,QP-MRPs在294 nm和420 nm处的吸光度升高。pH为6时多肽溶液开始出现少量沉淀,可能是该pH比较接近藜麦多肽的等电点,分子间排斥作用减弱,疏水相互作用增大[26],因此参与反应的多肽减少,导致产物减少,吸光度较低。体系pH在7~11区间,产物的吸光度缓慢提高。体系pH为11时吸光度最高。由图5中B可知,pH上升使产物的荧光强度快速下降,说明pH值提高有利于美拉德修饰,结合QP-MRPs的DPPH·和·OH清除率发现,荧光强度较低的QP-MRPs清除率更高。
由图6可知,美拉德反应体系的pH值对反应速度有显著影响。pH过低会导致氨基质子化,适宜的pH有利于中间产物进一步反应形成类黑精等终产物[27]。在EPR波谱图中,pH增大,DPPH·和·OH的波谱信号减弱,表明QP-MRPs对DPPH·和·OH的清除率逐渐提高,说明提高反应体系的pH有利于美拉德反应的发生[28]。
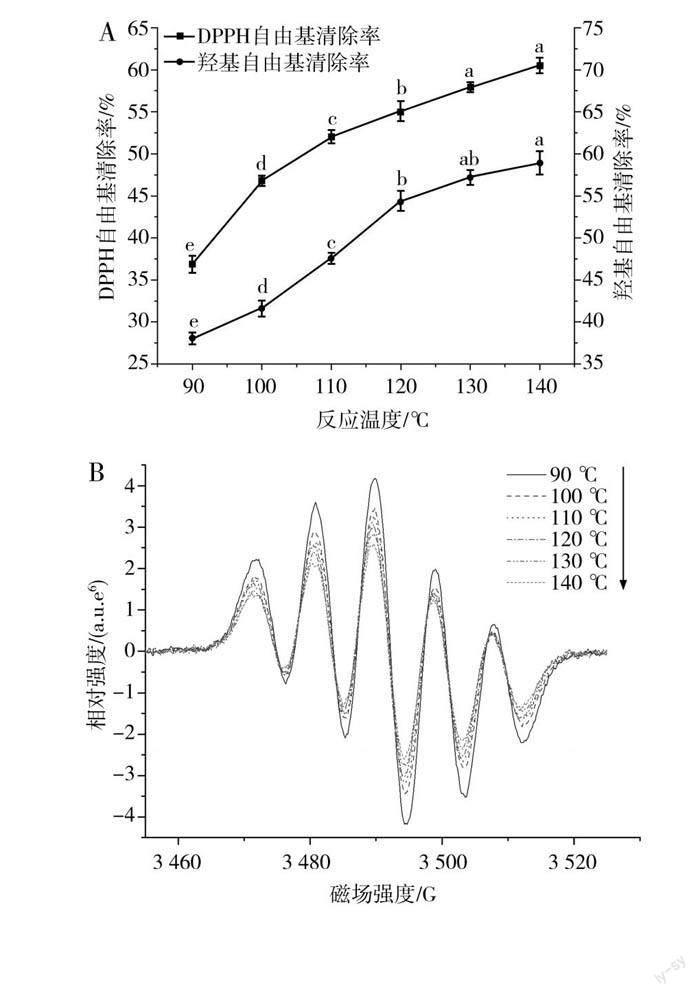
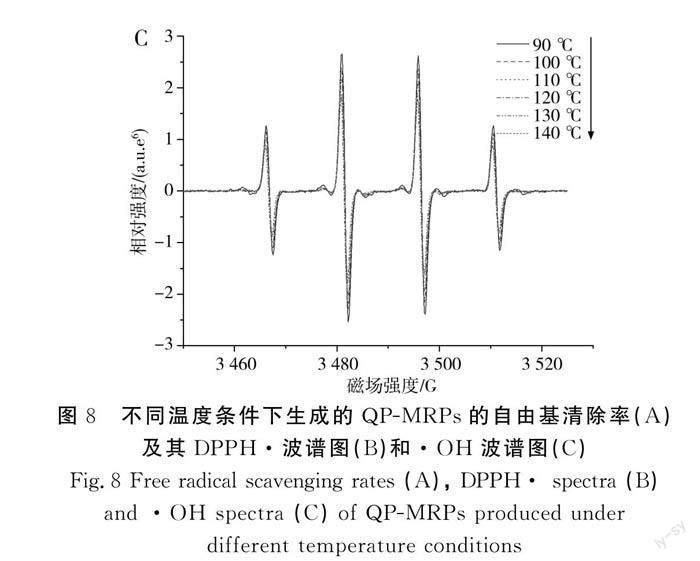
2.4 温度单因素试验
由图7中A可知,随着温度的上升,QP-MRPs的吸光度逐渐上升,说明随着反应温度的上升,美拉德反应的速度加快。在90~100 ℃条件下,QP-MRPs在294 nm和420 nm处的吸光度显著低于其他组,说明在温度较低的情况下,美拉德反应较难发生[29]。当温度达到130~140 ℃区间时,QP-MRPs的吸光度上升速度有所减缓。由图7中B可知,随着温度的上升,QP-MRPs的荧光强度下降,表明温度的升高有利于进一步修饰藜麦多肽,同时温度升高还会使波长发生红移,140 ℃组与90 ℃组的荧光光谱相比,发射波长红移了5 nm,可能是QP-MRPs中的荧光产物逐渐向有色产物转变[30]。
由图8可知,反应温度对产物的抗氧化活性有显著影响,在90~100 ℃条件下,通过EPR测得DPPH·和·OH的波谱信号较强,表明QP-MRPs的抗氧化活性相对较弱,而随着反应温度的升高,DPPH·和·OH的波譜信号逐渐减弱,表明QP-MRPs对DPPH·和·OH的清除率逐渐升高,说明随着温度的升高,美拉德反应的速度随之加快,产生的抗氧化物质(如杂环类化合物、类黑精等)的量逐渐增多[31]。
2.5 时间单因素试验
由图9中A可知,随着反应时间的增加,QP-MRPs的吸光度逐渐上升。在40~120 min区间,QP-MRPs在294 nm和420 nm处的吸光度均快速上升,而在160~240 min区间,产物在294 nm处的吸光度上升速度减缓,而在420 nm处的吸光度上升速度比294 nm处更快一些。可能是前期反应已经生成了较多的中间产物,在后期反应中,中间产物生成速度减缓,并且有部分中间产物进一步反应生成了大分子物质。由图9中B可知,修饰时间延长会致使QP-MRPs的荧光强度下降,并发生红移(240 min组相对40 min组红移了5 nm)。
由图10可知,随着反应时间的延长,通过EPR测得DPPH·和·OH的波谱信号逐渐下降,表明QP-MRPs对DPPH·和·OH的清除率快速提高,说明美拉德修饰时间的延长有利于产生更多的抗氧化活性物质,提高QP-MRPs对自由基的清除能力[32]。
2.6 均匀试验结果
为了进一步探讨肽糖比、反应pH、反应温度、反应时间4个因素对QP-MRPs抗氧化活性的影响,以DPPH·考察指标设计均匀试验,结果见表2。
利用Mathematics 9.0软件分析得出:
ln[1]:= << Statistics`LinearRegression`
ln[2]:=data={{0.33,7,130,200,52.14}t,{0.33,10,110,160,51.05},{0.5,7,150,80,57.02},{0.5,10,120,40,42.42},{0.67,6,100,240,34.31},{0.67,9,140,160,69.48},{1.5,6,110,120,39.49},{1.5,9,150,40,53.19},{2,5,130,240,56.66},{2,8,100,200,55.46},{3,5,140,120,47.78},{3,8,120,80,57.49}};
ln[3]:=(regress=Regress[data,{1,x1,x2,x3,x4,x2^2,x3*x4,x3^2},{x1,x2,x3,x4}];
Chop[regress,10^(-6)])
Out[3]:={ParameterTable→
EstimateSETStatPValue
1476.611205.9992.313 660.081 703
X15.435 041.149 824.726 860.009 125 23
X219.195 45.854 453.278 770.030 535 9
X3-7.982 592.928 35-2.725 970.052 661 6
X4-0.915 6490.287 047-3.189 890.033 219 7
X22-0.952 1810.388 03-2.453 880.070 151 4
X3X40.008 249 370.002 296 123.592 740.022 905 8
X320.029 273 60.010 513 12.784 480.049 590 7
RSquared→0.961 637,AdjustedRSquared→0.894 502,
EstimatedVariance→9.314 48
ANOVATable→
DFSumofSqMeanSqFRatioPValue
Model7933.978133.42514.323 90.010 864 6
Error437.259 59.314 88
Total11971.237
以DPPH·清除率為考察指标Y,肽糖比(X1)、反应pH(X2)、反应温度(X3)、反应时间(X4)为影响因素进行回归分析,得到回归方程(P值为0.010 86):Y=476.61+5.44X1+19.20X2-7.98X3-0.92X4-0.95X22-0.008 2X3X4+0.029X32。
由回归分析的显著性可以看出肽糖比(X1)、反应pH(X2)、反应时间(X4)对DPPH·的清除率具有显著的影响,P值分别为0.009 1,0.030 5,0.033 2,反应温度(X3)的P值为0.052 7。影响QP-MRPs抗氧化活性的主次顺序为肽糖比(X1)>反应pH(X2)>反应时间(X4)>反应温度(X3);反应温度(X3)与反应时间(X4)之间的交互作用影响显著(P=0.022 9)。
经过计算得到最佳优化条件:肽糖比(X1)为1.5∶1,反应pH(X2)为10,反应温度(X3)为140 ℃,反应时间(X4)为240 min。该反应条件下修饰的QP-MRPs抗氧化活性最强,理论DPPH·清除率为79.53%。在该反应条件下修饰的QP-MRPs的DPPH·清除率为76.11%,高于各试验值,表明该条件修饰的QP-MRPs抗氧化活性最强,优化结果可靠。
2.7 美拉德修饰对藜麦多肽的影响
由图11可知,修饰前的藜麦多肽(quinoa polypeptides,QP)抗氧化活性相对较低,DPPH·清除率和·OH清除率分别为11.44%和15.70%,抗氧化活性弱于抗坏血酸和QP-MRPs。藜麦多肽经过修饰后,抗氧化活性得到了显著的提升,DPPH·清除率和·OH清除率分别达到了76.11%和71.57%,可媲美同质量浓度的抗坏血酸。
3 结论
为进一步提高藜麦多肽的抗氧化活性,通过美拉德反应修饰藜麦多肽。获得了抗氧化活性更强的藜麦多肽美拉德产物(QP-MRPs)。利用紫外光谱、荧光光谱、DPPH·清除率和·OH清除率,探究了糖种类以及反应条件对QP-MRPs的影响。核糖、木糖、葡萄糖、果糖反应获得的QP-MRPs均有抗氧化活性,其中核糖、木糖生成的QP-MRPs 的DPPH·清除率和·OH清除率较高,可能是因为核糖和木糖是五碳糖,碳链更短,反应位阻更小。以DPPH·清除率为指标,运用均匀试验设计法对条件进行优化,得到最佳工艺条件为肽糖比1.5∶1、反应pH 10、反应温度140 ℃、反应时间240 min。使用木糖以优化的最佳条件对藜麦多肽进行修饰,QP-MRPs的DPPH·清除率为76.11%,·OH清除率为71.57%,结果表明经过美拉德反应修饰的藜麦多肽抗氧化活性得到了显著提升,并且抗氧化效果与抗坏血酸相近。
参考文献:
[1]CAO H, SUN R, SHI J, et al. Effect of ultrasonic on the structure and quality characteristics of quinoa protein oxidation aggregates[J].Ultrasonics Sonochemistry,2021,77:105685.
[2]HINOJOSA L, GONZALEZ J A, BARRIOS-MASIAS F H, et al. Quinoa abiotic stress responses: a review[J].Plants(Basel),2018,7(4):106.
[3]NAVRUZ-VARLI S, SANLIER N.Nutritional and health benefits of quinoa (Chenopodium quinoa Willd.)[J].Journal of Cereal Science,2016,69:371-376.
[4]申瑞玲,张文杰,董吉林,等.藜麦的主要营养成分、矿物元素及植物化学物质含量测定[J].轻工学报,2015,30(2):17-21.
[5]HEMALATHA P, BOMZAN D P, SATHYENDRA RAO B V, et al. Distribution of phenolic antioxidants in whole and milled fractions of quinoa and their inhibitory effects on α-amylase and α-glucosidase activities[J].Food Chemistry,2016,199:330-338.
[6]JIMENEZ M D, LOBO M, SAMMN N. 12th IFDC 2017 Special Issue-Influence of germination of quinoa (Chenopodium quinoa) and amaranth (Amaranthus) grains on nutritional and technofunctional properties of their flours[J].Journal of Food Composition and Analysis,2019,84:103290.
[7]TINELLO F, LANTE A. Accelerated storage conditions effect on ginger- and turmeric-enriched soybean oils with comparing a synthetic antioxidant BHT[J].LWT-Food Science and Technology,2020,131:109797.
[8]ABDO E M, SHALTOUT O E, MANSOUR H M M. Natural antioxidants from agro-wastes enhanced the oxidative stability of soybean oil during deep-frying[J].LWT-Food Science and Technology,2023,173:114321.
[9]MANORANJITHAM J J, NARAYANAN S S. Electrochemical sensor for determination of butylated hydroxyanisole (BHA) in food products using poly O-cresolphthalein complexone coated multiwalled carbon nanotubes electrode[J].Food Chemistry,2021,342:128246.
[10]YE Q, MENG X, JIANG L. Identification and assessment of residual levels of the main oxidation product of tert-butylhydroquinone in frying oils after heating and its cytotoxicity to RAW 264.7 cells[J].Food Chemistry,2018,264:293-300.
[11]LIU Z Q. Bridging free radical chemistry with drug discovery: a promising way for finding novel drugs efficiently[J].European Journal of Medicinal Chemistry,2020,189:112020.
[12]ZARIC B L, MACVANIN M T, ISENOVIC E R. Free radicals: relationship to human diseases and potential therapeutic applications[J].The International Journal of Biochemistry & Cell Biology,2023,154:106346.
[13]DEN HARTOG S, NEUKERMANS S, SAMANIPOUR M, et al. Electrocatalysis under a magnetic lens:a combined electrochemistry and electron paramagnetic resonance review[J].Electrochimica Acta,2022,407:139704.
[14]LUND M, RAY C. Control of Maillard reactions in foods: strategies and chemical mechanisms[J].Journal of Agricultural and Food Chemistry,2017,65(23):4537-4552.
[15]陳贵堂,周琼飞,朱艳丽,等.采用美拉德反应提高灰树花多肽的抗氧化活性[J].食品科学,2013,34(14):26-29.
[16]尹丽莎,朱莹莹,董吉林,等.超声处理对藜麦分离蛋白功能特性和微观结构的影响[J].轻工学报,2022,37(2):38-43.
[17]JIANG W, LIU Y, YANG X, et al. Antioxidant and antibacterial activities of modified crab shell bioactive peptides by Maillard reaction[J].International Journal of Food Properties,2018,21(1):2730-2743.
[18]赵谋明,刘洋,张佳男,等.木糖-草鱼肽美拉德反应产物的抗氧化性[J].农业工程学报,2014,30(9):279-286.
[19]钱森和,王洲,魏明,等.美拉德反应对芝麻多肽抗氧化活性的影响[J].食品与机械,2018,34(8):24-28,88.
[20]CHEN K, YANG X, HUANG Z, et al. Modification of gelatin hydrolysates from grass carp (Ctenopharyngodon idellus) scales by Maillard reaction: antioxidant activity and volatile compounds[J].Food Chemistry,2019,295(1):569-578.
[21]JIANG Z H, HUANGFU Y P, JIANG L, et al. Structure and functional properties of whey protein conjugated with carboxymethyl cellulose through Maillard reaction[J].LWT-Food Science and Technology,2023,174:114406.
[22]董烨,张益奇,张晓頔,等.鳙鱼皮水解物美拉德反应产物抗氧化活性研究[J].核农学报,2022,36(11):2199-2209.
[23]张强,王松华,孙玉军,等.双孢蘑菇源抗氧化肽的美拉德反应修饰研究[J].食品工业科技,2012,33(17):208-211.
[24]陈美龄,封玲,李钰琪,等.复合酶解及美拉德反应制备鱿鱼调味品[J].食品安全质量检测学报,2018,9(8):1918-1925.
[25]胡晓,刘晶,高颖,等.裂壶藻蛋白肽美拉德反应产物的制备及其抗氧化特性[J].南方水产科学,2021,17(4):58-65.
[26]刘永创,杨晓泉,郭健,等.等电点附近大豆分离蛋白乳化稳定性的研究[J].现代食品科技,2015,31(5):84-89.
[27]TOLDR F, ARISTOY M C, MORA L, et al. Innovations in value-addition of edible meat by-products[J]. Meat Science,2012,92(3):290-296.
[28]HAN J R, YAN J N, SUN S G, et al. Characteristic antioxidant activity and comprehensive flavor compound profile of scallop (Chlamys farreri) mantle hydrolysates-ribose Maillard reaction products[J].Food Chemistry,2018,261:337-347.
[29]WEI C K, NI Z J, THAKUR K, et al. Acute, genetic and sub-chronic toxicities of flaxseed derived Maillard reaction products[J].Food and Chemical Toxicology,2019,131:110580.
[30]于珍,布冠好,王美月,等.花生肽的制备及其美拉德反应产物风味特性研究[J].食品安全质量检测学报,2022,13(14):4665-4673.
[31]KCHAOU H, BENBETTAEB N, JRIDI M, et al. Enhancement of structural, functional and antioxidant properties of fish gelatin films using Maillard reactions[J].Food Hydrocolloids,2018,83:326-339.
[32]KCHAOU H, BENBETTAIEB N, JRIDI M, et al. Influence of Maillard reaction and temperature on functional, structure and bioactive properties of fish gelatin films[J].Food Hydrocolloids,2019,97:105196.
收稿日期:2023-06-14
基金項目:河南省科技攻关项目(182102110094)
作者简介:郭浩彬(1998-),男,硕士,研究方向:食品科学与品质安全。
*通信作者:章银良(1963-),男,教授,博士,研究方向:食品科学与品质安全。
