液体发酵桦褐孔菌胞内多糖提取及抗氧化活性测定
2023-12-25金东箭金朝霞
金东箭 金朝霞


摘要:樺褐孔菌(Inonotus obliquus)多糖因具有良好的功能性调味特性,引起了食品行业的广泛关注。然而,目前对液体纯化培养桦褐孔菌胞内多糖的研究较少,缺乏系统的提取工艺优化和性质分析。该研究旨在比较热水浸提法和超声波辅助提取法对桦褐孔菌胞内多糖的提取效果,并利用Design Expert 13.0软件构建超声波提取以及热水浸提桦褐孔菌胞内多糖的响应面模型。结果表明,超声波辅助提取法优于热水浸提法,其最佳提取工艺条件为超声功率508.25 W、料液比1∶19.38、超声时间18.40 min。在此条件下,桦褐孔菌胞内多糖的最佳理论预测值为43.81 mg/g。此外,该研究还探讨了超声波辅助提取法得到的桦褐孔菌胞内多糖的抗氧化活性,发现其对DPPH自由基和羟基自由基(·OH)均有较强的清除能力,其IC50值分别为1.70,1.98 mg/mL。该研究为桦褐孔菌胞内多糖的工业化生产以及其在食品风味物质的开发利用中的应用提供了依据。
关键词:桦褐孔菌;胞内多糖;超声波辅助提取;Design Expert 13.0;抗氧化活性
中图分类号:TS201.3 文献标志码:A 文章编号:1000-9973(2023)12-0044-09
Extraction and Antioxidant Activity Determination of Intracellular Polysaccharides
from Inonotus obliquus by Liquid Fermentation
JIN Dong-jian, JIN Zhao-xia*
(College of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China)
Abstract: Inonotus obliquus polysaccharides have attracted widespread attention in the food industry due to their excellent functional seasoning properties. However, there is limited research on intracellular polysaccharides from Inonotus obliquus in liquid purification culture currently, and there is a lack of systematic extraction process optimization and property analysis. The aim of this study is to compare the extraction effects of hot water extraction method and ultrasonic-assisted extraction method on the intracellular polysaccharides from Inonotus obliquus, and to construct response surface models of ultrasonic extraction and hot water extraction of intracellular polysaccharides from Inonotus obliquus by Design Expert 13.0 software. The results show that ultrasonic-assisted extraction method is superior to hot water extraction method.The optimal extraction process conditions are ultrasonic power of 508.25 W, solid-liquid ratio of 1∶19.38 and ultrasonic time of 18.40 min. Under these conditions, the best theoretical predictive value of intracellular polysaccharides from Inonotus obliquus is 43.81 mg/g. In addition, the antioxidant activity of intracellular polysaccharides from Inonotus obliquus obtained by ultrasonic-assisted extraction method is also investigated. It is found that the polysaccharides have strong scavenging capacity on DPPH free radicals and hydroxyl free radicals (·OH), with IC50 values of 1.70, 1.98 mg/mL respectively. This study has provided a basis for the industrial production of intracellular polysaccharides from Inonotus obliquus and their application in the development and utilization of food flavor substances.
Key words: Inonotus obliquus; intracellular polysaccharides; ultrasonic-assisted extraction; Design Expert 13.0; antioxidant activity
桦褐孔菌,又名白桦茸、桦树菇或西伯利亚灵芝,是一种生长在北纬40°~50°温带地区的食用和药用真菌。它含有丰富的多糖和三萜类物质,具有多种功效。在食用方面,它不仅可以作为功能性调味品为食品提供独特的风味,而且能够发挥保健作用[1]。段胜利等[2] 以桦褐孔菌多糖为原料,通过响应面试验优化加工工艺得到最佳条件,制得抗氧化活性良好、口感适中的桦褐孔菌多糖复合运动饮品。李亚楠等[3] 以桦褐孔菌提取物为原料,通过单因素试验和多因素试验优化制成了复合饮料,该饮料呈焦糖色,无沉淀,具有特有风味和清淡的茉莉花香味,具有广阔的市场发展前景。另外,桦褐孔菌多糖可以在作为调味品的同时改善食品本身的缺陷。杨晨芝等[4]利用桦褐孔菌多糖促进了乳酸菌的发酵,使酸奶的稳定性及保质期得到进一步的提高。但由于野生资源有限且难以采集,人工栽培技术得到了快速发展。相比于固体培养,液体培养技术更节省时间和资源[5]。
真菌多糖的研究和开发正处于快速发展阶段,提取方法也日益多样,各有利弊。当前,对多糖的提取方法可以概括为三类:传统法[6-10]、酶法[11]和物理法[12-13]。传统法操作简单,条件容易达到,但耗时较长。酶法是利用酶除去细胞壁和细胞膜,释放细胞内容物,不会破坏内部物质,副产物少,环境友好,能耗低,操作要求低[14-15],但这种方法的成本较高。而物理法是利用超声波、微波等物理因素辅助提取,通过空化效应和高频交流电场使细胞壁破裂,释放内容物。相较于前两者其提取效率高,操作简单,能耗低,耗时短。还有一些物理方法的组合,如高压脉冲电场和超声波微波结合提取法等,这类方法对仪器和成本的要求较高[16-21]。然而,目前对热水浸提法和超声波辅助提取法进行比较的报道较少,本研究旨在探讨这两种方法对桦褐孔菌多糖提取率和活性的影响,为桦褐孔菌多糖的开发利用提供了参考。
随着多糖在生物活性方面的重要作用逐渐被揭示,开发多糖的检测方法成为新的研究方向。近30年来,DNS法、蒽酮-硫酸法一直是多糖的主要检测方法,然而该方法存在检测灵敏度低、结果易受蛋白质干扰、操作步骤繁琐等问题。因此,人们更倾向于发展新型的多糖检测方法。近10年来,研究者开发了苯酚-硫酸法,其原理是利用多糖经浓硫酸水解后生成的单糖与苯酚反应产生有色化合物,其颜色深度与多糖含量呈正比。该方法具有操作简单、反应快速、灵敏度高等特点,已被广泛应用于多糖的检测中。
本研究采用热水浸提法和超声波辅助法提取桦褐孔菌多糖,利用苯酚-硫酸法对提取的多糖进行检测,并进行比较。通过单因素试验,选取各方法的3个影响因素和水平,建立响应面模型优化提取条件。然后用Sevage法去除蛋白质,用G-100柱层析法纯化多糖,得到单一分子量的多糖樣品。最后测定样品的体外抗氧化活性,为工业化生产提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
桦褐孔菌菌种:由大连工业大学生物工程学院提供。
1.1.2 仪器
超声波破碎机、pH计、96孔板、酶标仪。
1.1.3 药品
PDA培养基粉、MgSO4·7H2O、DPPH-乙醇试剂(15 mg/500 mL)、FeSO4·7H2O、水杨酸、30%过氧化氢等:均为分析纯。
1.2 试验方法
1.2.1 桦褐孔菌菌丝体富集
液体培养基:PDA培养基粉26 g/L,KH2PO4 3.0 g,MgSO4·7H2O 1.5 g。
液体扩大培养条件:在真菌超净台中,用牙签将马铃薯浸渍在培养基中,将含有菌丝体部分切块(0.5 cm×0.5 cm×0.5 cm),并集中于装有100 mL马铃薯浸渍液培养基的锥形瓶中,将锥形瓶置于26 ℃恒温振荡培养箱中培养10 d,过滤菌丝体并用蒸馏水反复清洗得到桦褐孔菌菌丝体。
菌丝体收集:用蒸馏水将菌丝体清洗后,用纯净水洗净,分装并于65 ℃干燥备用,称重,分装至离心管中,并依据具体试验条件加入一定体积纯净水。
1.2.2 桦褐孔菌胞内多糖制备
经过以下步骤:清洗并在恒温65 ℃条件下烘干菌丝体→加入定量体积的超纯水(按试验所需料液比)→超声波辅助提取→5 000 r/min离心→保留上清液→95%乙醇沉淀→5 000 r/min离心→无水乙醇洗涤→65 ℃烘箱干燥→复溶→离心→65 ℃烘箱干燥,最终得到桦褐孔菌胞内多糖。
精密称取桦褐孔菌菌丝体样品1 g,并加入定量纯水,根据单因素试验条件需求设定超声功率和时间,超声波协同提取。将提取混合液静置1 h,以转速5 000 r/min离心15 min,取上清液,将上清液蒸发浓缩至10 mL,加入无水乙醇溶液40 mL,形成95%浓度的乙醇沉淀体系,于4 ℃下静置过夜,以转速5 000 r/min 离心15 min,保留沉淀,用无水乙醇洗涤3次并烘干。最终将沉淀全部溶解离心,保留上清液,65 ℃恒温烘干,即为桦褐孔菌粗多糖。
1.2.3 多糖测定
苯酚-硫酸法标准曲线的制作:准确称取无水葡萄糖标准品1.00 g,用超纯水定容至100 mL容量瓶中,再取1 mL,再次定容至100 mL,配成 0.1 mg/mL的葡萄糖标准液。精密移取0,2.00,4.00,6.00,8.00,10.00,12.00,14.00,16.00,18.00,20.00 μL葡萄糖标准液于反应管(离心管)中,每管各加25 μL 6%苯酚溶液,再加入超纯水,使葡萄糖标准溶液与超纯水体积总和为50 μL。振荡均匀,最终加入浓硫酸125 μL,振荡5 min摇匀,静置反应30 min。以试剂空白作为空白对照体系,用酶标仪于波长485 nm 处测定96孔板中反应体系的吸光度,横、纵坐标分别为吸光值和多糖浓度,绘制成葡萄糖标准曲线。
测定桦褐孔菌胞内多糖:将提取后的多糖溶于一定量蒸馏水中,每个样品取出10 μL并加入蒸馏水配成50 μL体系,采用上述测定方法制成200 μL反应液体系加至96孔板。
通过下式得出多糖得率:
Y=C×Vm。
式中:Y为多糖得率,mg/g;C为样品所含多糖浓度,mg/mL;V为样品的体积,mL;m为经过烘干处理的桦褐孔菌菌丝体质量,g。
1.2.4 超声波辅助提取单因素试验
1.2.4.1 超声功率对桦褐孔菌胞内多糖提取率的影响
按每份1 g称取桦褐孔菌菌丝体5份,分别放入离心管中,固定超声时间为20 min、料液比为1∶20,测定不同超声功率 450,500,550,600 W条件下桦褐孔菌胞内多糖得率,每个条件做3次重复试验以平衡误差。
1.2.4.2 超声时间对桦褐孔菌菌丝体多糖得率的影响
同上取5份菌丝体,分别放入离心管中并编号,固定超声功率为500 W、料液比为1∶20,测定不同超声时间 10,15,20,25,30 min条件下桦褐孔菌胞内多糖得率,每个条件做3次重复试验以平衡误差。
1.2.4.3 料液比对桦褐孔菌菌丝体多糖得率的影响
同上取5份菌丝体,分别放入50 mL离心管中并编号,固定超声功率为500 W、超声时间为20 min,测定不同料液比1∶10、1∶15、1∶20、1∶25、1∶30条件下桦褐孔菌胞内多糖得率,每个条件做3次重复试验以平衡误差。
1.2.5 提取参数三因素三水平响应面设计
在最高提取率对应的自变量周围各选取两个自变量参数作为三因素范围。以桦褐孔菌胞内多糖的得率为响应值(Y),以影响因素超声功率、料液比、超声时间为自变量,采用Box-Behnken设计桦褐孔菌胞内多糖的提取工艺优化试验,试验因素水平表见表1。
1.2.6 热水浸提法提取单因素试验
1.2.6.1 提取温度对桦褐孔菌胞内多糖提取率的影响
按每份1 g称取桦褐孔菌菌丝体5份,分别放入离心管中,固定提取时间为3.0 h、料液比为1∶30,测定不同提取温度 70,75,80,85,90 ℃条件下桦褐孔菌胞内多糖得率,每个条件做3次重复试验以平衡误差。
1.2.6.2 提取时间对桦褐孔菌菌丝体多糖得率的影响
同上取5份菌丝体,分别放入离心管中并编号,固定料液比为1∶30、提取温度为80 ℃,测定不同提取时间2.0,2.5,3.0,3.5,4.0 h条件下桦褐孔菌胞内多糖提取率,每个条件做3次重复试验以平衡误差。
1.2.6.3 料液比对桦褐孔菌菌丝体多糖得率的影响
同上取5份菌丝体,分别放入50 mL离心管中并编号,固定提取温度为80 ℃、提取时间为3.0 h,测定不同料液比1∶20、1∶25、1∶30、1∶35、1∶40条件下桦褐孔菌胞内多糖提取率,每个条件做3次重复试验以平衡误差。
1.2.7 提取参数三因素三水平响应面设计
在最高提取率对应的自变量周围各选取两个自变量参数作为三因素范围。以桦褐孔菌胞内多糖的得率为响应值(Y),以影响因素提取温度、提取时间、料液比为自变量,采用Box-Behnken设计桦褐孔菌胞内多糖的提取工艺优化试验,试验因素水平表见表2。
1.3 数据处理分析
使用Excel 2020对单因素试验数据进行总结整理,使用Design Expert 13.0软件中的Box-Behnken设计对试验结果进行分析并以响应面图为结果显示,使用Origin 8.0绘制折线图。
1.4 桦褐孔菌胞内多糖体外抗氧化活性测定
测定抗氧化活性,需要將所提取的多糖进行复融,利用Sevage方法,按照氯仿与正丁醇的比例为5∶1及混合液与多糖溶液的比例为1∶5进行混合,振荡摇匀20 min,离心取上清液进行蛋白脱除,脱除次数为3次。
1.4.1 胞内多糖体外清除DPPH自由基
DPPH-乙醇溶液是一种深紫色的工作液,用于测定抗氧化活性时在517 nm波长处有最大吸收峰。参考罗游[22]的方法,将15 mg/500 mL DPPH-乙醇溶液用甲醇配制成0.06 mmol/L DPPH溶液,将乙醇沉淀与65 ℃烘干的桦褐孔菌胞内多糖配制成10 mg/mL的水溶液并配制梯度浓度。多糖溶液与DPPH测定液按1∶2混合、摇匀,并在室温下暗室反应30 min后用酶标仪测定吸光值,以抗坏血酸作为抗氧化活性对照,不添加多糖溶液的DPPH-乙醇工作液作为阳性对照,以甲醇作为空白对照,每组测试取3组平行试验的平均值。
1.4.2 胞内多糖体外清除羟基自由基(·OH)
过氧化氢与二价铁离子反应生成羟基自由基,该自由基与水杨酸反应生成2,3-二羟基苯甲酸,该物质在510 nm处有最大吸收峰,可用来测定抗氧化活性[23]。多糖溶液浓度同上,设置梯度浓度,FeSO4、水杨酸、过氧化氢以及样品溶液以1∶1∶1∶1进行添加,FeSO4及水杨酸浓度均为6 mmol/L,过氧化氢配制成浓度为0.3%。以抗坏血酸作为抗氧化活性对照,以不添加过氧化氢的去离子水作为空白对照,不添加样品并以等体积去离子水替代样品作为阳性对照,每组测试取3组平行试验的平均值。
2 结果分析
2.1 多糖标准曲线绘制
多糖的标准曲线见图1,以吸光值为横坐标(x),葡萄糖浓度(mg/mL)为纵坐标(y),拟合得到标准曲线的回归方程:y=0.130 98x-0.013 06(R2=0.987 7),其线性关系良好,可以进行后续多糖的测定。
2.2 超声波辅助提取单因素试验分析
2.2.1 超声功率对胞内多糖提取的影响
超声功率对多糖得率的影响见图2。
由图2可知,超声功率对胞内多糖得率有显著影响。当超声功率在450~500 W之间时,多糖得率明显提升;当超声功率在500~600 W之间时,多糖得率大幅降低。当超声功率为500 W时,多糖得率达到最大值,为(45.3±3.0) mg/g。推测原因是超声功率在550~600 W时,功率过高,导致桦褐孔菌多糖受到强烈的空化效应,发生断裂或部分降解,得率下降[24]。因此,在后续的响应面试验中,选择450,500,550 W作为胞内多糖提取的3个水平。
2.2.2 超声时间对胞内多糖提取的影响
超声时间对多糖得率的影响见图3。
由图3可知,当超声时间从10 min增加到20 min时,多糖得率随之上升,这是因为超声波通过水的空化效应能够有效地破坏细胞膜和细胞壁,释放出细胞内容物。在20 min时,多糖得率达到最大值,为(44.5±1.5) mg/g。然而,当超声时间继续增加到30 min时,多糖得率反而降低,可能是超声时间过长导致多糖降解、稳定性下降[25]。
2.2.3 料液比对胞内多糖提取的影响
料液比对多糖得率的影响见图4。
由图4可知,当料液比从1∶10增加到1∶20时,多糖得率逐渐上升,达到最大值(43.9±3.0) mg/g。这是因为料液比增大有利于超声波在水中产生空化效应,增强了水分子对细胞膜和细胞壁的碰撞作用,促进了多糖的释放。然而,当料液比继续增大时,多糖得率反而降低,可能是由于超声波在水中的空化效应变弱,细胞破碎程度降低,导致多糖的释放减少。因此,确定料液比1∶20为最佳工艺参数,并选择1∶15、1∶20、1∶25作为响应面设计的3个水平。
2.3 Box-Behnken结果分析
2.3.1 Box-Behnken结果
基准条件:料液比为1∶20,超声时间为20 min,超声功率为500 W,以超声功率(A)、料液比(B)、超声时间(C)为自变量,采用 Box-Behnken 进行试验设计,见表3。
2.3.2 回归模型分析
注: “***”表示差异极显著(P<0.001),“**”表示差异较显著(P<0.01),“*”表示差异显著(P<0.05),表6同。
由表4可知,该回归模型极显著,具有统计学意义。该模型的R2=0.980 9,表明该模型是可信的。A、C、A2、B2、C2是重要的模型项,表明超声功率、超声时间及料液比对多糖的得率具有重要影响。RAdj2为0.956 2,表明数据模型与实际情况吻合度较高,该模型可以解释95.62%响应值的变化[26];模型的信噪比S/N为16.885 5(>4),说明信号充足,该模型用于分析提取工艺的参数是可信的;纯误差的P=0.461 4,远大于0.05,因此外界对该模型造成的误差很小,对模型的影响可以忽略 [27]。该模型通过拟合得到二次多项式回归方程:Y=43.24+2.09A-0.776 3B-2.25C-1.25AB-0.542 5AC+0.615 8BC-7.34A2-4.54B2-3.80C2,各因素与响应值之间是非线性关系。各因素存在交互关系,各因素影响顺序为超声时间>超声功率>料液比。
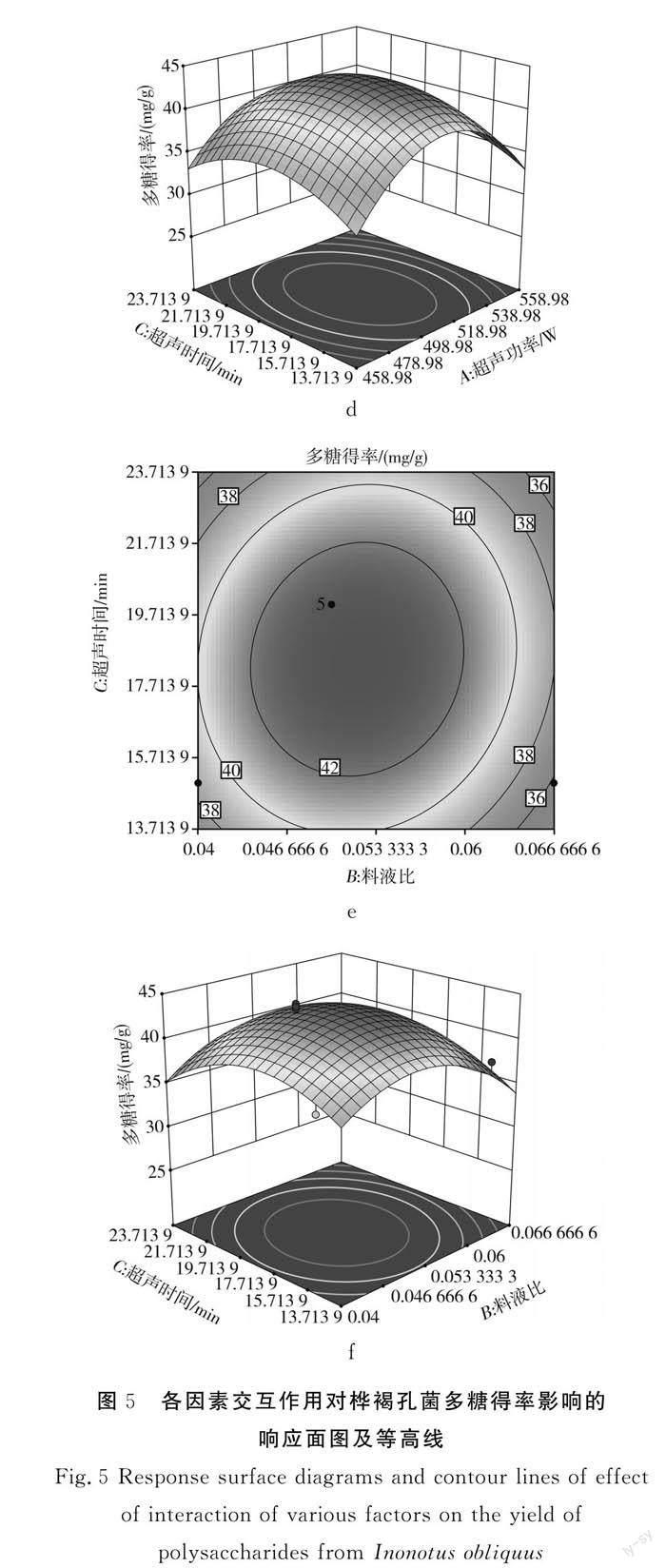
2.3.3 交互作用等高线图及三维响应面图
由图5可知,3个因素的交互作用均比较显著[22]。由图 5中a~b可知,当超声时间为20 min时,超声功率与料液比的交互作用对多糖得率的影响显著,其中超声功率的影响更显著;由图5中c~d可知,当料液比为1∶20时,多糖得率受超声功率及超声时间的交互作用影响显著,通过椭圆形等高线可看出超聲功率比超声时间的影响显著;由图5中e~f可知,当超声功率为500 W时,料液比与超声时间的交互作用对多糖得率的影响显著,其中料液比对多糖得率的影响更显著。
2.4 热水浸提单因素试验分析
2.4.1 提取温度对胞内多糖提取的影响
由图6可知,提取温度对胞内多糖得率有显著影响。当提取温度在70~80 ℃之间时,多糖得率明显提升,这是因为高温有利于水溶性多糖从细胞膜进入提取液的传质过程。当提取温度为80 ℃时,多糖得率达到最大值,为(36.6±1.6) mg/g。然而,当提取温度在80~90 ℃之间时,多糖得率大幅降低,可能是过高的温度导致多糖降解和稳定性下降。因此,在后续的响应面试验中,选择75,80,85 ℃作为提取温度的3个水平,其中以80 ℃作为中心点。
2.4.2 提取时间对胞内多糖提取的影响
由图7可知,当提取时间从2.0 h增加到3.0 h时,多糖得率随之增加,这是因为细胞内容物的扩散效率增高,细胞膜和细胞壁被充分破碎和释放。在3.0 h时,多糖提取率达到最大值,为(37.3±1.9) mg/g。然而,当提取时间继续增加到4.0 h时,多糖提取率反而降低,可能是过长的时间导致多糖的分子结构发生改变或降解。
2.4.3 料液比对胞内多糖提取的影响
由图8可知,多糖得率在料液比从1∶10增加到1∶30的过程中逐渐增加,在1∶30时达到最大值(35.2±0.9) mg/g。这是因为多糖在料液比增大时更容易从细胞扩散到提取液中。然而,当料液比继续增大时,多糖得率反而降低,可能是由于料液比过大,多糖在胞内逐步扩散的过程中浓度差下降过快,导致扩散率大幅度降低,多糖得率下降。因此,选择1∶20、1∶30、1∶40作为后续响应面试验中料液比的3个水平,其中1∶30为最佳工艺参数。
2.5 Box-Behnken结果分析
2.5.1 Box-Behnken结果
基准条件:料液比为1∶30,提取时间为3.0 h,提取温度为80 ℃,以提取温度(D)、提取时间(E)、料液比(F)为自变量,采用Box-Behnken进行试验设计,见表5。
2.5.2 回归模型分析
由表6可知,该回归模型极显著,具有统计学意义。该模型的R2=0.984 6,表明该模型是可信的。在此情况下,D、F、D2、E2、F2是重要的模型项,表明提取温度、提取时间及料液比对多糖得率具有重要影响。RAdj2为0.964 9,表明数据模型与实际情况吻合度较高,该模型可以用来解释96.49%响应值的变化[27];模型的信噪比S/N为17.328 1(>4),说明信号充足,该模型用于分析提取工艺的参数是可信的;纯误差的P=0.566 9,远大于0.05,因此外界对该模型造成的误差很小,对模型的影响可以忽略。该模型通过拟合得到二次多项式回归方程:Y=37.86+1.87D+1.03E+1.70F+1.06DE+0.542 5DF+1.85EF-6.70D2-5.06E2-4.15F2。各因素与响应值之间是非线性关系。各因素存在交互关系,各因素影响顺序为提取温度>料液比>提取时间。
2.5.3 交互作用等高线图及三维响应面图
由图9可知,3个因素的交互作用均比较显著。由图9中a~b可知,当料液比为1∶30时,提取温度与提取时间的交互作用对多糖得率的影响显著,其中提取温度的影响更显著;由图9中c~d可知,当提取时间为3.0 h时,提取温度与料液比的交互作用对多糖得率的影响显著,通过椭圆形等高线可看出提取温度的影响更显著;由图9中e~f可知,当提取温度为80 ℃时,料液比和提取时间的交互作用對多糖得率的影响显著,其中提取时间对多糖得率的影响更显著。
2.6 验证试验
根据实际情况调整最佳提取工艺。超声波辅助提取模型预测结果为超声功率508.25 W、料液比1∶19.38、超声时间18.40 min, 多糖得率最佳值为43.81 mg/g。实际操作时调整为超声功率500 W、料液比1∶19、超声时间19 min,在此条件下进行3次重复性验证试验,得到多糖得率3次试验的平均值为42.98 mg/g,与预测值基本一致;热水浸提法模型预测结果为提取温度80.81 ℃、提取时间3.08 h、料液比1∶24.63,多糖得率最佳值为38.31 mg/g。实际操作时调整为提取温度81 ℃、提取时间3.1 h、料液比1∶25,在此条件下进行3次重复性验证试验,得到多糖得率3次试验的平均值为38.56 mg/g,与预测值基本一致。
2.7 多糖体外抗氧化活性结果(DPPH自由基)
多糖浓度对桦褐孔菌胞内多糖清除DPPH自由基能力的影响见图10。
由图10可知,多糖浓度越高,DPPH自由基清除率越高,表明清除能力与剂量呈正相关。在本试验中,多糖最大浓度为2.0 mg/mL,此时DPPH自由基清除率为58.6%,虽然低于同等浓度的抗坏血酸(VC),但也表明桦褐孔菌胞内多糖具有一定的抗氧化活性。经过计算,VC和多糖的IC50值分别为0.149 99,1.701 4 mg/mL。
2.8 多糖体外抗氧化活性结果(羟基自由基)
多糖浓度对桦褐孔菌胞内多糖清除羟基自由基能力的影响见图11。
羟基自由基(·OH)是一种非常活泼的自由基,具有强氧化能力,可以氧化所有有机物。由图11可知,VC和桦褐孔菌多糖都能清除羟基自由基,且清除能力随着多糖浓度的增加而增加,表明清除能力与剂量呈正相关。在本试验中,多糖最大浓度为2.0 mg/mL时,VC和桦褐孔菌多糖的羟基自由基清除率分别为95.6%和51.36%。VC的清除率明显高于桦褐孔菌多糖,但桦褐孔菌多糖也表现出一定的抗氧化活性。经过计算,VC和桦褐孔菌多糖的IC50值分别为0.195 94,1.98 mg/mL。
3 结论
本文采用超声波提取法和热水浸提法,对桦褐孔菌胞内多糖的提取方法进行了优化和比较,并评价了其体外抗氧化活性,主要结论如下:
超声波辅助提取法的最佳条件为超声功率508.25 W、超声时间18.40 min、料液比1∶19.38,在此条件下多糖得率为43.81 mg/g;热水浸提法的最佳条件为提取温度 80.81 ℃、提取时间3.08 h、料液比1∶24.63,在此条件下多糖得率为38.31 mg/g。两种方法相比,超声波辅助提取法具有更高的多糖得率和更短的提取时间。
超声波辅助提取的桦褐孔菌胞内多糖具有一定的体外抗氧化活性,但与胞外多糖和子实体多糖相比,其活性较低。这可能与提取工艺对多糖结构及抗氧化活性相关官能团的影响或与桦褐孔菌胞内多糖本身抗氧化活性偏低有关。
本文提供了桦褐孔菌多糖作为食品调味成分的基础数据,这些研究将有助于提升工业化生产桦褐孔菌多糖产量以及开发出具有更好风味、更高营养和健康价值的桦褐孔菌多糖调味剂。
参考文献:
[1]刘雨婷.液体培养条件对桦褐孔菌产活性多糖的影响研究[D].长春:东北师范大学,2021.
[2]段胜利,窦彦丽.桦褐孔菌多糖复合运动饮品的制备及抗氧化活性研究[J].中国食品添加剂,2023,34(2):219-226.
[3]李亚楠,朱蕴兰,陈宏伟,等.桦褐孔菌复合饮料配方优化及抗氧化能力评价[J].农业工程,2022,12(9):78-84.
[4]杨晨芝,郝静,丁霄,等.桦褐孔菌多糖对乳酸菌发酵及酸奶品质的影响[J].中国乳品工业,2020,48(11):22-25.
[5]王维静,朱红薇,田建霞,等.桦褐孔菌液体发酵研究进展[J].智慧农业导刊,2022,2(14):28-30.
[6]敖珍,覃发玠,罗迎春,等.红托竹荪菌托多糖中试提取工艺及抗氧化能力[J].中国调味品,2022,47(10):179-183.
[7]陈悦柏.香菇多糖提取工艺的筛选及保健功效的研究现状分析[J].中国调味品,2021,46(8):189-191.
[8]XUE D N, FARID M M. Pulsed electric field extraction of valuable compounds from white button mushroom (Agaricus bisporus)[J].Innovative Food Science and Emerging Technologies,2015,29:178-186.
[9]ZHAO H J, LAI Q Q, ZHANG J J, et al. Antioxidant and hypoglycemic effects of acidic-extractable polysaccharides from Cordyceps militaris on type 2 diabetes mice[J].Oxidative Medicine and Cellular Longevity,2018,2018:1-15.
[10]KHATUA S, ACHARYA K. Antioxidation and immune-stimulatory actions of cold alkali extracted polysaccharide fraction from Macrocybe lobayensis, a wild edible mushroom[J].3 Biotech,2022,12(10):247.
[11]陈灼娟,周倩,杨志强.黑皮鸡枞菌多糖提取工艺及抗氧化活性研究[J].中国调味品,2023,48(3):199-203,215.
[12]何皎,孙晓菲,潘琳,等.微波提取香菇多糖制备微胶囊的抑菌抗氧化活性研究[J].中国调味品,2023,48(2):71-75.
[13]任昌娟,朱云龙.生姜多糖提取技术工艺优化及效益分析[J].中国调味品,2021,46(9):117-120.
[14]LI Y, ZHU C P, ZHAI X C, et al. Optimization of enzyme assisted extraction of polysaccharides from pomegranate peel by response surface methodology and their antioxidant potential[J].Chinese Herbal Medicines,2018,10(4):416-423.
[15]KHASKHELI A A, KHASKHELI S G, LIU Y, et al. Optimization of enzyme assisted extraction of polysaccharides from Poria cocos[J].Journal of Medicinal Plants Research,2017,11(17):331-337.
[16]袁巍,潘宗琴,潘攀,等.真菌菌絲多糖的提取研究进展[J].安徽师范大学学报(自然科学版),2008,31(6):576-579.
[17]陈凌华,程祖锌,杨志坚,等.灵芝多糖热水提取条件的优化试验[J].浙江食用菌,2009,17(4):21-23.
[18]CHEN X Y, WANG W X, LI X B, et al. Optimization of ultrasound-assisted extraction of Lingzhi polysaccharides using response surface methodology and its inhibitory effect on cervical cancer cells[J].Carbohydrate Polymers,2010,80(3):944-948.
[19]阿燕.真菌胞内多糖提取方法的研究进展[J].微生物学杂志,2011,31(5):82-86.
[20]肖慧.双孢菇多糖提取和分离纯化的研究[D].济南:山东轻工业学院,2012.
[21]刘超.液体深层发酵羊肚菌胞内多糖提取、结构分析及抗结肠癌作用研究[D].长春:吉林大学,2017.
[22]罗游.番石榴叶多糖活性分析及分离鉴定与发酵提升[D].广州:华南理工大学,2020.
[23]李伟.肉色香蘑液体发酵及多糖提取、纯化与抗氧化活性研究[D].沈阳:沈阳农业大学,2018.
[24]胡涛,解洛香,徐乐,等.超声波辅助提取桦褐孔菌子实体中多糖和三萜[J].食品科技,2012,37(2):213-217.
[25]郭佳.超声波辅助提取对枸杞细胞壁多糖解聚规律的研究[D].银川:宁夏大学,2022.
[26]卫萍,游向荣,张雅媛.响应面法优化火麻蛋白提取工艺研究[J].中国油脂,2016,41(5):24-29.
[27]檀琪,阮文辉,杨官娥,等.响应面法优化桦褐孔菌总三萜回流提取工艺[J].山西医科大学学报,2020,51(1):99-104.
收稿日期:2023-06-22
基金项目:国家自然科学基金项目(4217711,31670604)
作者简介:金东箭(1997-),男,硕士研究生,研究方向:微生物学活性物质。
*通信作者:金朝霞(1972-),女,教授,博士,研究方向:微生物资源与生物催化、生物活性物质资源挖掘与利用。
