基于MAPK/NF-κB 通路探究藏红花素对幼年小鼠肺炎模型的治疗作用及分子机制*
2023-12-25董丽君周波杨翠玲李志远张永峰
董丽君,周波,杨翠玲,李志远,张永峰
(1.潍坊医学院临床医学院,潍坊 261053;2.安丘市人民医院影像科,安丘 262199;3.安丘市人民医院儿科,安丘 262199;4.山东中医药大学中医学院,济南 250355;5.潍坊医学院附属医院儿科,潍坊 261035)
肺炎是一种常见的下呼吸道疾病,主要由病毒感染、细菌或真菌病原体引起,在世界范围内具有较高的发病率和病死率[1]。肺炎广泛发病于儿童中,主要是由于儿童免疫力低下和呼吸道解剖结构的缺陷,其高发病率和复发率可引起各种严重并发症和预后不良,严重影响儿童发育和生命健康[2]。因此,确定儿童肺炎的潜在发病机制,开发新的治疗策略来抑制肺炎的进展非常重要。革兰氏阴性菌中的脂多糖(LPS)是一种有效的炎症内毒素,可导致各种器官如肺部炎症性疾病的发生,LPS 通过激活丝裂原活化蛋白激酶(MAPK)/核因子-κB(NF-κB)通路来促进和扩增炎症介质的表达,而过度的炎症浸润导致肺炎进一步加重[3]。研究发现,通过下调NF-κB/MAPK 通路可减弱急性肺炎体外模型的炎症反应[4]。藏红花素(CRO)具有抗氧化、抗炎、抗肿瘤、抗细胞凋亡和心脏保护等多种生物活性,CRO对肺纤维化大鼠模型中的肺部炎症和肺血管功能障碍有减轻作用[5]。CRO 还能通过抑制p38 MAPK/NF-κB 信号通路发挥对脓毒症诱导的肝、肾和肺损伤的保护作用[6]。而CRO 能否通过调节MAPK/NFκB 信号通路发挥幼年肺炎小鼠的保护作用,尚不清楚。本研究通过构建幼年小鼠肺炎模型,探究CRO的治疗作用及其分子机制。
1 材料与方法
1.1 实验材料 SPF 级C57BL/6 小鼠80 只,购自武汉贝赛模式生物科技有限公司,生产许可证号:SCXK(鄂)2022-0029,3~4 周龄,适应性喂养1 周,饲养环境温度 22 ℃左右,湿度 55%,12 h 光暗循环,不禁水食。本研究通过动物伦理委员会批准。
1.2 主要试剂与仪器 CRO(纯度≥98%)、白细胞介素(IL)-1β 酶联免疫吸附(ELISA)试剂盒(上海源叶生物科技有限公司);LPS、髓过氧化物酶(MPO)(北京索莱宝公司);地塞米松(DEX,福州海王福药制药有限公司);MAPK 激活剂(Anisomycin,美国MedChemExpress 公司);ELISA 试剂盒:肿瘤坏死因子-α(TNF-α)、IL-6(上海酶联生物公司);苏木精-伊红(HE)染色试剂盒(上海翌圣生物公司);丙二醛(MDA)、超氧化物歧化酶(SOD)、吉姆萨染色试剂盒(北京百奥莱博科技有限公司);二抗辣根酶标记山羊抗兔(美国Abcam 公司);一抗p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、p-IκBα、核因子κB 抑制蛋白α(IκBα)和β-actin 抗体(赛默飞世尔科技公司)。全自动酶标仪(奥地利TECAN 公司);显微镜(日本尼康公司)。
1.3 实验方法
1.3.1 小鼠分组、建模和药物干预 将小鼠随机分为对照组、模型组、DEX(阳性对照)组、CRO 低剂量组、CRO 中剂量组、CRO 高剂量组、Anisomycin 组(CRO 高剂量+MAPK 激活剂Anisomycin),每组10 只。其中 DEX 组小鼠以2 mg/kg 灌胃[7],CRO 低、中、高剂量组分别以25、50、100 mg/kg 灌胃[8]、Anisomycin组在CRO 100 mg/kg 基础上加Anisomycin 2 mg/kg灌胃[9],对照组和模型组灌胃相同剂量生理盐水,每天1 次,连续给药1 周。除对照组外,其余小鼠最后1 次药物干预1 h 后,参照文献[10]采用腹腔注射LPS(5 mg/kg)构建肺炎模型,对照组注射相同剂量生理盐水。24 h 后小鼠出现呼吸频率增快、精神萎靡、活动减少等症状表明模型构建成功,对造模不成功或出现死亡的各组小鼠共10 只及时补充。
1.3.2 样本采集 各组小鼠造模72 h 后,眼球取血,离心取上清液-80 ℃保存;麻醉处死小鼠,取5 只小鼠手术暴露气管并插管,用磷酸缓冲盐溶液冲洗3 次,获得肺泡灌洗液(BALF),离心取上清液-80 ℃保存;剩余5 只小鼠分离肺组织,取小鼠左肺测量湿/干(W/D)比,右肺上叶进行HE 染色,其余肺组织-80 ℃保存进行蛋白免疫印迹(Western Blot)检测。
1.3.3 肺W/D 比 取小鼠左肺,擦净肺组织表面液体后称质量以获得湿质量,后将肺组织置于80 ℃的烘箱中 48 h 至质量稳定,再次称取获得干质量,W/D比由湿质量与干质量之比计算。
1.3.4 HE 染色观察肺部组织病理变化及病理损伤评分 取小鼠右上叶肺生理盐水洗净,4%多聚甲醛固定、石蜡包埋,制备肺切片(4 μm),脱蜡后HE染色,脱水封片在电子显微镜下观察肺部组织病理学变化并拍照。并进行肺组织病理损伤评分,根据以下参数进行评分:1)有无出血。2)水肿程度。3)肺泡充血,中性粒细胞在空隙空间或血管壁聚集。4)肺泡壁厚度/透明膜形成。分别记为0~4 分,分数越高损伤程度越重。
1.3.5 MPO 活性检测 取-80 ℃肺组织并准确称质量,并将组织在反应缓冲液中均质化(质量/体积比=1∶19),然后按照MPO 试剂盒说明检测肺组织的MPO 活性,测定450 nm 处吸光度变化。
1.3.6 BALF 中细胞计数 取-80 ℃保存的BALF,采用血细胞计数器和吉姆萨染色进行计数总细胞、中性粒细胞和白细胞。
1.3.7 血清和BALF 中炎症因子 取-80 ℃保存的血清和BALF,按照ELISA 试剂盒说明书,检测炎性因子IL-6、IL-1β 和TNF-α 的水平。
1.3.8 血清和BALF 中 MDA、SOD 水平 取-80 ℃保存的血清和BALF,按照试剂盒说明书,检测炎性因子MDA、SOD 的水平。
1.3.9 Western Blot 检测蛋白表达 取-80 ℃保存幼年小鼠肺组织,用RIPA 裂解,提取总蛋白,用BCA试剂盒进行浓度定量,按步骤将蛋白SDS-PAGE 电泳、转膜,5%脱脂奶粉封闭2 h,在4 ℃下加入一抗p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、p-IκBα、IκBα(1∶1 000)和β-actin(1∶2 000)过夜孵育,清洗,在4 ℃下加入二抗山羊抗兔IgG(1∶2 000),孵育2 h。用ECL 发光显影,观察拍照,各条带灰度值用Image J 软件处理分析。
1.4 统计学处理 数据采用SPSS 22.0 软件进行统计分析,计量资料统计描述用均数±标准差(±s)表示,多组间比较用单因素方差分析,组间两两比较采用SNK-q 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠W/D 比和MPO 活性变化 与对照组比较,模型组小鼠肺W/D 比、MPO 活性显著升高(P<0.05);与模型组比较,DEX 组和CRO 低、中、高剂量组肺W/D 比、MPO 活性显著下降(P<0.05),DEX 组与CRO 高剂量组间差异无统计学意义(P>0.05);与CRO 高剂量组比较,Anisomycin 组肺W/D比、MPO 活性显著升高(P<0.05)。见表1。
表1 各组小鼠肺W/D 比和MPO 活性比较(±s)Tab.1 Comparison of lung W/D ratio and MPO activity in each group(±s)

表1 各组小鼠肺W/D 比和MPO 活性比较(±s)Tab.1 Comparison of lung W/D ratio and MPO activity in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与CRO 高剂量组比较,△P<0.05。
?组别动物数肺W/D 比MPO(U/g)对照组52.58±0.261.28±0.15模型组55.71±0.82*5.82±0.91*DEX 组52.65±0.31#1.42±0.20#CRO 低剂量组54.26±0.57#4.31±0.36#CRO 中剂量组53.14±0.46#3.06±0.42#CRO 高剂量组52.68±0.35#1.40±0.21#Anisomycin 组55.02±0.71△5.68±0.73△
2.2 各组小鼠肺组织病理学变化及病理损伤评分 对照组小鼠肺结构完整,无炎症、水肿、出血,未见炎性细胞浸润;模型组小鼠出现肺组织损伤,肺泡壁有增厚融合,水肿破裂的肺泡充满红血球,肺间质有炎性细胞浸润,病理损伤评分显著升高(P<0.05);DEX 组和CRO 低、中、高剂量组小鼠肺组织病理损伤减轻,少量炎性细胞浸润,DEX 组与CRO 高剂量组改善效果相似,病理损伤评分显著下降(P<0.05);Anisomycin 组相比于CRO 高剂量组,肺部病理损伤加重,病理损伤评分显著升高(P<0.05)。见图1 和表2。

图1 各组幼年小鼠肺组织HE 染色图(×200)Fig.1 HE staining of lung tissue in young mice of each group(×200)
表2 各组小鼠肺组织损伤病理评分(±s)Tab.2 Pathological score of lung tissue injury in mice of each group(±s)

表2 各组小鼠肺组织损伤病理评分(±s)Tab.2 Pathological score of lung tissue injury in mice of each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与CRO 高剂量组比较,△P<0.05。
?
2.3 各组小鼠BALF 中细胞计数 与对照组比较,模型组小鼠总细胞、中性粒细胞和白细胞计数显著升高(P<0.05);与模型组比较,DEX 组和CRO 低、中、高剂量组总细胞、中性粒细胞和白细胞计数显著下降(P<0.05),DEX 组与CRO 高剂量组间差异无统计学意义(P>0.05);与CRO 高剂量组比较,Anisomycin 组总细胞、中性粒细胞和白细胞计数显著升高(P<0.05)。见表3。
表3 各组小鼠BALF 中细胞计数(±s)Tab.3 Cell count in BALF of mice in each group(±s)

表3 各组小鼠BALF 中细胞计数(±s)Tab.3 Cell count in BALF of mice in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与CRO 高剂量组比较,△P<0.05。
中性粒细胞(105/mL)对照组51.09±0.100.31±0.060.81±0.10模型组52.87±0.38* 1.04±0.11*1.69±0.21*DEX 组51.35±0.18#0.53±0.09#0.94±0.09#CRO 低剂量组51.91±0.22#0.86±0.10#1.14±0.13#CRO 中剂量组51.64±0.19#0.62±0.08#1.03±0.12#CRO 高剂量组51.26±0.15#0.51±0.07#0.89±0.08#Anisomycin 组52.36±0.27△ 0.91±0.10△ 1.34±0.15△组别动物数总细胞(105/mL)白细胞(105/mL)
2.4 各组小鼠血清和BALF 中炎症因子比较 与对照组比较,模型组小鼠血清和BALF 中 IL-6、IL-1β和TNF-α 水平显著升高(P<0.05);与模型组比较,DEX 组和CRO 低、中、高剂量组血清和BALF 中IL-6、IL-1β 和TNF-α 水平显著下降(P<0.05),DEX组与CRO 高剂量组间差异无统计学意义(P>0.05);与CRO 高剂量组比较,Anisomycin 组血清和BALF中 IL-6、IL-1β 和TNF-α 水平显著升高 (P<0.05)。见表4。
表4 各组小鼠血清和BALF 中炎症因子比较(±s)Tab.4 Comparison of inflammatory factors in serum and BALF of mice in each group(±s) pg/mL

表4 各组小鼠血清和BALF 中炎症因子比较(±s)Tab.4 Comparison of inflammatory factors in serum and BALF of mice in each group(±s) pg/mL
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与CRO 高剂量组比较,△P<0.05。
组别动物数血清BALF IL-6IL-1βTNF-αIL-6IL-1βTNF-α对照组519.42± 2.5119.73±2.4139.65±4.2721.25± 2.1423.18±3.0445.62± 5.09模型组581.57±10.16*63.82±7.35*87.30±9.31*98.41±10.61*78.36±8.53*117.39±12.03*DEX 组534.91± 3.17#26.19±3.62#43.17±4.57#43.28± 5.24#33.18±6.84#51.37± 5.46#CRO 低剂量组554.02± 6.83#42.58±5.23#63.57±6.39#74.38± 8.36#63.52±7.25#75.96± 8.03#CRO 中剂量组543.16± 5.60#38.06±4.75#55.28±5.42#51.52± 6.71#45.87±6.38#68.14± 7.52#CRO 高剂量组535.19± 3.81#27.05±3.16#42.05±5.14#40.81± 4.74#32.06±7.15#52.13± 5.24#Anisomycin 组565.10± 7.02△45.26±5.82△71.24±8.08△82.07±10.51△66.25±7.32△96.27±10.26△
2.5 各组小鼠血清和BALF 中 MDA、SOD 水平比较 与对照组比较,模型组小鼠血清和BALF 中 MDA水平显著升高,SOD 水平显著下降(P<0.05);与模型组比较,DEX 组和CRO 低、中、高剂量组血清和BALF中 MDA 水平显著下降,SOD 水平显著升高(P<0.05),DEX 组与CRO 高剂量组间差异无统计学意义(P>0.05);与CRO 高剂量组比较,Anisomycin 组血清和BALF 中 MDA 水平显著升高,SOD 水平显著下降(P<0.05)。见表5。
表5 各组小鼠血清和BALF 中MDA、SOD 比较(±s)Tab.5 Comparison of MDA and SOD in serum and BALF of mice in each group(±s)

表5 各组小鼠血清和BALF 中MDA、SOD 比较(±s)Tab.5 Comparison of MDA and SOD in serum and BALF of mice in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与CRO 高剂量组比较,△P<0.05。
SOD(U/mL)对照组513.52±2.47 53.29±6.01 18.43±2.71 59.23±5.31模型组561.38±6.84* 21.57±3.64* 63.18±6.49* 23.47±3.15*DEX 组526.38±3.71# 48.36±6.29# 25.17±3.08# 50.39±6.14#CRO 低剂量组549.06±4.91# 30.52±4.37# 46.39±5.17# 38.47±4.61#CRO 中剂量组538.25±3.92# 41.08±6.03# 36.59±4.27# 45.36±5.71#CRO 高剂量组527.58±3.06# 49.53±6.38# 24.68±3.25# 51.08±6.35#Anisomycin 组551.86±6.93△25.72±3.14△50.63±6.84△25.72±3.14△组别动物数血清BALF MDA(nmol/mL)SOD(U/mL)MDA(nmol/mL)
2.6 各组小鼠MAPK/NF-κB 通路蛋白表达比较 与对照组比较,模型组小鼠p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα 显著升高(P<0.05);与模型组比较,DEX 组和CRO 低、中、高剂量组p-p38 MAPK/p38 MAPK、p-NF-κB p65/NFκB p65、p-IκBα/IκBα 显著下降(P<0.05),DEX 组与CRO 高剂量组间差异无统计学意义(P>0.05);与CRO高剂量组比较,Anisomycin 组p-p38MAPK/p38MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα 显著升高(P<0.05)。见图2 和表6。
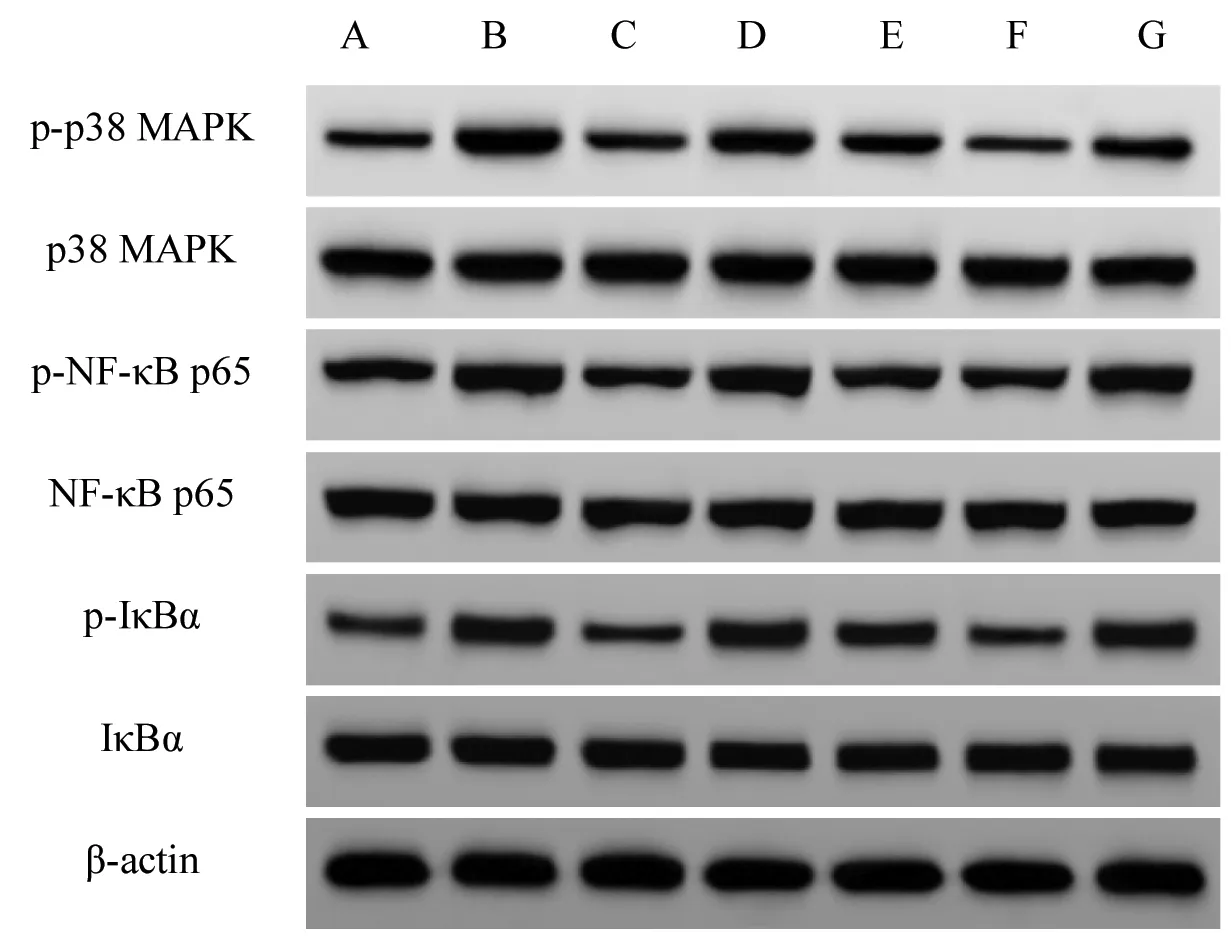
图2 各组小鼠肺组织蛋白表达结果Fig.2 Protein expression in lung tissue of mice in each group
表6 各组小鼠MAPK/NF-κB 通路蛋白表达比较(±s)Tab.6 Comparison of MAPK/NF-κB pathway protein expression of mice in each group(±s)
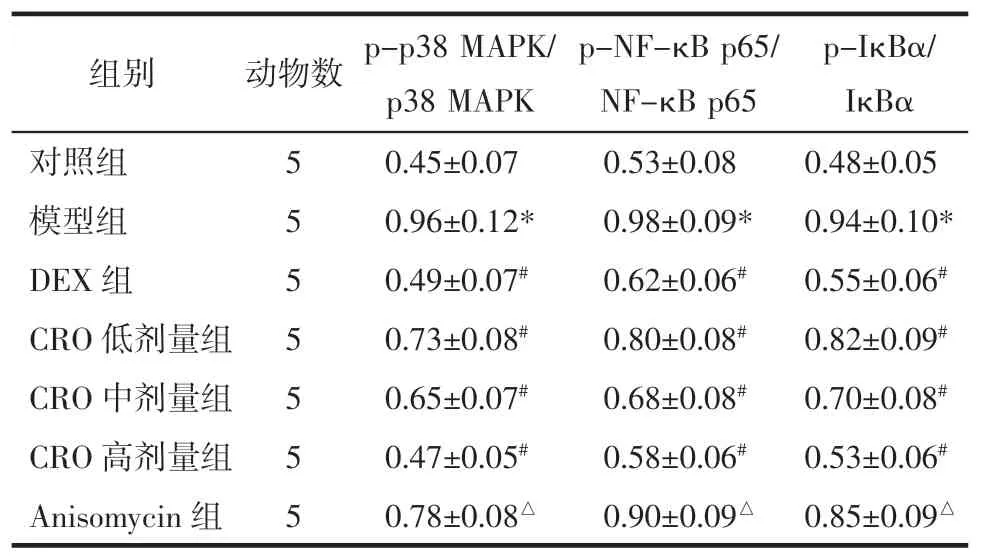
表6 各组小鼠MAPK/NF-κB 通路蛋白表达比较(±s)Tab.6 Comparison of MAPK/NF-κB pathway protein expression of mice in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与CRO 高剂量组比较,△P<0.05。
p-IκBα/IκBα对照组50.45±0.070.53±0.080.48±0.05模型组50.96±0.12*0.98±0.09*0.94±0.10*DEX 组50.49±0.07#0.62±0.06#0.55±0.06#CRO 低剂量组50.73±0.08#0.80±0.08#0.82±0.09#CRO 中剂量组50.65±0.07#0.68±0.08#0.70±0.08#CRO 高剂量组50.47±0.05#0.58±0.06#0.53±0.06#Anisomycin 组50.78±0.08△0.90±0.09△ 0.85±0.09△组别动物数p-p38 MAPK/p38 MAPK p-NF-κB p65/NF-κB p65
3 讨论
由于儿童的气道纤毛和免疫系统尚未发育完全,呼吸道经常暴露在碳颗粒、病毒和其他刺激物中,很容易引起肺炎等呼吸道疾病,严重影响患儿的生长发育,造成沉重的经济和社会负担[2]。LPS 与许多肺部炎症性疾病的发展有关,可刺激呼吸系统的免疫功能,引起急、慢性炎症反应,导致肺损伤、肺气肿、气道重塑等病理改变,影响儿童肺发育[11]。以往的研究主要是针对中老年呼吸系统疾病,而关于儿科呼吸系统疾病研究相对较少。本研究通过LPS 法构建幼年小鼠肺炎模型,选用3~4 周龄小鼠,其免疫功能和组织修复功能弱,肺部发育与人类的童年早期相似,为探究儿童肺炎的机制及临床应用奠定基础。本研究结果显示,模型组小鼠出现肺组织损伤,肺泡水肿出血,大量炎性细胞浸润,肺W/D比和病理损伤评分显著升高,表明肺炎小鼠模型构建成功。模型组小鼠BALF 中总细胞、中性粒细胞和白细胞计数显著升高,且血清和BALF 中 TNF-α、IL-lβ、IL-6、MDA 水平显著升高,SOD 水平显著降低,表明LPS 诱导炎症因子和氧化应激反应,多种炎症因子又通过激活中性粒细胞和巨噬细胞活化,进一步导致肺部炎症发生。
CRO 已被证实能通过发挥抗氧化、抗炎等作用对肺部炎症损伤起到保护作用,不仅可通过抑制炎症信号通路来缓解LPS 诱导的急性呼吸窘迫综合征和肺损伤[12];还通过发挥对白细胞和淋巴细胞的免疫调节作用,降低卵清蛋白致敏小鼠肺部炎症[8]。本研究发现,CRO 干预后小鼠肺组织病理损伤减轻,少量炎性细胞浸润,肺W/D 比和病理损伤评分、BALF 中总细胞、中性粒细胞和白细胞计数以及血清和BALF 中炎症因子和MDA 水平显著降低,SOD水平显著升高,表明CRO 具有减轻小鼠肺炎的功效,主要是通过发挥抗炎、抗氧化、免疫调节作用。本研究还选用DEX 作为阳性药物,其对小鼠肺炎损伤的改善效果与CRO 高剂量组效果相似,说明CRO对LPS 诱导的肺炎具有很好的改善效果。
MAPK 作为介导基本生物学过程和细胞对外部应激的信号分子,可被各种炎症和应激刺激激活来调节免疫应答,p38 MAPK 通路作为MAPK 信号传导的纽带,与炎症密切相关,在TNF-α、IL-1β 和IL-6的产生中起重要作用[13]。且MAPK 是NF-κB的上游激活剂,p38 MAPK 在NF-κB 向细胞核的活化和迁移中起重要作用,可通过激活NF-κB 促进促炎介质的表达。正常情况下,NF-κB 以非活性状态与IκB结合的状态存在于细胞质中,LPS 刺激增加MAPK的磷酸化,导致NF-κB 活化并以p65 活性形式易位到细胞核中,增加促炎细胞因子表达和过度炎症反应的发生[14]。Wang 等[15]研究发现抑制p38 MAPK 可缓解肺缺血再灌注损伤,可能是治疗急性肺损伤的有效方法。Yu 等[16]也发现使用NF-κB 抑制剂可改善炎症,进而预防LPS 诱导的急性肾损伤和肺损伤。还有研究表明,抑制MAPK/NF-κB 信号通路可以减少肺部炎症和血管重塑,并减轻 LPS 诱导的急性肺损伤[17]。本研究发现,模型组小鼠p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα表达显著升高,表明LPS 刺激可能激活MAPK/NFκB 信号通路。而CRO 干预后p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα 表达降低,表明CRO 可能具有抑制MAPK/NF-κB 激活的作用。这与CRO 通过抑制p38 MAPK/NF-κB信号通路发挥对脓毒症诱导的肝、肾和肺损伤的保护作用,以及抑制NF-κB 信号传导来减轻心肌纤维化中的氧化应激、炎症和细胞凋亡[6,18]结果相似,为进一步验证CRO 对MAPK/NF-κB 信号通路的干预作用,本研究在CRO 高 剂量组的基础上加上MAPK 激活剂Anisomycin,CRO 对LPS 诱导的肺炎小鼠的改善作用受到抑制,因此猜测CRO 的作用机制可能与抑制MAPK/NF-κB 信号通路的激活有关。
综上,CRO 可能通过抑制MAPK/NF-κB 通路激活,减少炎症反应和氧化应激,对LPS 诱导的肺炎小鼠肺部损伤有治疗作用。本研究为改善幼年肺炎小鼠提供了新思路,但仅初步探讨CRO 对幼年肺炎小鼠的治疗作用,后续将进一步探讨CRO 对成年小鼠的治疗作用以及研究药物与年龄的相关性。