白藜芦醇调控SDF-1/CXCR4 通路对颞下颌关节骨关节炎模型大鼠软骨细胞凋亡的影响*
2023-12-25陈萌萌邢春花
陈萌萌,邢春花
(1.哈尔滨市第四医院口腔科,哈尔滨 150026;2.哈尔滨市第四医院检验科,哈尔滨 150026)
骨关节炎是一种进行性退行性疾病,常导致软骨和周围组织恶化,引起关节疼痛和功能障碍,颞下颌关节是受骨关节炎影响的最常见部位之一[1]。颞下颌关节骨关节炎(TMJOA)的特征包括进行性软骨变性,软骨下骨重塑异常和滑膜炎,并伴随咀嚼困难、疼痛及颌面部畸形等症状[2]。软骨细胞作为软骨的常驻细胞,是维持软骨基质稳态的关键介质,其细胞凋亡和功能损伤会破坏软骨的稳态,加速骨关节炎的进程[3]。因此,研究软骨细胞的凋亡机制对TMJOA 的治疗有重要意义。基质细胞衍生因子-1(SDF-1)属于α 趋化因子家族,是一种小分子量的趋化因子蛋白。CXC 趋化因子受体4(CXCR4)在多种组织和器官中广泛表达,是SDF-1 的唯一特异性受体。当SDF-1 与CXCR4 特异性结合时,可以发挥多种生物学功能[4]。最近有研究显示,SDF-1/CXCR4 在骨关节炎的发展中发挥重要作用,阻断SDF-1/CXCR4 信号通路能够抑制TMJOA 的成骨分化,减轻软骨损伤[5-6]。白藜芦醇(RES)是天然的多酚类物质,是植物在胁迫下产生的一种植物抗毒素,具有抗癌、抗氧化、抗炎等特性。前期有研究发现RES 可以有效改善炎症损伤防止骨关节炎发展,减轻白细胞介素-1β 诱导的软骨细胞损伤,同时也可以通过下调TMJOA 中的环氧化物酶2(COX-2)/核因子κB(NF-κB)信号通路,抑制软骨细胞凋亡[7-8]。但有关细胞增殖和炎症诱导COX-2 的机制还尚未得到证实。另一项研究显示,COX-2 是SDF-1/CXCR4 轴下游信号通路的重要成员之一,SDF-1 能够增强COX-2 的表达[9]。因此,本研究探讨了RES是否能够通过调控SDF-1/CXCR4 信号通路来抑制TMJOA 大鼠的软骨细胞凋亡,为RES 成为TMJOA 的治疗策略提供更充分的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级Wistar 大鼠36 只,6 周龄,(160±20)g,购自辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2020-0002。实验前将所有大鼠置于温度 26 ℃,湿度 60%的环境中饲养。
1.1.2 主要试剂 白藜芦醇(HPLC≥98%,四川省维克奇生物科技有限公司);AMD3100(货号:HY-10046,美国MedChemExpress 公司);重组SDF-1(货号:ab9798,英国Abcam 公司);苏木精-伊红(HE)染色液、改良番红 O-固绿软骨染色液(货号:SY2022、SY1418,北京伊塔生物科技有限公司);Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(货号:FY600003-20T,弗元生物科技有限公司);一氧化氮合酶(iNOS)、一氧化氮(NO)、细胞色素C(Cyt C)酶联免疫吸附法(ELISA)检测试剂盒(货号:XYELISA0380、XY-SJH-2984、XY-SJH-3050,上海烜雅生物科技有限公司);caspase-9、Bcl-2、Bax、SDF-1、CXCR4 兔单抗(货号:ab32539、ab182858、ab32503、ab155090、ab124824,英国Abcam 公司);山羊抗兔lgG(H+L)(货号:AP31L014,和元李记生物技术有限公司)。
1.2 方法
1.2.1 TMJOA 大鼠模型建立和分组处理 将所有大鼠随机分为对照组、模型组、CXCR4 抑制剂组(AMD3100 组)、RES 低剂量组、RES 高剂量组、RES高剂量+重组SDF-1 组(RES 高+SDF-1 组),每组6 只。除对照组,其余组均通过在大鼠颞下颌关节上腔内注射12.5 μL 胶原酶建立TMJOA 模型[8]。1 周后,AMD3100 组关节腔内注射40 μL 浓度为1 μg/μL的CXCR4 抑制剂AMD3100[6];RES 低、高剂量组关节腔内分别注射80 μL 浓度为1.25、12.5 μg/μL 的RES[10],RES 高+重组SDF-1 组先注射80 μL 浓度为12.5 μg/μL 的RES,再注射剂量为30 μg/kg 的重组SDF-1,对照组和模型组用相同方式注射等量的生理盐水,每周注射3 次,持续4 周。
1.2.2 细胞分离和培养 干预结束后,每组随机选取3 只大鼠用1%戊巴比妥钠(40 mg/kg)麻醉并处死,取颞下颌关节,用手术刀片轻轻刮取髁突软骨组织层,然后将软骨组织用无菌生理盐水清洗,并剪成体积小于1 mm3的碎块儿,用0.1%Ⅱ型胶原酶在37 ℃下消化5 h,然后吹打过滤后,2 000×g 离心 10 min,离心半径10 cm,收集细胞用含有10%胎牛血清 DEME 培养基培养,24 h 后再次收集细胞立即进行后续实验。
1.2.3 组织学染色观察软骨组织病理学变化 按照1.2.2 中的方法收集每组剩余大鼠的髁突软骨组织,放入4%多聚甲醛中固定过夜,然后进行石蜡包埋并切片。接着按照常规步骤用二甲苯和梯度乙醇脱蜡水化,然后将组织切片分别放入HE 染色液和番红 O-固绿染液中染色20 min,再次使用梯度乙醇脱水,二甲苯透明,最后中性树脂封片。在光学显微镜下观察髁突软骨组织结构形态和基质蛋白多糖的变化,并参考文献[11]中 Mankin 评分标准来评估软骨组织损伤情况。
1.2.4 流式细胞术检测细胞凋亡 将1.2.2 中收集的软骨细胞用磷酸盐缓冲液(PBS)清洗后,分别加入10 μL Annexin V-FITC 和10 μL 碘化丙啶(PI),室温避光孵育15 min。用流式细胞仪分析细胞凋亡情况并计算细胞凋亡率。
1.2.5 ELISA 检测细胞中 iNOS、NO、Cyt C 的水平将1.2.2 中收集的软骨细胞,加入PBS 重悬后,4℃,2 000×g 离心 10 min,离心半径10 cm,收集上清液。然后按照ELISA 试剂盒的操作步骤检测软骨细胞中 iNOS、NO、Cyt C 的含量。
1.2.6 蛋白免疫印迹分析(Western Blot)检测软骨细胞中 caspase-9、Bcl-2、Bax、SDF-1、CXCR4 蛋白表达 将1.2.2 中收集的软骨细胞置于玻璃匀浆器中,加入蛋白裂解液匀浆,离心收集上清液,用BCA测定蛋白浓度。然后用10%SDS-PAGE 凝胶电泳分离蛋白并转移至PVDF 膜上。用5%脱脂牛奶将PVDF 膜在4 ℃下封闭过夜,随后加入一抗稀释液(caspase-9、Bcl-2、Bax 比例1∶1 000,SDF-1 比例1∶10 000,CXCR4 比例1:100),室温孵育2 h 后加入羊抗兔IgG 二抗稀释液(1∶500)中,室温孵育2 h,最后用ECL 显影。以GAPDH 为内参蛋白,用凝胶成像仪和Image J 软件观察并分析蛋白条带灰度值。
1.3 统计学分析 本研究数据均采用Graphpad prism8.0 软件统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠软骨组织的病理学变化 对照组髁突软骨组织结构层次清晰,软骨细胞排列整齐,软骨着色均匀,主要着色部位在软骨浅层;与对照组比较,模型组软骨组织层次紊乱,细胞数量减少,软骨着色明显减退,组织损伤评分增加(P<0.05);与模型组比较,AMD3100 组和RES 组软骨组织结构层次逐渐明显,细胞数量增多,软骨着色增加,组织损伤评分减少(P<0.05);与RES 高剂量组比较,RES高+SDF-1 组软骨组织的病理变化与模型组相似,组织损伤评分增加(P<0.05),见图1 和表1。

图1 HE 和番红O-固绿染色检测各组大鼠软骨组织损伤情况(×100)Fig.1 HE and saffron O-fast green staining were used to detect the damage of cartilage tissue in rats in each group(×100)
表1 各组大鼠软骨组织的损伤评分比较(±s)Tab.1 Damage score of cartilage tissue in rats in each group(±s) 分
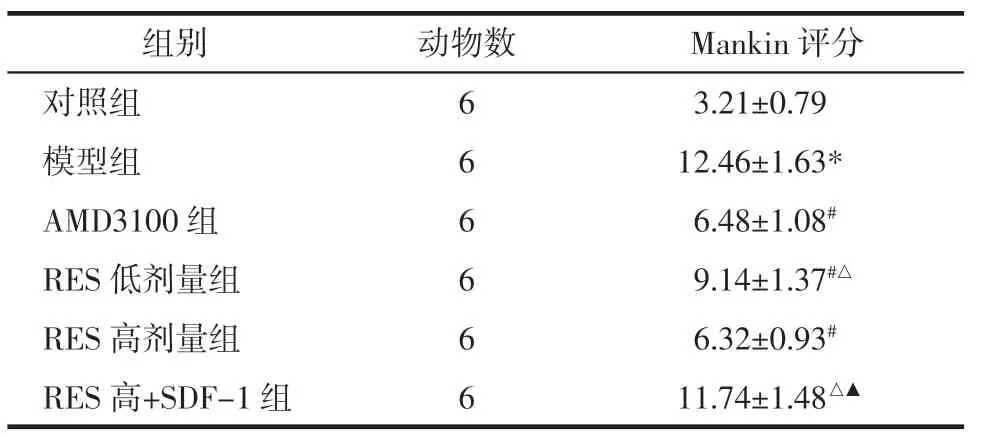
表1 各组大鼠软骨组织的损伤评分比较(±s)Tab.1 Damage score of cartilage tissue in rats in each group(±s) 分
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与AMD3100 组比较,△P<0.05;与RES 高剂量组比较,▲P<0.05。
?组别动物数Mankin 评分对照组63.21±0.79模型组612.46±1.63*AMD3100 组66.48±1.08#RES 低剂量组69.14±1.37#△RES 高剂量组66.32±0.93#RES 高+SDF-1 组611.74±1.48△▲
2.2 各组大鼠软骨细胞的凋亡情况比较 与对照组比较,模型组软骨细胞凋亡率增加(P<0.05);与模型组比较,AMD3100 组和RES 组软骨细胞凋亡率降低(P<0.05);与RES 高剂量组比较,RES 高+SDF-1组软骨细胞凋亡率增加(P<0.05),见图2 和表2。
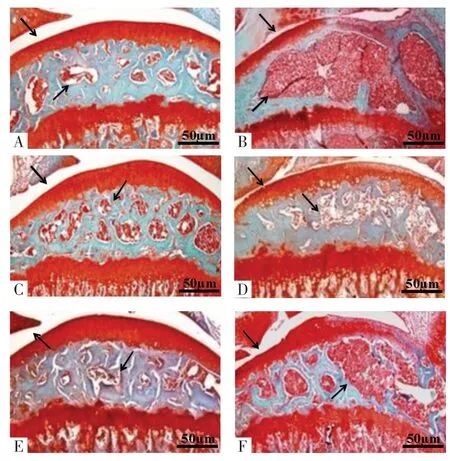
图2 流式细胞术检测各组大鼠软骨细胞凋亡Fig.2 Detection of chondrocyte apoptosis in each group of rats by flow cytometry
表2 各组大鼠软骨细胞的凋亡率比较(±s)Tab.2 Apoptosis rate of rat chondrocytes in each group(±s) %
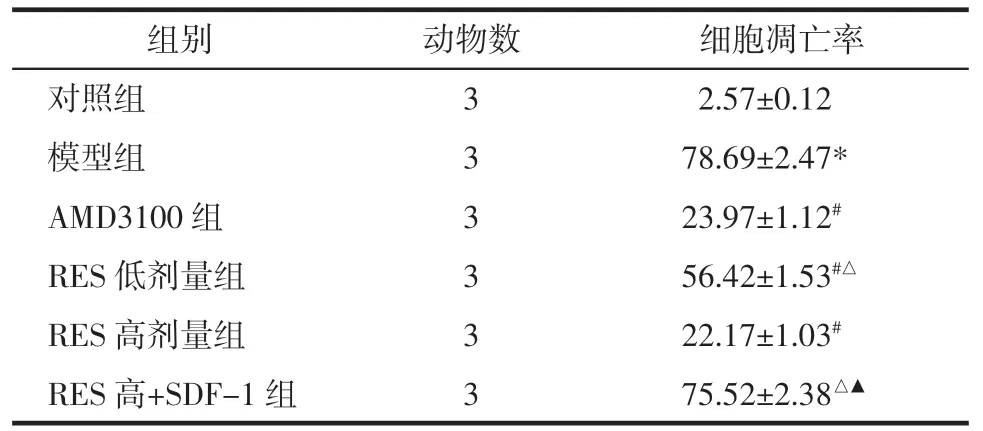
表2 各组大鼠软骨细胞的凋亡率比较(±s)Tab.2 Apoptosis rate of rat chondrocytes in each group(±s) %
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与AMD3100 组比较,△P<0.05;与RES 高剂量组比较,▲P<0.05。
?组别动物数细胞凋亡率对照组32.57±0.12模型组378.69±2.47*AMD3100 组323.97±1.12#RES 低剂量组356.42±1.53#△RES 高剂量组322.17±1.03#RES 高+SDF-1 组375.52±2.38△▲
2.3 各组大鼠软骨细胞中 iNOS、NO、Cyt C 的水平比较 与对照组比较,模型组软骨细胞中 iNOS、NO、Cyt C 含量升高(P<0.05);与模型组比较,AMD3100组和RES 组软骨细胞中 iNOS、NO、Cyt C 含量降低(P<0.05);与RES 高剂量组比较,RES 高+SDF-1 组软骨细胞中 iNOS、NO、Cyt C 含量升高(P<0.05),见表3。
表3 各组大鼠软骨细胞中iNOS、NO、Cyt C 水平比较(±s)Tab.3 Levels of iNOS,NO and Cyt C in chondrocytes of rats in each group(±s) pg/mL
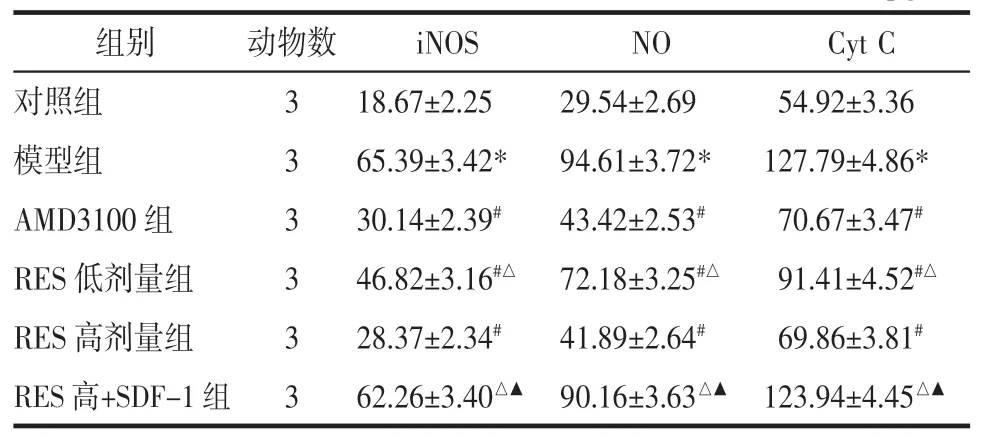
表3 各组大鼠软骨细胞中iNOS、NO、Cyt C 水平比较(±s)Tab.3 Levels of iNOS,NO and Cyt C in chondrocytes of rats in each group(±s) pg/mL
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与AMD3100 组比较,△P<0.05;与RES 高剂量组比较,▲P<0.05。
组别对照组模型组AMD3100 组RES 低剂量组RES 高剂量组RES 高+SDF-1 组动物数333333 iNOSNOCyt C 18.67±2.2529.54±2.6954.92±3.36 65.39±3.42*94.61±3.72*127.79±4.86*30.14±2.39#43.42±2.53#70.67±3.47#46.82±3.16#△ 72.18±3.25#△91.41±4.52#△28.37±2.34#41.89±2.64#69.86±3.81#62.26±3.40△▲ 90.16±3.63△▲ 123.94±4.45△▲
2.4 各组大鼠软骨细胞中 caspase-9、Bcl-2、Bax、SDF-1、CXCR4 蛋白的表达水平比较 与对照组比较,模型组软骨细胞中 caspase-9、Bax、SDF-1、CXCR4蛋白表达升高,Bcl-2 蛋白表达降低(P<0.05);与模型组比较,AMD3100 组和RES 组软骨细胞中 caspase-9、Bax、SDF-1、CXCR4 蛋白表达降低,Bcl-2 蛋白表达升高(P<0.05);与RES 高剂量组比较,RES 高+SDF-1组软骨细胞中 caspase-9、Bax、SDF-1、CXCR4 蛋白表达升高,Bcl-2 蛋白表达降低(P<0.05),见图3 和表4。
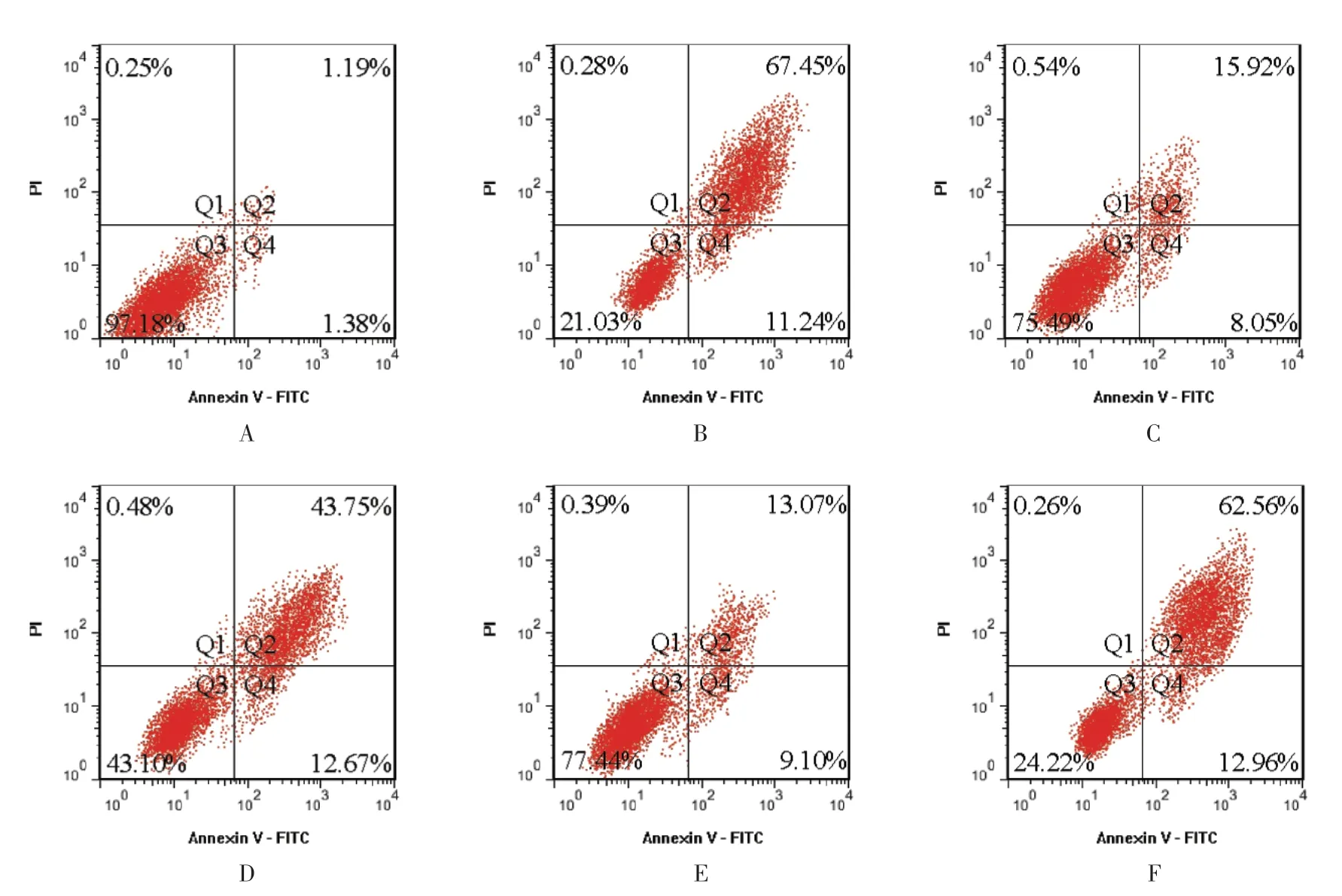
图3 各组大鼠软骨细胞中caspase-9、Bcl-2、Bax、SDF-1、CXCR4 蛋白表达条带Fig.3 Expression bands of caspase-9,Bcl-2,Bax,SDF-1 and CXCR4 in rat chondrocytes of each group
表4 各组大鼠软骨细胞中caspase-9、Bcl-2、Bax、SDF-1、CXCR4 蛋白相对表达量(±s)Tab.4 Relative expressions of caspase-9,Bcl-2,Bax,SDF-1 and CXCR4 proteins in rat chondrocytes in each group(±s)
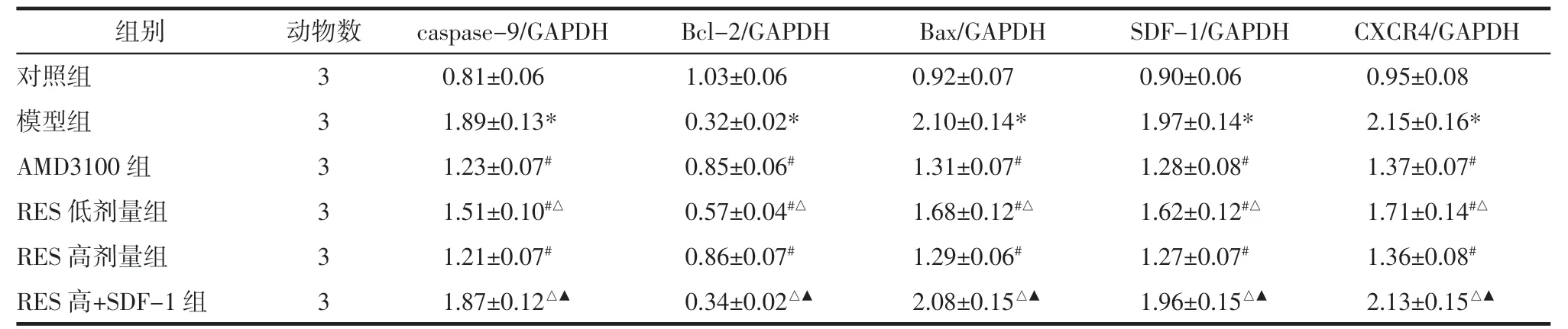
表4 各组大鼠软骨细胞中caspase-9、Bcl-2、Bax、SDF-1、CXCR4 蛋白相对表达量(±s)Tab.4 Relative expressions of caspase-9,Bcl-2,Bax,SDF-1 and CXCR4 proteins in rat chondrocytes in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与AMD3100 组比较,△P<0.05;与RES 高剂量组比较,▲P<0.05。
组别动物数caspase-9/GAPDHBcl-2/GAPDHBax/GAPDHSDF-1/GAPDHCXCR4/GAPDH对照组30.81±0.061.03±0.060.92±0.070.90±0.060.95±0.08模型组31.89±0.13*0.32±0.02*2.10±0.14*1.97±0.14*2.15±0.16*AMD3100 组31.23±0.07#0.85±0.06#1.31±0.07#1.28±0.08#1.37±0.07#RES 低剂量组31.51±0.10#△0.57±0.04#△1.68±0.12#△1.62±0.12#△1.71±0.14#△RES 高剂量组31.21±0.07#0.86±0.07#1.29±0.06#1.27±0.07#1.36±0.08#RES 高+SDF-1 组31.87±0.12△▲0.34±0.02△▲2.08±0.15△▲1.96±0.15△▲2.13±0.15△▲
3 讨论
TMJOA 是一种影响颞下颌关节最常见的慢性退行性关节炎疾病,主要特征是软骨细胞死亡、ECM 降解和软骨下骨重塑。颞下颌关节髁突软骨变性与TMJOA 的发展密切相关。软骨逐渐变性是由软骨细胞调节不当以及组织破坏与生成之间的不平衡引起的,髁突软骨细胞作为颞下颌关节髁突软骨中唯一的细胞类型,在软骨变性过程中起着决定性作用[12-13]。研究显示软骨细胞更新的增加引发了髁突软骨的退化,细胞凋亡和坏死性凋亡加速了关节软骨的破坏。软骨细胞的异常死亡不仅会减少软骨细胞的数量,还会引发软骨的退化和软骨下骨的破坏[14]。因此,抑制软骨细胞凋亡是保护软骨组织免受损伤的重要途径。本研究首先通过HE 和番红 O-固绿染色检测TMJOA 髁突软骨组织的损伤情况,结果显示模型组软骨组织结构层次紊乱,细胞数量减少,软骨着色明显减退,损伤评分升高,揭示了TMJOA 大鼠模型建立成功。而RES 低、高剂量组软骨组织结构层次逐渐明显,细胞数量增多,软骨着色增加,损伤评分降低,揭示了RES 可以缓解大鼠的软骨组织损伤。接着分离软骨细胞检测细胞凋亡情况,结果显示模型组细胞凋亡率高于对照组,RES低、高剂量组细胞凋亡率低于模型组,揭示了RES可以抑制TMJOA 大鼠髁突软骨细胞的凋亡,减轻关节软骨的损伤。
钙在软骨细胞凋亡中也存在非常重要的作用,细胞内高浓度钙可以激活诱导型iNOS,从而诱导NO抑制线粒体呼吸,并通过释放Cyt C 和caspase-9导致软骨细胞凋亡[15]。已知Bcl-2 超家族成员也是细胞凋亡的关键调节者,该超家族可分为促凋亡和抗凋亡成员,促凋亡成员如Bax 主要位于细胞质中,抗凋亡成员如Bcl-2 本身主要定位于线粒体外膜[16]。本研究结果显示,与对照组比较,模型组软骨细胞中 iNOS、NO、Cyt C 含量及Bax 蛋白表达升高,Bcl-2 蛋白表达降低;而RES 低、高剂量组iNOS、NO、Cyt C 含量及Bax 蛋白表达升高,Bcl-2 蛋白表达升高。揭示了RES 可以抑制TMJOA 大鼠髁突软骨细胞中的钙浓度及促凋亡因子的表达,从而抑制软骨细胞凋亡,减轻 TMJOA 的软骨损伤。
SDF-1 是一种与炎症相关的细胞因子,在邻近关节软骨的滑膜中被发现,来自滑膜的外源SDF-1可以与软骨细胞膜上的G 蛋白偶联受体CXCR4 结合,随后进入软骨细胞并调节软骨细胞的增殖、存活、分化和成熟[17-18]。有研究证明SDF-1 与CXCR4的结合通过诱导基质金属蛋白的分泌导致骨关节炎软骨细胞基质的降解,且SDF-1/CXCR4 可诱导过度功能矫形引起的TMJOA 成骨分化并导致软骨降解[6]。已知CXCR4 的抑制剂AMD3100 已有效用于治疗骨关节炎,也可以减轻碘乙酸钠诱导的TMJOA的严重程度[19-20]。因此,本研究将AMD3100 作为阳性对照,结果显示,模型组软骨细胞中 SDF-1 和CXCR4 的蛋白表达明显高于对照组,RES 低、高剂量组细胞中 SDF-1 和CXCR4 的蛋白表达明显低于模型组,AMD3100 组细胞凋亡率、凋亡相关因子mRNA 水平和SDF-1、CXCR4 蛋白表达与RES 高剂量组差异无统计学意义,揭示了RES 可以抑制SDF-1 与受体CXCR4 结合,其作用与AMD3100 作用一致。在RES 高剂量的基础上进一步加入重组蛋白SDF-1,SDF-1 表达的升高逆转了RES 对信号通路以及软骨细胞凋亡的抑制作用。揭示了RES 可能是通过阻断SDF-1/CXCR4 信号通路来抑制TMJOA大鼠软骨细胞的凋亡。
综上所述,RES 可以通过阻断SDF-1/CXCR4信号通路抑制TMJOA 大鼠软骨细胞的凋亡。本研究为寻找治疗TMJOA 的潜在药物提供了新思路和治疗策略。但骨关节炎中软骨细胞凋亡的机制比较复杂,因此RES 对骨关节炎软骨细胞中的凋亡机制还有待进一步深入研究。
