刺五加注射液对急性心肌梗死后心力衰竭大鼠心肌保护作用的研究*
2023-12-25冯玲玲陈树杰车炜
冯玲玲,陈树杰,车炜
(邯郸市中心医院老年病二科,邯郸 056001)
心力衰竭(HF)是ST 抬高型急性心肌梗死(AMI)患者最常见并发症。据统计,AMI 后1 年内HF 发病率超过45%,而AMI 后HF(HF-AMI)患者5 年生存率不足40%,HF-AMI 是影响AMI 患者中远期预后的重要因素[1-2]。HF-AMI 病理机制复杂,其中氧化应激和心肌组织纤维化在HF-AMI 发生发展过程中扮演着重要角色,由核因子E2 相关因子2(Nrf2)及其下游蛋白血红素加氧酶1(HO-1)组成的信号通路对氧化应激具有重要调控作用。有文献报道通过干预Nrf2/HO-1 信号通路可有效减轻 HF-AMI大鼠心肌组织氧化应激和纤维化,改善心功能[3]。
刺五加(又名五加参)为《中国药典(一部)》收录中药品种,以五加科植物刺五加的干燥根和根茎入药,性温、味辛,归脾、肾、心经,具有益气健脾、补肾安神等功效。刺五加注射液(CWJI)是以刺五加水醇提取物为有效成分制成的中成药,目前主要用于缺血性脑病以及冠心病、心绞痛的治疗。有研究报道CWJI 可通过激活Nrf2/HO-1 信号通路减轻氧化应激对大鼠肾缺血再灌注损伤起到保护作用[4],并且CWJI 对化疗药物等所致大鼠心肌损伤具有保护作用[5-6],但CWJI 对HF-AMI 大鼠的影响及相关机制尚未见文献报道。本研究通过复制HF-AMI 大鼠模型,探讨CWJI 对HF-AMI 大鼠心肌组织的影响及相关机制,以期为HF-AMI 临床治疗提供参考。
1 材料与方法
1.1 实验动物 清洁级Wistar 大鼠(雄性、7 周龄、210~240 g)105 只购自北京科宇动物养殖中心[许可证号:SCXK(京)2018-0010]。在(23±1)℃、相对湿度(55±10)%、光照12 h 黑暗12 h 的控制环境中饲养,进食饮水不限。本实验获得医院伦理委员会批准。实验动物相关操作遵循减少、替代、优化原则。
1.2 药物与试剂 CWJI(黑龙江乌苏里江制药有限公司,国药准字Z23023215,批号21A0917005);卡托普利注射液(CPT,常州制药厂有限公司,国药准字H10970293,批号220113);心肌肌钙蛋白T(cTnT)、血管紧张素Ⅱ(Ang Ⅱ)酶联免疫吸附法(ELISA)试剂盒和苏木精-伊红(HE)、原位末端转移酶标记(TUNEL)、马松(Masson)染色试剂盒(北京索莱宝生物科技公司,货号SEKR-0047、SEKR-0049、G1120、T2190、G1340);醛固酮(ALD)ELISA法试剂盒(泉州市睿信生物科技有限公司,货号RXJ302392R);总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)检测试剂盒和RIPA 裂解液、2,2’-联喹啉-4,4’-二甲酸二钠(BCA)法蛋白定量试剂盒(上海碧云天生物科技有限公司,货号S0109、S0056、S0131S、W063-1-1、A045-4-1);活性氧(ROS)检测试剂盒、TRIzol 总RNA 提取试剂、一步法RT-PCR 试剂盒(南京建成生物工程研究所,货号E004-1-1、N065、N116);Nrf2、HO-1、β-肌动蛋白(β-actin)抗体和免疫球蛋白G 抗体(IgG 二抗)、增强化学发光液(ECL)(北京博奥森生物技术公司,货号bs-1074R、bs-2075R、bs-0061R、bs-0295G、C05-07004)。
1.3 主要仪器 小动物呼吸机(DW-3000 型,安徽正华生物仪器公司);多普勒超声仪(770TM-120型,加拿大Visual Sonics 公司);生理信号采集系统(MP150 型,美国BSI 公司);酶标仪(DTX880 型,美国贝克曼公司);紫外-可见分光光度计(ND2000C型,美国Thermo 公司);930F 型荧光分光光度计(上海仪电分析仪器有限公司);石蜡切片机(RM2016型,上海徕卡仪器公司);超薄切片机(EMUC7 型,德国Leica 公司);透射电子显微镜(HT7700 型,日本日立公司);蛋白电泳转膜系统(PowerPac 型,美国Bio-Rad 公司);QuantStudio 5 型PCR 仪(美国ABI公司)。
1.4 实验方法
1.4.1 HF-AMI 大鼠模型制备与给药 适应性饲养1 周后,随机取105 只大鼠中的16 只作为假手术(Sham)组,剩余89 只通过结扎左冠状动脉前降支复制HF-AMI 大鼠模型,结扎后心尖部位颜色变苍白、心电图ST 段明显抬高或T 波高耸则说明心肌梗死制备成功,2 周后通过多普勒超声检测左室射血分数(LVEF),LVEF <50%即可判定HF-AMI 大鼠模型制备成功[7]。共造模成功82 只,随机取80 只HF-AMI 成模大鼠随机分为模型(Model)组、CPT 组和CWJI 低(CWJI-L)、中(CWJI-M)、高剂量(CWJIH)组,每组16 只。Sham 组大鼠除了不结扎左冠状动脉前降支外,其余操作同Model 组。CPT 组腹腔注射给药10 mg/kg[8],CWJI-L、CWJI-M、CWJI-H 组分别腹腔注射给药15、30、60 mg/kg(参照人临床应用剂量,根据人与大鼠剂量换算公式计算所得,分别相当于人临床剂量的1/2、1、2 倍),Sham 组和Model组分别腹腔注射给予生理盐水,给药频次均为1 次/日,疗程4 周。
1.4.2 大鼠心功能指标检测 治疗完成后,随机取每组8 只大鼠,腹腔注射水合氯醛溶液(0.35 mg/kg)进行麻醉后,通过多普勒超声仪,取左室短轴解剖位M 模式图像,检测大鼠心功能指标[LVEF 和左室短轴缩短率(LVFS)];通过生理信号采集系统检测心功能指标[左室内压最大上升速率和最大下降速率(+dp/dtmax、-dp/dtmax)]。
1.4.3 ELISA 法检测血清 cTnI、AngⅡ、ALD 水平 经腹主动脉采血 5 mL 并离心(1 500 r/min,离心半径10 cm,5 min)取血清,遵照试剂盒操作说明,采用ELISA 法检测血清 cTnI、Ang Ⅱ、ALD 水平。
1.4.4 计算左室心肌肥厚指数(LVHI) 称量大鼠体质量(M1),开胸取心脏,剪取左心室心肌用生理盐水冲洗干净后称质量(M2),LVHI(%)=(M2/M1)×100%。
1.4.5 HE、TUNEL、Masson 染色法观察心肌组织病理学改变、细胞凋亡和组织纤维化状况 取左心室缺血区心肌组织,经4%多聚甲醛溶液固定、石蜡包埋、切片、展片、烤片等处理后,按照各试剂盒操作说明:1)行HE 染色后显微镜下观察心肌组织病理学改变。2)行TUNEL 染色后观察心肌细胞凋亡状况(细胞核黄褐色为阳性着色),400 倍光学显微镜下取每张切片5 个互不重叠的视野,计数视野内凋亡细胞数和细胞总数,凋亡指数(AI)=(凋亡细胞数/细胞总数)×100%。3)行Masson 染色后观察心肌组织纤维化状况(蓝色为胶原着色),400 倍光学显微镜下拍取5 个互不重叠的视野,通过Image J 软件分析视野内蓝色胶原纤维面积和视野总面积,胶原容积分数(CVF)=(蓝色胶原纤维面积/视野总面积)×100%。
1.4.6 透射电子显微镜观察心肌细胞线粒体超微结构变化 取每组剩余的8 只大鼠,颈椎脱臼处死后开胸取心脏,剪取少量左心室心肌修饰成1 mm3小块后行2.5%戊二醛3 h 和1%锇酸1 h 双固定,脱水和丙酮置换后环氧树脂包埋,50 nm 超薄切片后行醋酸双氧铀和柠檬酸铅双染色,通过透射电子显微镜观察心肌细胞线粒体超微结构。
1.4.7 分光光度法检测心肌组织T-SOD、GSH-Px 活性和MDA、ROS 含量 取部分左心室缺血区心肌组织加入适量4 ℃生理盐水研磨匀浆,离心(3 500 r/min,离心半径10 cm,5 min)取上清液,遵照试剂盒操作说明,通过紫外-可见分光光度计检测心肌组织TSOD 活性(检测波长560 nm)、GSH-Px 活性(检测波长340 nm)、MDA 含量(检测波长535 nm);通过荧光分光光度计检测心肌组织ROS 含量(激发波长502 nm,发射波长530 nm)。
1.4.8 RT-PCR 法检测心肌组织Nrf2、HO-1 mRNA表达 取适量左心室缺血区心肌组织,TRIzol 法提取总RNA,按试剂盒说明将RNA 逆转录成cDNA后行PCR 扩增,引物序列:Nrf2 上游引物5’-TGACAATGAGGTTTCTTCGGCTACG-3’,下游引物5’-TGCCCCTGAGATGGTGACAA-3’,扩增长度 112 bp;HO-1 上游引物5’-GGCCTCCCTGTACCACATCT-3’,下游引物5’-CTGCA TGGCTGGTGTGTAGG-3’,扩增长度 173 bp;β-actin 上游引物5’-CTGTGTTG TCCCTGTATGCC TCTG’,下游引物5’- GGAACCG CTCATTGCCGATAGTG-3’,扩增长度 116 bp。扩增程序:95 ℃5 min;95 ℃30 s、60 ℃30 s,重复40 个循环。以β-actin 为内参,运用公式2-ΔΔCt计算Nrf2、HO-1 mRNA 相对表达量。
1.4.9 Western Blot 法检测心肌组织Nrf2、HO-1 蛋白表达 取100 mg 左心室缺血区心肌组织加入1 mL RIPA 裂解液提取总蛋白,BCA 法进行蛋白定量后,30 μg 总蛋白量上样、凝胶电泳分离蛋白、转PVDF膜、5%蛋白封闭液室温封闭2 h 后,加目标蛋白一抗稀释液Nrf2(1∶1 000)、HO-1(1∶1 000)和内参蛋白稀释液β-actin(1∶2 000)4 ℃孵育过夜,洗膜后加二抗稀释液IgG(1∶2 000)室温孵育1 h,洗膜后加ECL 显影,通过蛋白条带灰度值半定量目标蛋白相对表达量。
1.5 统计学处理 采用SPSS 20.0 软件行统计分析。计量资料符合正态分布以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠心功能指标比较 与Sham 组比较,Model 组大鼠LVEF、LVFS、+dp/dtmax、-dp/dtmax 显著降低(P<0.05)。与Model 组比较,CPT 组和CWJIL、CWJI-M、CWJI-H 组LVEF、LVFS、+dp/dtmax、-dp/dtmax(CWJI-L 组除外)显著升高(P<0.05),CWJI各剂量组间上述效应呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H 组LVEF、+dp/dtmax、-dp/dtmax 显著升高(P<0.05),两组间LVFS 差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠心功能指标比较(±s)Tab.1 Comparison of cardiac function indexes of rats in each group(±s)

表1 各组大鼠心功能指标比较(±s)Tab.1 Comparison of cardiac function indexes of rats in each group(±s)
注:与Sham 组比较,*P<0.05;与Model 组比较,#P<0.05;与CPT 组比较,△P<0.05;与CWJI-L 组比较,▲P<0.05;与CWJI-M 组比较,&P<0.05。
组别动物数LVEF(%)LVFS(%)+dp/dtmax(mmHg/s)-dp/dtmax(mmHg/s)Sham 组879.84±8.1353.09±5.262 399.04±243.181 871.92±230.71 Model 组836.02±3.97*25.48±2.33*1 193.57±160.31*1 145.07±148.26*CPT 组862.14±6.50#5.24#41.36±4.20#1 834.71±212.28#1 424.35±187.31#CWJI-L 组848.66±30.14±3.17#1 442.89±191.76#1 274.30±155.62 CWJI-M 组859.31±6.40#▲37.96±3.68#▲1 800.64±206.05#▲1 438.75±170.19#▲CWJI-H 组870.78±7.53#△▲&45.07±4.41#▲&2 095.32±227.28#△▲&1 659.11±193.27#△▲&
2.2 各组大鼠血清 cTnI、Ang Ⅱ、ALD 水平比较 与Sham 组比较,Model 组大鼠血清 cTnI、Ang Ⅱ、ALD水平显著升高(P<0.05)。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组血 清 cTnI、Ang Ⅱ、ALD 水平显著降低(P<0.05),CWJI 各剂量组间上述效应呈剂量依赖性(P<0.05)。与CPT 组比较,CWJIH 组cTnI、Ang Ⅱ、ALD 水平显著降低(P<0.05)。见表2。
表2 各组大鼠血清cTnI、Ang Ⅱ、ALD 水平比较(±s)Tab.2 Comparison of the level of cTnI,Ang Ⅱ,ALD in serum of rats in each group(±s)
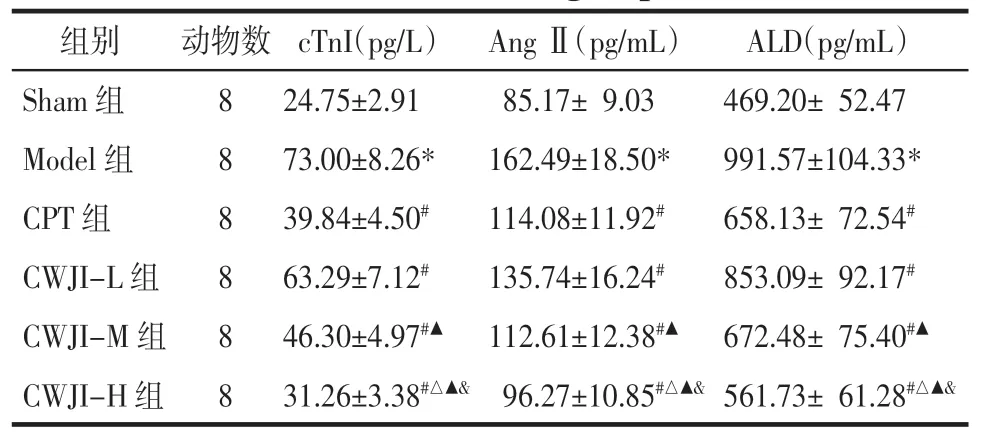
表2 各组大鼠血清cTnI、Ang Ⅱ、ALD 水平比较(±s)Tab.2 Comparison of the level of cTnI,Ang Ⅱ,ALD in serum of rats in each group(±s)
注:与Sham 组比较,*P<0.05;与Model 组比较,#P<0.05;与CPT组比较,△P<0.05;与CWJI-L 组比较,▲P<0.05;与CWJI-M 组比较,&P<0.05。
?组别动物数 cTnI(pg/L) Ang Ⅱ(pg/mL)ALD(pg/mL)Sham 组824.75±2.9185.17± 9.03469.20± 52.47 Model 组873.00±8.26*162.49±18.50*991.57±104.33*CPT 组839.84±4.50#114.08±11.92#658.13± 72.54#CWJI-L 组863.29±7.12#135.74±16.24#853.09± 92.17#CWJI-M 组846.30±4.97#▲ 112.61±12.38#▲ 672.48± 75.40#▲CWJI-H 组831.26±3.38#△▲& 96.27±10.85#△▲& 561.73± 61.28#△▲&
2.3 各组大鼠LVHI 比较 与Sham 组比较,Model组大鼠LVHI 显著升高(P<0.05)。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组LVHI 显著降低(P<0.05),CWJI 各剂量组间上述效应呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H 组LVHI 显著降低(P<0.05)。见表3。
表3 各组大鼠LVHI、AI 及CVF 比较(±s)Tab.3 Comparison of LVHI,AI,CVF of rats in each group(±s)

表3 各组大鼠LVHI、AI 及CVF 比较(±s)Tab.3 Comparison of LVHI,AI,CVF of rats in each group(±s)
注:与Sham 组比较,*P<0.05;与Model 组比较,#P<0.05;与CPT组比较,△P<0.05;与CWJI-L 组比较,▲P<0.05;与CWJI-M 组比较,&P<0.05。
?
2.4 各组大鼠心肌组织病理学改变比较 Sham 组大鼠心肌组织形态和细胞结构均未见异常。Model组心肌组织可见明显的病理学改变,如心肌纤维断裂,细胞排列紊乱、空泡变性、坏死、消失,结缔组织增生,间质区水肿、巨噬细胞及中性粒细胞浸润等炎性细胞浸润。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组心肌组织病理学改变均明显改善,CWJI 各剂量组改善效果呈剂量依赖性,且CWJI-H 组效果优于CPT 组。见图1。
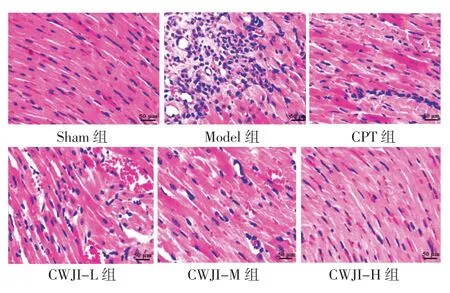
图1 各组大鼠心肌组织病理学改变比较(HE 染色,×400)Fig.1 Comparison of myocardial histopathological changes of rats in each group(HE staining,×400)
2.5 各组大鼠心肌细胞凋亡状况及AI 比较 Sham组心肌组织可见少量散在分布的凋亡细胞。Model组心肌细胞凋亡数量较Sham 组明显增多。与Model组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组心肌细胞凋亡数量明显减少,CWJI 各剂量组上述效应呈剂量依赖性,且CWJI-H 组优于CPT 组。与Sham 组比较,Model 组AI 显著升高 (P<0.05)。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H组AI 显著降低(P<0.05),CWJI 各剂量组对AI 的作用呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H组AI 显著降低(P<0.05)。见图2、表3。

图2 各组大鼠心肌细胞凋亡状况比较(TUNEL 染色,×400)Fig.2 Comparison of cardiomyocyte apoptosis of rats in each group(TUNEL staining,×400)
2.6 各组大鼠心 肌组织纤维化状况及CVF 比较 Sham 组心肌组织可见生理状态下极少量丝状的胶原纤维分布。Model 组心肌组织间质区和血管壁周围可见大量条索状胶原纤维沉积,部分融合成片状。与Model 组比较,CPT 组和CWJI-L、CWJIM、CWJI-H 组胶原纤维沉积状况明显减轻,CWJI各剂量组效应呈剂量依赖性,且CWJI-H 组优于CPT 组。与Sham 组比较,Model 组CVF 显著升高(P<0.05)。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组CVF 显著降低(P<0.05),CWJI各剂量组对CVF 的作用呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H 组CVF 显著降低(P<0.05)。见图3、表3。

图3 各组大鼠心肌组织纤维化状况比较(Masson 染色,×400)Fig.3 Comparison of myocardial fibrosis of rats in each group(Masson staining,×400)
2.7 各组大鼠心肌细胞线粒体超 微结构变化比较 Sham 组大鼠左心室心肌细胞线粒体形态结构均未见异常。与Sham 组比较,Model 组可见肌原纤维紊乱,线粒体空泡化、肿胀、破裂,嵴断裂或者减少,可见线粒体自噬体。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组心肌细胞线粒体上述病变明显改善,CWJI 各剂量组效果呈剂量依赖性,且CWJI-H 组效果优于CPT 组。见图4。

图4 各组大鼠心肌细胞线粒体超微结构变化比较(透射电子显微镜,×20 000)Fig.4 Comparison of mitochondrial ultrastructural changes of cardiomyocyte of rats in each group(Transmission electron microscope,×20 000)
2.8 各组大鼠心肌组织T-SOD、GSH-Px 活性和MDA、ROS 含量比较 与Sham 组比较,Model 组大鼠心肌组织T-SOD、GSH-Px 活性显著降低,MDA、ROS 含量显著升高(P<0.05)。与Model 组比较,CPT组和CWJI-L、CWJI-M、CWJI-H 组T-SOD、GSH-Px活性显著升高,MDA、ROS 含量显著降低(P<0.05);CWJI 各剂量组间上述效应呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H 组T-SOD、GSH-Px 活性显著升高,MDA、ROS 含量显著降低(P<0.05)。见表4。
表4 各组大鼠心肌组织T-SOD、GSH-Px 活性和MDA、ROS 含量比较(±s)Tab.4 Comparison of the activity of T-SOD,GSH-Px and the content of MDA,ROS in myocardial tissue of rats in each group(±s)

表4 各组大鼠心肌组织T-SOD、GSH-Px 活性和MDA、ROS 含量比较(±s)Tab.4 Comparison of the activity of T-SOD,GSH-Px and the content of MDA,ROS in myocardial tissue of rats in each group(±s)
注:与Sham 组比较,*P<0.05;与Model 组比较,#P<0.05;与CPT 组比较,△P<0.05;与CWJI-L 组比较,▲P<0.05;与CWJI-M 组比较,&P<0.05。
?组别动物数T-SOD(U/mg)GSH-Px(U/mg)MDA(nmol/mg)ROS(μmol/mg)Sham 组849.35±6.4738.16±4.091.27±0.22120.64±11.52 Model 组820.08±2.83*15.37±2.14*4.36±0.60*351.76±43.09*CPT 组835.61±5.40#25.83±3.32#2.31±0.28#243.03±27.46#CWJI-L 组827.50±3.61#19.48±2.27#3.53±0.49#299.58±30.27#CWJI-M 组836.28±5.38#▲27.62±3.51#▲2.47±0.32#▲235.19±25.61#▲CWJI-H 组844.25±6.09#△▲&33.17±4.16#△▲&1.64±0.19#△▲&171.40±18.83#△▲&
2.9 各组大鼠心肌组织Nrf2、HO-1 mRNA 表达比较 与Sham 组比较,Model 组大鼠心肌组织Nrf2、HO-1 mRNA 表达量显著降低(P<0.05)。与Model组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组Nrf2、HO-1 表达量显著升高(P<0.05);CWJI 各剂量组间上述效应呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H 组Nrf2、HO-1 表达量显著升高 (P<0.05)。见表5。
表5 各组大鼠心肌组织Nrf2、HO-1 mRNA 表达量比较(±s)Tab.5 Comparison of the expression of Nrf2,HO-1 mRNA in myocardial tissue of rats in each group(±s)

表5 各组大鼠心肌组织Nrf2、HO-1 mRNA 表达量比较(±s)Tab.5 Comparison of the expression of Nrf2,HO-1 mRNA in myocardial tissue of rats in each group(±s)
注:与Sham 组比较,*P<0.05;与Model 组比较,#P<0.05;与CPT组比较,△P<0.05;与CWJI-L 组比较,▲P<0.05;与CWJI-M 组比较,&P<0.05。
?组别动物数Nrf2HO-1 Sham 组82.15±0.191.95±0.18 Model 组80.36±0.04*0.40±0.05*CPT 组81.09±0.11#1.17±0.14#CWJI-L 组80.71±0.08#0.82±0.11#CWJI-M 组81.15±0.13#▲1.30±0.15#▲CWJI-H 组81.68±0.17#△▲&1.72±0.19#△▲&
2.10 各组大鼠心肌组织Nrf2、HO-1 蛋白表达比较 与Sham 组比较,Model 组大鼠心肌组织Nrf2、HO-1 蛋白表达量显著降低(P<0.05)。与Model 组比较,CPT 组和CWJI-L、CWJI-M、CWJI-H 组Nrf2(CWJI-L 组除外)、HO-1 蛋白表达量显著升高 (P<0.05);CWJI 各剂量组间上述效应呈剂量依赖性(P<0.05)。与CPT 组比较,CWJI-H 组Nrf2、HO-1 蛋白表达量显著升高(P<0.05)。见图5、表6。

图5 各组大鼠心肌组织Nrf2、HO-1 蛋白表达比较Fig.5 Comparison of the expression of Nrf2,HO-1 in myocardial tissue of rats in each group
表6 各组大鼠心肌组织Nrf2、HO-1 蛋白表达量比较(±s)Tab.6 Comparison of the expression of Nrf2,HO-1 in myocardial tissue of rats in each group(±s)

表6 各组大鼠心肌组织Nrf2、HO-1 蛋白表达量比较(±s)Tab.6 Comparison of the expression of Nrf2,HO-1 in myocardial tissue of rats in each group(±s)
注:与Sham 组比较,*P<0.05;与Model 组比较,#P<0.05;与CPT组比较,△P<0.05;与CWJI-L 组比较,▲P<0.05;与CWJI-M 组比较,&P<0.05。
?
3 讨论
CWJI 是由刺五加水醇提取物制成的一种中药注射剂,主要成分包括刺五加苷D、刺五加苷E、异嗪皮啶、咖啡酸、绿原酸等,具有较好的抗氧化、抗凋亡等药理学作用[9-10]。本研究探讨了CWJI 对HFAMI 大鼠心肌组织的影响及相关机制,结果显示,CWJI 可剂量依赖性提高 HF-AMI 大鼠LVEF、LVFS、+dp/dtmax、-dp/dtmax,提示CWJI 具有改善HF-AMI 大鼠心功能的作用,与李影雄等[11]报道相似。HE、TUNEL 染色结果显示,HF-AMI 模型大鼠心肌组织可见心肌纤维断裂,细胞空泡变性、数量减少,结缔组织增生,间质区水肿、炎性细胞浸润等病理学改变,以及大量心肌细胞凋亡,与顾峥等[12]研究结果一致;线粒体是细胞能量代谢的场所,对维持细胞生理状态及新陈代谢具有重要作用,本研究发现HF-AMI 模型大鼠心肌线粒体呈现空泡化、肿胀、破裂,嵴断裂或者减少,自噬体形成等超微结构改变,与Cheng 等[13]研究结果一致。CWJI 可剂量依赖性改善HF-AMI 大鼠心肌组织病理学改变、细胞凋亡和线粒体结构改变,并且CWJI-H 组效果优于CPT 组,提示CWJI 具有减轻 HF-AMI 大鼠心肌组织损伤的作用。
氧化应激和心肌组织纤维化是HF-AMI 发生和进行性加重的重要原因,并且心肌组织纤维化与氧化应激密切相关。AMI 发生后线粒体结构和功能受损导致氧化呼吸链电子传递受阻,致使大量活性氧簇(ROS)生成,过度消耗内源性ROS 还原性清除酶T-SOD、GSH-Px 等,导致ROS 蓄积而引发氧化应激,损伤线粒体脊结构、线粒体膜等,并破坏细胞膜、核酸、结构蛋白等引发细胞凋亡[14-15]。心室重构是HF-AMI 的病理基础,而心肌纤维化是导致心室重构的关键,血清 cTnT 水平能够敏感地反映心肌损伤程度,而Ang Ⅱ、ALD 水平能够反映心肌纤维化及心室重构状况[16]。ROS 可刺激心肌成纤维细胞向肌成纤维细胞分化,分泌大量细胞外基质(ECM)而促进心肌组织纤维化病变[17]。Nrf2 是哺乳动物细胞内广泛存在的一种核转录因子,可诱导T-SOD、GSH-Px等抗氧化酶和下游靶蛋白HO-1 转录表达,HO-1具有催化血红素降解的生理学作用,降解产物中 Fe2+、胆绿素等均具有较好的抗氧化作用,从而提高机体抗氧化能力[18-19]。本研究发现,CWJI可剂量依赖性降低HF-AMI 大鼠血清cTnI、Ang Ⅱ、ALD 水平,改善心肌组织纤维化状况,提高 T-SOD、GSH-Px 活性并降低MDA、ROS 含量,提高 Nrf2、HO-1 mRNA 和蛋白表达量,并且CWJI-H 组效果优于CPT 组,提示CWJI具有抑制HF-AMI 大鼠心肌组织纤维化和氧化应激的作用,激活Nrf2/HO-1 信号通路可能是其重要的作用机制。与纪新博等[20]报道相似。
综上,CWJI 可减轻 HF-AMI 大鼠心肌组织病变、细胞凋亡、组织纤维化和线粒体超微结构病变,改善心功能,其机制可能与激活Nrf2/HO-1 信号通路,抑制氧化应激有关。本研究结果为CWJI 作为HF-AMI 治疗备选药物提供了理论依据,但其作用机制尚需深入研究。