小球藻醇提物体外抗氧化活性及降糖作用研究
2023-12-25杨玉
杨玉
(福清市产品质量检验所,福建 福清 350300)
0 引言
小球藻作为一种绿藻,在微藻中有重要研究地位,其含有蛋白质、氨基酸、维生素、矿物质、β胡萝卜素、叶绿素、脂肪酸以及其他促进健康的物质,它被认为是21世纪功能和治疗效果的预防性营养素[1,2]。小球藻有抗炎症、抗肿瘤、降血压、抗菌、降血脂以及增强免疫力等药理活性,但其在降血糖和抗氧化的活性方面却很少被研究[3,4]。越来越多的研究显示抗氧化是预防衰老死亡的重要步骤,如果能够消除过多的氧化自由基,对于许多自由基引起的老化相关疾病都能够预防[5]。魏文志通过清除羟自由基、超氧阴离子自由基、DPPH自由基、烷基自由基、还原力等试验,测定小球藻糖蛋白的抗氧化活性。结果显示,不同浓度小球藻糖蛋白有一定的还原能力,且具有清除羟自由基、超氧阴离子自由基、DPPH自由基、烷基自由基的能力,其还原能力和清除自由基的能力与剂量有一定的效应关系[6]。Jeong等研究表明小球藻粉末的摄入可能可以改善T2DM和正常Wistar大鼠的胰岛素敏感性[7]。Wang等[8]研究发现,蛋白核小球藻多肽能够抑制人肝癌HepG2细胞活性。
近年来患有糖和脂质代谢紊乱的人数呈指数增长,逐渐成为人们担心的问题。糖脂代谢紊乱是导致肥胖、高血压、炎症、高血脂、冠心病等疾病的关键因素,因此,如何预防和治疗由糖脂代谢紊乱导致的一系列的慢性代谢综合征是人们迫切需要解决的问题。小球藻中含有的丰富的多不饱和脂肪酸,奠定了其调血压、降血脂的基础,因此能够预防动脉粥样硬化、高血脂和冠心病等多种慢性疾病[9]。之前的研究主要是围绕小球藻多糖、多肽等活性物质进行研究,本实验主要研究小球藻醇提物(CAE)的体外抗氧化、降血糖活性,为充分利用小球藻资源,开发小球藻功能性食品或医药保健品提供理论依据。
1 材料与方法
1.1 主要实验材料
DPPH购于上海阿拉丁生化科技股份有限公司;ABTS、α-葡萄糖苷酶、p-NPG购于上海源叶生物科技有限公司;阿卡波糖购于上海安耐吉化学有限公司;蛋白定量测试盒购于南京建成生物工程公司,其余试剂均为国产分析纯。
1.2 主要仪器与设备
电子天平(BSA423S)北京赛多利斯科学仪器有限公司;酶标仪(SpectraMax i3x)上海美谷分子仪器有限公司;低速台式离心机(TD5A-WS)湖南湘仪实验室仪器开发有限公司;电热恒温鼓风干燥箱(DHG-9203A)上海精宏实验设备有限公司;旋转蒸发仪(SENCO W2-100SP)上海申生科技有限公司;双频数控超声波清洗器(KQ-500VDE)昆山市超声仪器有限公司;低温恒温槽(DC-M-0506)上海衡平仪器仪表厂;数显恒温水浴锅(HH-6)常州国华电器有限公司。
1.3 试验方法
1.3.1 CAE的制备
将100 g小球藻粉末按料液比 1∶10(g/mL)溶于70%乙醇,搅拌混匀,45~50 ℃水浴超声辅助提取1 h,然后过滤,离心,取上清液,将上清液置于旋转蒸发仪在60 ℃进行减压浓缩后冻干,-20 ℃保存备用。
1.3.2 CAE成分分析
⑴ 总糖含量的测定
将烘干的葡萄糖作为对照品,准确称取0.02 g并加纯水定容至10 mL(2 mg/mL),取上述溶液1 mL加9 mL纯水使对照品溶液终浓度为0.2 mg/mL,而后按照不同稀释比配制0、10、20、50、100、200 μg/mL的葡萄糖标液。精确称取待测样品0.002 g配置成200 μg/mL的样品溶液。
上述溶液准备完毕后,分别取0.5 mL溶液于15 mL玻璃管中,加入0.5%苯酚溶液0.5 mL,再加入2.5 mL浓硫酸,混匀后置于100 ℃水浴锅中煮沸10 min,并冷却至室温。取200 μL混匀的溶液于96孔板中,在490 nm波长下测定吸光度值。以吸光度值为纵坐标,葡萄糖标液浓度为横坐标(μg/mL)绘制标准曲线,并根据样品吸光度值得到糖含量,最终计算出总糖含量。
⑵ 蛋白含量的测定
按试剂盒说明书操作,在96孔板中加入10 μL待测样品与250 μL工作液混匀,标准孔以10μL 浓度为524 μg/mL蛋白标准液代替样品,空白孔以10 μL双蒸水代替样品,置于水浴锅37 ℃水浴30 min。酶标仪562 nm波长处测定吸光值,每组设置3个平行。
总蛋白浓度(μg/mL)=[(A样品-A空白)/(A标准-A空白)]×标准品浓度×样品稀释倍数
⑶ 多酚含量的测定
参照吴晓青的方法[10]准确称取0.l g没食子酸,用50 mL蒸馏水溶解,定容至100 mL,得到质量浓度为1000 mg/L的没食子酸标准储备液,分别取标准储备液0、1.25、2.5、5、10、20、40 mL于100 mL容量瓶中,用蒸馏水定容至刻度,配制质量浓度为0、12.5、25、50、100、200、400 mg/L的系列标准溶液。
称取2 g样品,与20 mL蒸馏水混合均匀。置于离心机3000 r/min转速离心10 min后,取其上清液,稀释50倍。吸取1 mL样品液于15 mL的试管中,分别加入1 mL福林酚显色剂及3 mL 20% 的Na2CO3,混合均匀。在50 ℃水浴条件下水浴30 min,设定酶标仪波长765 nm测定吸光度。各项浓度做3个平行测定,计算平均值,根据平均值绘制标准曲线,得出吸光度值A与没食子酸标准溶液浓度之间的回归方程,计算总酚含量。
1.3.3 CAE体外活性的研究
⑴ DPPH自由基清除率
参考李倩茹的方法[11]。配制浓度分别为0.25、0.5、1.0、1.5、2.0 mg/mL的CAE水溶液,样品组在离心管中分别加入100 μL不同浓度的多糖待测液与100 μL DPPH(0.1 mmol/L,无水乙醇溶液)混合。空白组以100 μL无水乙醇代替DPPH,对照组以100 μL蒸馏水代替样品溶液作对照,混合均匀后于室温下避光30 min后,使用酶标仪在517 nm波长下测吸光度。
DPPH自由基清除能力的计算公式为:DPPH自由基清除率(%)=[1-(A样品-A空白)/A对照]×100%
⑵ ABTS自由基清除率
参考孟庆焕的方法[12]。将ABTS溶液用PBS(pH值7.4)稀释至在734 nm处吸光度为0.70±0.02。在离心管中分别加入50 μL不同浓度(0.25、0.5、1.0、1.5、2.0 mg/mL)CAE与150 μL ABTS工作液混匀,在30 ℃下水浴3 min,于酶标仪734 nm处测量其吸光度。以150 μL PBS代替ABTS工作液作为空白组,以50 μL蒸馏水代替样品作对照组。
ABTS自由基清除能力的计算公式为:
⑶ 羟自由基清除率
根据Pu的方法[13]配制浓度分别为0.1、0.2、0.3、0.4、0.5 mg/mL的CAE水溶液,样品组在离心管中分别加入500 μL不同浓度样品、500 μL FeSO4溶液(18 mmol/L)与500 μL水杨酸(10 mmol/L)混匀。在37 ℃下孵育10 min后,加入500 μL H2O2溶液(6 mmol/L)混匀,再次置于水浴锅37 ℃水浴30 min,以510 nm波长测定吸光度。空白组以1500 μL蒸馏水代替水杨酸、FeSO4溶液以及H2O2溶液,对照组以500 μL蒸馏水代替样品。
羟基自由基清除能力的计算公式为:
⑷ α-葡萄糖苷酶抑制活性的测定
配制浓度分别为6.25、12.5、25、37.5 μg/mL的多糖水溶液,CAE各取不同浓度的样品液30 μL,在37 ℃下保温5 min后,分别加入α-葡萄糖苷酶液30 μL,在37 ℃下保温10 min,然后加入30 μL p-NPG溶液反应15 min,再加入100 μL 0.1 mol/L的Na2CO3终止反应,在405 nm处测定吸光度。空白组以60 μL PBS代替酶液与p-NPG溶液,对照组以30 μL PBS代替样品。试验以相同浓度梯度的阿卡波糖作为阳性对照,重复上述操作,并设置平行。
α-葡萄糖苷酶抑制率的计算公式为:
1.4 数据处理
试验数据采用Excel进行统计分析,结果用Mean±SD表示,采用Graphpad prism 7.0.对相关数据进行作图。
2 结果与分析
2.1 总糖、蛋白、多酚含量
根据所测数据绘制CAE总糖含量标准曲线,以没食子酸浓度为横坐标,吸光度为纵坐标,进行线性回归,得标准曲线方程:y=0.0013x+0.0059,R2=0.9963。将数据代入公式计算CAE的总糖含量,得到总糖占比为9.6 %。根据所测数据绘制CAE多酚含量标准曲线,得标准曲线方程:y=0.0099x+0.0981,R2=0.9921。
将数据代入公式计算CAE的多酚含量,得到多酚占比为1.68%。将所得OD平均值代入总蛋白浓度公式,计算CAE的蛋白质含量,得到CAE的蛋白质含量为26.96%。
2.2 CAE对DPPH自由基的清除作用
DPPH自由基是一种稳定的有机自由基,常用来测定样品是否具有抗氧化活性[14]。以Vc为对照测定CAE对DPPH自由基的清除率结果如图1所示。由图1可知,CAE在3~5 mg/mL时,对DPPH自由基的清除率与提取物浓度呈剂量关系,当 CAE浓度达到5 mg/mL时,清除率达到81.86%;相同浓度Vc的清除率为94.50%。实验结果显示,在实验质量浓度范围内CAE对DPPH自由基显示出良好的清除活性。

图1 CAE和Vc的DPPH自由基清除率
2.3 CAE对ABTS自由基的清除作用
ABTS自由基经氧化会形成较为稳定的蓝绿色自由基,被普遍用于测定样品的抗氧化能力。以Vc为对照测定CAE对ABTS自由基的清除率结果如图2所示。由图2可知,CAE在3~5 mg/mL时,其对ABTS自由基的清除率与提取物浓度呈剂量关系,当 CAE浓度达到5 mg/mL时,清除率达到97.78%。实验结果显示:在实验质量浓度范围内CAE对ABTS自由基显示出良好的清除活性。

图2 CAE和Vc的ABTS自由基清除率
2.4 CAE对羟自由基的清除作用
以Vc为对照测定CAE对羟自由基的清除率结果如图3所示。由图3可知,在3~5 mg/mL时,Vc对羟自由基的清除率远远大于CAE的清除率,浓度为4.5 mg/mL时Vc最大清除率为110.83%,而小球藻提取物清除率最大值仅有12.49%。CAE对羟自由基的清除率较不理想,且与浓度无明显剂量依赖关系。

图3 CAE和Vc的羟自由基清除率
2.5 CAE抑制α-葡萄糖苷酶活性的结果
α-葡萄糖苷酶是一种糖苷水解酶,具有抑制作用靶点,可被作用于调节体内糖代谢水平,目前,阿卡波糖等α-葡萄糖苷酶抑制剂已经成为一种成熟的治疗糖尿病的药物。α-葡萄糖苷酶对碳水化合物具有消化作用,可以有效减缓人体消化过程中对碳水化合物的降解,减缓其吸收速度,从而达到降低餐后高血糖水平的目的[15]。以阿卡波糖为对照测定CAE对α-葡萄糖苷酶的抑制率结果如图4所示。由图4可知,CAE在0~25 μg/mL时,其对α-葡萄糖苷酶的抑制率与提取物浓度呈剂量关系,当 CAE浓度达到25 μg/mL时,清除率达到最大91.24%。
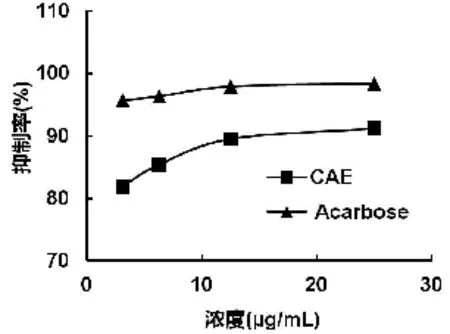
图4 CAE和阿卡波糖的α-葡萄糖苷酶抑制率
3 结论
本研究以蛋白核小球藻为原料用乙醇进行提取,结果表明小球藻醇提物(CAE)中总糖含量为38.27%,蛋白含量为26.96%,多酚含量为1.68%。当 CAE浓度为5 mg/mL时,DPPH自由基与ABTS自由基清除率分别为81.86%、97.78%;CAE对α-葡萄糖苷酶的活性有抑制作用,在0~25 μg/mL浓度范围内,其抑制率最大为91.24%。
综上所述,选用小球藻的活性物质进行提取分离,具有较高的经济效益,后续可开展CAE的体内降糖与抗衰老研究,并对CAE进行分离纯化,为CAE开发出具有抗氧化及降糖作用的功能性产品提供基础。
