GRM1通过AKT/mTOR通路调控肾细胞癌细胞的生物学行为
2023-12-25卢颖
卢 颖
复旦大学附属中山医院厦门医院,福建省厦门市 361015
肾细胞癌(Renal cell carcinoma,RCC)简称肾癌,是常见恶性肿瘤,占成人所有恶性肿瘤2%~3%,每年新增肾癌患者30万例,死亡10万例[1]。世界各地肾癌的发病率差异较大,亚洲地区发病率较低,但是近年来我国肾癌的发病率呈逐年上升趋势[2]。由于肾细胞癌对放疗、化疗均不敏感,其治疗效果较差,大约30%的患者在诊断时就发现了肿瘤转移,还有30%在治疗过程中出现了转移,转移性肾细胞癌5年生存率仅为2%,中位生存期为8个月[3-4]。有研究指出有代谢综合征的肾癌患者,其肿瘤细胞的侵袭性往往更高[5]。谷氨酸的代谢是细胞代谢中的重要组成部分,已有研究证实谷氨酸信号通路参与肿瘤的发生、进展。Pollock PM等人于2003年第一次报道了代谢型谷氨酸受体-1(GRM1)与肿瘤潜在联系[6]。Martino JJ等发现RCC中亲代谢型谷氨酸受体-1(mglur1)的表达影响肿瘤细胞的生长[7]。笔者推测GRM1可能参与RCC的发生发展,因此本研究首先分析GRM1在RCC患者肿瘤组织中的表达情况,其次通过慢病毒转染抑制RCC肿瘤细胞中GRM1的表达,观察GRM1对RCC细胞增殖、迁移、侵袭等的影响,及其可能存在的分子机制。
1 材料与方法
1.1 细胞与试剂 人肾细胞癌组织及癌旁组织标本来自我院,人肾透明细胞腺癌细胞(786-O)购自中科院上海生命科学研究院。DMEM培养基及胎牛血清来自美国 Gibco 公司。GRM1、mTOR、GAPDH抗体购自Proteintech公司。LY404039和SC79购自Selleck公司。转染试剂盒、实时荧光定量PCR试剂盒、CCK-8试剂盒、即用型SP免疫组化试剂盒、Annexin V-FITC/PI双染试剂盒购自北京索莱宝科技有限公司。Transwell小室及基质胶购自美国Corning公司。
1.2 细胞培养与转染 在无菌超净台中,将786-O细胞接种在含10% FBS和DMEM的培养皿,37℃、5%CO2的恒温培养箱培养。细胞以4×105/ml密度接种于6孔板,当细胞密度融合到70%~80%时,根据转染试剂盒说明进行转染,分为对照序列sh-NC和3组干扰序列shGRM1-1、shGRM1-2和shGRM1-3,并检测转染效率。sh-NC为非目标基因干扰序列,自身无功能,用以排除转染过程本身对细胞的影响。3组干扰序列相同,重复实验以减少误差。
1.3 细胞分组 抑制GRM1影响786-O细胞生物行为的实验分为对照组“786-O组”(即非干预状态),沉默基因对照组“786-O-shNC组”(即转染对照序列sh-NC,为无功能性非目标基因干扰序列,下文简称“shNC组”),GRM1沉默基因组“786-O-shGRM1组”(即转染干扰序列shGRM1后细胞不表达GRM1,下文简称“shGRM1组”)和GRM1抑制剂组“786-O+LY404039组”(即通过GRM1抑制剂LY404039抑制786-O细胞表达GRM1,下文简称“LY404039组”)。相关机制研究实验分为“786-O-shGRM1组”(同前所述),使用AKT激活剂组“786-O-shGRM1+SC79组”(即AKT激活剂SC79作用于经转染后GRM1被沉默的细胞,下文简称shGRM1+SC79组)和“786-O+LY404039+SC79组”(即AKT激活剂SC79作用于GRM1被抑制剂LY404039所影响的细胞)。
1.4 免疫组化染色 组织经固定、石蜡包埋、切片后,根据免疫组化试剂盒说明书步骤进行染色,DAB显色,脱水,透明,中性树胶封固。
1.5 RT-qPCR 肿瘤组织及各组细胞中的总RNA用Trizol试剂提取,且依实时荧光定量PCR试剂盒逆转录为cDNA,再进行qPCR。荧光定量计算循环数(Cycle threshold,CT),并绘制标准曲线,使用2-ΔΔCT方法进行定量计算。
1.6 蛋白质印迹技术(Western blot,WB) 裂解细胞提取总蛋白后将样本等量上样至SDS-PAGE凝胶,蛋白经电泳分离后恒流转至PVDF膜,5%脱脂乳粉封闭后加入一抗震荡孵育过夜,用TBST漂洗后室温震荡孵育二抗,经ECL试剂盒显色后通过使用凝胶成像分析仪扫描计算灰度值。
1.7 CCK-8 将各组细胞分别接种于96孔板(1×105/孔),每组至少设置6个重复孔。37℃恒温培养箱孵育,每孔加入10μl CCK-8 (0.5g/L)溶液培养4 h,测定各孔细胞在波长450nm处的光密度(Optical density,OD)值。
1.8 流式细胞术 对数生长期细胞经细胞筛过滤及PBS洗涤后,取1×105个细胞经预冷75%乙醇4℃过夜处理后加入5μl PI染色液,避光混匀,流式细胞仪检测周期变化。取2×105个细胞经Binding buffer混悬后加入5μl FITC-AnnexinV和5μl PI,避光温育,流式细胞仪检测凋亡细胞的百分比。
1.9 Transwell染色 Transwell小室的上室接种细胞(1×105个/孔,无血清培养基),下室加入完全培养基(含10%胎牛血清),孵育48h后分别经4%多聚甲醛固定和0.1%结晶紫染色后,拍照并计数统计以检测细胞迁移能力。Martrigel基质胶平铺于Transwell上室后温育。小室的上室接种细胞(1×105个/孔,无血清培养基),下室加入完全培养基(含10%胎牛血清)。孵育48h,PBS清洗去除未穿膜的细胞,4%多聚甲醛固定和0.1%结晶紫染色后,拍照并计数统计以检测细胞侵袭能力。
1.10 统计学方法 统计软件SPSS22.0用于数据分析,数据以(Mean±SD)表示,两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 GRM1在RCC肿瘤组织中高表达 RT-qPCR检测RCC组织中GRM1的表达水平(见图1a),与癌旁组织比较,RCC患者的肿瘤组织中GRM1 mRNA表达水平显著上升(P<0.05)。免疫组化染色检测GRM1蛋白的表达水平(见图1b),与癌旁组织比较,GRM1蛋白在RCC患者肿瘤组织中呈明显阳性表达。这些结果表明GRM1在RCC肿瘤中高表达,提示GRM1与RCC的发生发展存在一定的关系。
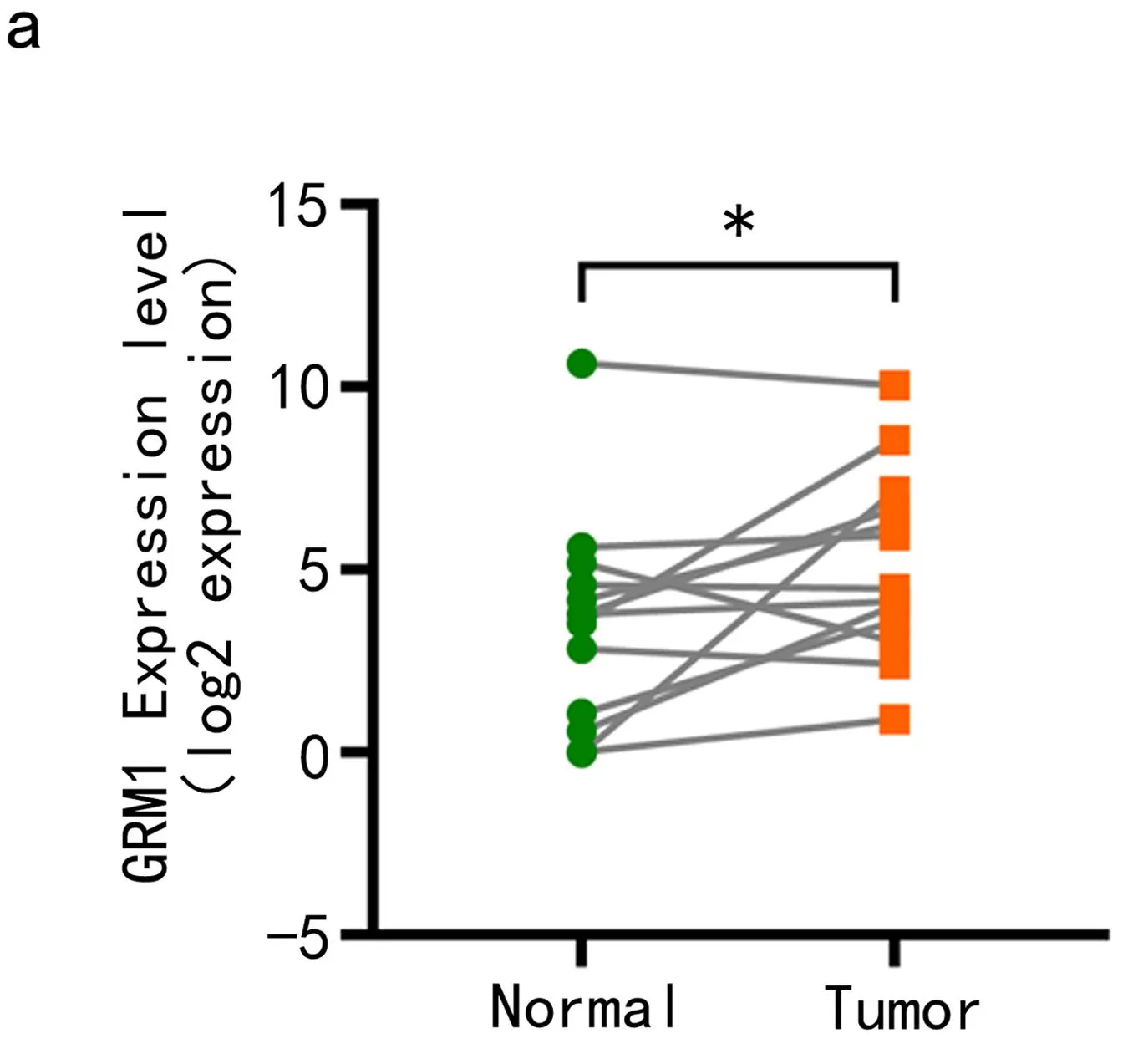
图1 GRM1在RCC肿瘤组织中的表达情况
2.2 构建GRM1沉默的RCC肿瘤细胞株 与对照786-O-shNC组比较,荧光显微镜观察到786-shGRM1-1、786-shGRM1-2和786-shGRM1-3各转染组的荧光强度均减弱(见图2a),RT-qPCR检测到各转染组细胞中GRM1 mRNA水平均降低(均P<0.01,见图2b),WB检测各转染组细胞中GRM1蛋白水平均降低(均P<0.01,见图2c)。这些结果表明成功构建786-O-shGRM1稳转细胞系。
2.3 抑制GRM1影响RCC肿瘤细胞的生物学行为 与对照786-O组比较,786-O-shGRM1组和786-O+LY404039组的细胞活力均下降(P<0.01,见图3),细胞周期受阻断(P<0.01,见图4),且细胞凋亡比例增加(P<0.01,见图5),细胞迁移和细胞侵袭均受抑制(P<0.01,见图6~7)。这些结果说明抑制GRM1能够抑制RCC肿瘤细胞的增殖、迁移、侵袭,促进RCC肿瘤细胞的凋亡。
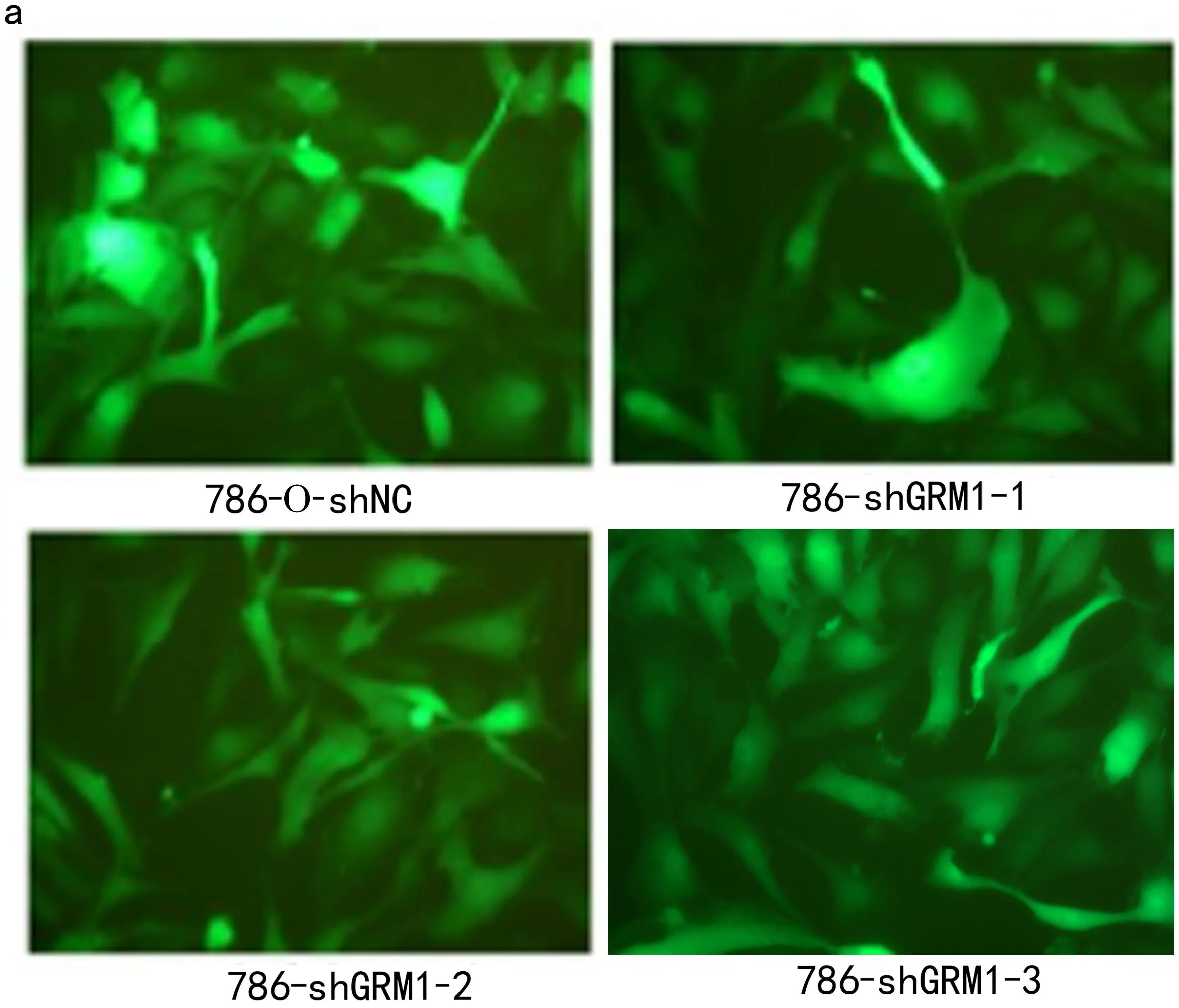
图2 shGRM1通过慢病毒系统构建的稳转786-O细胞系的干扰效率检测
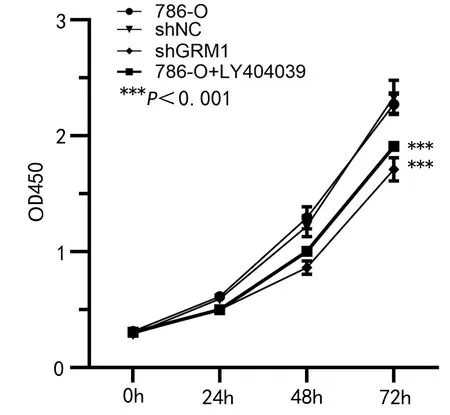
图3 CCK-8检测细胞的活力
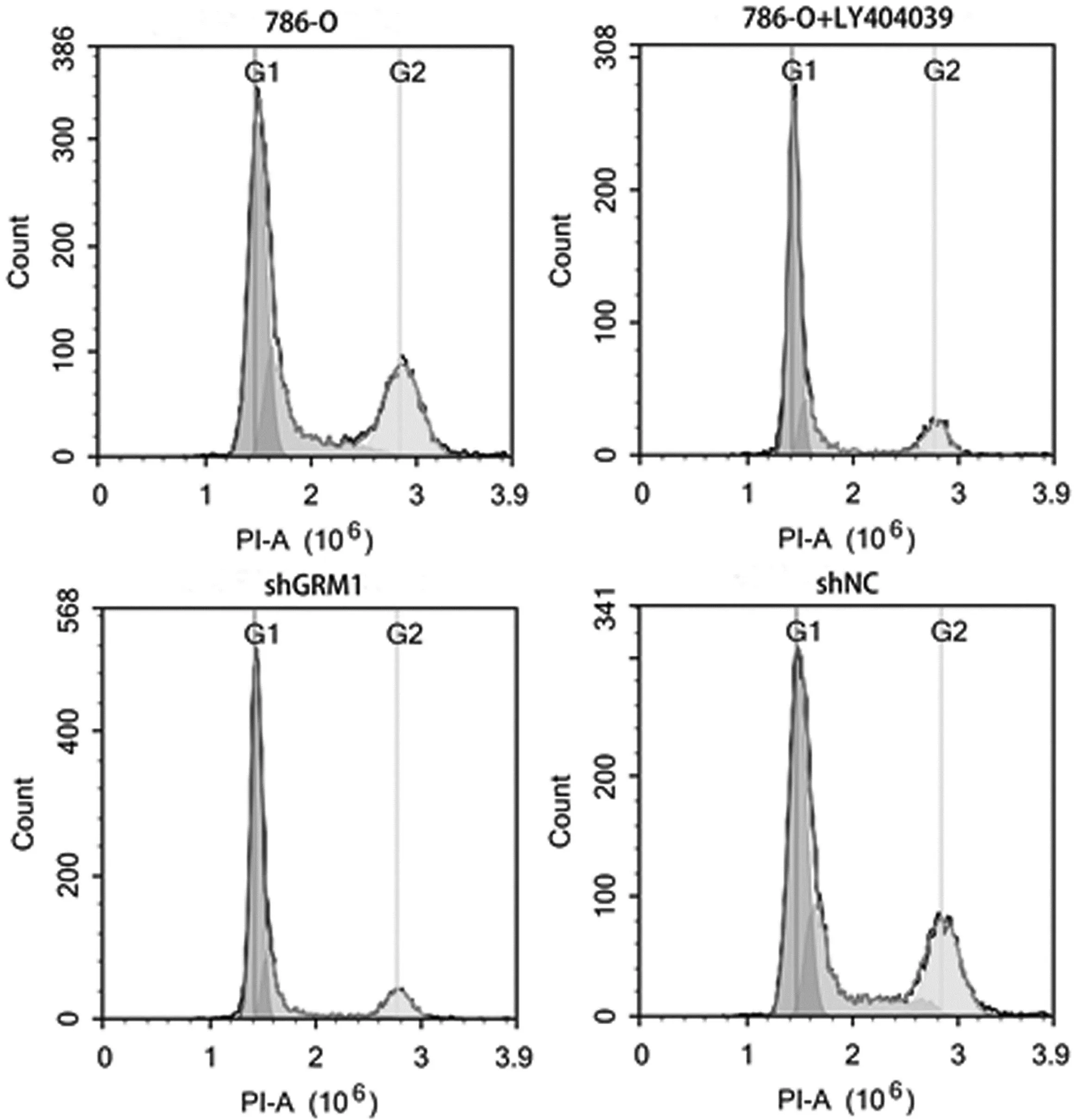
图4 流式细胞术检测细胞的周期
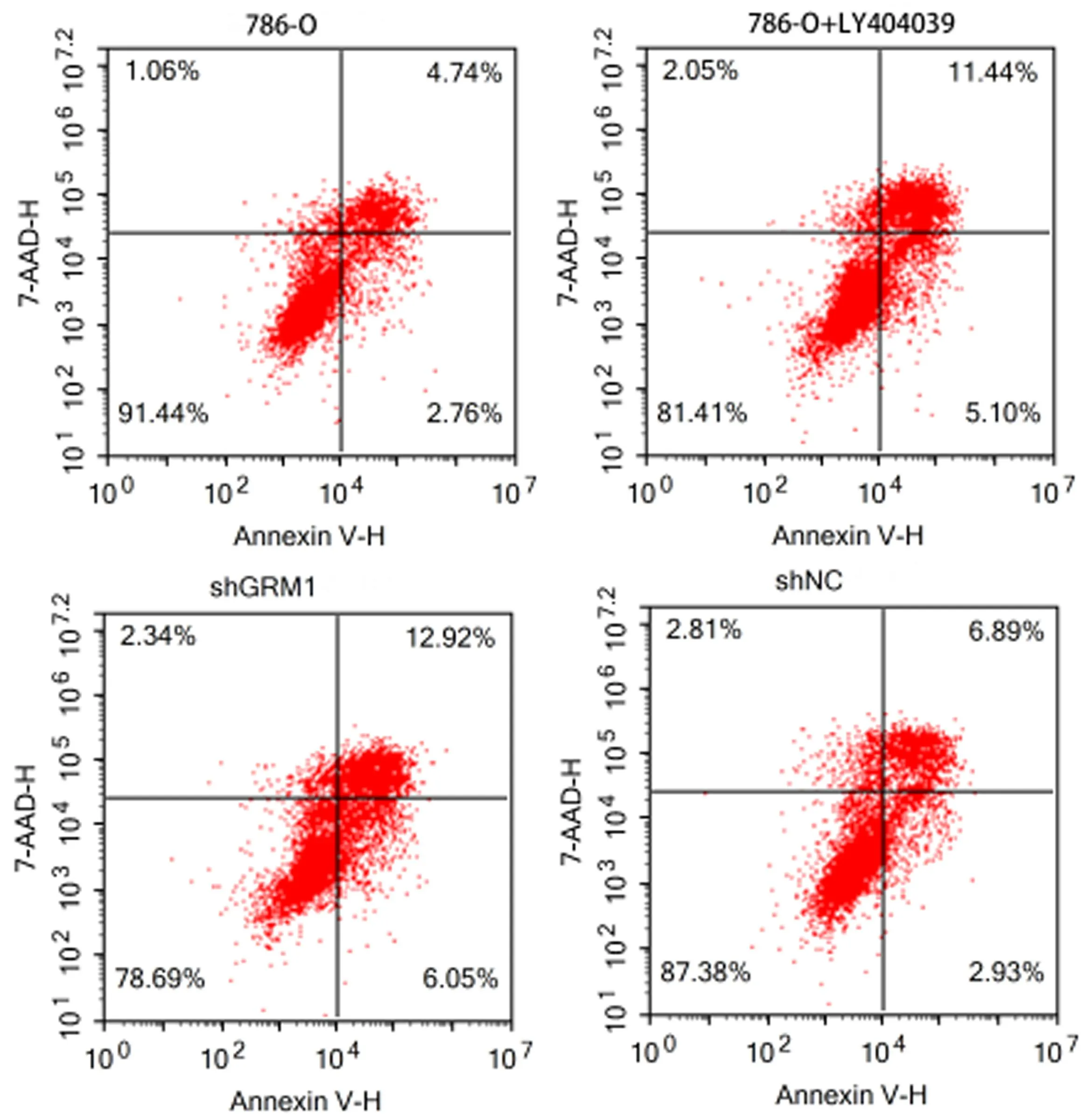
图5 流式细胞术检测细胞的凋亡
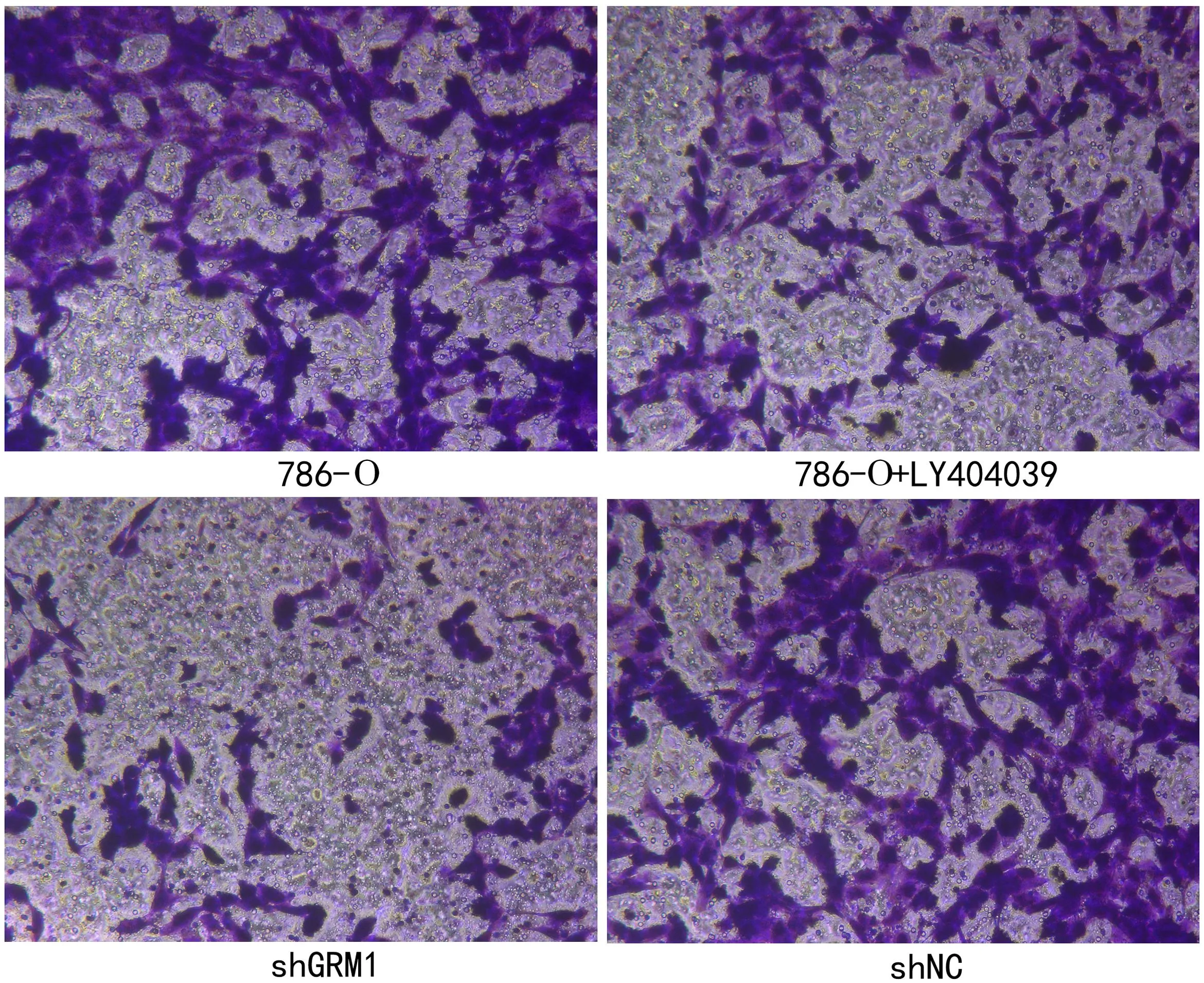
图6 Transwell检测细胞的迁移
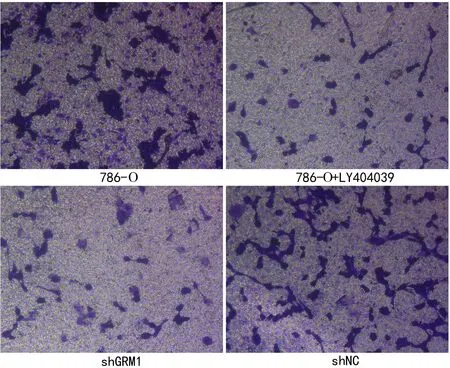
图7 Transwell检测细胞的侵袭
2.4 GRM1通过AKT/mTOR通路影响RCC肿瘤 细胞的生物学行为 为了探讨GRM1的作用机制,本节使用AKT激活剂(SC79)对细胞进行处理,观察各组细胞的生物学行为变化。与对照786-O-shGRM1组比较,使用AKT激活剂后,786-O-shGRM1+SC79组和786-O+LY404039+SC79组细胞活力均增强(P<0.01,见图8),且细胞中mTOR表达量升高(P<0.01,见图9),同时,G0/G1期的细胞比例降低(P<0.01,见图10),且细胞凋亡比例降低(P<0.01,见图11),细胞迁移增强(P<0.01,见图12),细胞侵袭增强(P<0.01,见图13),这些结果说明抑制GRM1可能通过AKT/mTOR途径影响RCC肿瘤细胞的增殖、迁移、侵袭和凋亡。
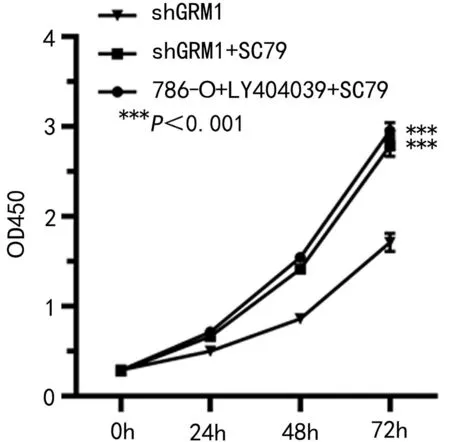
图8 CCK-8检测细胞的活力

图9 WB检测细胞mTOR蛋白的表达
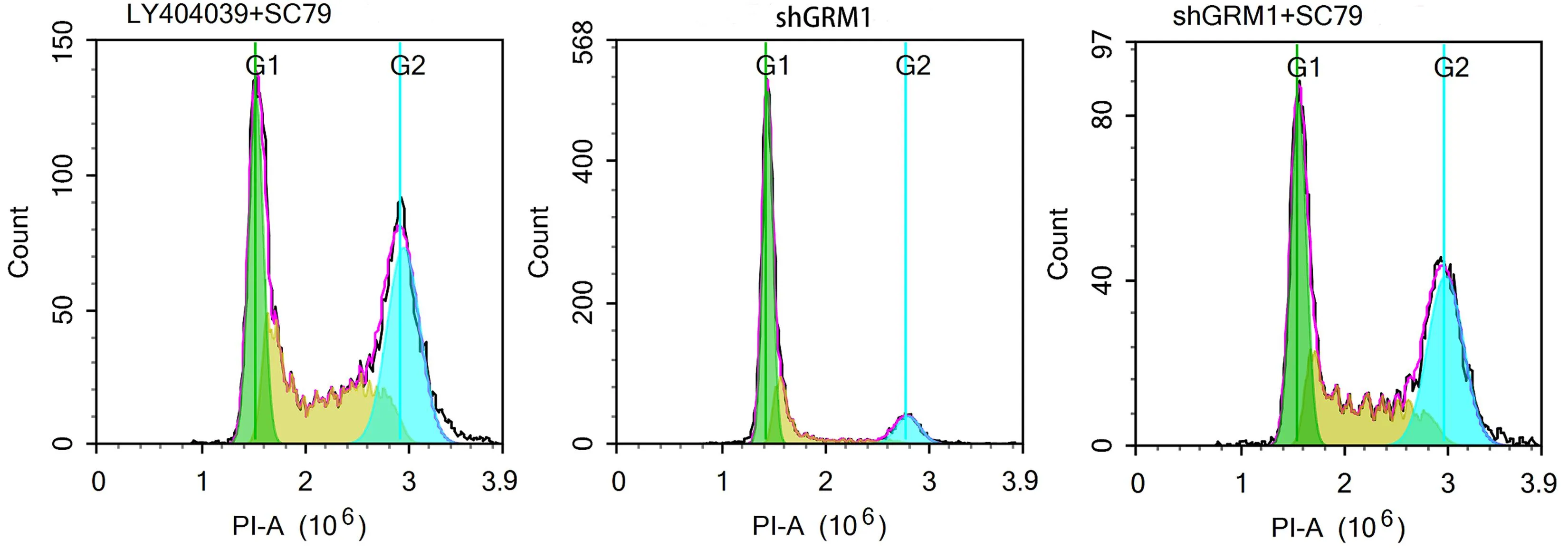
图10 流式细胞术检测细胞的周期
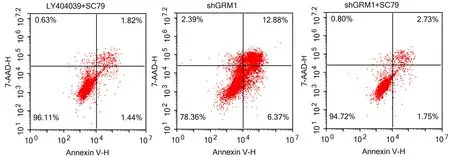
图11 流式细胞术检测细胞的凋亡
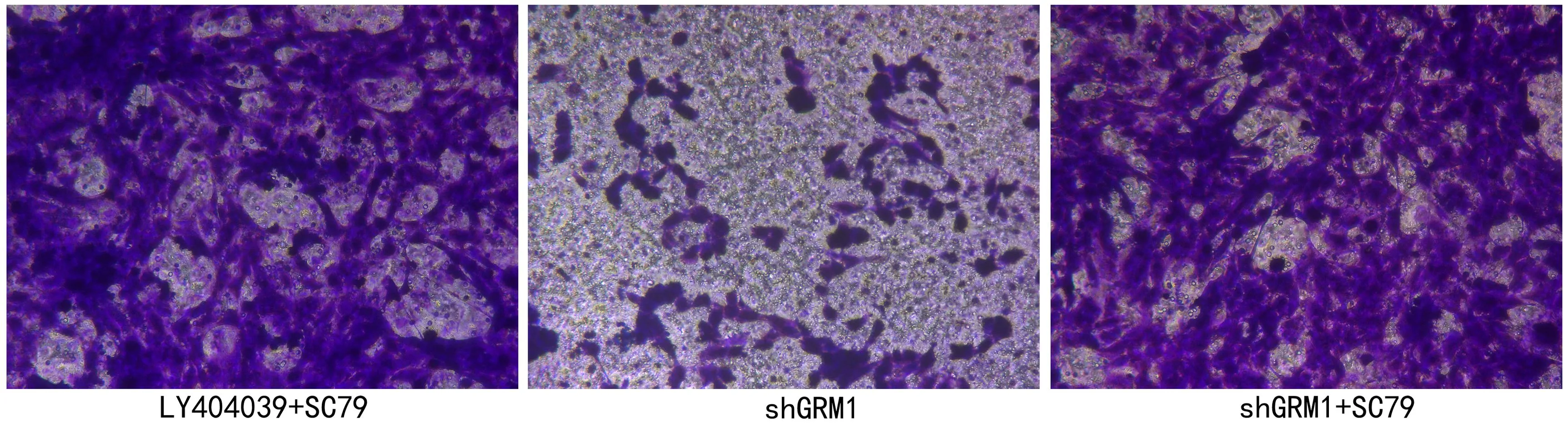
图12 Transwell检测细胞的迁移
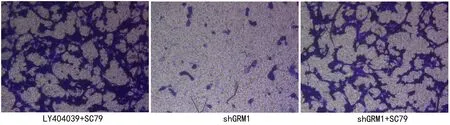
图13 Transwell检测细胞的侵袭
3 讨论
RCC发病率上升与肥胖、高血压、吸烟、暴露等危险因素相关[8]。外科手术治疗仍是目前RCC的最终治疗方法,但是术后复发或转移率高,且对放化疗不敏感[9-10]。对于晚期肾癌,分子靶向药物的治疗效果较好,已成为晚期肾癌的一线治疗药物[11]。但是靶向药物耐药仍是一个比较常见及棘手的问题,所以研究RCC的发病机制,探讨新的治疗方法具有重要意义。
有学者提出RCC拥有一个独立的代谢系统,其可能是一种代谢性疾病[12-13]。谷氨酸的代谢属于细胞代谢中的重要组成部分,谷氨酸受体家族已经被证实在肿瘤细胞分化、肿瘤进展、诊断及治疗中具有一定的价值。其中,代谢型谷氨酸受体-1(GRM1)失调会增加黑色素瘤的发生,GRM1可能是乳腺癌抗血管生成的治疗靶点,GRM1与结节硬化症患者室管膜下巨细胞瘤的发生有关[6,14-15]。Kalariti N等人也通过PCR技术证明GRM1相关mRNA在骨肉瘤细胞中过度表达[16]。也有文献报道GRM1在前列腺癌细胞株PC-3和LNCaP过度表达[17]。本研究通过对13例临床RCC肿瘤标本进行检测,结果显示GRM1在RCC肿瘤中高表达,提示GRM1可能与RCC的发生发展有关联。
磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路是细胞内的重要信号转导通路,在多种肿瘤的发生、发展中发挥着重要作用。PI3K/AKT信号通路在肾癌中适度突变,但高度活化。活化的AKT可以使大量的底物磷酸化,从而参与细胞病理及生理功能的各个方面,包括细胞生长、代谢及肿瘤发生及转移[18-19]。在肾癌中PI3K/AKT信号通路与VHL/HIF信号通路在大型信号网络中广泛交叉,促进了肾癌的发生发展。首先由于VHL丢失导致HIF上调,促进了多种生长因子的表达[20]。这些生长因子又反过来激活PI3K/AKT信号通路,从而激活mTOR然后促进HIF的表达,从而形成正循环[21]。已有文献报道GRM1通过PI3K/AKT信号通路调节了黑色素瘤的生长及发展,并且在此文献中使用利鲁唑(GRM1信号传导抑制剂)的黑色素瘤细胞中血管生长标记物及PI3K/AKT的下调[22]。本研究通过siRNA技术抑制GRM1在肾细胞癌细胞中的表达,结果发现抑制GRM1表达后能够显著抑制肿瘤细胞的增殖,阻断细胞周期的G0/G1期,增强细胞凋亡,抑制细胞迁移和侵袭。使用GRM1抑制剂LY404039处理肿瘤细胞,与基因沉默GRM1具有一致的效果。GRM1敲除细胞后,使用AKT激活剂SC79能够逆转GRM1受抑制而产生的一系列生物学行为,提示抑制GRM1影响肾细胞癌细胞生物学行为可能通过AKT介导。进一步对AKT下游蛋白mTOR进行检测发现抑制GRM1后mTOR的表达显著降低,AKT激活剂处理能够有效逆转mTOR的低表达。
综上所述,本研究明确了GRM1在肾细胞癌中高表达,通过抑制GRM1能够抑制肾细胞癌细胞的增殖、迁移和侵袭,促进肿瘤细胞的凋亡,且AKT/mTOR参与了该过程。当然,本研究仅对786-O细胞进行了生物学行为研究,后续还需在其他人肾癌细胞系中进行验证,并行动物实验以更深刻地理解GRM1在肾癌发生、发展的过程中所起到的作用。
