雷公藤红素治疗非酒精性脂肪性肝病的研究进展
2023-12-25王四园刘成海陶艳艳
王四园 王 帆 孙 鑫 刘成海,,3 陶艳艳,,3△
1.上海中医药大学附属曙光医院肝病研究所 (上海, 201203) 2.上海市中医临床重点实验室 3.肝肾疾病病证教育部重点实验室(上海中医药大学)
雷公藤红素又名南蛇藤素,为雷公藤根茎的提取物——去甲基木栓烷型三萜类化合物。据报道雷公藤红素有一定肝毒性[1],而更多研究证实其对肝脏具有保护作用,可减轻肝脏炎症[2]、肝损伤[3]和肝纤维化[4],尤其对非酒精性脂肪性肝病(NAFLD)具有治疗作用。NAFLD指除酒精和其他明确肝损害因素外,以肝细胞脂肪变性为主要特征的临床病理综合征,可分为单纯性肝脂肪变和非酒精性脂肪性肝炎(NASH)[5],其发病关键在于高碳水化合物和脂肪酸在代谢过程中产生的脂毒性物质超过肝细胞处理能力,引起肝细胞应激、损伤和/或死亡,出现肝损伤、肝硬化甚至是肝癌[6]。有研究证实雷公藤红素可直接影响脂质合成、炎症或间接改善肥胖和胰岛素抵抗而发挥治疗NAFLD作用。本文综述雷公藤红素对NAFLD治疗作用进展,以期为雷公藤红素治疗NAFLD药物研发提供可能思路。
1 NAFLD发病机制
1.1 参与脂质合成 NAFLD肝组织沉积脂质主要以甘油三酯形式存在,其合成原料59%来源于脂肪组织的脂解作用,26%来源于脂质新生,15%则直接来自于食物[7],其中脂质新生主要受固醇调节元件结合蛋白1c(SREBP-1c)调控。SREBP-1c可控制脂质生成基因的表达,参与肝脏中脂肪酸和甘油三酯的合成[8];合成的甘油三酯以脂滴形式储存于肝细胞内或以极低密度脂蛋白形式向肝外输出,而当脂滴合成过多或输出障碍时便会导致脂质蓄积。研究证实雷公藤红素在肝脏和原代肝细胞中均可通过增加沉默交配型信息调节因子2同源蛋白1(SIRT1)表达,而使SREBP-1c及乙酰辅酶A羧化酶水平降低,以改善肝细胞脂滴堆积和气球样变[9]。但是有研究表明雷公藤红素可通过降低转录因子过氧化物酶体增殖物激活受体γ2(PPARγ2)及CCAAT增强子结合蛋白α(C/EBPα)表达而抑制脂肪细胞分化,增加脂解[10],而脂解无疑会增加甘油三酯合成。
1.2 抑制未折叠蛋白反应 游离脂肪酸(FFA)增加与NAFLD发病密切相关,FFA可经线粒体β氧化消耗或酯化为甘油三酯以脂滴形式储存于肝细胞,脂滴则可再脂解为脂肪酸释放回肝细胞的游离脂肪酸池。反复进行的线粒体β氧化和再脂解使脂毒性物质积累,引起内质网应激,激活未折叠蛋白反应(UPR),以维持肝细胞正常生理活动,但当持续刺激超过代偿后便会诱导炎症和细胞死亡,使NAFLD加重[11]。UPR激活主要涉及需肌醇酶1(IRE1)、活化转录因子6(ATF6)和蛋白激酶R样内质网激酶(PERK)3条通路,在非应激条件下IRE1、ATF6及PERK与葡萄糖调节蛋白78(GRP78)结合而呈失活状态[12],可见GRP78是UPR的关键分子。研究证实雷公藤红素可有效降低高脂肪饮食诱导肥胖小鼠的体重,其机制可能是雷公藤红素维持了GRP78与IRE1及ATF6的结合,从而抑制内质网应激[13]。
1.3 对抗炎症 内质网应激伴FFA聚集及细胞死亡可激活核因子κB(NF-κB),引起炎症因子释放,而使NAFLD发展为NASH[14]。临床研究显示,约1/3的NASH患者在初诊后5~10年会发展为3期或4期肝纤维化[15],因此阻断甚至消除炎症对NASH的治疗极为重要。NF-κB家族是沟通炎症反应上下游的重要因子,它们可在内、外源性刺激下形成不同形式的二聚体,经翻译后修饰进入细胞核,在核内单独或联合其他转录因子,诱导靶基因表达,产生多种细胞因子,发挥生物学效应[16]。研究证实雷公藤红素可抑制NAFLD小鼠SIRT1表达而使NF-κB及下游炎症因子水平下调[9]。另外在高脂饮食联合链脲佐菌素诱导2型糖尿病的模型中,雷公藤红素通过抑制Toll样受体4(TLR4)/髓样分化因子88(MyD88)/NF-κB通路及炎症因子(TNFα、IL-1β)释放,而改善肝组织的炎症细胞浸润、脂肪变性及纤维化[17]。在HepG2细胞中也证实雷公藤红素可通过抑制TLR4/MyD88/NF-κB通路而使TNFα和IL-1β表达下降[18]。见图1。

图1 NAFLD发病机制及雷公藤红素作用靶点
2 改善NAFLD相关风险因素
2.1 减轻体重 荟萃分析表明肥胖者患NAFLD的风险是正常体重者的3.5倍[19]。人口学研究显示在严重肥胖者(BMI≥40 kg/m2)和病态肥胖者[BMI≥40 kg/m2或≥35 kg/m2和至少一种严重肥胖相关的医疗并发症(如高血压、2型糖尿病、睡眠呼吸暂停综合征等)]中NAFLD发病率更是高达88.7%和93%[20,21]。肥胖者脂肪细胞的功能障碍、脂解加速,导致血液中FFA增加,这时肝细胞以甘油三酯的形式储存增多的脂质,从而发生NAFLD[22]。两项临床试验证实成年和儿童NAFLD患者在通过节食和锻炼减肥后,其肝细胞脂肪变性、炎症和损伤均得到改善[23,24]。由此可见减轻体重对肥胖型NAFLD患者而言至关重要。
2.1.1 改善瘦素抵抗 瘦素是由白色脂肪组织的脂肪细胞合成和分泌的一种多肽类激素,正常情况下与下丘脑瘦素受体结合,影响下游阿黑皮素原及神经肽Y/刺鼠关联蛋白,减少食物摄入量,增加能量消耗[25]。那么是瘦素缺乏导致了肥胖呢?恰好相反,研究发现大多数肥胖者的瘦素循环水平要高于非肥胖者[26],这表明机体处于瘦素抵抗状态,若增加瘦素敏感性,从而改善肥胖。有研究证实雷公藤红素是一种强效瘦素增敏剂,可增加肥胖及高瘦素血症小鼠下丘脑中信号传导与转录激活因子3(STAT3)磷酸化水平,同时抑制下丘脑内质网应激,而使小鼠体重下降最多达45%,但对瘦小鼠、ob/ob小鼠和db/db小鼠却无效[27]。进一步对喂食雷公藤红素后的肥胖小鼠、瘦小鼠和db/db小鼠的下丘脑转录组分析表明其提升瘦素敏感性需要白介素-1受体1(IL1R1)参与[28]。另外研究发现下丘脑弓状核中的蛋白酪氨酸磷酸酶1B(PTP1B)和T细胞蛋白酪氨酸磷酸酶(TCPTP)具有负调节瘦素信号的作用,而雷公藤红素可通过抑制PTP1B和TCPTP表达而发挥减重效果[29]。
2.1.2 平衡能量代谢 肥胖者能量摄入与能量消耗的失衡导致肝细胞内脂质堆积,故增加能量消耗有可能改善肥胖。过氧化物酶体增殖物激活受体γ共激活因子1(PGC-1)是线粒体功能和氧化代谢的主要调节因子,与体内能量代谢关系密切[30]。研究表明雷公藤红素可通过热休克因子1激活PGC-1α,而诱导腹股沟白色脂肪组织褐变,激活棕色脂肪组织,增加脂肪和肌肉中的线粒体功能,引起能量消耗增加,以此改善小鼠肥胖和肝脂肪变性[31]。甘丙肽是一种神经肽,作用于甘丙肽受体后可降低交感系统活性及解耦联蛋白1(UCP-1)表达,增加胃肠动力,加速肌肉对碳水化合物的利用,减少能量消耗及产热,从而引起肥胖[32]。研究表明雷公藤红素可使肥胖小鼠体重下降,食物摄入量减少,这可能与下调下丘脑中甘丙肽和甘丙肽受体1、3的表达有关[33]。
2.1.3 其他 雷公藤红素的抗炎作用可能改善肥胖,有研究将雷公藤红素确定为抗炎蛋白Nur77的配体,其可促进Nur77从细胞核迁移到线粒体内被肿瘤坏死因子受体相关因子2泛素化;泛素化的Nur77促使功能失调的线粒体自噬并减轻炎症,从而显著减轻高脂饮食诱导肥胖小鼠的体重,并改善肝脂肪变[2]。另外雷公藤红素还可通过抑制Toll样受体3/NOD样受体热蛋白结构域相关蛋白3依赖性炎症体激活途径,促进棕色脂肪组织产热,腹股沟白色脂肪组织褐变,改善代谢紊乱,以减轻因高脂饮食诱导肥胖小鼠的体重[34]。见图2。

图2 雷公藤红素改善肥胖机制
2.2 改善胰岛素抵抗 胰岛素抵抗时靶器官对循环胰岛素缺乏反应,使抑制脂解能力受损,糖原合成减少,使游离葡萄糖和FFA增多,两者均可转化为甘油三酯储存于肝细胞而发生脂肪变性,进一步引起线粒体功能失调和脂肪组织释放细胞因子,导致非酒精性肝炎的发生[35]。在NAFLD中,脂毒性物质、氧化应激及炎症因子等通过不同途径使胰岛素受体底物(IRS)丝氨酸磷酸化,抑制下游磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)通路,进一步加剧胰岛素抵抗[36]。研究表明雷公藤红素可抑制NF-κB通路而改善db/db小鼠的胰岛素抵抗[37],这可能与雷公藤红素干扰脂质与髓样分化蛋白2的结合而抑制TLR4/NF-κB通路有关[38]。此外雷公藤红素可逆转不同细胞的胰岛素抵抗,在肝细胞中雷公藤红素通过抑制NF-κB和c-Jun氨基末端激酶(JNK),恢复线粒体功能,降低胰岛素受体底物丝氨酸磷酸化水平,改善棕榈酸引起的胰岛素抵抗[39]。在HepG2细胞中雷公藤红素通过增加microRNA-223表达,逆转胰岛素受体底物的下调,改善棕榈酸诱导的胰岛素抵抗[40]。在骨骼肌细胞中雷公藤红素通过激活PI3K/AKT通路,增加葡萄糖摄取及线粒体活性,改善抗霉素A诱导的胰岛素抵抗[41]。见图3。
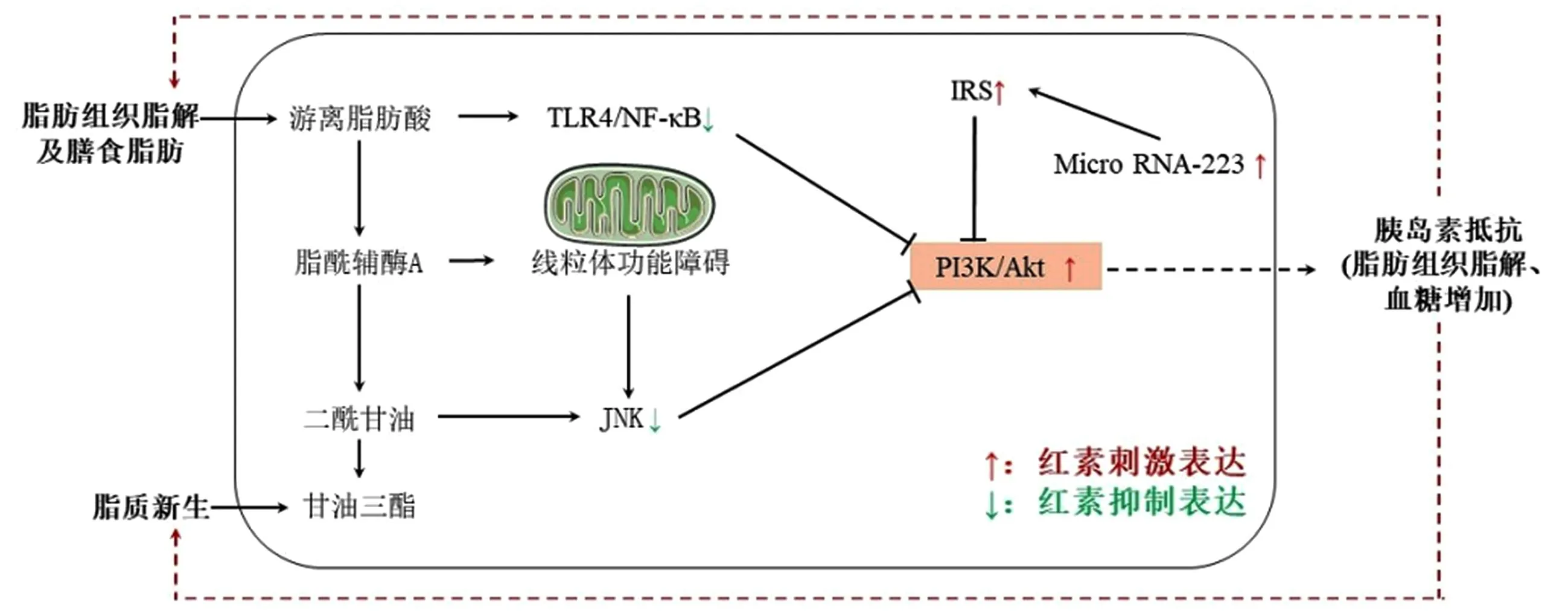
图3 雷公藤红素改善胰岛素抵抗机制
3 结论及展望
上述研究提示雷公藤红素对NAFLD具有潜在治疗效应,但缺乏相关临床研究,且雷公藤红素治疗NAFLD的作用机制有待深入开展。此外,在大鼠中雷公藤红素的口服生物利用度为17.06%[42],并可能出现生殖毒性[43]和心脏毒性[44]等毒副作用,很大程度限制雷公藤红素的开发与应用。纳米给药系统的发展可能为雷公藤红素应用提供解决方法,已有学者采用雷公藤红素-白蛋白纳米颗粒给药发挥出更好的肝脏靶向释放和NAFLD治疗效果[45],这为雷公藤红素的开发利用提供了可能性。
