猪传染性胸膜肺炎病例报告
2023-12-23李瑜祥魏唐婷胡秀花苏瑞景王少林许建海胡艳欣
李瑜祥 , 魏唐婷 , 胡秀花 , 苏瑞景 , 王少林 , 许建海 , 孟 迪 , 胡艳欣
(1.中国农业大学动物医学院 , 北京 海淀 100193 ; 2.福清市畜牧兽医中心 , 福建 福清 350300)
2020年12月,某猪场个别育肥猪突然出现了体温升高、呼吸窘迫等症状,用抗生素盐酸林可霉素、复方新诺明和链霉素等治疗后没有好转并且症状持续恶化,几天后病猪死亡,对其进行了大体剖检和病料采集。根据流行病学、临床症状和大体病变,疑似该猪患有猪传染性胸膜肺炎(Porcine contagious pleuropneumoniae,PCP)。为了进一步确诊是否为PCP,并深入探讨该病的病理变化特点,进行了后续的实验室检测和组织病理学分析。
1 材料与方法
1.1 病料来源 病猪死亡后立即进行大体剖检和取材。无菌采集病死猪的心脏、肝脏、脾脏、肺脏、肾脏、淋巴结、血液和胸腔积液。将收集的病料分为两部分,一部分先用液氮保存,后移至实验室-80 ℃冰箱中冷冻保存,待进行细菌分离和鉴定,另一部分固定在4%甲醛溶液中待制作石蜡切片。
1.2 主要试剂 胰蛋白胨大豆琼脂(Tryptone soybean agar,TSA)培养基和胰蛋白胨大豆肉汤(Tryptone soybean broth,TSB)培养基,均购自绍兴天恒生物科技有限公司;辅酶Ⅰ(Nicotinamide adenine dinucleotide,NAD),购自生工生物工程(上海)股份有限公司;胎牛血清和PCR试剂盒,均购自北京索莱宝科技有限公司;革兰染色试剂盒,购自北京中杉金桥生物公司;4%甲醛固定液,由实验室自行配置。
1.3 主要仪器 基质辅助激光解吸电离飞行时间质谱仪,赛默飞世尔科技公司产品;PCR仪,Applied Biosystems产品;光学显微镜,Olympus corporation产品。
1.4 试验方法
1.4.1 细菌分离培养 利用消毒后的接种环无菌采集病料,将每份病料分别划线接种于TSA培养基(含5%胎牛血清和0.01% NAD),在37 ℃条件下培养24 h,之后挑取TSA培养基上的单个菌落进行划线培养,纯化2次后观察平皿上的菌落形态,根据说明书操作对纯化后的菌株进行革兰染色镜检。将划线培养的单菌落接种于TSB培养基(含5%胎中血清和0.01%NAD),振荡培养12 h,留样备用。
1.4.2 细菌分子生物学和血清型鉴定 利用质谱分析和PCR进行细菌鉴定。按照基质辅助激光解吸电离飞行时间质谱仪手册说明进行操作,将每份病料纯化后的单个菌落加入样品孔中进行检测。该系统首先识别分子量为2~20 kDa的图谱,之后采集图谱进行分析。根据结果与仪器数据库内的参考图谱进行比对,依据匹配程度来判断菌株种类。
利用水煮模板法提取细菌DNA,设计并合成用于鉴定胸膜肺炎放线杆菌(Actinobczcilluspleuropeu-monicze,APP)16S rDNA的引物,上游引物:5′-GTG-GCACTGACGGTGATGAT-3′,下游引物:5′-GGCCA-TCGACTCAACCAT-3′,目标片段大小377 bp。鉴定APP血清型分型所要使用的引物序列见表1,引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系(25 μL):2×TaqMaster Mix 12.5 μL,ddH2O 9.5 μL,上、下游引物各1 μL,DNA模板1 μL。16S rDNA PCR反应程序:95 ℃预变性5 min;95 ℃变性 30 s,56 ℃ 退火30 s,72 ℃延伸 30 s,进行35个循环;72 ℃延伸10 min。1、2、3、5和7型APP反应程序:95 ℃预变性5 min;95 ℃变性 50 s,62 ℃ 退火50 s,72 ℃延伸1 min 30 s,进行35个循环;72 ℃延伸10 min。8型APP反应程序:95 ℃预变性5 min;95 ℃变性 50 s,60 ℃ 退火50 s,72 ℃延伸1 min 30 s,进行35个循环;72 ℃延伸10 min。15型APP反应程序:95 ℃预变性5 min;95 ℃变性 30 s,61 ℃ 退火1 min 30 s,72 ℃延伸2 min,进行25个循环;68 ℃延伸15 min。PCR产物经1%琼脂糖凝胶电泳,将扩增出阳性条带的PCR产物送北京诺赛基因组研究中心有限公司进行测序并比对。

表1 猪胸膜肺炎放线杆菌血清型鉴定引物Table 1 Primer of serotype identification of Actinobacillus pleuropneumoniae
1.4.3 组织病理学分析 将所采集的组织样品在4%甲醛溶液中固定48 h,对样品进行修块、脱水,常规石蜡包埋,制备的石蜡切片厚度为3~4 μm,利用自动染色机完成苏木精-伊红(Hematoxylin-eosin,H.E.)染色,在光学显微镜下进行观察并采集病变典型的图片。
2 结果
2.1 临床症状和剖检病理变化 病猪表现精神沉郁、体温升高(41~42 ℃)、咳嗽和呼吸困难,鼻内流出血色样泡沫分泌物等症状。剖检发现胸腔有大量积液(图1A),肺脏肿大并可见弥散性大面积的出血灶(图1B)。
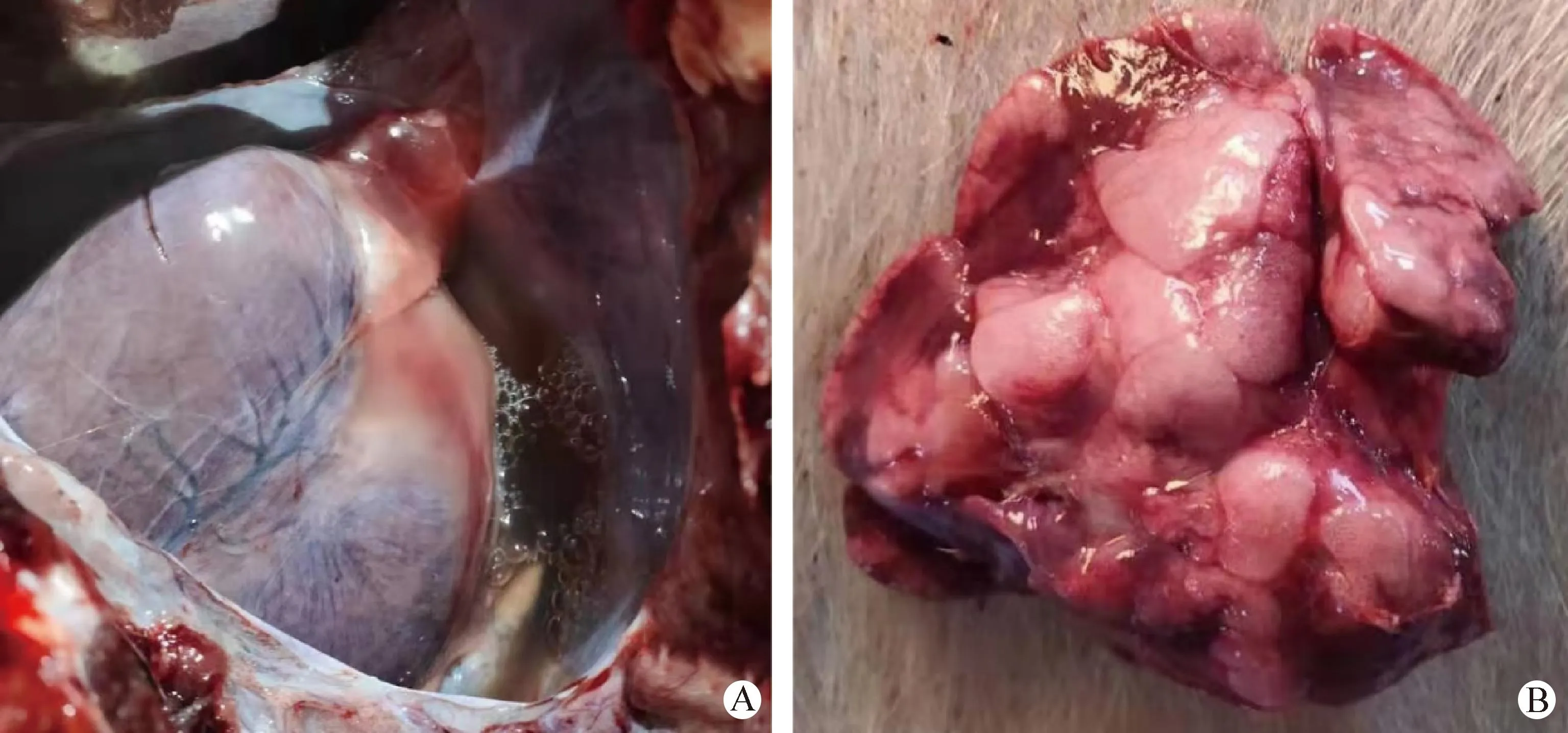
图1 大体剖检观察Fig.1 Gross necropsy observationA:胸腔; B:肺脏A:Pleural cavity; B:Lung
2.2 细菌分离培养 从病猪的胸腔积液、肺脏和心脏中都分离出了菌株,纯化2次后在TSA培养基上主要可见数个针尖大小、隆起、表面光滑、边缘整齐的半透明呈露珠状的白色菌落(图2A),革兰染色后,单个、成双或链状的革兰阴性球杆菌在光镜视野下清晰可见,符合APP的形态特征(图2B)。

图2 细菌分离培养Fig.2 Bacteria isolation and cultureA:菌落形态; B:革兰染色(100×)A:Colony morphology; B:Gram staining(100×)
2.3 细菌分子生物学鉴定 质谱检测结果显示,病死猪胸腔积液、血液、心脏、肺脏和肾脏中均含有APP(表2)。16S rDNA PCR鉴定结果显示,上述病料均可扩增出APP阳性条带(图3),初步判定病猪体内的主要菌株为APP。

图3 不同病料分离菌株16S rDNA的PCR鉴定Fig.3 16S rDNA PCR identification of isolates from different specimensM:DL2 000 DNA相对分子质量标准; 1:血液1; 2:血液2; 3:血液3; 4:淋巴结; 5:脾脏; 6:心脏; 7:肝脏; 8:肺脏; 9:胸腔积液1; 10:胸腔积液2; 11:胸腔积液3; 12:肾脏; 13:阳性对照; 14:阴性对照M:DL2 000 DNA Marker; 1:Blood 1; 2:Blood 2; 3:Blood 3; 4:Lymph node; 5:Spleen; 6:Heart; 7:Liver; 8:Lung; 9:Pleural effusion 1; 10:Pleural effusion 2; 11:Pleural effusion 3; 12:Kidney; 13:Positive control; 14:Negative control
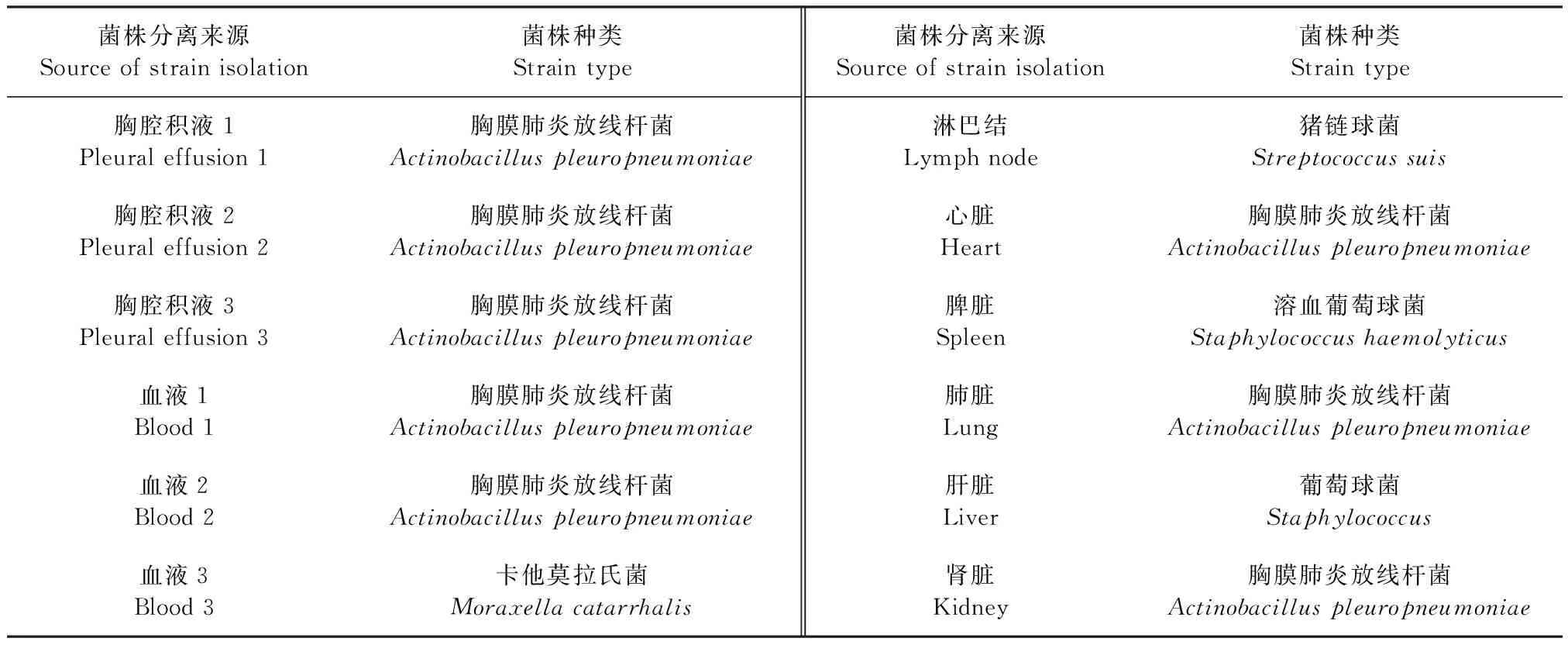
表2 不同病料分离菌株的质谱鉴定Table 2 Mass spectrometry identification of isolates from different specimens
2.4 细菌血清型鉴定 细菌血清型PCR鉴定结果显示,各样本中含有符合血清型7型条带的目标片段,大小为396 bp(图4)。其测序结果在NCBI数据库中进行BLAST比对为APP血清型7型,表明该猪所感染的APP为血清型7型。
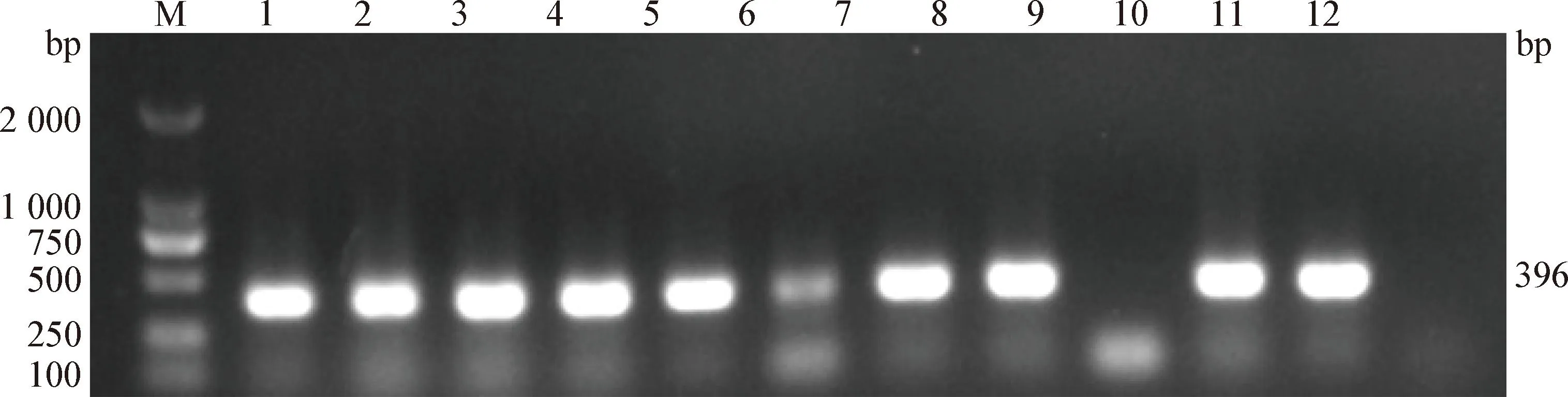
图4 胸膜肺炎放线杆菌血清型的PCR鉴定Fig.4 PCR identification of Actinobacillus pleuropneumoniae serotypeM:DL2 000 DNA相对分子质量标准; 1:胸腔积液1; 2:胸腔积液2; 3:心脏; 4:血液1;5:阳性对照a; 6:阳性对照b; 7:胸腔积液3; 8:血液2; 9:血液3; 10:肺脏; 11:肾脏;12:阴性对照M:DL2 000 DNA Marker; 1:Pleural effusion 1; 2:Pleural effusion 2; 3:Heart; 4:Blood 1; 5:Positive control a; 6:Positive control b; 7:Pleural effusion 3; 8:Blood 2; 9:Blood 3; 10:Lung; 11:Kidney; 12:Negative control
2.5 组织病理学分析
2.5.1 肺脏 显微镜下可见,肺小叶间质疏松水肿,淋巴管扩张形成淋巴栓(图5A),有大量炎性细胞浸润,主要为中性粒细胞和淋巴细胞(图5B);有的肺小叶局部呈现严重出血性肺炎(图5C),肺脏正常组织结构消失,肺泡和支气管管腔中可见大量的炎性渗出液和红细胞聚集,残存的肺泡代偿性扩张(图5D);有的肺小叶呈现纤维素性肺炎,肺泡上皮细胞大量增生,呈岛屿状排列(图5E);肺泡和肺间质内可见蓝染的菌团(图5F)。

图5 肺脏组织病理学检测(H.E.染色)Fig.5 Histopathological examination of the lung(H.E. staining)A、C、E:20×; B、D、F:40×黑色箭头:肺小叶间质疏松水肿、淋巴管扩张形成淋巴栓; 蓝色箭头:炎性细胞浸润; 绿色箭头:残存的肺泡代偿性扩张; 黄色箭头:肺泡上皮细胞大量增生; 白色箭头:蓝染菌团Black arrow:Pulmonary lobular interstitial looseness and edema,lymphatic vessel dilatation forming lymphatic embolus; Blue arrow:Inflammatory cell infiltration; Green arrow:Compensatory expansion of the remaining alveoli; Yellow arrow:Abundant proliferation of alveolar epithelial cells; White arrow:Blue-stained clumps
2.5.2 其他脏器 肝脏、淋巴结、肾脏和心肌组织均可见明显的组织病理学变化。肝小叶中央静脉和肝窦淤血、有散在坏死灶,中央静脉管壁下组织疏松水肿(图6A);淋巴结可见淋巴滤泡中淋巴细胞坏死排空,毛细血管扩张充血(图6B);脾脏表现出急性脾炎的病理学变化,大面积出血,白髓与红髓之间的界限不清晰,白髓面积缩小,动脉周围淋巴鞘萎缩,大量淋巴细胞坏死排空(图6C);肾脏可见严重水肿、肾小管脱离基底膜,肾小管上皮细胞广泛变性坏死,肾间质有明显的结缔组织增生(图6D)和炎性细胞浸润(图6E);心脏的心肌纤维间大量红细胞聚集,呈现局灶性出血灶(图6F)。
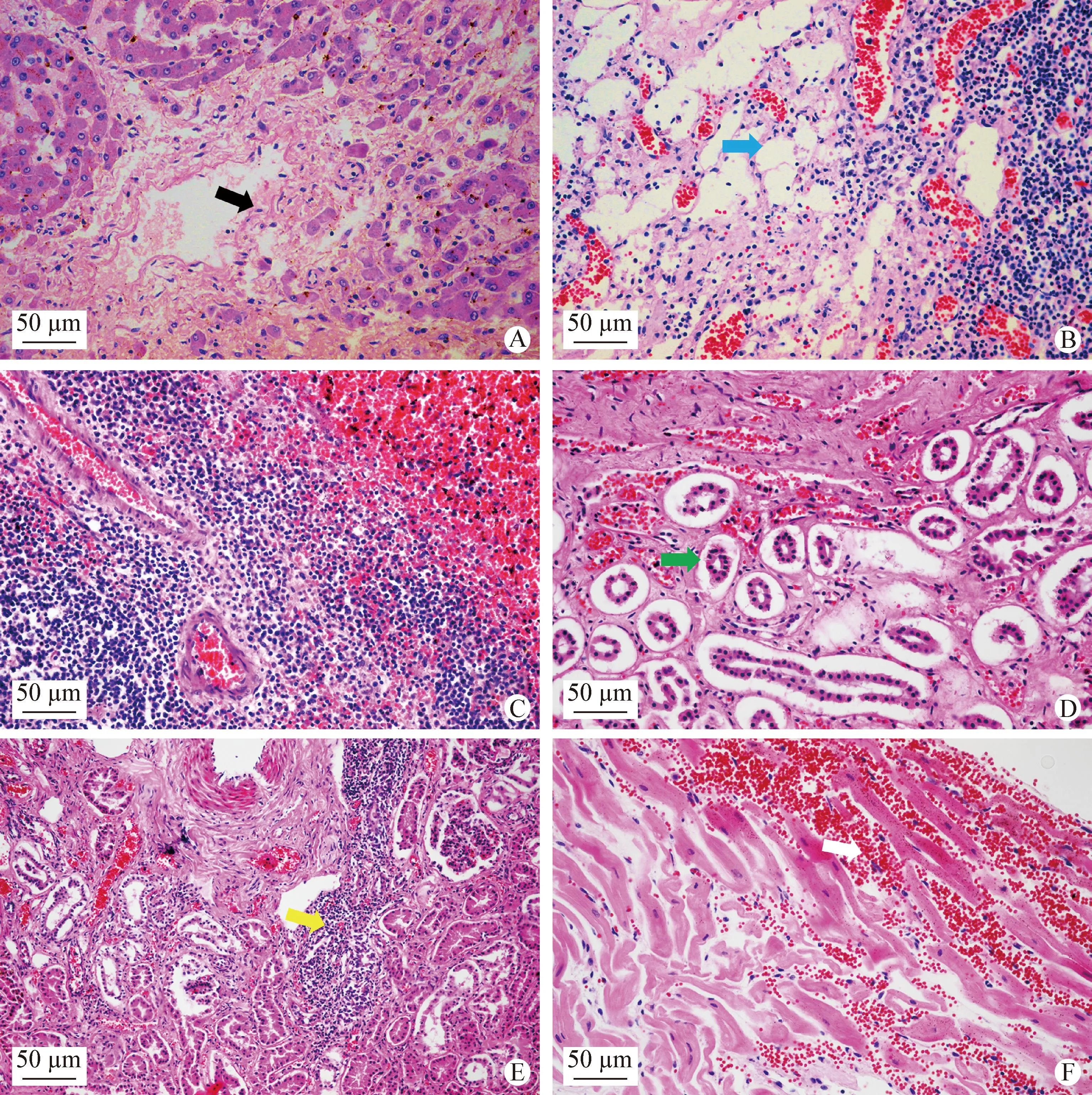
图6 其他脏器组织病理学检测(H.E.染色,40×)Fig.6 Histopathological examination of other organs tissues (H.E. staining,40×)A:肝脏; B:淋巴结; C:脾脏; D:肾脏; E:肾脏; F:心脏黑色箭头:中央静脉管壁下组织疏松水肿; 蓝色箭头:淋巴滤泡中淋巴细胞坏死排空; 绿色箭头:肾小管脱离基底膜; 黄色箭头:炎性细胞浸润; 白色箭头:心肌纤维间大量红细胞聚集A:Liver; B:Lymph node; C:Spleen; D:Kidney; E:Kidney; F:HeartBlack arrow:The tissue under the central vein wall was loose and edema; Blue arrow:Necrotic emptying of lymphocytes in lymphoid follicles; Green arrow:Renal tubules detached from the basement membrane; Yellow arrow:Inflammatory cell infiltration; White arrow:Massive aggregation of red blood cells between myocardial fibers
3 讨论
PCP是由APP感染导致的一种高传染性、致死性的猪呼吸道传染病,由于环境、品系、机体免疫状态和APP血清型等因素不同而对猪的致病性有所差异。该病原自1957年在英国被首次分离以来,已分离鉴定出18个血清型(1~18型)[1]。有研究表明,胸腔和肺脏是该病的主要病理损伤部位[2],临床表现为急性或慢性纤维素性胸膜肺炎[3]。
本试验在剖检病死猪时发现胸腔积液和肺脏肿大出血等症状。组织病理学观察结果亦显示病死猪多脏器发生病变,尤其以肺脏病变最为明显,呈现出血性肺炎和纤维性肺炎的病理学变化,同时可观察到蓝染菌团。结合细菌学检查结果,推测该病猪可能感染了血清型7型APP菌,细菌在肺内繁殖,引发严重的肺炎,最终导致呼吸困难等急性猪胸膜肺炎的症状。在急性感染期间,该菌主要通过淋巴管和血管在病猪体内传播和释放毒素,引起感染猪发生菌血症和毒血症[4],最终导致感染猪的死亡。
研究表明,肺脏呈现纤维素性肺炎的病理损伤是急性猪传染性胸膜肺炎的特征表现[5,6]。在本试验中,病死猪的肺脏组织也有明显的出血性纤维素性渗出,同时可见大量肺泡上皮细胞呈岛屿状聚集,可能是疾病正在由急性向亚急性转变,继续发展有可能成为亚急性型特征性病变“肉芽肿”。病死猪的心脏、肝脏、肾脏、淋巴结和脾脏等也表现出不同程度的病理损伤。质谱检测结果显示,大部分病变组织中都有APP存在,提示这些部位的病理组织学变化与APP感染有关。因此,心肌纤维间的散在出血灶,肾小管上皮细胞的变性坏死可能是APP感染引起的病理学变化。
PCP作为一种细菌感染性疾病,感染初期出现的急性肺损伤的程度决定了病情是否进一步恶化,所以尽早确诊才能快速防控[7]。因此,在面对猪场猪群突发PCP时,灵敏高效的检测方法是极其重要的。目前,酶联免疫吸附测定(Enzyme-linked immunosorbnent Assay,ELISA)是在猪群中监测猪APP最为常用的方法,该方法经济且方便。但在某些亚临床感染中,感染猪的血清学检查结果可能为阴性,仅靠ELISA方法检测将会影响后续的诊断和治疗[8]。本试验利用PCR和质谱分析结合来鉴定APP,检测结果准确,但在实际操作中存在难度大、耗时长等问题,无法应对猪场的需求。因此,研发针对PCP的成本低、准确性高、操作简单的诊断方法依旧是热点问题。
对于PCP的防控,首先需要加强猪场的饲养管理,其次应采取相关措施保障生物安全,定期进行血清学检查,并根据血清学检查结果制定相应的免疫程序进行免疫接种。近年来,我国不同地区的规模化猪场常有APP感染的报道出现,目前 APP 血清型 1~5、7~10 和 15 型的相关抗体已经在我国许多猪场成功分离或者检测得到,且不同地域的优势血清型存在差异[9],例如:APP血清型1型主要在福建和海南存在,血清型2、3和7型主要分布于甘肃、青海和宁夏等,血清型3、7和9型是湖南和湖北的优势血清型[10]。本试验中所测得的血清型7型APP在我国最为普遍[11]。宋志强等统计2017—2019年关于PCP的屠宰检查结果发现,3年来我国猪群感染PCP的平均概率为12%[12],相较于以前感染率有所升高。因此,建立PCP分离菌株血清型分布的流行病学数据库,依据大数据来筛选预测优势血清型,对于APP疫苗的研发和PCP的防治具有重要意义[13]。当养殖场中发现有猪群疑似感染PCP时,应及时隔离患病猪,由于不同区域猪场长期使用的抗生素不同,治疗时需要有针对地筛选出敏感药物并及时进行治疗,才能有效阻止APP的进一步传播。在耐药性方面,APP对诸如四环素、青霉素和甲氧苄啶磺酰胺等抗生素的耐药性增加,但广谱抗生素头孢曲松、头孢哌酮和哌拉西林等对该菌依然有效[14,15],使得该病在确诊后能得到有效的控制。有研究表明,猪的上皮细胞分泌的一种抗菌肽防御素β2能够增强猪对APP的抵抗力,为在治疗PCP上减少抗生素的使用提供了新思路[16]。防控该病最重要的还是养猪场内避免引入携带新血清型菌株的猪,从源头上阻断感染源[13]。
4 小结
本病例诊断结果可见,死亡猪的肺脏等脏器中分离出的细菌鉴定为APP,血清型为7型;大体剖检可见胸腔积液和肺脏出血,组织病理学观察结果显示出血性纤维素性肺炎,均符合PCP的大体病变和组织病理学特征。因此,此病例确诊为PCP。
