鸡传染性鼻炎三价灭活疫苗生产用菌株的筛选
2023-12-23金云云刘怡宁吴营霞翟路峰高盛果高晓静田克恭
金云云 , 刘怡宁 , 吴营霞 , 翟路峰 , 高盛果 , 高晓静 , 田克恭
(1.国家兽用药品工程技术研究中心 , 河南 洛阳 471000 ; 2. 普莱柯生物工程股份有限公司 , 河南 洛阳 471000)
鸡传染性鼻炎(Infectious coryza,IC)是由副鸡禽杆菌(Avibacteriumparagallinarum,Apg)引起的一种鸡急性呼吸道疾病[1],临床症状主要表现为面部肿胀、流鼻涕和结膜炎,肉垂可出现明显肿胀,鸡是Apg的自然宿主,各种日龄的鸡对Apg均易感,但幼鸡一般不太严重[2]。该病造成较大经济损失,可导致育成鸡生长不良和产蛋鸡产蛋明显下降(10%~40%),当Apg与其他病原体混合感染时,情况会变得复杂,这些损失将增加到85%并且死亡率相当高[2-5]。通常临床症状和产蛋率下降会在Apg感染20 d内消失,但复杂的病例可能持续长达2个月。Page等[6]使用平板凝集试验将Apg分为A、B、C 三个血清型;Kume等[7]通过使用硫氰酸钾处理并经超声裂解的菌体细胞、戊二醛固定的鸡红细胞和家兔高免血清进行血凝抑制试验(Hemagglutination inhibitio,HI),将Apg分为A、B、C 三个血清群,与Page血清型A、B、C相对应[8]。目前认为,9种Kume血清型分别为A-1、A-2、A-3、A-4、B-1、C-1、C-2、C-3 和 C-4[8]。很多按照Page方法无法分型的菌株使用Kume方法很容易进行分型[9]。Apg A、B、C型菌株引起的IC在我国不同地区均有流行[10],使用良好的灭活疫苗免疫接种是预防和控制该病的有效措施。Apg A、B、C三个血清型之间缺乏交叉保护[11,12],但同一血清型的不同亚型之间存在部分交叉保护[13],故良好的鸡传染性鼻炎灭活疫苗应包含A、B、C三个血清型菌株,且菌株需要具备良好的免疫原性,才能对该病起到全面的预防和保护作用。
本试验为了筛选免疫原性良好的鸡传染性鼻炎灭活疫苗生产用菌株,通过对实验室前期分离的A、B、C型Apg不同菌株的致病性和免疫原性进行比较分析,选择毒力较强、免疫原性较好的菌株用于后续疫苗研发,为开发良好的鸡传染性鼻炎三价灭活疫苗提供支持。
1 材料与方法
1.1 菌种 11株Apg分离株,由国家兽用药品工程技术研究中心分离、鉴定并保存[10],其中A型菌5株(HN2株、HN3株、SD2株、HB1株、HB2株),B型菌3株(HN4株、HN5株、SD4株),C型菌3株(HN1株、SD1株、SD3株)。
1.2 阳性血清 标准Apg血清A型菌株CCM6032株(CVCC 269)、血清B型菌株CCM6075株(CVCC 257)、血清C型菌株Modesto株(CVCC 258)阳性血清,由国家兽用药品工程技术研究中心制备和保存。
1.3 主要试剂 鸡肉汤琼脂平板、鸡肉汤培养基、磷酸缓冲盐溶液(Phosphate buffer saline,PBS,0.01 mol/L,pH 7.2),由国家兽用药品工程技术研究中心制备并检验合格后备用。
1.4 主要仪器设备 二氧化碳培养箱(Hera cell 240I),购自德国Thermo公司;台式恒温摇床(EXCELLA E24R),购自美国NBS公司;生物安全柜(Nu-425-400E),购自美国NuAire公司;旋涡混匀器(MS3DS25),购自德国IKA公司。
1.5 实验动物 SPF种蛋和SPF白羽肉鸡,均购自北京勃林格殷格翰维通生物技术有限公司[生产许可证号:SCXK(京)2014—0002],本试验经普莱柯生物工程股份有限公司动物实验伦理委员会批准后开展(批准号:201402001)。
1.6 毒力试验
1.6.1 Apg对鸡胚的毒力 将分离的11株Apg分别接种于鸡肉汤琼脂平板,置37 ℃、5% CO2培养箱培养24 h,挑取典型菌落接种于鸡肉汤培养基培养11 h。按照《中华人民共和国兽药典》三部附录的活菌计数方法测定11株Apg菌液的活菌含量,将菌液均进行105倍稀释,卵黄囊接种6~7日龄SPF鸡胚各10枚,每胚0.2 mL,置37 ℃继续孵化,观察鸡胚30 h内死亡情况。
1.6.2 Apg对鸡的致病性 使用1.6.1制备的11株Apg菌液,经眶下窦接种12~14周龄SPF鸡各5只,0.2 mL/只,接种后连续观察7 d,统计各菌株的发病比例,出现面部肿胀或流鼻涕任一项症状即判为发病。
1.6.3 最小发病剂量测定 根据1.6.1和1.6.2试验结果筛选出毒力较强的A型、B型和C型Apg各2株,按照1.6.1方法制备菌液,将菌液均稀释至活菌数约为106、105、104和103CFU/mL,分别经眶下窦接种12~14周龄SPF鸡10只,0.2 mL/只,接种后连续观察7 d,统计各菌株的发病比例。
1.7 免疫原性试验 根据1.6毒力试验结果筛选出毒力较强的A型、B型和C型Apg各2株,按照1.6.1方法制备菌液,8 000 r/min离心10 min,去除上清,用PBS(0.01 mol/L,pH 7.2)重悬菌体沉淀至原体积的1/10,使用硫柳汞溶液灭活后,分别与氢氧化铝胶佐剂混合制备单价铝胶佐剂灭活疫苗(每毫升疫苗含菌数均为2.0×109CFU),免疫组每种疫苗免疫8~10周龄SPF鸡各20只,0.5 mL/只,另设60只不免疫鸡作为对照组。免疫后28 d,所有免疫组和对照组鸡只采血、分离血清,免疫组分别使用同血清型的2株HI抗原(制备方法参考国家农业行业标准[14])检测HI抗体效价(血清使用鸡醛化红细胞吸附后检测,待检血清起始稀释度均为1∶5)。
免疫后28 d,对每个A型菌单价灭活苗免疫组和对照组的各20只鸡,分别经眶下窦注射2株A型Apg菌液,每株各接种10只鸡,0.2 mL/只(最小发病剂量);B型菌和C型菌单价灭活苗免疫组和对照组也分别使用2株B型菌和2株C型菌以同样方式进行攻毒。接种后连续观察7 d,统计各组的发病比例。比较各菌株的免疫原性和菌株间的交叉保护性。
1.8 最小抗原含量测定 根据1.7免疫原性试验筛选出免疫原性和交叉保护性较好的A型、B型和C型菌株各1株,按照1.7方法均制备成抗原含量分别为5.0×108、1.0×109、1.5×109和2.0×109CFU/mL的单价铝胶佐剂灭活疫苗,免疫组分别免疫8~10周龄SPF鸡10只,0.5 mL/只,另设30只鸡不免疫作为对照组。免疫后28 d,所有免疫组和对照组鸡只采血、分离血清,使用对应疫苗菌株HI抗原分别检测HI抗体效价。
免疫后28 d,对不同抗原含量的A型菌单价灭活苗免疫组各10只鸡和对照组10只鸡,经眶下窦注射A型Apg菌液,0.2 mL/只(最小发病剂量);不同抗原含量的B型和C型菌单价灭活苗免疫组和对照组也分别使用B型菌和C型菌以同样方式进行攻毒。接种后连续观察7 d,统计各组的发病比例。
2 结果
2.1 毒力试验
2.1.1 Apg对鸡胚的毒力 经测定,11株Apg攻毒菌液的活菌含量介于1.8×109~2.4×109CFU/mL,每胚实际接种剂量介于3.6×103~4.8×103CFU,接种后30 h内鸡胚死亡比例介于7/10~10/10(表1)。结果表明,11株Apg菌株对鸡胚均具有较强的毒力。
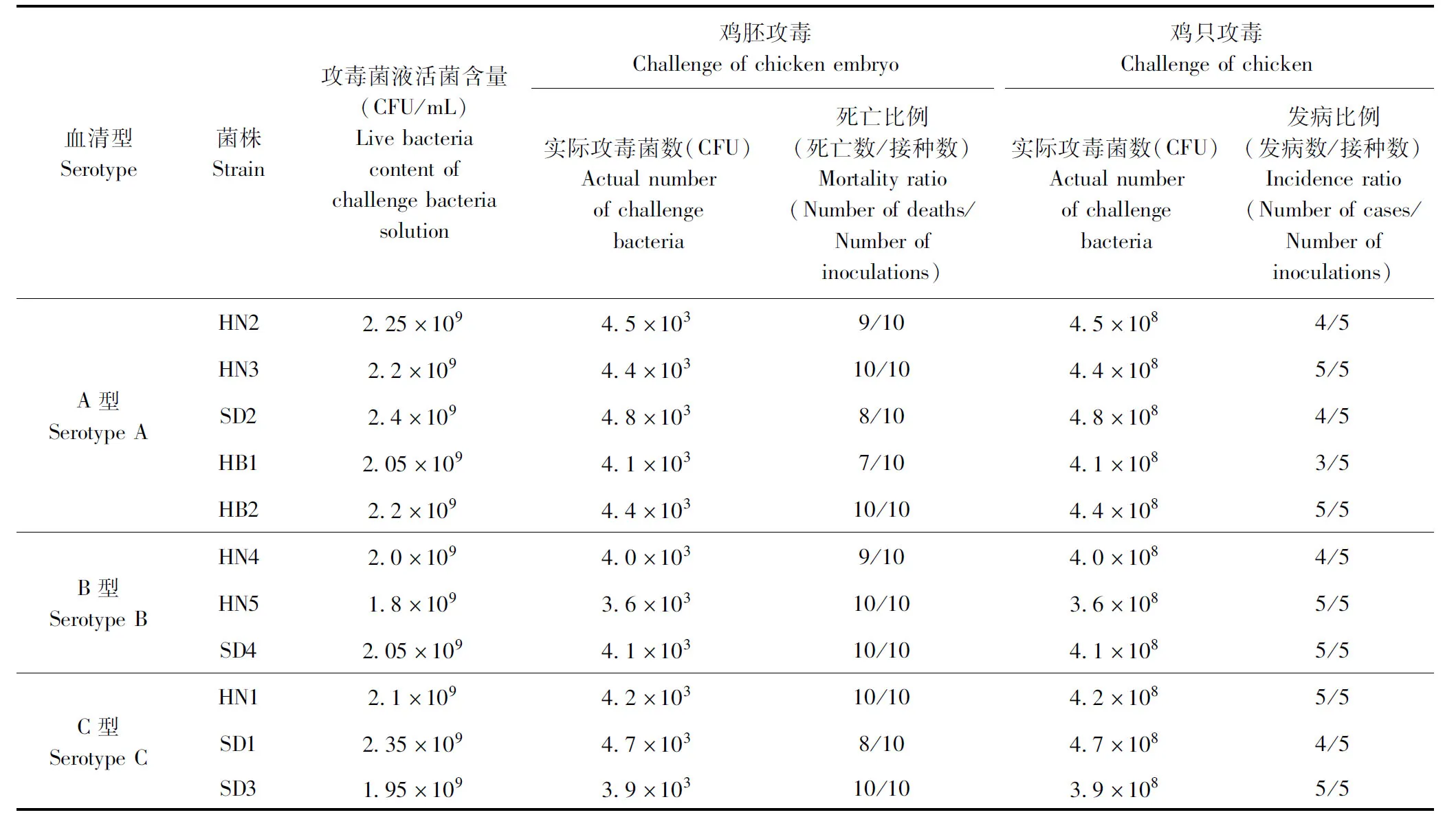
表1 11株副鸡禽杆菌的毒力测定Table 1 Virulence determination of 11 Apg strains
2.1.2 Apg对鸡的致病性 经计算,每只鸡实际接种剂量介于3.6×108~4.8×108CFU。接种菌液后24~72 h试验鸡出现不同程度的临床症状,主要为面部肿胀和流鼻涕;接种后连续观察7 d,出现面部肿胀或流鼻涕任一项症状即判为发病,各菌株攻毒鸡的发病比例介于3/5~5/5(表1)。结果表明,11株Apg菌株对鸡均具有一定的毒力,其中A型HN3株和HB2株,B型HN5株和SD4株,C型HN1株和SD3株毒力较强,用于后续试验。
2.1.3 最小发病剂量测定 将Apg A型HN3株和HB2株、B型HN5株和SD4株、C型HN1株和SD3株菌液稀释至不同活菌数后进行攻毒,结果见表2,A型HN3株和HB2株的最小发病剂量分别约为2.0×104和2.5×105CFU;B型HN5株和SD4株的最小发病剂量分别约为1.8×103和2.2×105CFU;C型HN1株和SD3株的最小发病剂量分别约为2.1×105和2.3×103CFU。

表2 6株副鸡禽杆菌最小发病剂量测定Table 2 Minimum pathogenic dose determination of 6 Apg strains
2.2 免疫原性试验 将Apg A型HN3株和HB2株、B型HN5株和SD4株、C型HN1株和SD3株制备成单价铝胶佐剂灭活疫苗,免疫SPF鸡28 d后,检测HI抗体效价,结果见表3~5,相同血清型之间A型HN3株、B型HN5株和C型SD3株灭活疫苗免疫后血清,使用同源和异源菌株HI抗原检测HI抗体效价的几何平均值介于1∶139~1∶970(4.8~7.6 log2×5),阳性比例(HI抗体效价≥1∶10判为阳性)介于8/10~10/10;而A型HB2株、B型SD4株和C型HN1株灭活疫苗免疫后血清使用同源和异源菌株HI抗原检测HI抗体效价的几何平均值介于1∶30~1∶299(2.6~5.9 log2×5),阳性比例介于5/10~9/10。
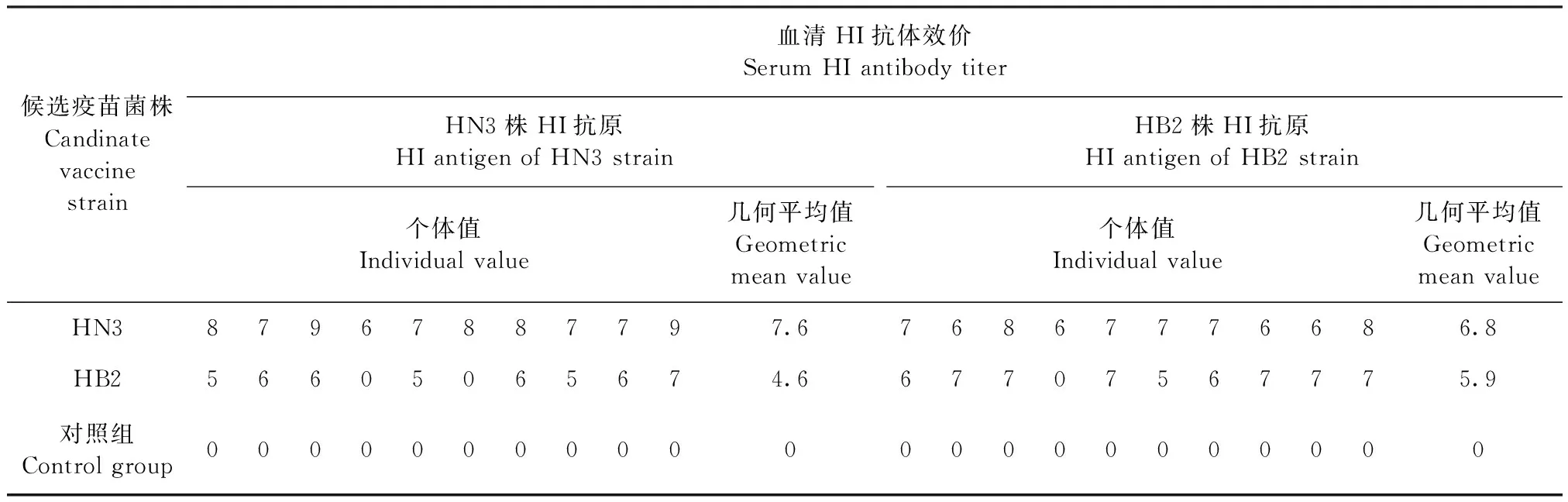
表3 A型副鸡禽杆菌不同菌株免疫原性试验血清HI抗体检测Table 3 Serum HI antibody determination in immunogenicity test of different Apg strains of serotype A (log2×5)
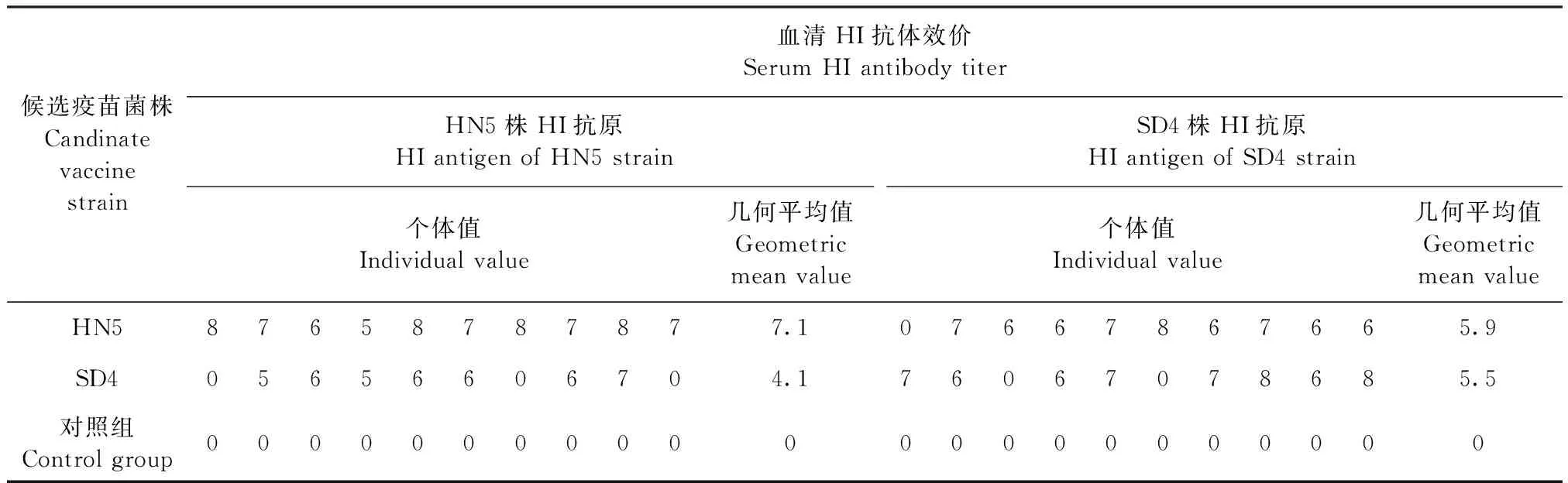
表4 B型副鸡禽杆菌不同菌株免疫原性试验血清HI抗体检测Table 4 Serum HI antibody determination in immunogenicity test of different Apg strains of serotype B (log2×5)
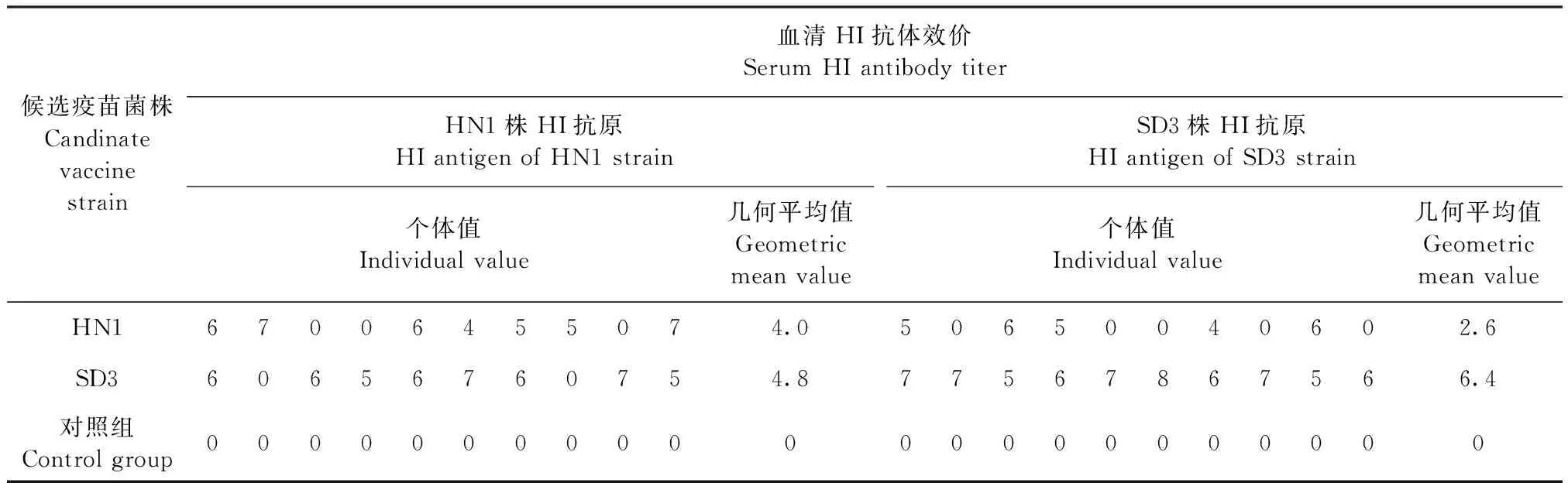
表5 C型副鸡禽杆菌不同菌株免疫原性试验血清HI抗体检测Table 5 Serum HI antibody determination in immunogenicity test of different Apg strains of serotype C (log2×5)
免疫后28 d,各型单价疫苗免疫组分别使用同血清型不同菌株进行攻毒(含至少1个发病剂量),攻毒后发病结果见表6,相同血清型之间A型HN3株、B型HN5株和C型SD3株对同源和异源菌株的攻击均可产生理想的保护效果,保护比例介于8/10~10/10;而A型HB2株、B型SD4株和C型HN1株对同源菌株的保护比例分别为9/10、8/10和7/10,对异源菌株的保护比例分别只有8/10、7/10和5/10,攻毒保护结果与血清HI抗体效价结果相关性较高,HI抗体阳性的鸡只攻毒后均获得保护。因此将毒力较强、免疫原性较好的A型HN3株、B型HN5株和C型SD3株作为疫苗生产和攻毒用菌株。
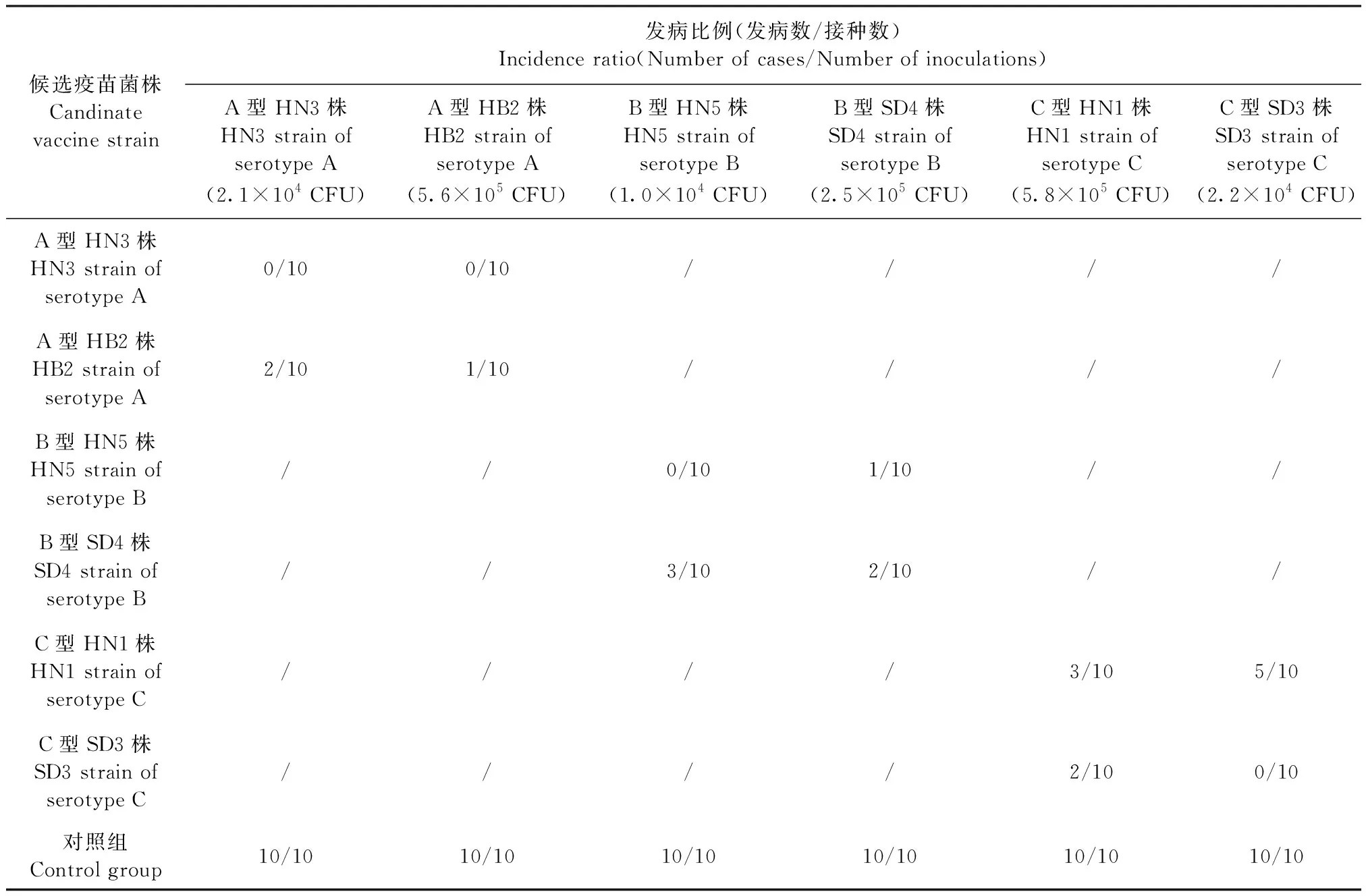
表6 副鸡禽杆菌不同菌株免疫原性试验攻毒后发病比例Table 6 Incidence ratio after challenge in immunogenicity test of different Apg strains
2.3 最小抗原含量测定 将A型HN3株、B型HN5株和C型SD3株制备成不同抗原含量的单价灭活疫苗,进行免疫攻毒保护试验,免后28 d血清HI抗体效价和攻毒后发病比例见表7和表8。A型HN3株抗原含量不低于5.0×108CFU/mL时,免疫后28 d血清HI抗体效价几何平均值介于1∶98~1∶1 114(4.3~7.8 log2×5),阳性比例介于8/10~10/10,攻毒后能提供8/10~10/10的保护;B型抗原含量不低于1.0×109CFU/mL时,免疫后28 d血清HI抗体效价几何平均值介于1∶184~1∶788(5.2~7.3 log2×5),阳性比例介于8/10~10/10,攻毒后能提供8/10~10/10的保护;C型SD3株抗原含量不低于1.5×109CFU/mL时,免疫后28 d血清HI抗体效价几何平均值介于1∶139~1∶368(4.8~6.2 log2×5),阳性比例介于8/10~10/10,攻毒后能提供8/10~10/10的保护。因此,疫苗中A型HN3株、B型HN5株和C型SD3株的最小抗原含量分别为5.0×108、1.0×109和1.5×109CFU/mL。
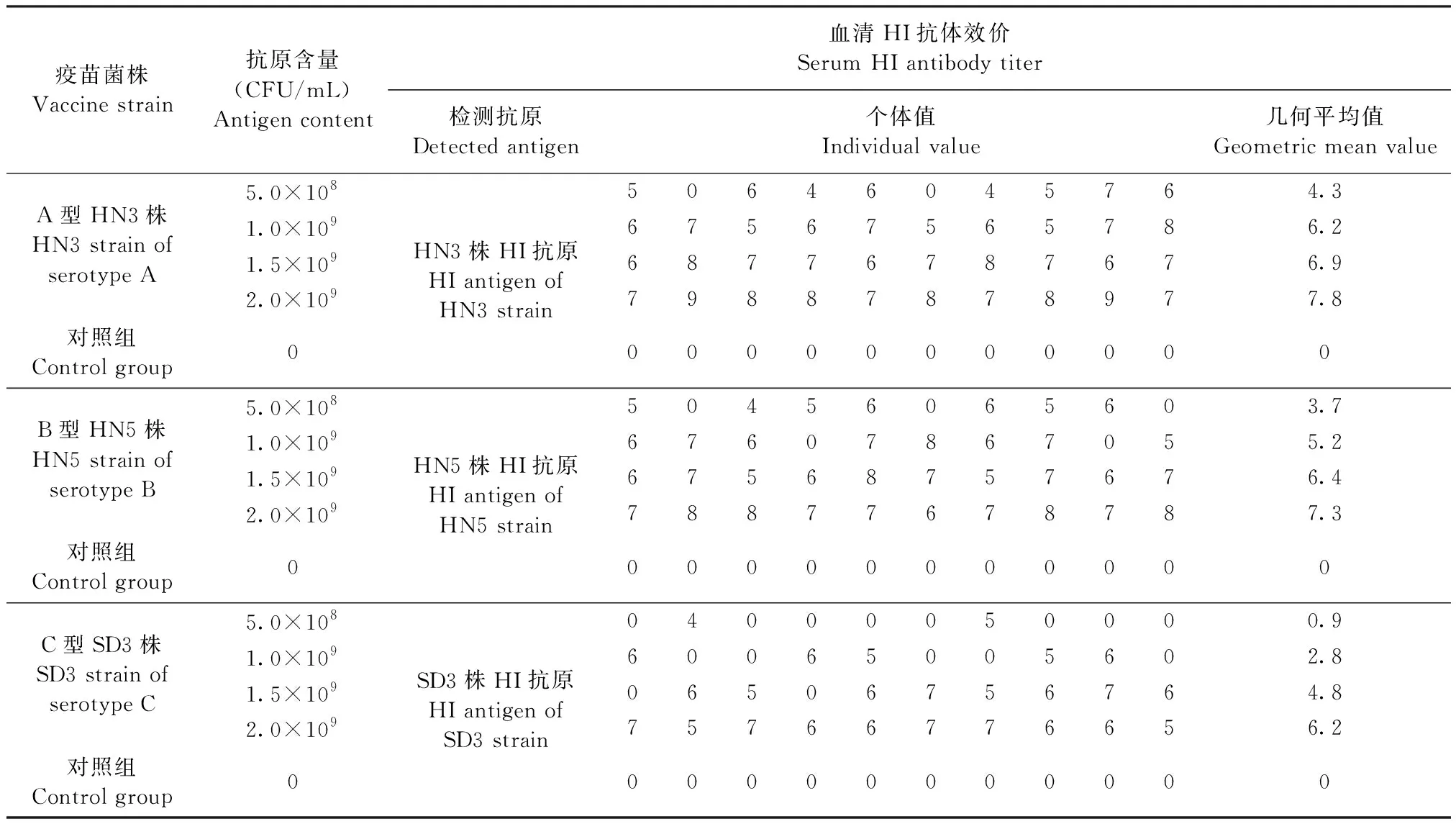
表7 副鸡禽杆菌不同菌株最小抗原含量测定试验血清HI抗体检测 Table 7 Serum HI antibody determination in minimum antigen content test of different Apg strains (log2×5)
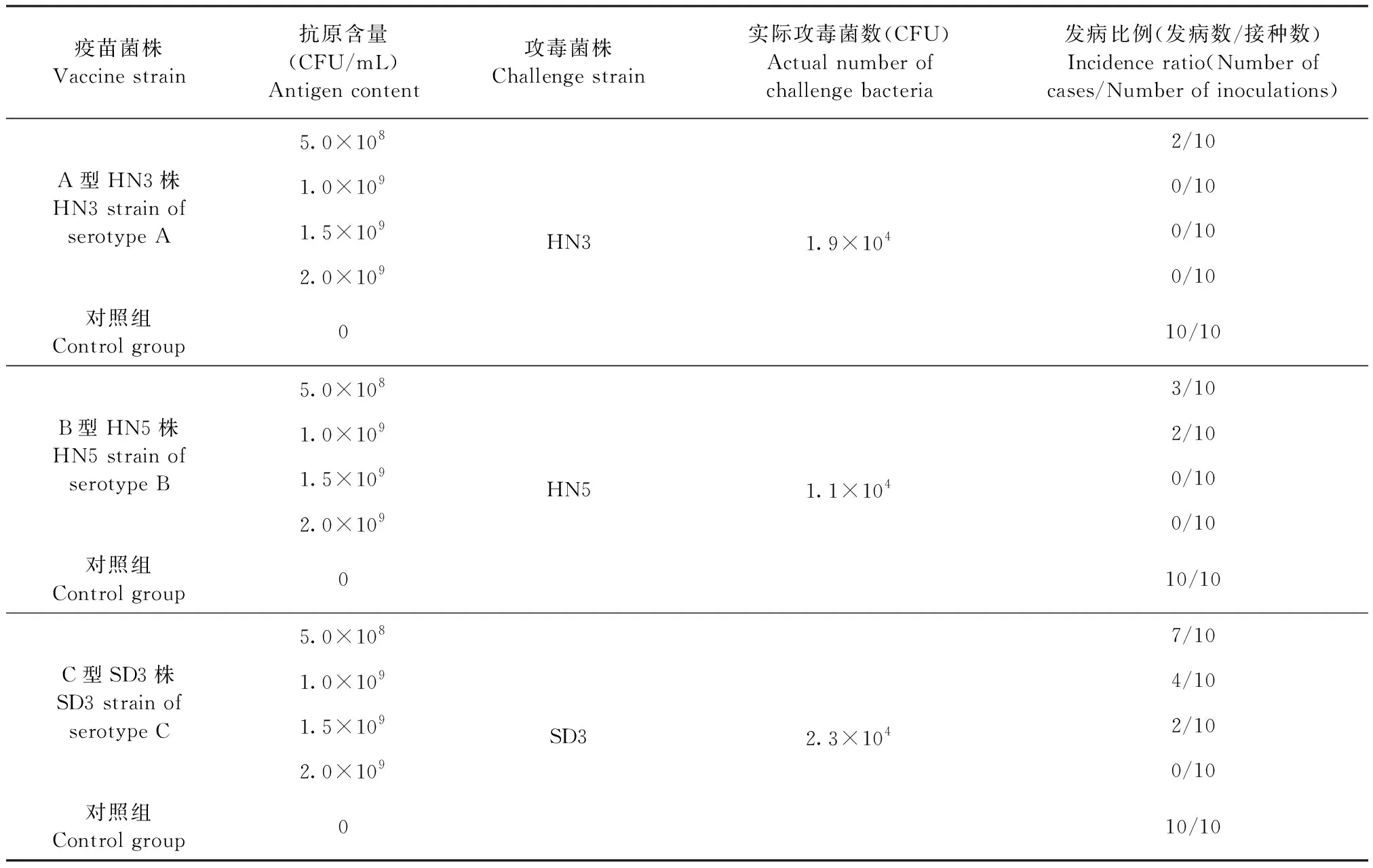
表8 副鸡禽杆菌不同菌株最小抗原含量测定攻毒后发病比例Table 8 Incidence ratio after challenge in minimum antigen content test of different Apg strains
3 讨论
研究表明,不同Apg菌株的致病性存在差异,并通过田间菌株和参考菌株得到证实[15,16]。Apg的致病性与多种因素有关,目前研究主要针对血凝素抗原(Hemagglutination antigen,HA)[2],HA抗原是一种大小为210 kDa的蛋白(HMTp210蛋白),由血凝素、自转运蛋白和黏附素构成的三聚体,具有血凝、细胞黏附和生物被膜形成活性[17]。针对HA抗原作为保护性抗原也开展了很多研究,Takagi等[18,19]已证实一种针对Page血清A型HA的特异性单克隆抗体具有被动保护作用,并且用该抗体纯化的HA抗原也具有保护性。
Caballero-Garcia等[20]通过研究包含3种血清型的24株Apg菌株的致病性,选择各血清型中致病性最强的菌株制备灭活疫苗进行同源菌株的攻毒评价,证实菌株的免疫原性良好,同时提出了另一种筛选鸡传染性鼻炎灭活疫苗菌株的方法,即根据致病性而不仅仅是血清型来选择疫苗菌株。
本试验通过鸡胚和鸡只的毒力试验对分离的5株A型、3株B型和3株C型Apg的毒力进行比较,各血清型初步筛选出2株毒力较强的菌株进行最小发病剂量测定,从而确定毒力最强的A型、B型和C型Apg菌株并建立各菌株的攻毒模型,用于疫苗效力检验;在此基础上,通过对各血清型的2株毒力较强菌株的免疫原性研究发现,毒力最强菌株制备的灭活疫苗免疫后不仅能够抵抗同源菌株的攻击,对同血清型异源菌株也能提供良好的保护,说明毒力更强的菌株其免疫原性和交叉保护性更好,与Caballero-Garcia等[20]的研究结果一致。
Sawata等[21]研究发现,用HI检测免疫鸡只的抗体效价达到1∶5或更高时,对攻毒有保护作用,但疫苗免疫后不刺激机体产生HI抗体也具有保护作用[15],说明其他抗体在免疫保护过程中也具有重要作用。在本试验中对各菌株灭活疫苗免疫后28 d血清的HI抗体效价进行测定,与攻毒保护结果具有较高的相关性,毒力更强菌株的灭活疫苗免疫血清使用同源菌株及同血清型异源菌株HI抗原检测的HI抗体效价和阳性比例均较高,HI抗体阳性的鸡只攻毒后均获得保护,个别HI抗体阴性的鸡只攻毒后也获得保护,进一步印证了上述文献[21]报道的结论,但可能也与Apg HI抗体检测方法的灵敏度不高有关。HI抗体检测方法与灭活疫苗免疫攻毒保护结果相关性较好,可以作为疫苗攻毒保护效力评价的替代方法,但该方法所用抗原和鸡醛化红细胞制备过程较为繁琐,在临床推广使用较为困难,临床需要一种操作更简便的方法用于疫苗免疫效果评价。
综上所述,为了筛选更好的鸡传染性鼻炎灭活疫苗生产菌株,提升鸡传染性鼻炎灭活疫苗的免疫保护效果,在疫苗菌株筛选过程中,可以将菌株致病性作为一项重要指标,同时可以结合HI抗体检测方法,使用同血清型的多个不同菌株HI抗原检测候选菌株灭活疫苗免疫后血清的HI抗体效价,选择能够产生更高HI抗体及能够与多个不同菌株HI抗原反应良好的菌株作为疫苗菌株,确保疫苗具备良好和广谱的免疫保护效果。
