乌龙茶鲜叶游离氨基酸组成轮廓的模式识别研究
2023-12-21张应根宋振硕陈林陈键王丽丽项丽慧
张应根, 宋振硕, 陈林, 陈键, 王丽丽, 项丽慧
(福建省农业科学院茶叶研究所,福州 350013)
茶树鲜叶中的游离氨基酸约占干重的1%~4%,其与茶叶风味品质、质量等级和保健特性密切相关[1]。迄今从茶叶中发现并鉴定的游离氨基酸多达26 种,并以茶氨酸含量最为丰富[2]。由于受茶树品种特性、自然环境、农艺措施、采摘标准和制茶工艺等诸多因素的影响,游离氨基酸在成品茶中呈现出多样化的组成轮廓特征[3–8]。在茶叶加工过程中,特定的制作工序将促使在制品中的蛋白和非蛋白游离氨基酸发生一定的规律性变化。如在鲜叶萎凋或摊晾过程的蛋白水解将有助于游离氨基酸含量的增加、厌氧处理或机械损伤可明显提高γ-氨基丁酸含量[9]。此外,揉捻和发酵过程发生脱氨、脱羧或羟化作用,干燥过程的非酶促反应(如Maillard 反应和Strecker降解)及渥堆过程的微生物代谢等引起的游离氨基酸变化亦可有效调节成品茶的风味品质[10–11]。尽管如此,游离氨基酸在除黑茶外的其他茶类加工过程中的增减幅度较为有限,其在成品茶中的种类和含量在很大程度上仍由茶鲜叶原料所持有的游离氨基酸组成特征所决定[12–13]。福建是乌龙茶的发祥地和主产区,独特的气候条件和地理环境,孕育了丰富的乌龙茶种质资源。特殊的鲜叶理化性状为乌龙茶加工品质形成奠定了必要的物质基础[14–15]。通过前期对乌龙茶和绿茶品种一芽二或三叶及中小开面二至四叶的水浸出物、茶多酚、游离氨基酸总量、可溶性糖和咖啡因等主要品质成分的检测分析及化学模式识别结果表明,不同芽叶嫩度的春季乌龙茶与绿茶品种鲜叶的主要品质化学轮廓存在较好的类群区分,且乌龙茶品种春季和秋季鲜叶的主要品质成分亦有明显的季节性差异[16–17]。为进一步探明乌龙茶品种鲜叶的化学品质特征,本试验以国家或省级审(认、鉴)定绿茶品种春季鲜叶为对照,对采自乌龙茶品种春、秋两季的一芽二或三叶和中小开面二至四叶进行了游离氨基酸检测分析,并对不同鲜叶来源茶样的游离氨基酸组成轮廓进行了主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)等统计模式识别及差异特征成分筛选,以期为乌龙茶品种的生化鉴定和种质资源创新利用提供参考依据。
1 材料和方法
1.1 材料
供试鲜叶均采自集中管理并分行种植于福建省茶树资源圃4~5 龄试验茶园(27°13′57″ N,119°34′31″ E)的10 个绿茶品种春季第一轮新梢与10 个乌龙茶品种春季和秋季第一轮新梢。春茶和秋茶样品采摘时间分别为3 月26 日—5 月7 日、10 月9 日—24日。采摘标准:一芽二或三叶(简称幼嫩鲜叶)和中小开面二至四叶(简称成熟鲜叶)。绿茶品种包括:(1) 国家认(鉴)定绿茶品种‘福云6 号’、‘福云7 号’、‘福云10 号’、‘福鼎大白茶’、‘福鼎大毫茶’、‘福安大白茶’和‘霞浦春波绿’;(2) 福建省审定绿茶品种‘九龙大白茶’、‘霞浦元宵茶’和‘早春毫’。乌龙茶品种按产地来源包括:(1) 新选品种‘茗科1 号’和‘黄观音’,均为‘铁观音’(♀)与‘黄棪’(♂)人工杂交后代;(2) 闽北品种‘肉桂’、‘福建水仙’、‘大红袍’和‘矮脚乌龙’;(3) 闽南品种‘铁观音’、‘黄棪’、‘梅占’和‘白芽奇兰’。
氨基酸标准品:茶氨酸(THE),纯度为99%, 瑞士Adamas 试剂;γ-氨基丁酸(GABA),纯度为99%,美国Sigma-Aldrich 试剂;L-谷氨酸(L-Glu),BR 级,纯度≥98.5%,上海沪试试剂;17 种氨基酸混和标样(Agilent PN 5061-3331):250 pmol/mL,溶于0.1 mol/L HCl,内含天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、精氨酸(Arg)、丙氨酸(Ala)、酪氨酸(Tyr)、半胱氨酸(Cys)、缬氨酸(Val)、蛋氨酸(Met)、苯丙氨酸(Phe)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)和脯氨酸(Pro)。氨基酸衍生化试剂:(1) 硼酸缓冲液(Agilent PN:5061-3339):0.4 mol/L 水溶液,pH 10.2;(2) 邻苯二甲醛(OPA)试剂(Agilent PN:5061-3335):10 mg/mL,溶于0.4 mol/L 硼酸缓冲液和3-巯基丙酸。甲醇和乙腈,HPLC 级,美国Sigma-Aldrich 试剂;超纯水(自制)。除特殊要求外,其余均为国产分析纯试剂。
1.2 主要仪器设备
6CHM-901 型电热式碧螺春烘干机(浙江省富阳茶叶机械总厂)。安捷伦1260 Infinity 液相色谱系统,包括四元泵(G1311C VL)、标准自动进样器(G1329B)、柱温箱(G1316A)和二极管阵列检测器(G1315D VL);化学工作站:ChemStation for LC 3D systems Rev. B.04.03。ACD-0502-U 实验室超纯水系统(重庆颐洋企业发展有限公司);PL203 电子天平(美国Mettler-Toledo 集团);PB-21 标准型pH 计(德国Sartorius 公司);GM-0.33A 隔膜真空泵和1L 溶剂过滤器(天津市津腾实验设备有限公司);DHG-9246A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);A11basic 分析研磨机;MS3 BASIC 小型涡旋混合器(德国IKA 集团)。
1.3 方法
茶样制备将电热式碧螺春烘干机升温至180 ℃,开启风机,投入鲜叶150~180 g,进行热风杀青(先闷后透,温度100 ℃~105 ℃,约10 min),再将茶样转入电热恒温鼓风干燥箱,80 ℃烘至足干,冷却后用锡箔袋真空密封包装,于-20 ℃冷冻保存备用。各供试茶样根据其鲜叶来源(茶树品种、芽叶嫩度和采摘季节)可划分为6 个类群(表1):绿茶品种春季幼嫩鲜叶(YGS)、绿茶品种春季成熟鲜叶(MGS)、乌龙茶品种春季幼嫩鲜叶(YOS)、乌龙茶品种春季成熟鲜叶(MOS)、乌龙茶品种秋季幼嫩鲜叶(YOA)和乌龙茶品种秋季成熟鲜叶(MOA)。
表1 茶样编码及其鲜叶来源Table 1 Codes of tea samples and fresh leaf sources
游离氨基酸组分测定(1) 茶样预处理:准确称取0.400 g 粉碎茶样(过40 目筛),置50 mL 具塞试管中,加入40 mL 蒸馏水,沸水浴充分浸提1 h(30 min 时摇匀1 次),冷却后加水定容至40 mL, 摇匀后滤去茶渣,茶汤经0.45μm 水膜过滤待测;(2)柱前衍生化自动进样程序:吸取2.5μL 硼酸盐缓冲液→吸取0.5μL 样品,混合,等待0.5 min→用水清洗针头→吸取0.5μL OPA,混合→用水清洗针头→吸取32.5μL 水,混合→进样;(3) 色谱分析条件: 色谱柱:ZORBAX Eclipse-AAA (4.6 mm×150 mm, 粒径:5μm,美国Agilent 公司),柱温40 ℃;流动相:40 mmol/L Na2HPO4(A 相,pH7.8)和乙腈:甲醇:水(45:45:10,V/V/V)(B 相)。梯度洗脱程序:100% A (0 min)→100% A (1.9 min)→43% A、57% B (18.1 min)→100% B(18.6 min)→100% B (22.3 min)→100% A (23.2 min)→100% A (26 min),后运行时间: 3 min。进样量:10μL;流速:2 mL/min;检测波长:338 nm。(4) 游离氨基酸定量:在100μL 的氨基酸混和标样中加入1μL茶氨酸(20 mg/mL)和1μLγ-氨基丁酸(2 mg/mL),稀释成4 个浓度梯度(25、50、125 和250 pmol/mL), 并按步骤(2)和(3)进行氨基酸标准品的自动在线衍生化检测。随后以游离氨基酸色谱峰面积为纵坐标,氨基酸进样浓度为横坐标绘制标准曲线,并将其应用于供试茶样中游离氨基酸组分的定量分析[18]。茶样干物质含量参照GB/T 8303—2013,采用120 ℃烘干法测定[19]。
1.4 统计分析
预先将液相色谱化学工作站ChemStation B.04.03创建的各供试茶样游离氨基酸组分数据文件转换成标准AIA 格式文件,并将其导入到化学指纹图谱系统解决方案软件ChemPattern 2017 [科迈恩(北京)科技有限公司]进行各检出峰定性、多组分定量、色谱图绘制和供试茶样游离氨基酸组成轮廓的可视化模式识别[主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)]。采用SIMCA 17 (德国Sartorius Stedim Data Analytics AB 公司)确定各PLS-DA 模型的最佳潜变量数,开展所构建模型的交互验证预测残差的方差分析(CV-ANOVA)和置换检验(n=200), 同时应用R 4.0.5 软件(奥地利维也纳统计计算R 基金会)及其程序包agricolae 1.3-5 (秘鲁拉莫利纳国立农业大学)对不同鲜叶来源茶样的氨基酸总量及其组分进行单因素方差分析(One-Way ANOVA)和组间差异显著性比较(LSD 法,P值采用Bonferroni 校正)。
2 结果和分析
2.1 茶样游离氨基酸组成轮廓的模式识别
从图1 和2 可见,各供试茶样游离氨基酸的高效液相色谱轮廓相似,且均以THE 色谱峰响应值最高,其次为谷氨酸、天冬氨酸、酪氨酸和精氨酸,而半胱氨酸、蛋氨酸、苯丙氨酸、异亮氨酸和亮氨酸等仅在部分茶样中少量检出。
图1 茶样的游离氨基酸高效液相色谱图。自上而下依次为YGS1~YGS10、MGS1~MGS10、YOS1~YOS10、MOS1~MOS10、YOA1~YOA10 和MOA1~MOA10。Fig. 1 HPLC of FAAs in tea samples. From top to bottom are YGS1-YGS10, MGS1-MGS10, YOS1-YOS10, MOS1-MOS10, YOA1-YOA10 and MOA1-MOA10, respectively.
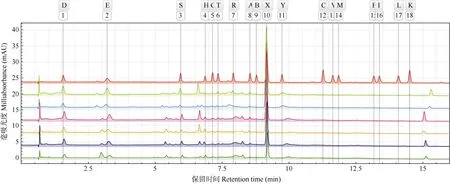
图2 代表性茶样游离氨基酸的高效液相色谱图。自上而下依次为氨基酸标准品(AAS)、YGS1、MGS1、YOS1、MOS1、YOA1 和MOA1。D: 天冬氨酸; E: 谷氨酸; S: 丝氨酸; H: 组氨酸; G: 甘氨酸; T: 苏氨酸; R: 精氨酸; A: 丙氨酸; B: γ-氨基丁酸; X: 茶氨酸; Y: 酪氨酸; C: 半胱氨酸; V: 缬氨酸;M: 蛋氨酸; F: 苯丙氨酸; I: 异亮氨酸; L: 亮氨酸; K: 赖氨酸。Fig. 2 HPLC of FAAs in representative tea samples. From top to bottom are amino acid standard (AAS), YGS1, MGS1, YOS1, MOS1, YOA1 and MOA1. D:Aspartic acid; E: Glutamate; S: Serine; H: Histidine; G: Glycine; T: Threonine; R: Arginine; A: Alanine; B: Gamma aminobutyric acid; X: Theanine; Y:Tyrosine; C: Cysteine; V: Valine; M: Methionine; F: Phenylalanine; I: Isoleucine; L: Leucine; K: Lysine.
分别以各游离氨基酸含量最小值的1/5 对相应游离氨基酸进行缺失值填充,并通过基于变量均一化预处理的PCA 建模结果表明,全部供试茶样的游离氨基酸组成化学模式可用3 个主成分来刻画,其方差贡献度分别为31.11% (PC1)、25.34% (PC1)和10.20% (PC3),累积方差贡献率达66.65%。由图3可见,不同来源茶样在前2 个主成分(PC1×PC2)二维得分视图的平面分布可按茶树品种特性(绿茶vs乌龙茶)划分成2 大类群(半胱氨酸、γ-氨基丁酸、赖氨酸、甘氨酸、和亮氨酸等为主要区分性成分),同时各茶样亦可根据芽叶嫩度(幼嫩vs成熟)和采摘季节(春季vs秋季)进行一定的类群区分,具体表现为:(1) 相同芽叶嫩度茶鲜叶可按茶树品种特性进行相互间的类群区分(YGSvsYOS、MGSvsMOS);(2) 春季乌龙茶品种相较绿茶品种鲜叶具有更为明显的芽叶嫩度区分,且秋季乌龙茶鲜叶亦有较明显的采摘嫩度区分(YOSvsMOS、YOAvsMOA);(3) 相同芽叶嫩度的乌龙茶鲜叶存在较明显的采摘季节差异(YOSvsYOA、MOSvsMOA),并以秋季鲜叶和成熟鲜叶样品的群体分布较春季鲜叶样品更为聚集。
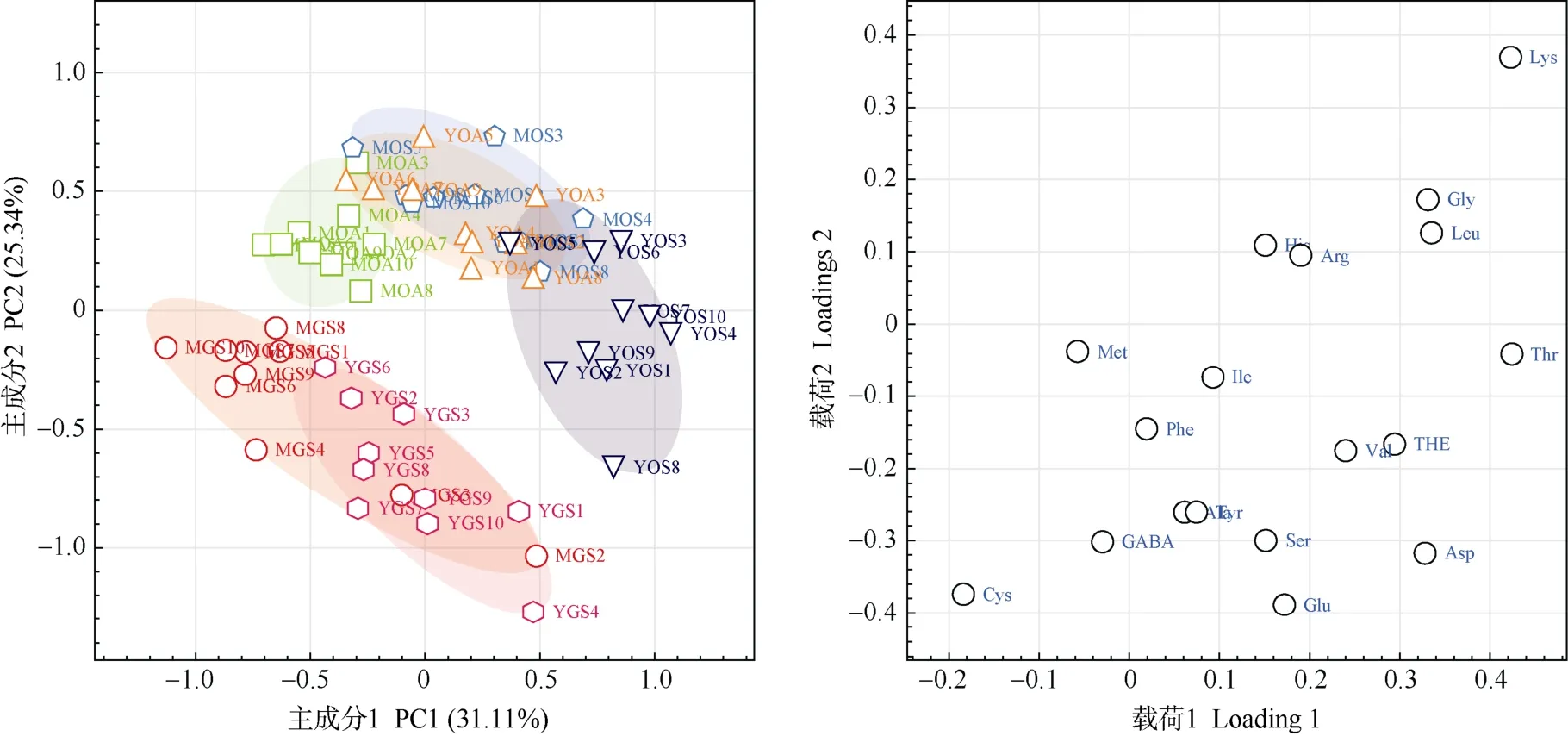
图3 基于供试茶样游离氨基酸组成轮廓的主成分分析。YGS1~YGS10、MGS1~MGS10、YOS1~YOS10、YOA1~YOA10、MOS1~MOS10 和MOA1~MOA10 见表1; Asp: 天冬氨酸; Glu: 谷氨酸; Ser: 丝氨酸; His: 组氨酸; Gly: 甘氨酸; Thr: 苏氨酸; Arg: 精氨酸; Ala: 丙氨酸; GABA: γ-氨基丁酸; THE: 茶氨酸; Tyr: 酪氨酸; Cys: 半胱氨酸; Val: 缬氨酸; Met: 蛋氨酸; Phe: 苯丙氨酸; Ile: 异亮氨酸; Leu: 亮氨酸; Lys: 赖氨酸。下同Fig. 3 Principal component analysis based on FAAs profile in tea samples. YGS1-YGS10, MGS1-MGS10, YOS1-YOS10, YOA1-YOA10, MOS1-MOS10, and MOA1-MOA10 see Table 1. Asp: Aspartic acid; Glu: Glutamate; Ser: Serine; His: Histidine; Gly: Glycine; Thr: Threonine; Arg: Arginine; Ala: Alanine; GABA:Gamma aminobutyric acid; THE: Theanine; Tyr: Tyrosine; Cys: Cysteine; Val: Valine; Met: Methionine; Phe: Phenylalanine; Ile: Isoleucine; Leu: Leucine; Lys:Lysine. The same below
PLS-DA 建模结果表明(图4, 5),绿茶与乌龙茶品种春季幼嫩鲜叶(YGSvsYOS)、绿茶与乌龙茶品种春季成熟鲜叶(MGSvsMOS)、春季乌龙茶品种幼嫩与成熟鲜叶(YOSvsMOS)、秋季乌龙茶品种幼嫩与成熟鲜叶(YOAvsMOA)、春季和秋季乌龙茶品种幼嫩鲜叶(YOSvsYOA)及春季和秋季乌龙茶品种成熟鲜叶(MOSvsMOA)在前2 个潜变量(LV1×LV2)二维得分视图的平面分布均具有良好的类群区分。通过7 次循环交互验证(7-fold CV)确定各判别分析模型的最优潜变量数,并采用交互验证预测残差的方差分析(CV-ANOVA)和置换检验(n=200)对模型的有效性检验结果显示,各模型两组间均有极显著差异(P<0.01),且不存在过拟合现象。这表明乌龙茶与绿茶品种春季幼嫩鲜叶或成熟鲜叶的游离氨基酸组成化学模式存在客观的类群区分,且其亦受芽叶嫩度和采摘季节的影响。

图4 基于供试茶样游离氨基酸组成轮廓的偏最小二乘判别分析Fig. 4 Partial least squares discriminant analysis based on the free amino acids profile in tea samples
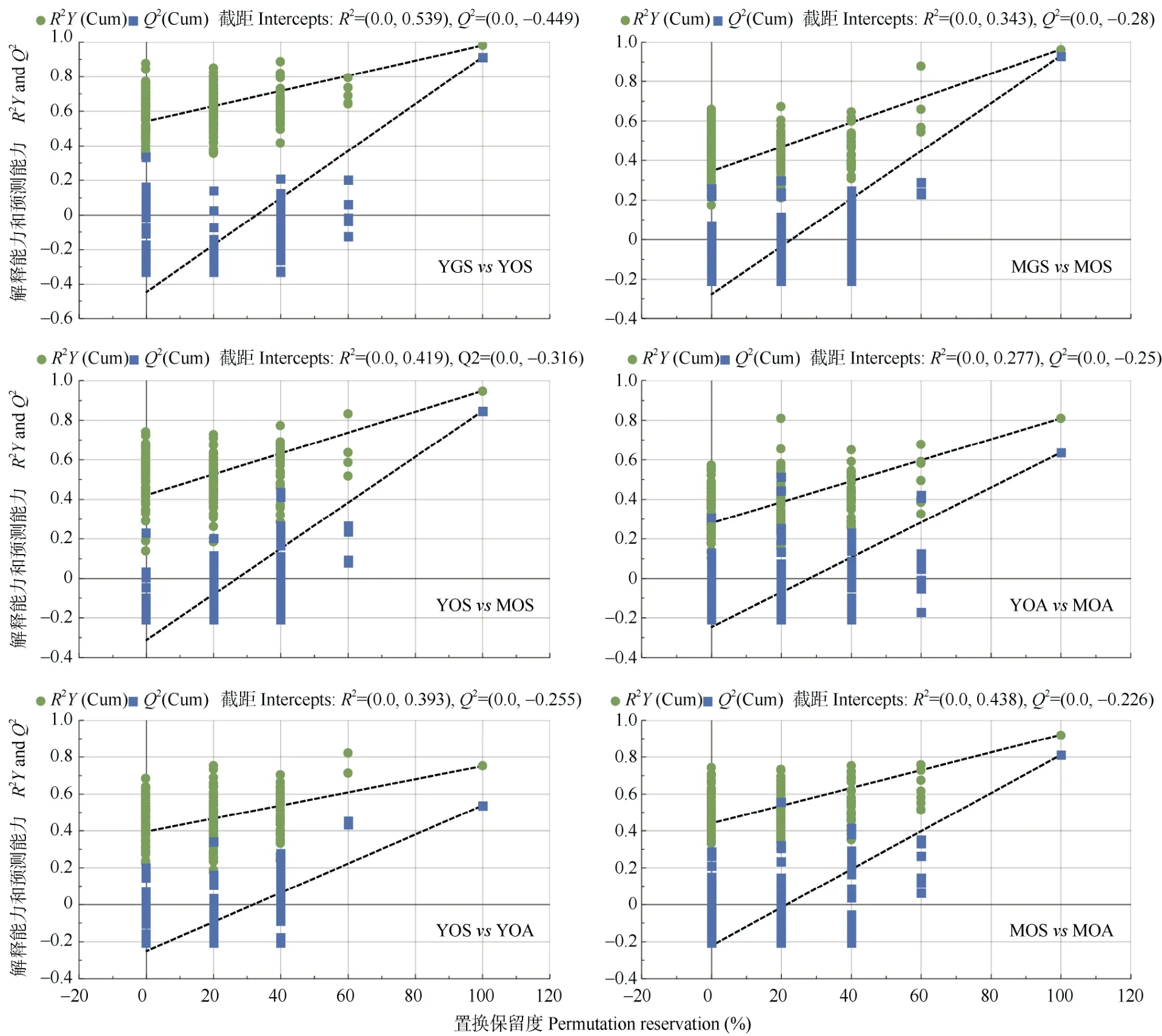
图5 不同鲜叶来源茶样偏最小二乘判别分析模型的响应排序检验Fig. 5 Permutation test of partial least squares discriminant analysis for tea samples from different fresh leaf sources
2.2 乌龙茶品种鲜叶游离氨基酸组成特征分析
One-Way ANOVA 结果表明,不同类群茶样的游离氨基酸总量有极显著差异(P<0.01),且其他游离氨基酸组分(除蛋氨酸和异亮氨酸外)亦有显著(P<0.05)或极显著差异(表2)。结合PLS-DA 模型中的变量投影重要性(VIP>1)和多重比较分析(LSD 法)结果表明: (1) 较高的GABA 含量和较低的甘氨酸、亮氨酸、赖氨酸含量是区分绿茶与乌龙茶品种春季幼嫩鲜叶(YGSvsYOS)的主要差异性成分,而较高的γ-氨基丁酸、酪氨酸、半胱氨酸含量和较低的甘氨酸、苏氨酸、亮氨酸、赖氨酸含量则是区分绿茶与乌龙茶品种春季成熟鲜叶(MGSvsMOS)的主要差异性成分;(2) 较高的天冬氨酸、谷氨酸、丝氨酸、精氨酸、茶氨酸和酪氨酸含量是区分春季乌龙茶品种幼嫩与成熟鲜叶(YOSvsMOS)的主要差异性成分,而较高的精氨酸和赖氨酸含量则是区分秋季乌龙茶品种幼嫩与成熟鲜叶(YOAvsMOA)的主要差异性成分;(3) 较高的天冬氨酸、谷氨酸、茶氨酸和缬氨酸含量是区分春季和秋季乌龙茶品种幼嫩鲜叶(YOSvsYOA)的主要差异性成分,而较高的亮氨酸和赖氨酸含量则是区分春季和秋季乌龙茶品种成熟鲜叶(MOSvsMOA)的主要差异性成分。由此可见,较高的甘氨酸、亮氨酸、赖氨酸含量和较低的γ-氨基丁酸含量是乌龙茶品种有别于绿茶品种春季鲜叶的主要差异性成分;相同采摘季节的乌龙茶品种幼嫩鲜叶相较成熟鲜叶拥有更高的精氨酸含量,而不同芽叶嫩度的春季和秋季乌龙茶鲜叶存在不同的差异特征组分。
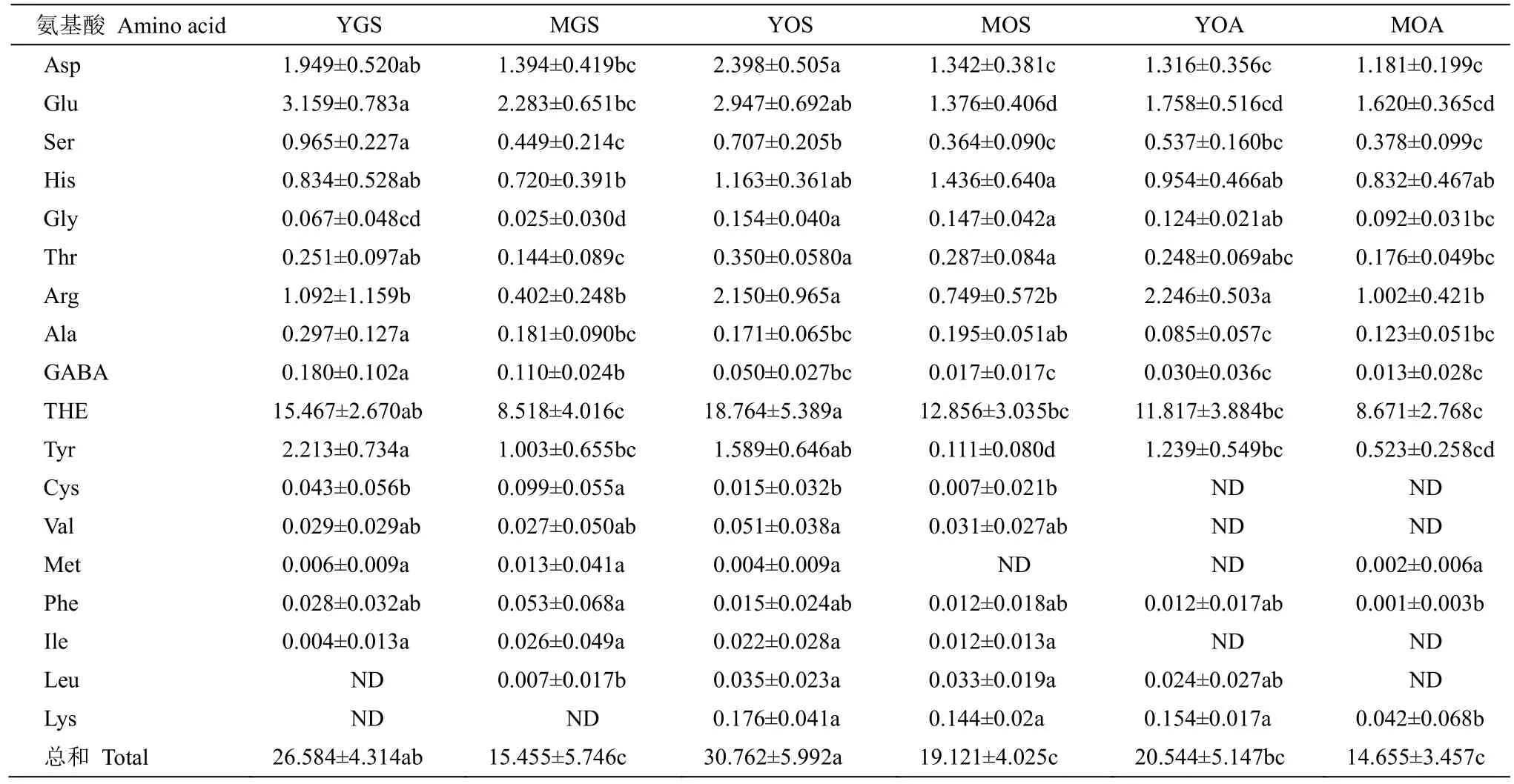
表2 茶样游离氨基酸组分的含量(mg/g DW)Table 2 Free amino acid contents (mg/g DW) in tea samples
3 结论和讨论
3.1 乌龙茶与绿茶品种春季鲜叶游离氨基酸组成存在模式差异
尽管受鲜叶原料特性和制茶工艺技术的影响,不同茶类中游离氨基酸组成特征存在一定的规律性差异。Horanni 等[20]对白茶、绿茶、红茶、乌龙茶和普洱茶共86 份茶样的研究表明,白茶拥有最高的游离氨基酸和较高的γ-氨基丁酸、天冬酰胺含量,且游离氨基酸(尤其是精氨酸)含量与茶样氧化(发酵)程度呈反比。Zhou 等[21]对市售白茶、绿茶、红茶、乌龙茶和黑茶共28 份茶样进行检测,结果表明绿茶具有较高含量的鲜爽味氨基酸(天冬氨酸、谷氨酸和茶氨酸),而白茶则以鲜甜味氨基酸(甘氨酸、丝氨酸、苏氨酸和脯氨酸)更为丰富;茶氨酸、精氨酸、天冬氨酸和谷氨酸可作为区分不同发酵程度茶类的主要差异成分。Alcazar 等[22]对绿茶、白茶、红茶、乌龙茶和普洱茶共94 份茶样的游离氨基酸进行检测,将天冬酰胺、丙氨酸、亮氨酸、异亮氨酸、谷氨酸和丝氨酸作为输入变量,使用反向传播多层感知器(BPMLP)人工神经网络可对全部茶样按茶类进行100%区分。本试验通过PCA 建模能有效呈现茶树品种特性、芽叶嫩度和采摘季节对供试茶样游离氨基酸组成轮廓的影响,且春季供试茶样亦可按茶树品种特性划分成乌龙茶与绿茶品种两种类群。可见,在一致的生育树龄、生态环境和栽培管理条件下,春季茶鲜叶中游离氨基酸组成(含量和比例)的模式差异可作为区分乌龙茶与绿茶品种的重要生化鉴别依据。
3.2 低含量氨基酸为区分乌龙茶与绿茶品种的主要标识性成分
乌龙茶鲜叶原料通常采自乌龙茶品种顶芽形成驻芽的幼嫩新梢(即中小开面二至四叶),这与其他茶类对鲜叶原料的采摘标准存在较大差异。已有研究表明,在乌龙茶品种茶树新梢生育过程中,游离氨基酸(尤其是茶氨酸)将发生明显的增减变化[23]。通过比较不同鲜叶来源茶样的游离氨基酸总量可以看出,春季绿茶和乌龙茶幼嫩鲜叶中的游离氨基酸总量均显著高于成熟鲜叶。另从本试验可以看出,芽叶嫩度对乌龙茶品种鲜叶游离氨基酸组成轮廓的影响仅次于茶树品种特性引起的茶样类群区分。值得关注的是,甘氨酸、亮氨酸、赖氨酸和γ-氨基丁酸等低含量氨基酸为区分乌龙茶与绿茶品种的主要标识成分,而茶氨酸、谷氨酸、天冬氨酸和精氨酸等含量较高的游离氨基酸则为春季乌龙茶品种幼嫩与成熟鲜叶(YOSvsMOS)的主要差异性成分,据此表明茶鲜叶中高含量的游离氨基酸对乌龙茶品种鉴别并无主导作用。由于茶鲜叶中特有的茶氨酸高含量特征及各游离氨基酸比例分布的不均衡性,本试验采用邻苯二甲醛(OPA)柱前衍生反相高效液相色谱(紫外吸收)法对供试茶样中低含量的游离氨基酸检出能力较为有限。近年融合生物小分子(分子量<1 000)高通量检测和大数据分析的代谢组学作为系统生物学研究的重要组成部分,其基本方法被逐步应用于茶叶生化成分及其代谢与转化机制研究[24–25]。因此,随着现代仪器分析检测技术的快速发展及其在茶树品种鉴定领域的深入应用,同时选择多绿茶品种为对照,相信更多乌龙茶品种鲜叶的生化组成特征将会被不断挖掘出来,从而有效推动高香或特色乌龙茶新品种的选育与鉴定。
综上,茶树品种、芽叶嫩度和采摘季节均为影响茶鲜叶的游离氨基酸组成轮廓的重要因素, 其中茶树品种遗传特性是影响茶树鲜叶游离氨基酸组成轮廓的主导因子。茶叶中的游离氨基酸组成、含量及其降解和转化产物可直接或间接地影响茶叶的风味品质,故乌龙茶特定的鲜叶游离氨基酸组成化学模式为其加工品质的形成提供了必要的物质基础。
