西葫芦CpWRKY2 基因的分离、鉴定及其对非生物胁迫分析
2023-12-21刘建汀曾美娟张前荣叶新如陈敏氡裘波音王彬李永平朱海生温庆放
刘建汀, 曾美娟, 张前荣, 叶新如, 陈敏氡, 裘波音, 王彬, 李永平,朱海生, 温庆放
(福建省农业科学院作物研究所, 福建省蔬菜遗传育种重点实验室, 福建省蔬菜工程技术研究中心, 福州 350013)
植物生长发育过程中往往面临各种生物和非生物胁迫,并在长期进化过程中形成了复杂的自我防御反应调控网络。WRKY 是一类植物特异的转录因子,广泛参与植物生长发育代谢、生物和非生物胁迫(温度、干旱等)调控[1–4]。研究表明,WRKY 家族成员的典型特征是含有1 或2 个由约60 个氨基酸构成的高度保守WRKY 结构域,其5′端包含保守的WRKYGQK 基序(极少数突变为WRKYGKK、WRKYGMK、WRKYGEK 等),3′端则含有1 个保守的锌指结构基序,可以特异结合下游靶基因启动子核心序列中的W-box 顺式元件,激活或抑制下游基因的表达,并对生物和非生物胁迫反应,改变植株的耐逆性[5–6]。根据WRKY 的结构数目和特点,WRKY 转录因子可分为3 类,第一类(Ⅰ)含有2 个WRKY 保守结构域,锌指结构为C2H2型;第二类(Ⅱ)含有1 个WRKY 结构域,锌指结构均为C2H2型, 又可细分为5 个亚类(Ⅱa~Ⅱe);第三类(Ⅲ)含有1 个WRKY 结构域,锌指结构为C2HC 型[7–8]。目前, 从植物中分离到的WRKY 类转录因子大多都定位于细胞核中,且大部分WRKY 含有核定位信号保守基序[9]。
近年来,西葫芦(Cucurbitapepo)的栽培面积仅次于黄瓜(Cucumissativus),己经成为农民增收、农业产业结构调整的重要栽培作物。西葫芦易受低温、干旱等非生物胁迫影响,造成落花落果、果实畸形以及多种病害等生理障碍,导致产量与品质严重下降[10–11]。据PlantTFDB v5.0 统计,目前已分离出约94 个拟南芥、125 个马铃薯(Solanumtuberosum)、109 个水稻(Oryzasativasubsp.indica)、69 个辣椒(Capsicumannuum)和88 个黄瓜WRKY 转录因子。植物通过信号传导并产生一系列应答基因表达产物,以减少胁迫产生的伤害和增加耐受性,WRKY蛋白起着重要的调控作用。WRKY 对逆境胁迫反应主要依赖于脱落酸(ABA)[12]、水杨酸(SA)[13–14]、茉莉酸(MeJA)[15]和乙烯利(ETH)[16]等激素信号转导途径,WRKY 能够直接与自身或下游基因启动子中的W-box 结合,正向或负向调控下游靶基因的表达,形成复杂的信号调控网络,从而增强或降低植物对环境的耐受能力[17–18]。玉米(Zeamays)的ZmWRKY79通过激活下游靶基因ZmAAO3的表达并增加ABA 激素合成来提高耐旱能力[19];在黄瓜的CsWRKY46通过介导ABA激素响应积极参与低温胁迫反应防御[20];番茄(Lycopersiconesculentum)中20 个SlWRKYs基因通过结合下游基因或与其他转录因子形成的复合体参与ICE-CBF-COR 低温调控途径[21];密罗木(Myrothamnusflabellifolia)中MfWRKY17的过量表达可以调控ABA 响应基因(靶基因MfNECD3和MfRAB18),以提高转基因拟南芥(Arabidopsisthaliana)植株的耐盐和抗旱性[22];狗牙根(Cynodondactylon)的CdWRKY2基因受低温诱导显著上调表达,并提高转基因植株的抗寒性, CdWRKY2 能特异地结合到CdSPS1和CBF2启动子的W-box 元件并激活其表达,协调介导蔗糖的合成和CBF 信号通路,调控植物的抗寒性[23]。目前,除本研究团队2020 年报道了2 个WRKY基因外,还鲜见西葫芦其他WRKY基因的克隆和功能分析研究。
前期田间育种过程中发现西葫芦‘福美6 号’容易受低温、干旱等逆境胁迫影响,引起产量和品质的下降。本研究以‘福美6 号’为材料,采用转录组测序技术从叶片中克隆获得CpWRKY2基因,对基因结构、编码蛋白的生物信息学及其表达模式进行了分析,探讨CpWRKY2在西葫芦非生物胁迫响应过程中的调控作用,为开展西葫芦优良品种的选育以及非生物胁迫防御反应的分子机理研究提供科学依据。
1 材料和方法
1.1 材料
试验材料西葫芦‘福美6 号’ (Cucurbitapepo‘Fumei 6’)由福建省蔬菜遗传育种重点实验室福清东张基地(119.18° E,25.69° N)保存[10]。植物DNA提取试剂盒FastPure®Plant DNA Isolation Mini Kit、DNA Marker (DL 2000)、植物RNA 提取试剂盒Fast-Pure®Plant total RNA Isolation Kit、RNA 逆转录试剂盒PrimeScriptTM1st Strand cDNA、限制性内切酶SacⅠ和BamH Ⅰ购于TaKaRa 公司,基因扩增试剂盒Phanta Max Master Mix、荧光定量试剂盒ChangesQTMUniversal SYBR qPCR Master Mix、DL2000 plus DNA Marker、质粒抽提试剂盒FastPure®Plasmid Mini Kit、DNA 产物纯化试剂盒FastPure®Gel DNA Extraction Mini Kit、同源重组试剂盒ClonExpress Ultra One Step Cloning Kit、DNA 快速克隆试剂盒TA/Blunt-Zero Cloning Kit 购自南京诺唯赞生物科技有限公司,瞬时表达载体PC1300S-GFP由本实验室保存,大肠杆菌DH5α和农杆菌GV3101 菌株均购自上海唯地生物技术有限公司,其他生化试剂均为国产分析纯级。
1.2 WRKY 基因及其上游启动子扩增
参考植物DNA 试剂盒说明书提取西葫芦样品的DNA,根据西葫芦全基因组数据库和前期转录组测序库中搜索到的CpWRKY2基因信息,设计基因启动子和全长克隆引物(表1),PCR 扩增产物经1.0%琼脂糖电泳、纯化、回收后,与PCE2TA/Blunt-Zero载体进行连接、转化大肠杆菌DH5α,PCR 检测后的阳性单克隆菌液送至福州尚亚生物科技有限公司进行测序验证。
表1 引物Table 1 Primers
1.3 蛋白生物信息学分析
采用在线工具包(SMS)(http://www.bio-soft.net/sms/index.html)进行基因和蛋白序列分析; DNAMAN软件和EditSeq 5.01软件分析蛋白的理化性质;进化树的最大似然法构建采用MEGA 7.0 软件; 保守结构域分析采用SMART 软件(http://smart.emblheidelberg.de/); 蛋白的一级结构分析采用ProtParam(http://web.expasy.org/protparam/)和ProtScale (http://web.expasy.org/protscale/)软件; 蛋白翻译后修饰采用MotifScan 软件(http://myhits.isb-sib.ch/cgibin/motif_scan); 蛋白信号肽分析采用SignalP 6.1 Server 软件(http://www.cbs.dtu.dk/services/SignalP/); 蛋白跨膜分析采用TMHMM Server v6.0 软件(http://www.cbs.dtu.dk/services/TMHMM/); 蛋白二级结构分析采用在线软件CFSSP (http://www.biogem.org/tool/choufasman/); 蛋白三级结构分析采用在线软件SWISSMODEL (https://swissmodel.expasy.org/interactive)进行蛋白模板比对,采用SPDBV 软件构建蛋白三级结构模型,采用VMD 软件进行蛋白模型呈现; 亚细胞定位分析采用Wolf Psort Prediction 软件(http://www.genscript.com/psort/wolf_psort.html)。
1.4 CpWRKY2 基因的表达分析
选取颗粒饱满的西葫芦种子,用0.2%高锰酸钾溶液进行浸泡消毒2 h,清水洗净晾干,在福建省蔬菜遗传育种重点实验室福清东张基地蔬菜育苗大棚内,播种于32 孔穴盘中,出现第2 片真叶后进行移栽,采集商品期的西葫芦根、茎、叶、花和果,利用百泰克试剂盒提取各组织的总RNA,反转录成cDNA 后,调整cDNA 浓度至50 ng/µL。根据获得的CpWRKY2序列设计特异引物(表1),以西葫芦Actin基因(GenBank 登录号:MH21108)为内参基因[24],利用ABI7500 Real-Time PCR system (美国ABI 公司),参考ChangesQTMUniversal SYBR qPCR Master Mix 说明书进行PCR 扩增,均开展3 次生物学和3 次技术重复实验。
1.5 不同处理下CpWRKY2 的表达分析
西葫芦种子发芽后播种于32 孔育苗盘中,在光照培养箱(28 ℃,16 h 光照/28 ℃,8 h 黑暗)中培养4 周后,在5 ℃、10% PEG 6000、0.1 mmol/L ABA、50 mmol/L ETH、10 mmol/L SA 和50 mmol/L MeJA分别处理幼苗20 株,在0、2、4、8 和12 h 采集叶片液氮速冻,并于–80 ℃冰箱保存备用。每处理3个生物学重复。
1.6 CpWRKY2 亚细胞定位分析
利用Primer3Plus 在线软件设计引物MQCp-WRKY2(表1),在CpWRKY2基因的开放读码框(ORF)两端加入酶切位点SacⅠ和BamH Ⅰ (去掉终止密码子),以测序验证后的重组质粒PCE2TA/Blunt-CpWRKY2为模板进行ORF 全长扩增和胶回收。用限制性内切酶BamHⅠ和SacⅠ对质粒pCAMBIA 1300-GFP(35S::GFP)进行双酶切。用同源重组连接酶将回收的CpWRKY2连接载体35S::GFP,转化至DH5α大肠杆菌感受态,经菌液PCR 及测序验证, 获得重组质粒35S::CpWRKY2::GFP。将重组质粒35S::CpWRKY2::GFP和对照空载质粒35S::GFP分别转入农杆菌GV3101 菌株中,挑取阳性的单克隆菌落于含有50μg/mL 利福平和50μg/mL 卡那霉素的LB液体培养基中培养,在28 ℃摇床以200 r/min 培养过夜;用含10 mmol/L MgCl2、10 mmol/L MES 和100 mmol/L 乙酰丁香酮的侵染液重悬农杆菌至OD600约为0.8,冰浴1 h 后,用无针头的10 mL 注射器将35S::CpWRKY2::GFP重组载体和35S::GFP空载体的菌液注射至烟草(Nicotianatabacum)下表皮。注射后的烟草置于室温黑暗放置24 h,然后于28 ℃气候箱中培养1 d。利用激光共聚焦显微镜(LEICA TCS SP8,德国莱卡)观察侵染烟草叶片,分析CpWRKY2蛋白的亚细胞定位情况。
1.7 数据分析
采用Excel 软件和2–ΔΔCT方法计算CpWRKY2基因的相对表达量,利用SPSS 19.0 软件中单因素方差分析法对CpWRKY2表达进行差异显著性分析。
2 结果和分析
2.1 CpWRKY 基因克隆
根据西葫芦全基因组信息,设计WRKY基因启动子引物QCpWRKY2,扩增得到西葫芦WRKY基因启动子序列长度为1 513 bp (图1)。通过设计基因全长引物,从西葫芦基因组中克隆得到1 条全长为1 349 bp 基因序列,同源性分析表明,该CDS 序列与同为南瓜属的中国南瓜(Cucurbitamoschata,XM_023091218.1,E value: 0)的WRKY序列相似性高达98.51%,经测序验证和比对分析,获得的WRKY基因(GenBank登录号: MF988287)[11]和NCBI中公布的西葫芦WRKY全基因组(XM_023676898.1)序列信息完全一致[25],将该基因命名为CpWRKY2。
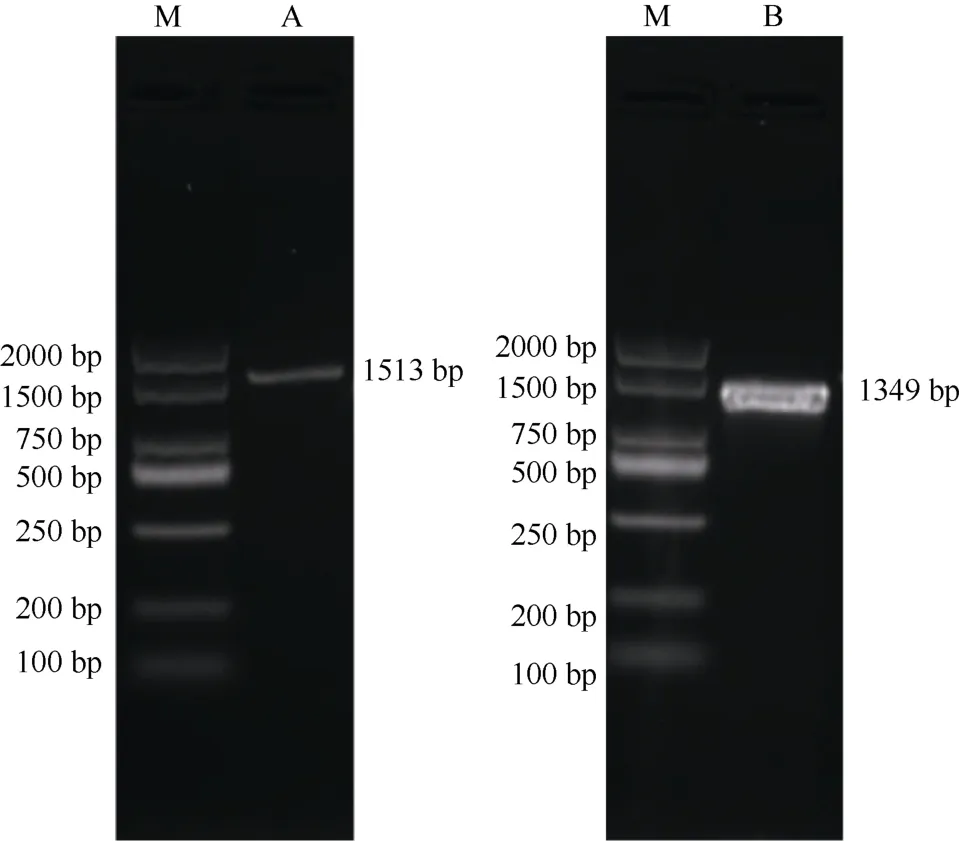
图1 西葫芦CpWRKY2 基因和启动子的PCR 扩增。 M: DL2000 marker;A: 启动子; B: CpWRKY2 基因。Fig. 1 PCR amplified of CpWRKY2 and promoter of Cucurbita pepo.M: DL2000 marker; A: Promoter; B: CpWRKY2 gene.
2.2 生物信息学分析
序列分析表明,CpWRKY2基因全长1 351 bp,上游和下游非编码区长度分别为193 和38 bp,基因编码区含有2 个内含子(第590~775,905~998 位)(图2)。预测CpWRKY2基因编码279个氨基酸(AA),CpWRKY2 蛋白(登录号: XP_023532666.1)理论分子量(Mw)为30.18 kD,等电点为9.29,pH 7.0 时的带电荷数为12.87。CpWRKY2 蛋白由20 种氨基酸构成,其中丝氨酸(Ser)含量最高(17.6%),丙氨酸(Ala)次之(9%),色氨酸(Trp)最低(0.7%)。CpWRKY2蛋白包含79 个疏水氨基酸(A、I、L、F、W 和V)、91 个极性氨基酸(N、C、Q、S、T 和Y)、34 个碱性氨基酸(K 和R)和23 个酸性氨基酸(D 和E)。Cp-WRKY2 蛋白的总平均疏水性(GRAVY)为–0.534, 蛋白不稳定系数(II)为48.37,脂肪族指数(AI)为68.60,预测为亲水性蛋白。

图2 CpWRKY2 基因全长及其编码氨基酸序列。红色: 特征序列WRKYGQK 和锌指结构域C2H2; 方框: 起始密码子(ATG)和终止密码子(TGA)。Fig. 2 Full-length sequence of CpWRKY2and encoding amino acid sequence. Red: Characteristic sequence WRKYGQK and C2H2 domain; Box: Start codon(ATG) and stop codon (TGA).
西葫芦CpWRKY2 蛋白的二级结构(CFSSP)分析表明,随机卷曲最多,为71.68%,其次为α螺旋和延伸链,分别占19.71%和6.81%,没有β转角结构。利用SWISS-MODEL、SPDBV 和VMD 软件进行三级结构建模和可视化作图(图3),拟参与WRKY转录激活功能的61 个保守结构域(204~ 264 位)由1个WRKYGQK (212~218 位)基序和C2H2(Cys: 232,238 位;His: 262, 64 位)锌指结构共同组成。
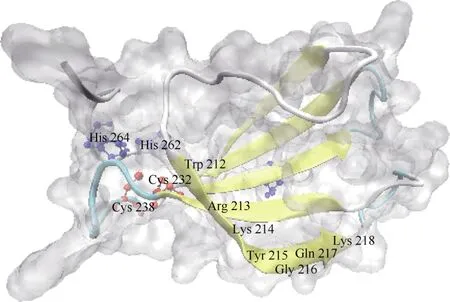
图3 CpWRKY2 的三级结构预测Fig. 3 Prediction of tertiary structure of CpWRKY2
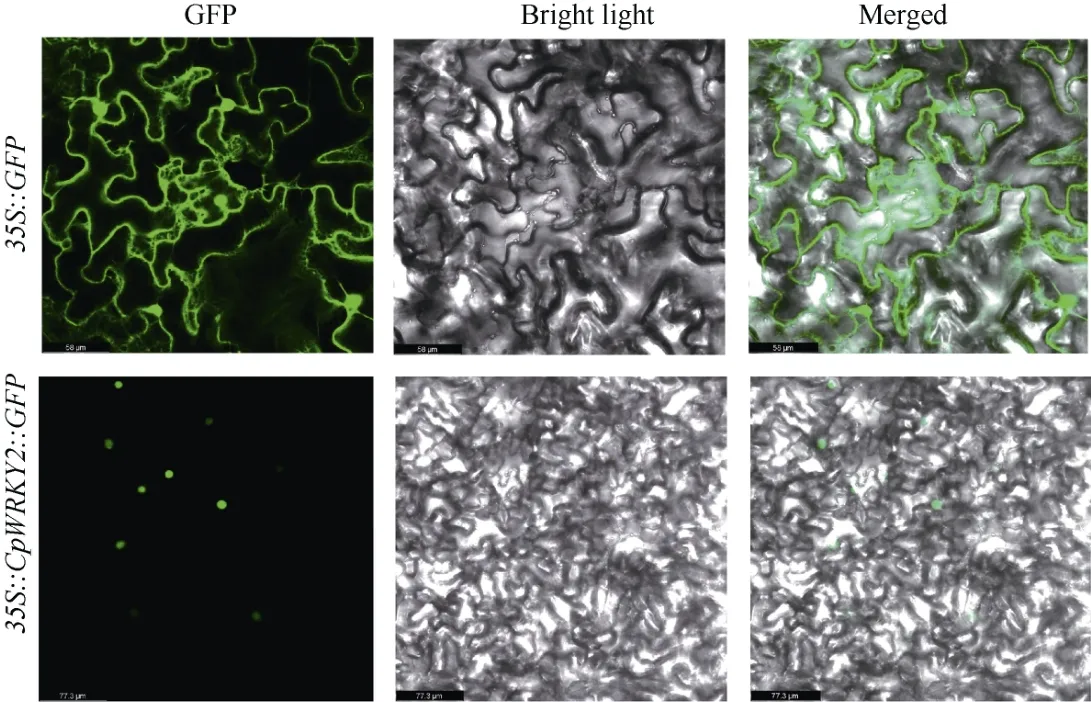
图 4 CpWRKY2 在本氏烟草下表皮细胞中的亚细胞定位。35S::GFP: 携带空载pCAMBIA1300-GFP 的农杆菌菌株;35S::CpWRKY2::GFP: 携带重组载体pCAMBIA1300-CpWRKY2-GFP 的农杆菌菌株。Fig. 4 Subcellular localization of CpWRKY2 in lower epidermal cells of Nicotiana benthamiana. 35S::GFP: Agrobacterium tumefaciens strain withe empty vector pCAMBIA1300-GFP; 35S::CpWRKY2::GFP: A. tumefaciens strain with recombinant vector pCAMBIA1300-CpWRKY2-GFP.
Motif Scan 在线软件分析表明,CpWRKY2 蛋白包含1 个保守的WRKY 结构域(201~267 位,E值为1.6e-24),206~266 位为WRKY 蛋白DNA 结合区域,锌指结构域(232~264 位)为C2H2型,且含有1 个保守RTGHARFRRAP (76~86 位)氨基酸序列,属于典型的Ⅱd 型WRKY 蛋白。分析表明,113~116 和263~266 位为N 糖基化位点;47~50 和267~270 位为酪蛋白激酶II 磷酸化位点;166~171 位为N-豆蔻酰化位点;33~35、74~76、156~158、167~169、181~183、184~186、199~201、211~213 和234~236位为蛋白激酶C 磷酸化位点。TMHMM 表明, Cp-WRKY2 属于非跨膜蛋白,不含跨膜螺旋区。SignalP分析表明,CpWRKY2 蛋白不含信号肽序列。CpWRKY2 中没有核定位信号保守基序。
蛋白亚细胞定位预测表明,CpWRKY2 转录因子位于细胞核中。通过农杆菌介导的烟草瞬时表达亚细胞定位分析表明,在注射空载体35S::GFP的对照组中,绿色荧光在细胞膜、细胞质和细胞核中均有分布,而注射瞬时表达载体35S::CpWRKY2::GFP的细胞中,仅在细胞核中有绿色荧光。说明CpWRKY2 蛋白定位在细胞核上,这与亚细胞定位预测结果一致,推测CpWRKY2 在细胞核内发挥转录调控作用(图4)。
从PlantTFDB (http://planttfdb.gao-lab.org/)转录因子数据库中下载了18 个CpWRKY2 同源蛋白的序列,利用MEGA7.0 软件构建CpWRKY2 (XP_023532666.1)、6 个葫芦科(Cucurbitaceae)、4 个十字花科(Brassicaceae)、4 个禾本科(Gramineae)和4 个茄科(Solanaceae)植物的WRKY 蛋白系统进化树。结果表明,西葫芦CpWRKY2 与中国南瓜、印度南瓜、黄瓜和甜瓜等葫芦科植物WRKY 聚为一类,亲缘关系较近,与烟草、番茄和马铃薯等茄科植物WRKY 蛋白的亲缘关系较远(图5)。
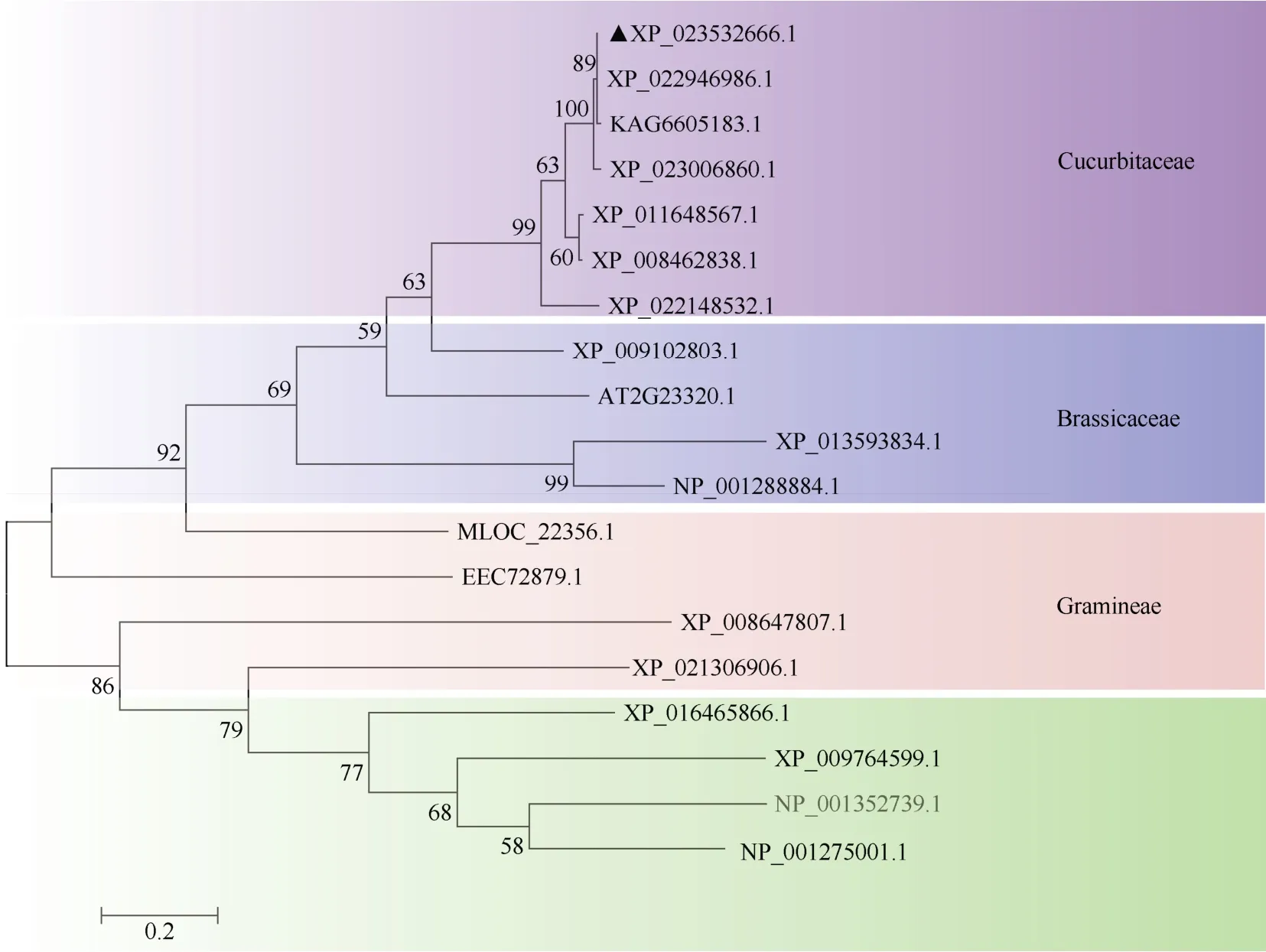
图5 WRKY 的系统进化树。XP_023532666.1: 西葫芦; XP_022946986.1: 中国南瓜; KAG6605183.1: 野生灰籽南瓜; XP_023006860.1: 印度南瓜; XP_011648567.1: 黄瓜; XP_008462838.1: 甜瓜; XP_022148532.1: 苦瓜; XP_009102803.1: 芜菁; AT2G23320.1: 拟南芥; XP_013593834.1: 甘蓝; NP_001288884.1: 欧洲油菜; MLOC_22356.1: 大麦; EEC72879.1: 水稻; XP_008647807.1: 玉米; XP_021306906.1: 高粱; XP_016465866.1, XP_009764599.1: 烟草; NP_001352739.1: 番茄; NP_001275001.1: 马铃薯。Fig. 5 Phylogenic tree of WRKY. XP_023532666.1: Cucurbita pepo; XP_022946986.1: C. moschata; KAG6605183.1: C. argyrosperma; XP_023006860.1: C.maxima; XP_011648567.1: Cucumis sativus; XP_008462838.1: C. melo; XP_022148532.1: Momordica charantia; XP_009102803.1: Brassica rapa;AT2G23320.1: Arabidopsis thaliana; XP_013593834.1: Brassica oleracea; NP_001288884.1: B. napus; MLOC_22356.1: Hordeum vulgare; EEC72879.1:Oryza sativa; XP_008647807.1: Zea mays; XP_021306906.1: Orghum bicolor; XP_016465866.1, XP_009764599.1: Nicotiana tabacum; NP_001352739.1:Lycopersicon esculentum; NP_001275001.1: Solanum tuberosum.
2.3 CpWRKY2 基因上游启动子分析
PlantCARE 启动子预测软件分析表明(表2),CpWRKY2基因启动子上游1 513 bp 具有许多顺式作用元件,其中包含ARE、ABRE、MBS、TC-rich repeat 和W-box 等胁迫响应元件,也存在光响应、昼夜节律响应等元件,暗示CpWRKY2基因可能受低温、弱光、干旱等非生物胁迫诱导表达。
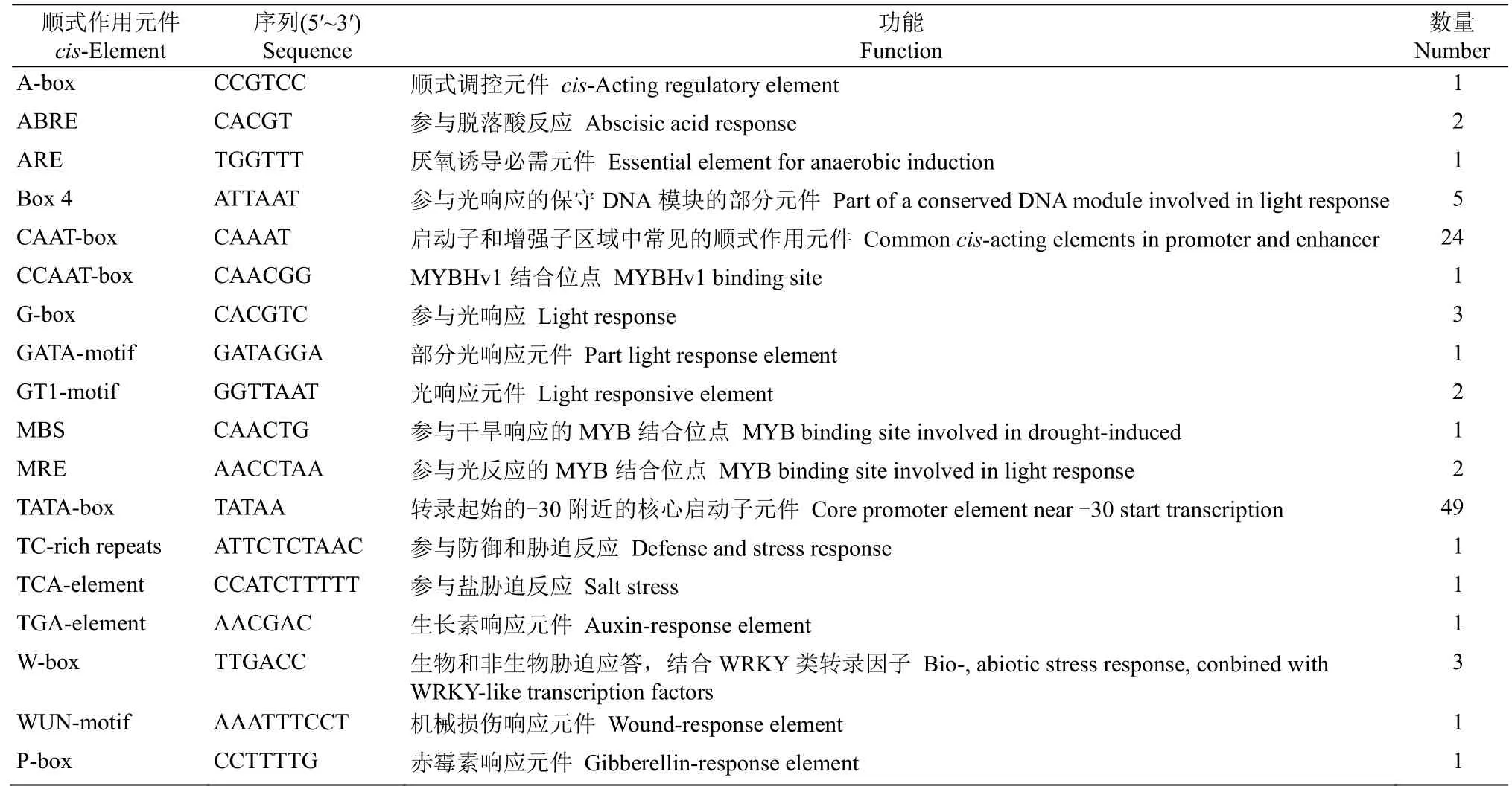
表2 PlantCARE 启动子预测Table 2 Promoter prediction by PlantCARE
2.4 CpWRKY2 基因表达模式分析
定量PCR 分析表明,CpWRKY2基因在西葫芦的根、茎、叶、花和果实中均有表达,其中,花中的表达丰度最高,其次为根和茎,在果实中的表达量最低,CpWRKY2基因表达呈现组织特异性(图6)。
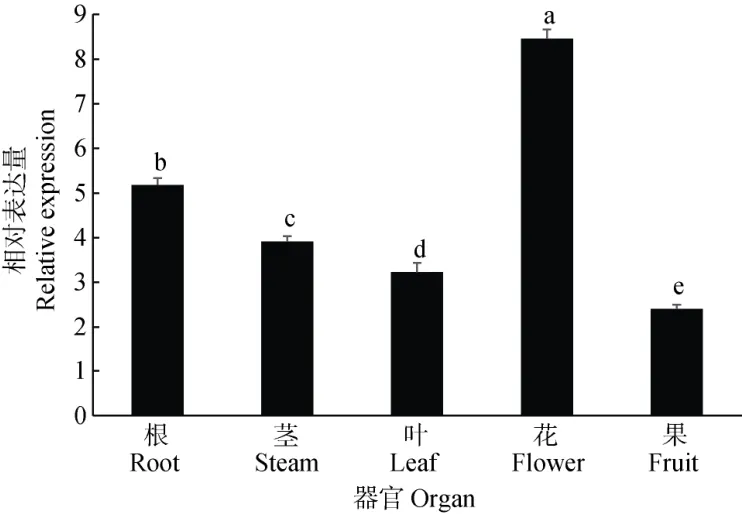
图6 CpWRKY2 的表达模式。柱上不同字母表示差异显著(P<0.05)。下同Fig. 6 CpWRKY2 Expression pattern of CpWRKY2. Different letters upon column indicate significant difference at 0.05 level. The same below
西葫芦幼苗经5 ℃低温处理,CpWRKY2在处理2、4 和6 h 有较高的表达丰度,12 h 后表达量降低,但表达量仍显著高于对照(0 h) (图7)。用10%PEG 6000 模拟干旱胁迫,CpWRKY2在处理4 h 内的表达无明显变化,处理8 h 后表达量显著高于对照,并在12 h 出现峰值。0.1 mmol/L ABA 处理后CpWRKY2呈现先上调后下调的表达趋势,处理2 h的表达量最高,为对照的23 倍,达极显著差异。CpWRKY2表达在50 mmol/L ETH 处理2 和4 h 上调,此后逐渐降低。CpWRKY2表达在10 mmol/L SA处理12 h 内总体呈上调趋势,在12 h 的表达丰度最高。CpWRKY2表达在50 mmol/L MeJA 处理2 和4 h 上升,此后逐渐降低,处理8 和12 h 的表达量低于对照。
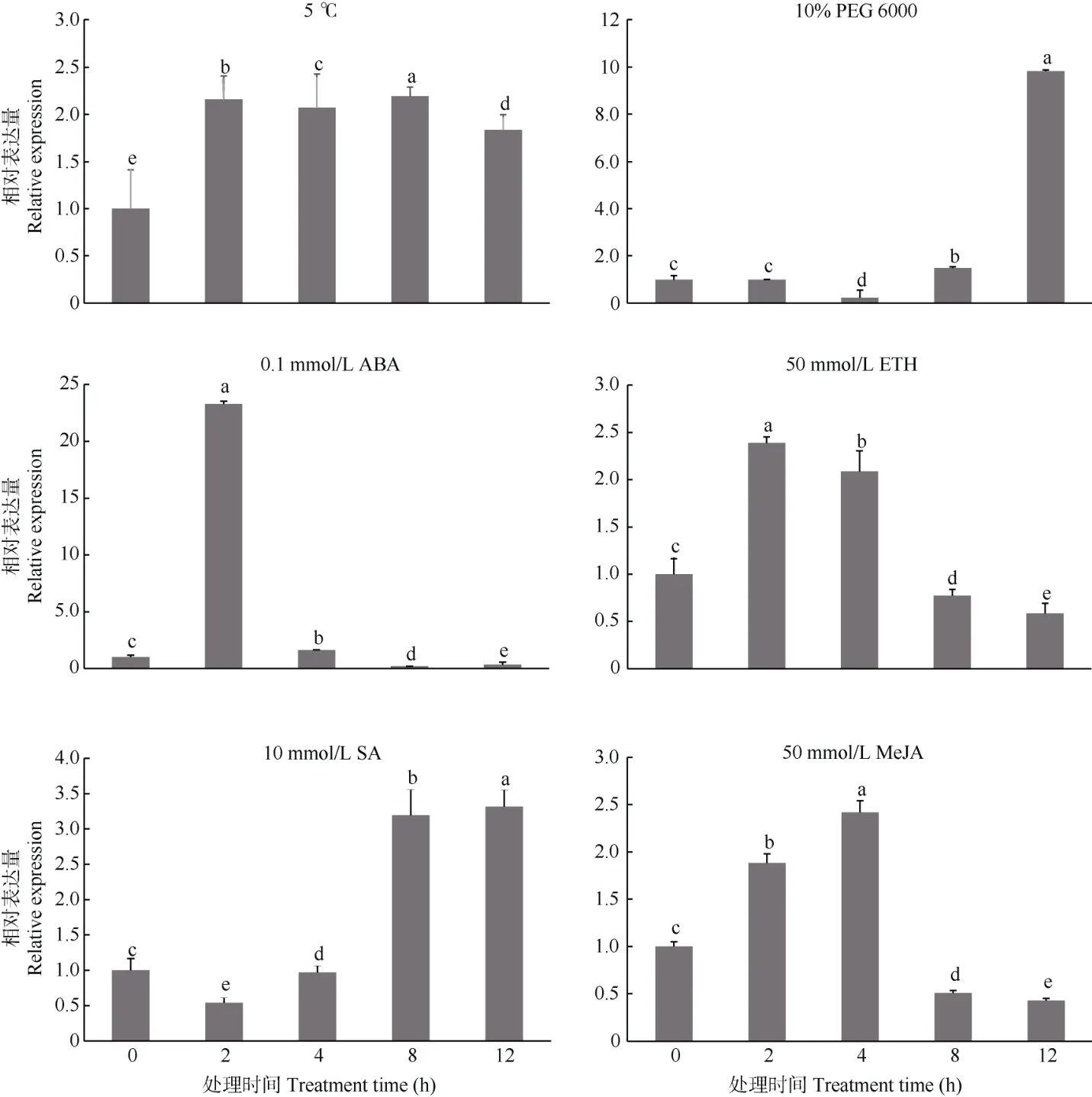
图7 不同胁迫下CpWRKY2 基因的表达模式Fig. 7 Expression pattern of CpWRKY2 gene under different stresses
3 结论和讨论
转录因子调节的应答胁迫转录重排在植物耐逆防御反应过程中起重要调节作用,并以多基因家族的形式存在,据PlantTFDB 统计。目前鉴定出的转录因子至少有58 种,主要包括NAC、MYB、WRKY、DREB/ERF 和M-type_MADS 等家族。随着转录组测序、全基因组测序等技术的快速发展,越来越多的WRKY基因被逐渐分离出来,植物中的WRKY 转录因子已达14 549 个,成为高等植物中最为常见及研究较多的转录因子家族之一[26]。研究表明,植物通过信号传导并产生一系列应答基因表达产物,以此减少胁迫产生的伤害并增加耐受性,WRKY 蛋白在此起着重要的调控作用。WRKY转录因子的基因克隆与功能鉴定研究在模式植物和其他作物中不断深入,但鲜见西葫芦中WRKY基因的克隆和分析的报道。本研究利用转录组测序技术,从西葫芦‘福美6号’叶片中克隆得到CpWRKY2转录因子基因,CpWRKY2的ORF 全长为840 bp,CpWRKY2 蛋白与中国南瓜(XP_022946987.1)和黄瓜(XP_011648567.1)同源蛋白的相似性分别为99.64%和86.39%,具有高度的蛋白进化保守性。Wolf Psort 在线预测和烟草瞬时表达分析表明,CpWRKY2 蛋白亚细胞定位于细胞核中。此外,Motif Scan 分析表明,CpWRKY2 蛋白包含WRKY 保守结构域(201~267 位)、WRKY 蛋白DNA 结合区域(206~266 位)和C2H2型(Cx5Cx23HX1H)锌指(232~264 位),且含有1 个RTGHARFRRAP 氨基酸保守基序,属于典型的Ⅱd 亚类WRKY 转录因子蛋白家族[27]。
本研究结果表明,CpWRKY2基因具有组织表达特异性,在花中的表达量较高,暗示CpWRKY2基因可能参与了西葫芦花期的发育调控[28–29]。目前已识别和克隆的WRKY 转录因子在各种环境(干旱、低温、盐、机械损伤等)的诱导下,其表达具有快速、瞬时等特点,同时还具有组织表达特异性,可通过介导ETH、SA、ABA 和MeJA 等信号通路对多种逆境胁迫进行防疫反应[30–32]。WRKY 转录因子上游启动子的顺式作用元件是其参与何种逆境胁迫响应的重要依据,本研究通过PlantCARE 在线网站预测CpWRKY2上游启动子1 513 bp 内包括1 个胁迫响应元件ARE、2 个脱落酸(ABA)响应元件ABRE、1 个MBS 干旱胁迫响应的MYB 结合响应元件、1 个TCrich repeat 防御和胁迫反应元件以及3 个结合WRKY响应生物和非生物胁迫响应的W-box 元件[33–35]。经RT-qPCR 验证,在5 ℃、PEG 6000 模拟干旱胁迫、ABA、ETH、SA 和MeJA 处理后,CpWRKY2均出现不同程度的上调表达,暗示CpWRKY2基因可能参与多种非生物逆境,包括低温、干旱等胁迫的调控,这与课题组前期对CpWRKY2基因在低温弱光胁迫中的研究结果一致[11]。进一步分析表明,正常情况下,CpWRKY2在西葫芦叶片的表达量相对较低,但ABA 处理后呈先上调后下调的表达趋势,可能受其他WRKY 蛋白或CpWRKY2 上游启动子中含有的W-box (TTGACC)结合而调控自身表达,或在此响应过程中受其他转录因子的竞争抑制影响而呈现下调表达[36–37]。因此,推测CpWRKY2可能通过ABA信号途径介导并参与多种胁迫反应。但对非生物胁迫下西葫芦中CpWRKY2的生物学功能及其调控分子机制还需进一步验证。本研究加深了对CpWRKY42参与逆境应答调控的认识,为下一步开展CpWRKY2转录因子基因调控低温、干旱等非生物胁迫的分子机制研究奠定了基础。
综上所述,本研究从西葫芦转录组数据库筛选出1 条CpWRKY2基因,全长1 071 bp,与中国南瓜的WRKY核苷酸序列相似性为98.51%,具有高度的保守性。CpWRKY2 蛋白包含1 个WRKY 保守结构域和C2H2型锌指,且含有1 个RTGHARFRRAP 氨基酸保守基序,属于Ⅱd 亚类WRKY 转录因子蛋白家族。CpWRKY2基因启动子中含有ARE、ABRE 和W-box 等可能的胁迫响应顺式作用调控元件,且CpWRKY2基因可受激素、低温及干旱胁迫诱导表达,推测CpWRKY2基因在响应西葫芦低温、干旱等非生物胁迫应答过程中具有重要的调控作用。
