高温高湿胁迫对鼠尾草属5 种植物生理特性的影响
2023-12-21陈云肖汉文黄艳波周翔宇黄卫昌彭东辉
陈云, 肖汉文, 黄艳波, 周翔宇**, 黄卫昌, 彭东辉
(1. 中国科学院上海辰山植物科学研究中心/上海辰山植物园,上海 201602;2. 福建农林大学园林学院,福州 350002;3. 南京林业大学,南京 210037)
鼠尾草属(Salvia)是唇形科(Lamiaceae)中最大的属,约有1 000 种[1]。根据花器官结构(形态、内部结构、雄蕊特征)和花粉接触传粉昆虫的部位可将东亚鼠尾草类群分为3 亚属: 弧隔鼠尾草亚属(subg.Salvia)、荔枝草亚属(subg.Sclarea)和鼠尾草亚属(subg.Allagospadonopsis)[3]。中国是鼠尾草属东亚分布中心,有82 种24 变种,分布范围广,尤以西南地区为分布中心,种类繁多[4]。我国鼠尾草花部形态各异、花色丰富、植株姿态优美,具有芳香气味,有较高的观赏价值[6]。但我国园林上常用的鼠尾草种类主要来源于国外,对国产鼠尾草的研究主要集中在药用价值和传粉生物学等方面[7],对其引种栽培、观赏评价和园林应用的研究较少。
近年来,全球气温变暖加剧,政府间气候变化专门委员会(IPCC) 2021 报告指出,全球地表温度比1850—1900 年间升高1.09 ℃,到21 世纪30 年代中期,气温上升可能达到或超过1.5 ℃[11]。研究预测未来中国极端高温事件(≥35 ℃)发生频率将增加4.5%[12],华中、华东和华南地区的夏季降水增加明显,洪涝灾害加重[13]。在我国长江以南地区,高温和高湿往往同时发生,对许多鼠尾草属植物的生长造成严重影响,已经成为限制引种栽培的主要环境因子。但两者复合胁迫对鼠尾草生长和生理影响的研究还未见报道,许多兼有较高药用和观赏价值的鼠尾草属植物缺乏引种栽培的指导依据。
为此,本研究选取国产鼠尾草属中具有较高园林观赏价值的4 种植物及1 种杂交后代为试验材料,分析在高温高湿环境下鼠尾草的形态变化、叶绿素含量(SPAD)、细胞质膜透性、超氧化物歧化酶(superoxide dismutase, SOD)活性及可溶性蛋白、可溶性糖、丙二醛(malondialdehyde, MDA)和游离脯氨酸(proline, Pro)含量的变化[14],探讨其对高温高湿复合环境的耐受性差异及生理变化,筛选出耐湿热性较强的鼠尾草种类,以期为今后国产鼠尾草的选育、应用和栽培管理提供参考。
1 材料和方法
1.1 材料
本研究选取引种至上海市唇形科植物国家林木种质资源库内的5 种鼠尾草属植物: 丹参(Salvia miltiorrhiza)、张家界鼠尾草(S.daiguii)、贵州鼠尾草(S.cavaleriei)、铁线鼠尾草(S.adiantifolia)和‘辰丹月白’鼠尾草(人工杂交F1代,♂S.miltiorrhiza×♀S.daiguii,‘Chendanyuebai’)。所有材料均为2 a 生盆栽实生苗,统一进行水分管理,每隔2 d 浇透1 次水。选择生长状况良好、长势一致,于2021 年9 月移至人工气候箱进行耐湿热试验处理。
1.2 试验处理
首先在人工气候箱(上海一恒科学仪器有限公司)中进行温度35 ℃、光强100% [312.5μmol/(m2s)]的热激处理(12 h),然后进行高温高湿处理。根据2021 年上海市气象局(http://sh.cma.gov.cn/)气象数据,7 月—9 月上海最高温度可达38 ℃,平均昼夜温差约7 ℃,试验组温度设置为40 ℃/33 ℃ (昼/夜),空气湿度90%~95%,土壤湿度95%~100%; 以试验起始时(0 d)为对照,温度设置为25 ℃/20 ℃ (昼/夜),空气湿度65%~70%。白天光照强度100%,夜晚关闭光照,每隔2 d 浇透1 次水。每物种分别于处理0、3、6、9 d 时取相同位置展开的成熟叶片,进行理化指标的测定,同时记录植株的形态变化。每种鼠尾草随机选择3 株,每株1~2 个重复,共5 个重复。
1.3 方法
形态指标参考于晓英[16]和陈文志[17]的方法,将高温高湿伤害程度划分为5 级:1 级,生长旺盛,叶色鲜亮,植株挺立;2 级,少于1/4 的叶片表现湿热伤害症状(叶色发黄卷曲、萎蔫掉落、植株倒伏等);3 级,1/4~1/2 的叶片表现湿热伤害症状;4 级,1/2 至3/4 的叶片表现湿热伤害症状;5 级,3/4以上的叶片表现湿热伤害症状至植株死亡。
叶片生理生化指标的测定叶绿素相对含量的测定参照冯时等[18]的方法,采用植物营养测定仪测定。细胞质膜透性采用电导率仪测定沸水浴前后的电导值S1、S2,计算叶片的相对电导率=S1/S2×100%[19];可溶性蛋白含量采用考马斯亮蓝法[19]测定。参照生工生物工程(上海)股份有限公司的试剂盒,采用氮蓝四唑(NBT)法测定SOD 活性、采用硫代巴比妥酸法测定MDA 含量、采用酸性茚三酮法测定Pro 含量。
耐湿热性的综合评定采用模糊数学隶属函数分析法[20]对5 种鼠尾草属植物进行耐湿热性综合评定。隶属函数公式为U(Xi)=(Xi–Xmin)/(Xmax–Xmin),如果某一指标与综合评判结果为负相关,则用反隶属函数进行定量转换,公式为U(Xi)=1–(Xi–Xmin)/(Xmax–Xmin),式中,Xi为指标测定值;Xmax和Xmin分别为指标的最大值和最小值。每种植物将各指标的耐湿热隶属值累加求平均,进行耐湿热性比较。
1.4 数据的统计分析
所有数据用Microsoft Excel 进行初步处理,采用SPSS 25.0 中的广义线性模型对高温高湿胁迫后的数据进行分析,将处理时间作为自变量,生理指标数据作为因变量,鼠尾草植株作为随机因子,并采用单因素方差分析,使用Tukey 进行事后检验,用GraphPad Prism 8.0 绘制图表,数据采用平均值±标准偏差(Mean±SD)表示。
2 结果和分析
2.1 胁迫对植株的伤害
由表1 可见,随着胁迫时间的延长,5 种鼠尾草的伤害等级均上升,但受害程度较低,处理9 d仅比对照上升1 个等级,无植株死亡。试验开始时除铁线鼠尾草正常生长外,其余鼠尾草的伤害等级均为2,表现为底部部分老叶发黄、枯萎;胁迫3 d,铁线鼠尾草开始出现底部叶片发黄、枯萎,伤害等级上升,其余种类底部发黄、枯萎叶片数量增加,但仍少于1/4;胁迫6 d 时,丹参和‘辰丹月白’鼠尾草底部发黄叶片增加明显,伤害等级提升;胁迫9 d时,各鼠尾草底部发黄叶片仍处于上升趋势,其中张家界鼠尾草和贵州鼠尾草的受害叶片数量超过1/4,伤害等级上升。整个胁迫过程中,各鼠尾草植株整体颜色趋向变黄,丹参、张家界鼠尾草和贵州鼠尾草表现得较为明显。胁迫结束后,经正常养护,5 种鼠尾草均恢复正常生长。

表1 高温高湿胁迫对5 种鼠尾草的伤害等级Table 1 Damage degree of five Salvia species under high temperature and high humidity stress
2.2 胁迫对叶绿素含量的影响
由图1 可见,随着胁迫时间的延长,5 种鼠尾草叶片的叶绿素SPAD 值总体呈下降的趋势,但变化拐点和幅度不同。丹参仅在胁迫3 d 时出现明显下降,随后保持稳定,而张家界鼠尾草、贵州鼠尾草的下降较为明显,3 种鼠尾草胁迫9 d 的SPAD值与对照有显著差异(P<0.05);‘辰丹月白’鼠尾草在胁迫6 d 时显著下降,虽在胁迫9 d 出现上升,但与6 d 时无显著差异(P>0.05);而铁线鼠尾草在胁迫时间内保持稳定,无显著差异。胁迫9 d 的SPAD比对照的下降幅度为贵州鼠尾草(16.5%)>张家界鼠尾草(14.8%)>丹参(12.3%)>‘辰丹月白’鼠尾草(5.5%)>铁线鼠尾草(2.3%)。

图1 高温高湿对5 种鼠尾草叶绿素相对含量的影响。同一条线上不同字母表示差异显著(P<0.05)。下同Fig. 1 Effects of high temperature and humidity on chlorophyll relative content of five Salvia species. Different letters upon the same line indicate significant difference at 0.05 level. The same below
2.3 胁迫对细胞膜透性的影响
由图2 可知,高温高湿胁迫下5 种鼠尾草叶片的相对电导率逐渐上升,细胞膜透性增大,胁迫9 d与对照有显著差异,但各物种出现显著差异的时间不同。贵州鼠尾草胁迫6 d 与对照有显著差异,之后大幅上升,胁迫9 d 时达最高,其余种类均在胁迫3 d 与对照有显著差异(P<0.05),之后稳定上升。细胞膜受损程度以贵州鼠尾草(99.1%)>张家界鼠尾草(60%)>丹参(53.5%)>‘辰丹月白’鼠尾草(51.7%)>铁线鼠尾草(45.7%)。

图2 高温高湿胁迫对5 种鼠尾草叶片细胞膜透性的影响Fig. 2 Effects of high temperature and high humidity stress on cell membrane permeability of five Salvia leaves
2.4 胁迫对SOD 活性和MDA 含量的影响
由图3 可见,贵州鼠尾草叶片的MDA 含量随胁迫时间的延长而逐渐上升,其余种类呈上升-下降-上升的趋势。张家界鼠尾草、铁线鼠尾草、‘辰丹月白’鼠尾草叶片的MDA 含量在胁迫3 d 迅速上升,达最高,而后急剧下降;丹参叶片的MDA 含量在胁迫3 d 的增幅较小,但仍比对照有显著差异(P<0.05), 并在胁迫6 d 下降至最低;贵州鼠尾草叶片的MDA 含量在胁迫时间内呈上升趋势,但整体水平较低。除铁线鼠尾草外,其余种类胁迫9 d 的叶片MDA 含量均显著高于对照。
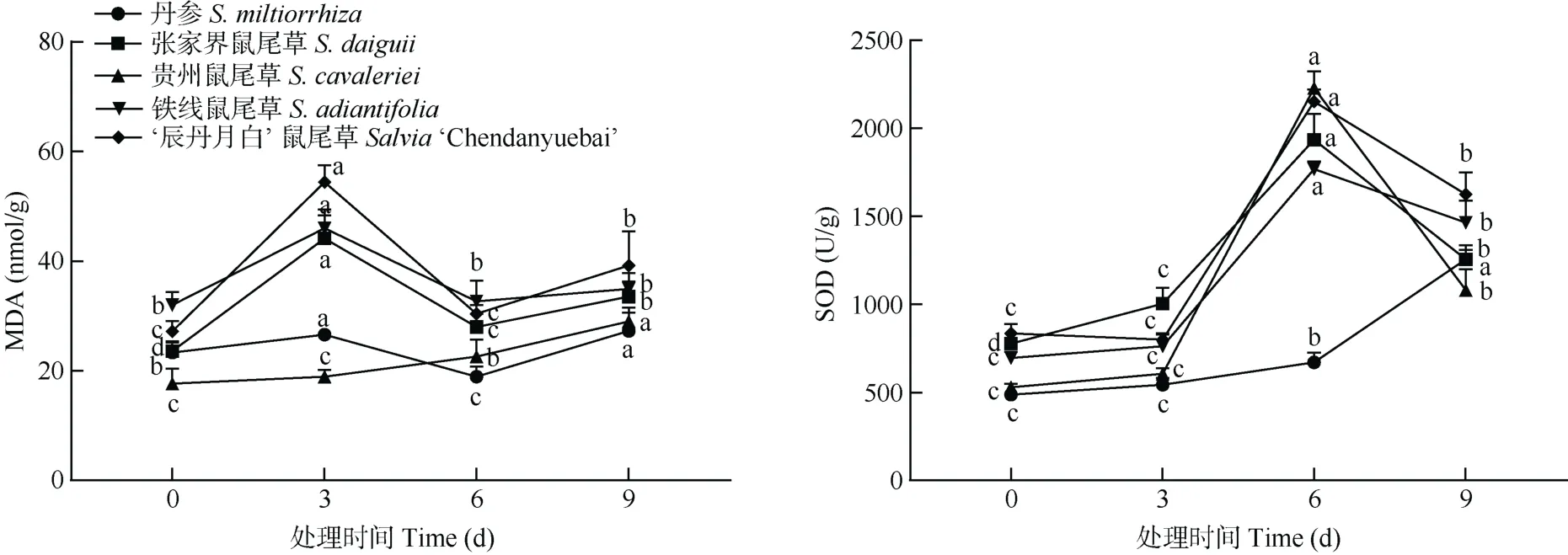
图3 高温高湿胁迫对5 种鼠尾草叶片的MDA 含量和SOD 活性的影响Fig. 3 Effects of high temperature and humidity stress on MDA content and SOD activity in leaves of five Salvia species
在胁迫期间,5 种鼠尾草叶片的SOD 活性比对照均显著提高(P<0.05),但各物种的变化趋势和幅度略有不同。丹参的SOD 活性随胁迫时间延长呈逐渐增长的趋势,胁迫9 d 时达最高,说明其对高温高湿较不敏感;除张家界鼠尾草外,其余种类胁迫3 d 的SOD 活性与对照没有显著差异(P>0.05);除丹参外,其余鼠尾草的SOD 活性均在胁迫6 d 时大幅上升,达最大值,而后急剧下降,但在胁迫结束后仍显著高于0 d。
2.5 胁迫对渗透调节物质含量的影响
由图4 可见,5 种鼠尾草叶片Pro 含量在高温高湿胁迫下的变化趋势和幅度不同。贵州鼠尾草和铁线鼠尾草随胁迫时间的延长持续上升,其余种类在胁迫3~6 d 呈下降趋势。5 种鼠尾草胁迫9 d 的Pro 含量比对照均显著增加,上升了83.1%~203.1%。5 种鼠尾草叶片的可溶性蛋白含量在胁迫时总体呈现上升的趋势,均在胁迫9 d 时达最高,比对照增加了65.8%~101.4%。除张家界鼠尾草外,其余种类叶片的可溶性糖含量在胁迫6 d 的变化平缓,偶有下降,均无显著差异(P>0.05),5 种鼠尾草胁迫9 d的可溶性糖含量比对照增加了49.5%~140.6%。
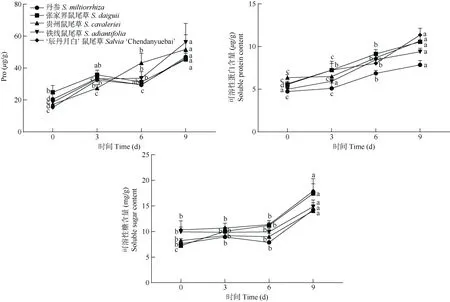
图4 高温高湿胁迫对5 种鼠尾草叶片渗透调节物质含量的影响Fig. 4 Effects of high temperature and humidity stress on osmoregulatory substances contents in leaves of five Salvia species
2.6 综合评价
隶属函数综合值越大,表示其耐湿热性越强。根据隶属函数综合值,对5 种鼠尾草进行耐湿热能力评价(表2),由强到弱依次为张家界鼠尾草≈铁线鼠尾草>‘辰丹月白’鼠尾草≈丹参>贵州鼠尾草。

表2 耐湿热指标的综合隶属函数值Table 2 Comprehensive membership function values of humidity and heat resistance indexes
3 结论和讨论
植物在胁迫下形态特征的变化可以直观反映其受害程度,是评价植物对逆境适应性强弱的直接指标[14]。本研究中,5 种鼠尾草在高温高湿胁迫下均发生了外部形态变化,底部黄叶数增多,叶色变黄,说明植物都受到一定程度的湿热伤害。但胁迫结束后鼠尾草均可恢复正常生长,表明本研究的高温高湿胁迫程度并未对鼠尾草产生不可逆的损伤,耐湿热性较好。此外,在对照环境下,除铁线鼠尾草外,其余鼠尾草的底部老叶也出现发黄、枯萎,与我们在资源圃中(正常生长条件)观察的结果一致,这可能是植物生长过程中的正常更新,而高温高湿使得这一过程加快,黄叶数明显增多。
叶绿素是植物光合作用的物质基础,对植物生长有重要作用,其含量变化与植物抗逆性密切相关[22]。SPAD 值是一个与叶片叶绿素含量相关的无量纲比值,反映植物绿色程度,与叶片叶绿素含量呈正比[24]。本研究中,‘辰丹月白’鼠尾草的SPAD值的变化幅度小于亲本,说明其叶绿素受高温高湿胁迫影响小于亲本。贵州鼠尾草叶绿素下降最多,受到的影响最大,而铁线鼠尾草最小,说明各鼠尾草对高温高湿的耐受性差异。
细胞膜的稳定性能准确反映植物在逆境中的适应能力,是评价植物抗逆性的适宜指标之一[26]。植物在逆境中细胞膜结构会遭到破坏,使细胞内的内含物外渗,引起电导率的改变[28],因而电导率可以判断植物细胞膜的受损程度。本研究中, 鼠尾草在高温高湿胁迫下相对电导率持续下降,细胞膜持续受损,这与前人[14]的研究结果相似,且与其形态表现较一致,说明相对电导率的变化可以作为判断鼠尾草属植物耐湿热性的根据。此外,本研究还表明鼠尾草的细胞膜受损程度与SPAD 的下降幅度具有一致性,故推测叶片细胞膜透性增加是导致叶绿素含量降低的重要原因。
植物在逆境中,细胞氧自由基的产生和清除的平衡遭到破坏,细胞膜脂过氧化加剧,导致膜脂过氧化最终分解产物MDA 含量的增加[31]。SOD 是植物体内重要的抗氧化酶,能通过歧化反应使O2、 OH等活性氧转变为O2和H2O2[32]。在高温高湿胁迫下,不同植物的SOD 活性和MDA 含量变化趋势有差异,无明显上升或下降规律[29]。本研究结果相似, 且鼠尾草的MDA 含量变化与细胞膜透性变化并不吻合,说明MDA 并非唯一影响细胞膜透性的因子, 可能还有其他原因导致膜透性增加。张家界鼠尾草、铁线鼠尾草和‘辰丹月白’鼠尾草的SOD 活性和MDA含量呈显著负相关,说明SOD 对MDA 含量的重要影响;但在丹参和贵州鼠尾草中并未呈现这种规律,可能其他抗氧化酶在高温高湿胁迫中同样对MDA 含量的降低起着重要作用,这与许华等[22]对美丽鼠尾草和贵州鼠尾草的研究相似。
脯氨酸、可溶性糖和可溶性蛋白都属于渗透调节物质,其含量变化可以反映植物的抗逆性,抗性强的植物往往积累更多的渗透调节物质[34]。不同植物体内的渗透调节物质在受到胁迫后变化趋势不一致,多数呈持续上升或先升后降的变化趋势,但也有持续下降或暂时下降的现象[14]。本研究结果表明,不同鼠尾草的渗透调节物质含量变化趋势存在差异,可能是不同鼠尾草对于逆境的敏感性和耐受性不同,对环境变化较不敏感或所受伤害超过自身调节范围时,渗透调节物质的上升速度小于其被分解或破坏的速度,从而导致其含量短暂降低。但胁迫结束后5 种鼠尾草的脯氨酸、可溶性糖和可溶性蛋白含量比对照仍有不同程度的提升,表明鼠尾草所受的湿热伤害仍在其调节范围内,具有较强的耐湿热能力。
通过隶属函数对7 项指标进行综合分析,耐湿热性为张家界鼠尾草≈铁线鼠尾草>‘辰丹月白’鼠尾草≈丹参>贵州鼠尾草。但各鼠尾草的隶属函数值差距较小,且在实际栽培中铁线鼠尾草在上海的夏季表现不如丹参,这可能是因为不同鼠尾草耐胁迫时间的临界点不同。在胁迫9 d 内,鼠尾草的耐湿热性均表现较好,而随着胁迫时间的延长,如夏季的持续高温高湿,鼠尾草的胁迫能力可能会发生变化。因此,未来在对鼠尾草属植物的耐湿热性测定时应适当延长胁迫时间。
综上,5 种鼠尾草在胁迫中未出现严重的湿热伤害,胁迫结束后仍能恢复正常生长,具有较好的耐湿热性,可以在上海及周边地区进行引种栽培。杂交鼠尾草花朵美丽、花序及植株挺拔,兼具父母本的优点,且耐湿热性好,可以作为观赏植物进行推广种植。
致谢感谢魏宇昆老师在研究过程中对本人的支持及解惑。
