一种大分割立体定向放射治疗计划质量评估方法
2023-12-21殷皓泽张婷李克周元波李丹汪森邱凌平通信作者
殷皓泽,张婷,李克,周元波,李丹,汪森,邱凌平(通信作者)
南昌大学第一附属医院 (江西南昌 330006)
脑转移作为恶性肿瘤最常见的并发症之一,对患者的神经认知功能、神经系统症状和生存率均会产生影响,通常表现为头痛、恶心及认知障碍等[1]。目前,临床主要通过外科手术、放射治疗、内科治疗等多学科综合治疗提高脑转移患者的生存质量[2]。考虑到潜在的神经认知毒副反应,2021 年美国放射肿瘤学会(American Society for Radiation Oncology,ASTRO)发表的脑转移治疗技术指南指出,立体定向放射治疗(stereotactic radiotherapy,SRT)是目前治疗局限性或多发性脑转移的主要方法[3-5]。而大分割立体定向放射治疗(hypofractionated stereotactic radiotherapy,HSRT)作为其中一种利用生物效应剂量优势的新型治疗方式,可以有效降低直径>2 cm 肿瘤的放射性坏死概率,并提高局部控制率[6-8]。
针对行SRT 的脑转移瘤患者,肿瘤放射治疗组(Radiation Therapy Oncology Group,RTOG)于1993 年提出了可以广泛用于计划质量评估的3 个参数:适形度指数(conformity index,CI)、质量指数(quality index,QI)及均匀性指数(homogeneity index,HI)[9]。近年来,随着临床对脑转移瘤的生物学和分子基础理解的不断加深,为了提高治疗比,更精细的预后模型和多种新型特异性治疗模式被用于该病患者的治疗[10]。此外,临床对于治疗计划的关注点也不仅局限于单个剂量学参数,更多的研究将剂量学和生物效应联系起来。例如,2021 年Simon 等[11]从认知障碍等生物效应角度对脑转移瘤患者的HSRT 计划质量进行评估,综合考虑了CI、梯 度 指 数(gradient index,GI)、QI、HI、V24.4及V12等参数;另有研究以反应肿瘤靶区覆盖程度的CI、GI、QI、HI 和危及器官毒副反应参数V24.4、V12为主要评估参数衡量脑转移瘤患者计划质量,具体标准则以计划靶区大小(bins of planning target volume,PTVbin)和处方剂量为准[12-13]。
目前,对于脑转移瘤患者放射治疗计划质量的评估多采用单因素分析进行,即通过统计不同靶区大小下的单项参数并计算相应的均值、中位数、方差及标准差,最后根据参考范围判断计划质量是否达标[14-15]。很少有研究关注每个因素在整个计划质量评估分析中发挥的真正作用。基于此,本研究针对我院收治的HSRT 脑转移瘤患者,提出一种基于剂量学和生物效应的临床评估方法,从肿瘤控制率和正常组织并发率出发,利用集成学习建立治疗计划质量评估关联模型,确立计划质量评估多参数间的相关性,阐明各项参数的重要程度,明确计划设计优化目标,为更迅速、有效地制定高质量治疗计划提供统计学证据。
1 资料与方法
1.1 一般资料
选取2021 年1—12 月我院收治的20 例病灶直径>2 cm 的脑转移瘤患者。其中,男14 例,女6 例;年龄31~63 岁,平均(45.3±0.6)岁;处方剂量40 Gy(5×8F/8×5F/10×4F)。所有患者均为仰卧位,定位系统采用真空垫+热塑膜。CT 定位参数如下:电流为400 mAs,电压为120 kV;辅以100 ml 碘帕醇注射液[南京正大天晴制药有限公司,国药准字H20203293,100 ml∶37 g(I)],流速2 m/s,延迟60 s;选取定位层厚2 mm。
1.2 仪器设备
西门子SOMATOM Confidence 64 排CT,配备对应平板床、主机及Syngo 工作站。LAP SN0160010 可移动激光定位系统,配备左右两侧及上方共3 支激光灯。医科达Monaco5.11 治疗计划系统。
1.3 方法
1.3.1 建立HSRT 治疗计划评估数据库
参考2020 年HSRT 脑组织辐射剂量体积耐受性方案指南[16]及前人研究成果[11],选取CI(包括CIRTOG和CIPaddick)、GI、QI、HI、V24.4、V12、V18、V23及PTVbin等为质量评估参数,建立HSRT 计划评估数据库。各个参数具体表达式如下:
其中,CI 分为2 种,CIRTOG为参考剂量体积PIV与靶区体积TV 的比值,CIPaddick为靶区达标体积平方TV2PIV与靶区体积TV、参考剂量体积VRI相乘的比值;GI 为50%等剂量体积V50与参考剂量体积PIV的比值;QI 为最大点剂量Imax与参考剂量体积PIV的比值;HI 则为最小点剂量Imin与参考剂量体积PIV的比值;V24.4、V12、V18、V23分别代表对应颅内所受照射24.4、12、18、23 Gy 的绝对体积;PTVbin代表靶区体积。
1.3.2 构建与验证治疗计划质量评估模型
目前,以机器学习为代表的人工智能已被广泛应用于放射治疗领域,使治疗决策更加简化、个体化和精确化,提高了治疗计划设计和质量控制环节的自动化程度[17-18]。集成学习作为功能强大的机器学习技术之一,通过构建组合多种不同机器学习模型从而获得更准确的预测结果,常用的算法策略包括Boosting、Bagging 和Stacking[19]。为探讨正常组织和靶区辐射剂量之间的内在联系、解释剂量参数彼此之间可能存在的线性或非线性复相关关系,本研究将收集的小规模HSRT 脑转移瘤患者样本集分为60%训练集、20%验证集和20%测试集,拟利用集成学习中的Bagging 算法构建多个相互独立的评估器形成一系列基学习器,通过选取具有代表性的特征并计算其包含的分类信息量进行相关的节点分裂,再将多个基学习器进行对应权重整合,使其成为一个质量评估集群分类学习模型,同时利用五折交叉验证法提高模型的泛化能力。
1.3.3 分析及优化质量评估模型
一个符合临床治疗标准的高质量放射治疗计划受到靶区照射程度和正常组织坏死程度的影响。本研究参考已有HSRT 计划质量评估标准[11],以多因子模型为核心,利用集成学习Bagging 思想,对20 例脑转移瘤患者的HSRT 计划参数进行集群分类学习,将计划质量评估过程模拟为多个基学习器,经过特征节点分裂、子节点权重分裂、放回抽样及泛化精度等步骤完成独立地学习和预测。集成学习模型见图1。
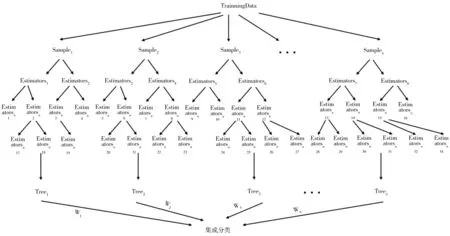
图1 集成学习模型
为提高模型预测精度及稳定度,防止出现过拟合等情况,通过Bagging 算法集成多个决策树,保证每个决策树看待问题角度不同并对模型设置进行优化。为避免出现边际效应,本研究针对基学习器数量从10 至1 000 设置了以10 为步长的梯度进行评估,结果发现,基学习器为100 时模型精确性不再上升或有所波动。考虑到计算量及处理速度问题,本模型将基学习器数量设置为100。在模型向下进行分枝质量衡量时,为缩小样本真实数据与回归结果差异,本模型采用叶子节点均值降低父节点和子节点之间的均方误差,力求各个参数平方和开方值最小;本模型中的特征分枝根据目标问题保证每次均分割相同的训练集和测试集,将随机状态设置为1。为提升训练速度调用CPU 进行并行处理。
2 结果
基于2022 ASTRO 发表的脑转移瘤放射治疗相关指南[20]及立体定向放射治疗正常组织剂量限制[21],所有治疗计划需符合靶区满足95%以上达到处方剂量、CI 尽可能小于1.5、R50 跌落根据靶区大小在一定范围内、正常组织耐受值未超标等临床要求。20 例患者的HSRT 计划评估结果见表1。
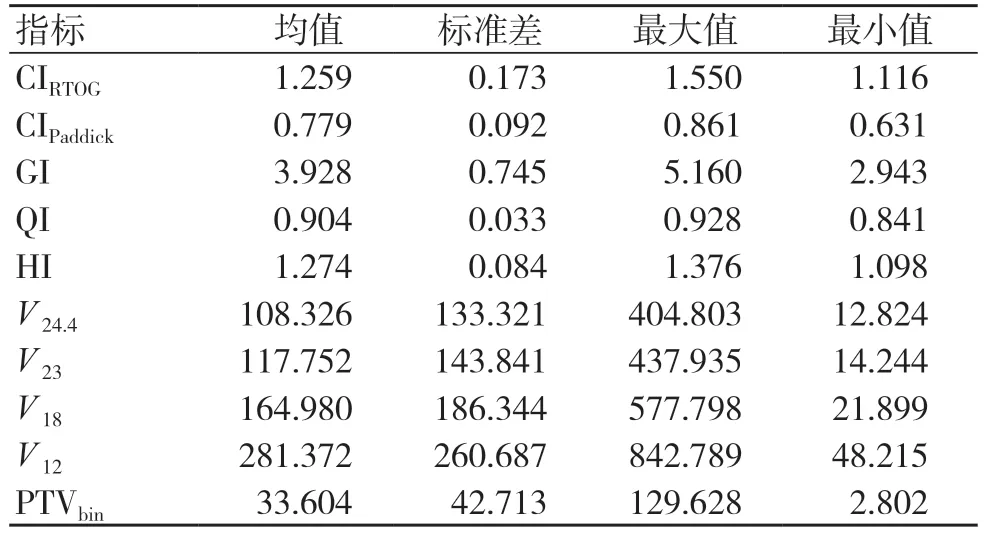
表1 20 例患者HSRT 计划评估结果
通过将尽可能多的与计划质量密切相关特征提供给Bagging 模型,多次打乱特征顺序,使算法反馈对预测最有用的特征列表,发现HSRT 计划的各参数占比如下:V12占比为16.2%,V24.4占比为14.1%,PTVbin占比为13.7%,GI 占比为11.5%,CIPaddick占比为9.5%,V23占比为9.3%,QI 占比为8.0%,V18占比为7.1%,CIRTOG占比为6.7%,HI占比为3.8%,结果见图2。
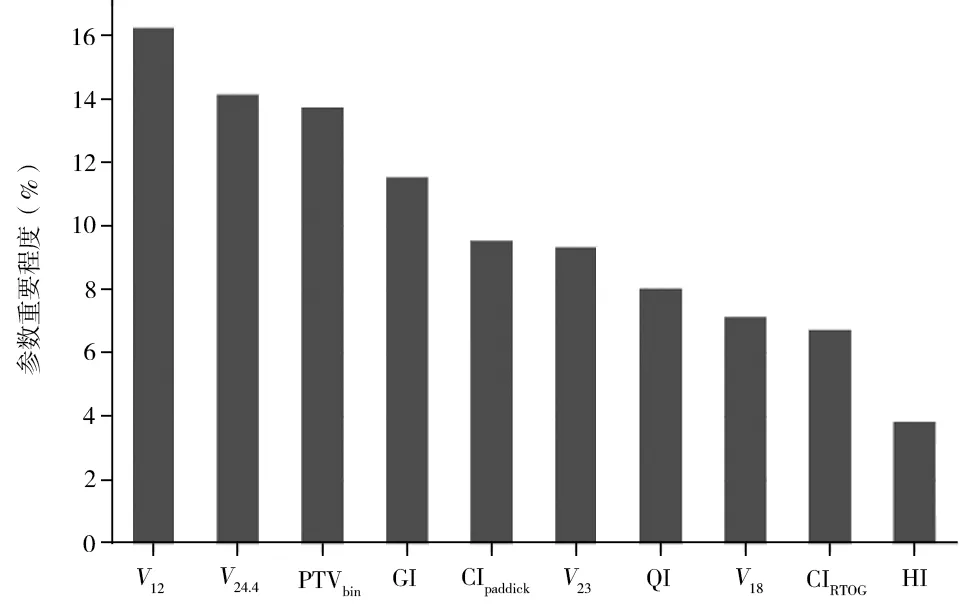
图2 HSRT 计划质量评估参数的预测结果
3 讨论
传统的放射治疗计划质量评估倾向于剂量学角度,着重考察目标靶区是否达到参考剂量标准、内部有无冷热点及适形度等单一标准。近年来,随着研究的不断深入,学术界普遍认为,在精准杀死靶区内肿瘤细胞的同时,要给予周边正常组织更多的保护,以降低放射性损伤的发生概率。因此,从治疗比的角度考察评估放射治疗计划质量值得探讨。本研究以多因子模型为核心,利用集成学习将计划质量评估过程模拟为多个基学习器,经过特征节点分裂、子节点权重分裂、放回抽样及泛化精度等步骤完成独立学习和预测,组合预测结果确认各个参数对计划质量的影响程度,探讨行HSRT 的脑转移患者肿瘤局部控制率和重要器官毒副反应的交互关系,为实现优质的肿瘤治疗比提供临床分析数据,减少放射治疗计划设计时间,缩短脑转移患者的等待治疗周期。
通过融合不同机器学习方法,本研究提出了基于集成学习Bagging 算法的集群分类学习模型,发现针对处方剂量为40 Gy 的HSRT 脑转移患者,关注V12、V24.4、PTVbin、GI 及CIPaddick等参数利于快速、准确地进行治疗计划评估。希望本研究结果可以为放射治疗计划设计优化指明方向,在后续临床实践过程中,微调对应指标有助于设计更符合临床要求的放射治疗计划。当然,本研究提出的模型也存在一定的优化空间:首先,本研究使用的样本数量在某种程度上可以定义为小样本,日后需在此基础之上收集更多病例扩大样本集;其次,由于本研究结果仅针对吸收剂量为40 Gy 的脑转移瘤患者,不具有普遍性,后续可将多种处方剂量及肿瘤类型置于模型中,为实现基于大数据的自动化放射治疗质量评估提供依据。
