脓毒症相关急性肾损伤患者血清Galectin-1、Galectin-3水平变化及其与院内死亡的关系
2023-12-21冯亚高春明张耀军陈自谦祁夏夏张梅荣房云岗
冯亚,高春明,张耀军,陈自谦,祁夏夏,张梅荣,房云岗
脓毒症是由感染引起宿主免疫系统失调而导致危及生命安全的器官功能损害临床综合征,近年来其在全球中的发病率有上升趋势,我国重症监护室(intensive care unit,ICU)脓毒症发病率为33.6%,病死率为29.0%,发病率和病死率远高于北美和欧洲国家[1-2]。脓毒症相关急性肾损伤(sepsis associated acute kidney injury,SA-AKI)是脓毒症常见的严重并发症,也是导致脓毒症患者死亡的重要因素之一[3]。寻找可及时评估SA-AKI患者病情严重程度和预后的血清标志物对指导临床治疗和促进预后改善具有积极意义。研究表明,炎性反应在SA-AKI的发生、发展过程中扮演重要角色[4]。半乳糖凝集素(galectin,Gal)是一类具有结合聚糖能力的凝集素,Gal-1和Gal-3是Gal家族成员,其中Gal-1通过调节T细胞功能抑制免疫反应发挥抗炎作用[5]。一项筛选脓毒症相关新型蛋白生物标志物的研究发现,Gal-1在脓毒症患者血清中升高[6]。Gal-3能通过诱导单核细胞迁移促进炎性反应发生发展[7]。相关研究报道,Gal-3水平与脓毒症病情严重程度和预后有关[8]。基于此,本研究拟探讨不同病情严重程度SA-AKI患者血清Gal-1、Gal-3的变化及其与院内死亡的关系,旨在为促进SA-AKI治疗和预后改善提供更多参考,报道如下。
1 资料与方法
1.1 临床资料 纳入2020年1月—2023年1月山西省临汾市中心医院重症医学科收治的脓毒症患者243例,其中SA-AKI患者123例作为SA-AKI组,女39例,男84例;年龄21~79(58.12±6.51)岁。单纯脓毒症患者120例为单纯脓毒症组,女38例,男82例;年龄18~81(55.63±7.68)岁。2组性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。参考改善全球肾脏病预后组织制定的标准[9],对纳入的SA-AKI患者根据病情严重程度分为1期亚组48例,2期亚组43例,3期亚组32例。同时根据患者院内结局分为死亡亚组49例和存活亚组74例。
1.2 病例选择标准 纳入标准:(1)脓毒症诊断符合脓毒症3.0诊断标准[10];(2)AKI诊断符合改善全球肾脏病预后组织标准[9]:①尿量<0.5 ml·kg-1·h-1,持续时间≥6 h;②48 h内血肌酐升高≥26.5 μmol/L;③确认或推测7 d内血肌酐升高超过基础值1.5倍,符合以上任一标准即可诊断为AKI;(3)患者的临床资料完整;(4)年龄≥18岁。排除标准:(1)既往慢性肾脏病、终末期肾病或肾移植;(2)合并恶性肿瘤患者;(3)合并急性肺损伤、急性心肌损伤等其他脏器损害疾病;(4)有血液疾病或入院前接受血制品输注、使用抗凝或溶栓药物;(5)处于妊娠期或哺乳期的妇女;(6)ICU入住时间<48 h。本研究经医院伦理委员会批准(2019-KY-0539),全部患者或其家属均知情同意并签署知情同意书。
1.3 方法
1.3.1 资料收集:使用医院病例管理系统收集SA-AKI患者的临床资料,包括性别、年龄、合并症、感染部位、干预措施(肾脏代替治疗、使用血管活性药物、机械通气)、急性生理和慢性健康评估Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分(总分0~71分,得分越高表示病情越严重)[11]和实验室指标(血肌酐、血乳酸、血红蛋白、白蛋白、白细胞计数、中性粒细胞计数、血小板计数、C反应蛋白、降钙素原、血尿酸)等资料。
1.3.2 血清Gal-1、Gal-3水平检测:脓毒症患者入住ICU后于床旁采集血液3 ml,3 000 r/min离心10 min(半径15 cm)留取血清待检测,采用酶联免疫吸附法检测血清Gal-1、Gal-3水平,试剂盒均购自深圳海思安生物技术有限公司(Gal-1货号:HAS-50985,Gal-3货号:HAS-55053)。
2 结 果
2.1 SA-AKI组与单纯脓毒症组血清Gal-1、Gal-3水平比较 SA-AKI组血清Gal-1、Gal-3水平高于单纯脓毒症组,差异有统计学意义(P<0.01),见表1。

表1 SA-AKI组与单纯脓毒症组血清Gal-1、Gal-3水平比较
2.2 不同病情严重程度SA-AKI患者血清Gal-1、Gal-3水平比较 1期亚组、2期亚组、3期亚组血清Gal-1、Gal-3水平依次升高,差异均有统计学意义(P<0.05),见表2。

表2 不同病情严重程度SA-AKI患者血清Gal-1、Gal-3水平比较
2.3 SA-AKI患者院内死亡的单因素分析 单因素分析结果显示,年龄、AKI分期、使用血管活性药物、机械通气、APACHEⅡ评分、血乳酸、Gal-1、Gal-3为SA-AKI患者院内死亡的影响因素(P<0.05),2组性别、合并症、感染部位、肾脏代替治疗、血肌酐、血红蛋白、白蛋白、白细胞计数、中性粒细胞计数、血小板计数、C反应蛋白、降钙素原、血尿酸组间比较差异无统计学意义(P>0.05),见表3。

表3 SA-AKI患者院内死亡的单因素分析
2.4 SA-AKI患者院内死亡的多因素Logistic回归分析 以表3中差异有统计学意义的年龄(≥60岁=1,<60岁=0)、AKI分期(1期=0,2期=1,3期=2)、使用血管活性药物(是=1,否=0)、机械通气(是=1,否=0)、APACHEⅡ评分(≥16分=1,<16分=0)、血乳酸(≥5 mmol/L=1,<5 mmol/L=0)、Gal-1、Gal-3作为自变量,将院内是否发生死亡作为因变量(是/否=1/0),建立多因素Logistic回归模型,结果显示,年龄≥60岁、AKI分期2~3期、机械通气和APACHEⅡ评分≥16分、血乳酸≥5 mmol/L、Gal-1、Gal-3水平升高为SA-AKI患者院内死亡的独立危险因素(P<0.05),见表4。
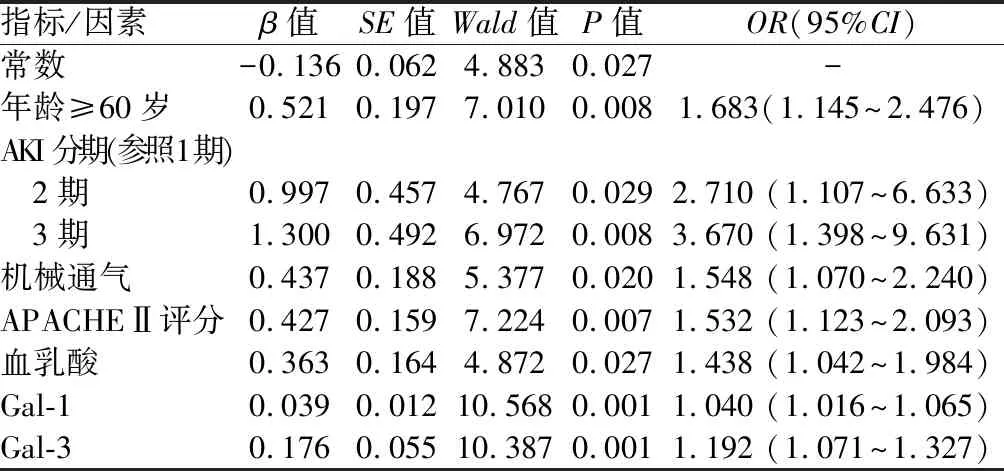
表4 SA-AKI患者院内死亡的多因素Logistic回归分析
2.5 血清Gal-1、Gal-3水平对SA-AKI患者院内死亡的预测价值 分别以死亡亚组(n=49)、存活亚组(n=74)为阳性、阴性样本,进行ROC曲线分析,探讨血清Gal-1、Gal-3水平(分成若干个组段)对SA-AKI患者院内死亡的预测价值。分析结果显示,血清Gal-1、Gal-3水平单独和联合预测SA-AKI患者院内死亡的曲线下面积AUC(0.95CI)分别为0.720(0.454~0.960)、0.771(0.558~0.971)、0.830(0.686~0.967),二者联合对SA-AKI患者院内死亡的预测价值大于各指标单独预测(Z=2.652、2.968,P=0.008、0.003),见表5、图1。
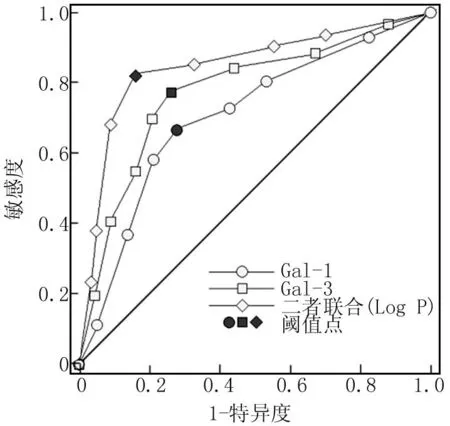
图1 血清Gal-1、Gal-3水平预测SA-AKI患者院内死亡的ROC曲线(组段法曲线)Fig.1 ROC curve (group method curve) for predicting in-hospital mortality in SA-AKI patients based on serum Gal-1 and Gal-3 levels

表5 血清Gal-1、Gal-3水平对SA-AKI患者院内死亡的预测价值
3 讨 论
脓毒症是一种危及生命的器官功能损害的症候群,肾脏是脓毒症病理变化中最易受到损害的靶器官之一,超过60%的脓毒症患者可并发AKI,以短时间内肾功能急剧下降为主要临床特征,SA-AKI不仅严重损伤患者肾功能,还会引发多器官功能障碍综合征,死亡风险较单纯脓毒症患者增加16倍[12]。SA-AKI的发病机制复杂,目前研究认为与肾细胞凋亡、凝血级联激活、免疫炎性反应、微循环障碍等有关[13-15]。尚无针对其有效的治疗策略,尽管近年来体外血液净化取得一定进展,但SA-AKI仍然是脓毒症患者死亡的重要原因之一[16-17]。因此及时评估SA-AKI患者病情严重程度和院内死亡风险,对指导患者个体化治疗和促进预后改善具有重要意义。
炎性反应是SA-AKI发生发展的重要机制,脓毒症过程中肾小管上皮细胞表面的模式识别受体和免疫细胞能释放损伤相关分子模式、病原相关分子模式引发细胞内分子级联反应,进而促进炎性细胞大量合成和释放形成级联炎性反应,通过诱导肾细胞凋亡、肾脏灌注不足等导致SA-AKI发生,而随着炎性反应加重和AKI引起的容量负荷增加、电解质失衡、贫血等,还可诱导肺脏、心脏、肝脏等器官损害,导致多器官功能障碍综合征,增加院内死亡风险[18-20]。Gal是一类β-半乳糖苷结合凝集素,Gal-1是Gal家族首个发现的成员,主要由巨噬细胞、激活的T细胞、B细胞和调节性T细胞合成和分泌,在肌肉、神经元、胸腺、肾脏和胎盘中含量丰富[21]。其主要功能是抑制促炎细胞因子合成、促进T细胞凋亡、促进调节性T细胞扩增、诱导抗原呈递细胞失活等,以起到控制免疫细胞稳态和缓解急慢性炎性反应的作用[22-23]。相关研究报道,Gal-1在类风湿性关节炎、糖尿病、系统性硬化症、系统性红斑狼疮等自身免疫性疾病中升高,但外源性Gal-1能抑制其炎性反应,缺乏Gal-1会抑制炎性反应消退[24]。另有实验指出,Gal-1在肾缺血再灌注损伤的肾组织中过表达,外源性给予Gal-1能抑制白介素-1β、肿瘤坏死因子-α和单核细胞趋化蛋白1等促炎细胞因子表达,进而改善肾脏损伤[25]。上述研究说明Gal-1具有重要的抗炎作用,其在病理过程中过表达可能是一种代偿反应。同时有多项研究报道,血清Gal-1水平在细菌、病毒等感染中升高[26-27]。因此推测Gal-1可能在SA-AKI过程中发挥作用。Gal-3是Gal家族中嵌合型唯一成员,主要由炎性反应细胞、骨细胞、内皮细胞、上皮细胞合成和分泌,在肝脏、肾脏、心脏等多种组织器官中均有表达,能活化巨噬细胞并以剂量依赖性方式促进炎性因子分泌,促进炎性反应发生发展[28]。多项研究报道,Gal-3能激活Toll样受体4/核因子-κB、磷脂酰肌醇3-激酶/蛋白激酶B、NOD样受体家族3炎性小体等炎性反应信号通路参与自身免疫性葡萄膜炎、动脉粥样硬化、溃疡性结肠炎等炎性反应疾病过程[29-31]。同时研究指出,Gal-3在肾缺血/再灌注诱导的AKI大鼠血清和尿液中升高,抑制Gal-3表达能改善AKI大鼠的肾损伤[32]。尽管有学者报道血清Gal-3水平升高与脓毒症患者病情严重程度和预后有关[8],但关于Gal-3与SA-AKI患者病情严重程度和院内死亡的关系尚未见报道。
本研究结果显示,SA-AKI患者血清Gal-1、Gal-3水平升高,并随着AKI分期增加而升高,是SA-AKI患者院内死亡的独立危险因素,说明血清Gal-1、Gal-3水平升高参与SA-AKI发生发展,并会增加患者院内死亡风险。其机制可能是脓毒症所致的AKI激活了机体代偿反应,通过抑制促炎细胞因子合成、促进T细胞凋亡等途径抑制炎性反应进展,因此血清Gal-1水平越高间接反映炎性反应程度越强[33];血清Gal-3水平升高能激活Toll样受体4/核因子-κB、磷脂酰肌醇3-激酶/蛋白激酶B、NOD样受体家族3炎性小体等信号通路共同激活炎性反应[34]。Gal-1、Gal-3水平升高介导的炎性反应通过直接损伤肾细胞诱导其凋亡、诱导肾血管内皮损伤降低肾脏灌注等导致病情加重,而随着血清Gal-1、Gal-3水平升高,会进一步增强炎性反应导致全身失控性炎性反应引起多脏器功能衰竭,增加院内死亡风险。本研究结果还发现,年龄增加、AKI分期2~3期、机械通气、APACHEⅡ评分和血乳酸升高也会增加SA-AKI患者院内死亡风险,分析原因可能是年龄越大的患者其合并的基础疾病越多,身体状况更差,因此院内死亡风险更高;AKI分期2~3期说明SA-AKI患者病情更严重,肾脏严重损伤能通过增加容量负荷、电解质失衡、贫血等加剧其他脏器损害,增加院内死亡风险;机械通气则反映患者不能自主维持足够的氧合和通气,使得组织灌注降低而增加死亡风险;APACHEⅡ评分越高说明患者病情越危重,死亡风险更高;血乳酸是组织低灌注的标志,其水平越高说明患者器官组织灌注越低,器官功能损伤更严重,因此院内死亡风险更高[35-37]。基于Gal-1、Gal-3对SA-AKI患者院内死亡的影响,本研究绘制ROC曲线发现,血清Gal-1、Gal-3水平为75.00 μg/L、13.00 μg/L时,预测SA-AKI患者院内死亡的AUC为0.720、0.771,而血清Gal-1、Gal-3水平联合预测SA-AKI患者院内死亡的AUC为0.830,明显大于Gal-1、Gal-3单独预测。这说明血清Gal-1、Gal-3水平有助于SA-AKI患者院内死亡预测,二者联合能提升其预测价值。但本研究结果还需多中心研究进一步验证,同时关于Gal-1、Gal-3参与SA-AKI的机制,还有待进一步实验发现。
综上所述,SA-AKI患者血清Gal-1、Gal-3水平升高,与病情严重程度和院内死亡有关,联合检测血清Gal-1、Gal-3水平对SA-AKI患者院内死亡的预测价值较高,有望成为辅助预测SA-AKI患者院内死亡的指标。
利益冲突:所有作者声明无利益冲突
作者贡献声明
冯亚:设计研究方案,实施研究过程,论文撰写与修改;高春明:提出研究思路,分析试验数据,论文审核;张耀军、陈自谦、祁夏夏:实施研究过程,资料搜集整理;张梅荣、房云岗:数据收集,统计学分析
