胃腺癌和淋巴结转移癌中Claudin18.2表达研究
2023-12-20袁雪芹张静婷
袁雪芹,张静婷,2,李 霞,2
(1.济宁医学院附属金乡医院病理科,山东 济宁 272299;2.深圳市龙岗区第三人民医院病理科,广东 深圳 518115)
胃癌是全球最常见的恶性肿瘤之一,2020年全球发病率排名第五,死亡率排名第四[1],也是我国最常见的消化道恶性肿瘤[2],大多数患者确诊时已是晚期。目前治疗仍然是以化疗为主,靶向药物较少,晚期胃癌患者的治疗效果差,5年生存率仅 为30%左右[3],急需开发一些新的靶向治疗药物[4]。Claudin18.2(CLDN18.2)是在上皮紧密连接处表达的四肽蛋白Claudin家族的成员,正常情况下 Claudin18.2蛋白主要表达在胃黏膜上皮细胞,其在胃癌、胰腺癌、食管癌等癌变组织中表达明显上调,并参 与肿瘤细胞的增殖、分化及转移[5]。在一项随机2期研究(FAST)中,对经组织学证实的中到强Claudin18.2表达的进展期胃癌和胃食管连接部癌患者,zolbetuximab (IMAB362)联合化疗比单纯化疗延长了总生存期和无进展生存期,安全性和耐受性可接受[6]。目前多项研究在进行,对于Claudin18.2在胃癌中的分布及表达仅在国外有一些研究[7-8],目前在中国胃癌患者中仅查及少量研究[9-10],对于Claudin18.2 在胃癌中表达及临床病理学特征之间的关系尚不清楚。因而,本研究进一步探讨患者胃原发性腺癌及淋巴结转移癌中Claudin18.2的表达情况,为靶向选择、治疗积累一些理论依据。
1 资料与方法
1.1一般资料:收集深圳市龙岗区第三人民医院病理科和济宁医学院附属金乡医院病理科2010~2022年间胃腺癌组织和淋巴结转移癌样本共计110组,病理学分级采用WHO 分类标准(2019),本研究的组织学样本均经两位病理学家复诊。组织标本经 4%中性甲醛固定,石蜡包埋,常规5 μm切片。本研究经过本院医学伦理委员会审批同意执行。
1.2方 法:应用免疫组织化学 EnVision法检测 Claudin18.2(上海杰浩)的表达水平,操作按试剂盒说明书进行,正常胃黏膜作为阳性对照。
1.3免疫组织化学结果判定:免疫组织化学结果由两位病理医师进行交叉双盲判定。Claudin18.2的免疫组织化学结果判读参照 Sahin等[6,11]报道的方法,该方法参考肿瘤细胞膜的染色强度和肿瘤细胞的百分比综合评价,对完全、基底及侧膜或侧膜染色的癌细胞百分比进行评估。染色强度分为0(无细胞膜反应)、1+(弱细胞膜反应)、2+(中等细胞膜反应)和3+(强细胞膜反应),只有阳性对照(健康胃组织)显示预期的染色模式,肿瘤标本的染色才被认为是有效的。Claudin18.2阳性定义为至少40%的肿瘤细胞中中度(2+)或强Claudin18.2染色(3+)。
1.4统计学方法:应用 Office 2010软件的Excel程序进行χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1患者和肿瘤特征:患者年龄35~75岁(中位年龄65岁),男和女患者分别为65例和45例。原发肿瘤位于胃小弯及胃窦部71例(64.5%),胃体部22例(20%),胃食管交界处17例(15.5%)。按肿瘤分期,Ⅲ期80例(72.7%),Ⅱ期30例(27.3%);按Lauren表型,肠型58例(52.7%),弥漫型43例(39.1%),混合型10(8.2%)。见表1。
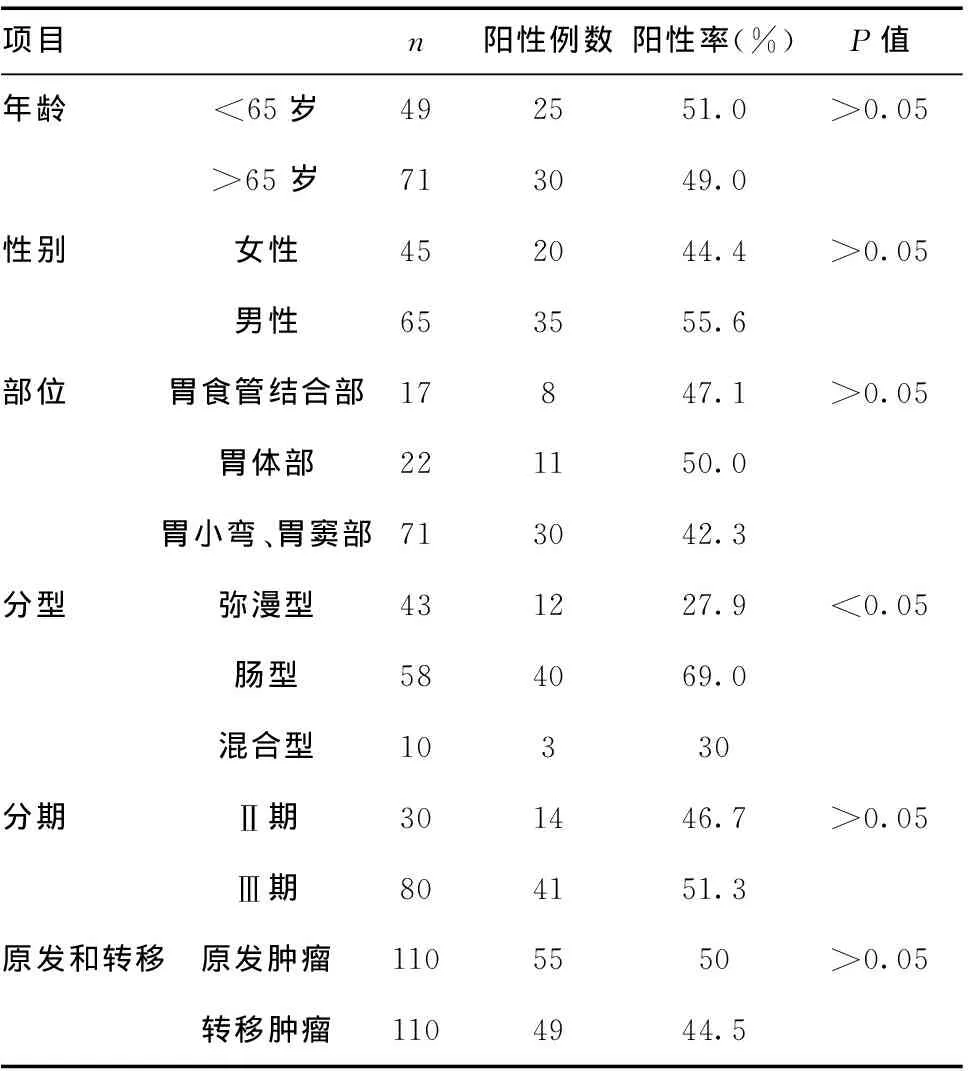
表1 胃癌患者Claudin18.2的表达和临床病理特征之间的关系
2.2免疫组化结果
2.2.1胃癌原发部位及淋巴结转移部位Claudin18.2的表达:在正常胃黏膜上皮可见中度的Claudin18.2表达,其作为本次研究的内对照(图1A)。在胃癌中,Claudin18.2主要表达于细胞膜,部分肿瘤细胞可见细胞质表达。细胞膜可见完整的、基底侧膜或者侧膜表达阳性。按照FAST研究的标准(≥40%的肿瘤细胞中≥2+膜染色强度),本研究胃癌Claudin18.2的阳性率为50%(55/110)图1B-1D分别显示胃腺癌组Claudin18.2 强度1+~3+。淋巴结转移癌中观察到中到强Claudin18.2表达阳性率为44.5%(49/110),图2A-2D分别显示Claudin18.2在淋巴结转移癌中强度0~3+。两组间差异无统计学意义(P>0.05)。
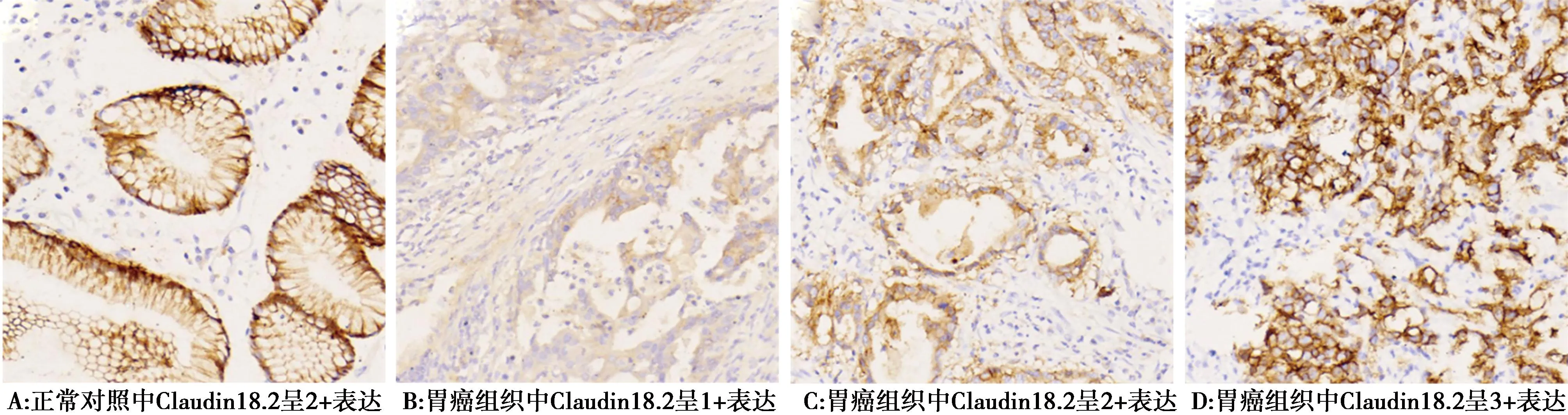
图1 胃腺癌组织中Claudin18.2的表达水平(EnVision,×200)
2.2.2胃腺癌原发灶中Claudin18.2的表达水平与临床病理学特征之间的关系:不同年龄、性别、临床分期的患者Claudin18.2的表达差异无统计学意义(P>0.05);但Lauren分型中肠型较弥漫型的Claudin18.2的表达明显增高,差异有统计学意义(P<0.05)。见表1。
3 讨论
在国外FAST研究[6]中显示:在Claudin18.2表达阳性的胃癌患者中,化疗联合zolbetuximab (IMAB362)的治疗II期临床试验已经显示了很好的疗效,因而有必要进一步研究明确Claudin18.2在中国胃癌患者中的表达情况及与临床特征的关系。
本研究中选择了110例原发性胃癌进行Claudin18.2免疫组化检测,本研究发现Claudin18.2在胃腺癌中表达于肿瘤细胞基底及侧膜,胃腺癌中的阳性率为54.5%。FAST研究中共计筛选了689例欧美胃癌患者,其Claudin18.2阳性率为49%。Rohde等[12]收集了134例日本胃癌患者,运用与FAST研究相同的抗体及评价标准,其Claudin18.2的阳性率为52%,据此发现本研究与日本及欧美胃腺癌Claudin18.2的阳性率相似。Dottermusch等共收集了德国278例胃癌患者,运用免疫组化研究结果显示Claudin18.2的阳性率为42.2%。在阳性患者中,1+、2+及3+的患者的阳性率分别为患者的14.8%、13.3%及14.1%,≥40%的肿瘤细胞中≥2+膜染色强度的百分率仅仅为10%,该结果明显比我们的研究及既往研究均低。进一步分析原因,该研究使用的抗体是Abcam的CLDN18.2抗体(clone EPR19202,Cambridge,UK),与我们及FAST研究中使用的均不同,这可能是其中的原因之一,这些结果也提示,在Claudin18.2的检测中使用一致的抗体及评价体系比较可靠。本研究中比较了胃腺癌和淋巴结转移癌组织中Claudin18.2的阳性率,结果显示两者阳性率相似,这一结果和Rohde等[12]研究结果相似。此结果也初步提示,未来对于Claudin18.2的临床检测可以使用原发灶或转移灶,增加了临床检测的便利性。
本研究中继续分析了Claudin18.2的表达与临床参数之间的关系,研究显示Claudin18.2在不同年龄组、性别及临床分期之间均未见明确的统计学差异,但是Claudin18.2的表达与Lauren分型由一定关系。Claudin18.2在肠型胃癌中表达近70%,弥漫型胃癌中仅30%,该研究结果和Dottermusch等[7]的研究结果相似。Kim等[13]检测了弥漫型胃癌中Claudin18.2的表达水平,其用H-Score 对结果进行统计,结果即使H-Score 80分的患者约占25%,与本研究结果相似。这一结果提示,肠型胃癌比弥漫型胃癌将更有机会从Claudin18.2的治疗中获益。
本研究对Claudin18.2在胃癌中的表达水平及临床参数之间的关系做了初步探讨,初步提示约50%的中国胃癌患者未来有可能从Claudin18.2的治疗中获益。由于样本量有限,尚需要进一步扩大样本量来验证该结果。
