晚期左右半结肠癌患者组织MSI、KRAS、BRAF状态与疗效的相关性
2023-12-20李燕芳毛祖宜
刘 峰,李燕芳,熊 钢,毛祖宜
(1.湖北省兴山县人民医院肿瘤科,湖北 兴山 443700;2.三峡大学附属第二人民医院 宜昌市肿瘤医院肿瘤科,湖北 宜昌 443000)
结肠癌是临床上常见的消化道恶性肿瘤之一,由于社会经济水平的提高、饮食结构的改变及人口老龄化的加剧等诸多因素,导致我国结肠癌发病率和死亡率逐年上升[1]。结肠癌早期症状多无显著特异性,一旦确诊多为中晚期,而对于晚期结肠癌患者,临床上大多使用综合治疗方式,主要包括化疗、放疗及靶向治疗等[2],但预后较差、5年生存率较低[3]。根据发病部位及临床表现的不同,可将结肠癌分为左半结肠癌(LSCC)和右半结肠癌(RSCC),LSCC和RSCC在组织形态学、分子生物学、药物敏感性等方面存在着明显差异[4]。目前,转移性结直肠癌的一线化疗方案为5-氟尿嘧啶+亚叶酸钙+奥沙利铂(FOLFOX)方案[5]。据文献报道,微卫星(MS)的稳定情况与肿瘤发生密切相关[6],肿瘤发生时可能存在微卫星不稳定型(MSI)和微卫星稳定型(MSS)的不同情况。另外,发现结直肠癌的发生与许多重要抑癌基因的突变相关,如原癌基因(KRAS)、B-RAF原癌基因丝氨酸/苏氨酸蛋白激酶(BRAF)等[7]。基于此,本研究通过回顾性分析晚期左右半结肠癌患者临床资料,探讨其组织MSI、KRAS、BRAF状态与疗效相关性,以期为临床诊疗提供一定的参考依据。
1 资料与方法
1.1一般资料:选取2019年1月~2022年12月兴山县人民医院收治的80例晚期结肠癌患者为研究对象。纳入标准:①符合《美国肿瘤联合会结直肠癌分期系统(第8版)》[8]中关于晚期结肠癌的诊断及分期标准,临床分期均为Ⅳ期,且不可手术的患者;②年龄18~70岁;③未患有其他类型恶性肿瘤;④经影像学检查发现,可测量病灶不得少于一个;⑤东部肿瘤学协作组(ECOG)制定的活动状态评分≤2分,无化疗及靶向治疗禁忌证;⑥经实验室检查,凝血及肝肾功能检测结果未见明显异常;⑦对于本研究中的治疗方案,至少可耐受4个周期。排除标准:①存在精神或意识障碍;②依从性差,无法规律接受治疗及评估疗效。本研究经过本院医学伦理委员会同意。
1.2方法:(1)从电子病历系统中导出患者年龄、性别、病理分型、肿瘤部位等临床资料;(2)观察指标:①MSI:选取结肠癌病变组织蜡块进行切片脱蜡,同时选择正常人体组织用以对照,在使用苏木素-伊红染色后,置于显微镜下观察病变组织,刮取细胞后离心取DNA,通过使用MSI检测试剂扩增结肠癌组织中5个标准位点MSI的突变状态,若组织中存在的突变位点≥2个,判定为高频微卫星不稳定型(MSI-H);若突变位点为1个,判定为低频微卫星不稳定型(MSI-L);若无突变位点,判定为MSS。②KRAS、BRAF:将石蜡包埋的晚期结肠癌组织切成片,放入微型离心(EP)管中提取脱氧核糖核酸(DNA),使用基因突变联合检测试剂盒进行操作。制备样本和聚合酶链式反应(PCR)扩增,在PCR反应中设立对照组,共同进行检测和分析。根据有无突变可分为KRAS、BRAF突变型和野生型。试剂盒均由厦门丽宝生物有限公司提供。③治疗方案:所有患者均予贝伐珠单抗联合FOLFOX方案治疗,具体用药为贝伐珠单抗注射液[齐鲁制药有限公司,国药准字S20190040,生产批号:181123、200905、220614,规格100 mg]静脉滴注,使用剂量为5 mg/kg,隔周1次。FOLFOX方案具体如下:将奥沙利铂[齐鲁制药(海南)有限公司,国药准字H20093167,生产批号:171206、190823、210712规格50 mg]85 mg/m2+亚叶酸钙(山东罗欣药业集团有限公司,国药准字H20054302,生产批号:181205、201018、220527,规格100 mg)400 mg/m2+氟尿嘧啶(天津金耀药业有限公司生产,国药准字H12020959,生产批号:181116、200725、220319,规格0.25 g/10 ml)2 400 mg/m2持续泵注46 h,以14 d为1个周期。在第4周期化疗结束后,对两组患者均予影像学检查以评估疗效。 ④疗效判定:按实体肿瘤疗效评价标准RECIST 1.1版[9]评价疗效,具体如下,完全缓解(CR):所有靶病灶均消失,且至少持续4 w以上;部分缓解(PR):所有可测量靶病灶的最大长径之和较前减少≥30%;疾病稳定(SD):所有可测量靶病灶的最大长径之和减少<30%,但直径和相对增加<20%;疾病进展(PD):所有可测量靶病灶直径之和相对增加≥20%(直径和绝对增加不少于5 mm,出现的新病灶不少于1个)。根据疗效可将患者分为两组,其中一组为疾病控制(DC,n=57)组:CR+PR+SD,另一组为疾病进展组(PD,n=23)。
1.3统计学处理:采用SPSS23.0统计学软件进行t检验、χ2检验、Fisher精确检验及秩和检验。相关性使用多因素Logistic回归分析。
2 结果
2.1DC组与PD组相关因素比较:DC组与PD组的性别、年龄、Karnofsky功能状态(KPS)评分、病理分型、肿瘤部位、KRAS状态比较差异无统计学意义(P>0.05);但PD组的MSI-L+MSS、BRAF突变型占比高于DC组,差异有统计学意义(P<0.05)。见表1。
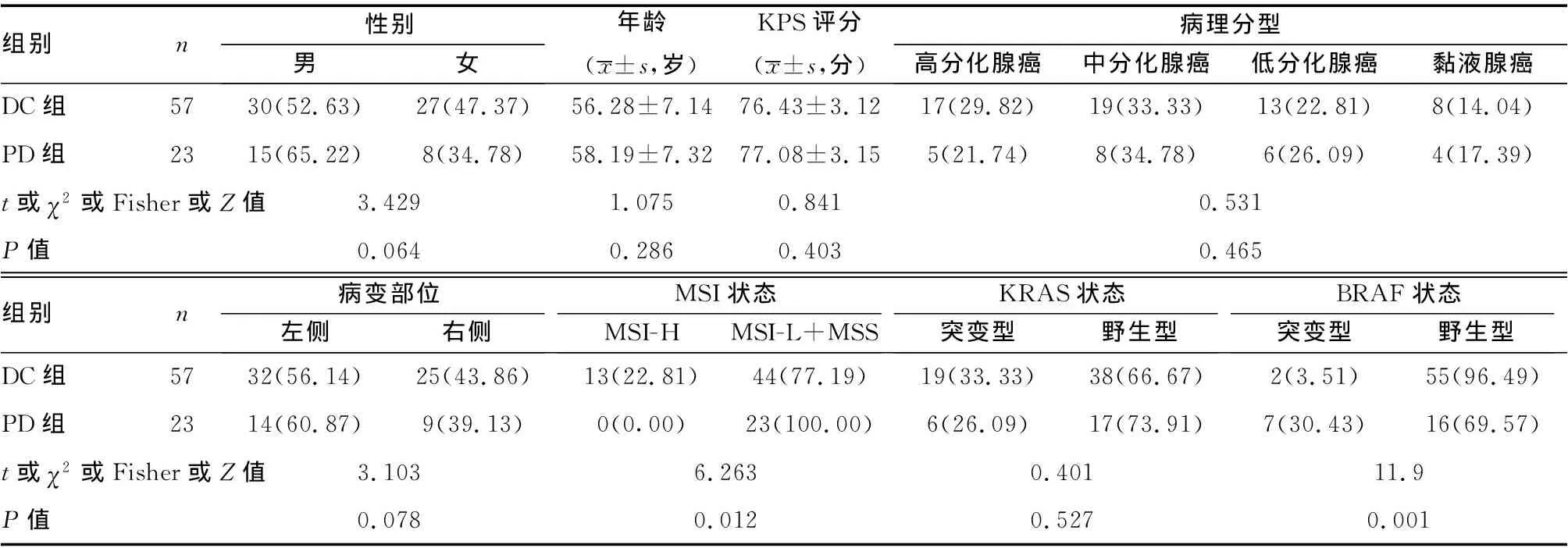
表1 两组患者相关因素比较[n(%)]
2.2MSI、BRAF状态与疗效的Logistic回归分析:运用Logistic回归分析影响疗效的差异变量,根据实际情况赋值,以疗效为因变量(DC为0,PD为1),以单因素分析具有统计学意义的因素为自变量进行赋值(MSI-H为0,MSI-L+MSS为1;BRAF野生型为0,突变型为1)。多因素Logistic回归分析显示,MSI-L+MSS、BRAF突变型是影响贝伐珠单抗联合化疗治疗晚期左右半结肠癌患者疗效的独立危险因素(P<0.05)。见表2。

表2 影响疗效的多因素Logistic回归分析
2.3MSI、KRAS、BRAF基因突变发生情况:本研究80例患者中,检测到MSI基因突变共13例,KRAS基因突变共25例,BRAF基因突变共9例,基因突变具体情况见表3。
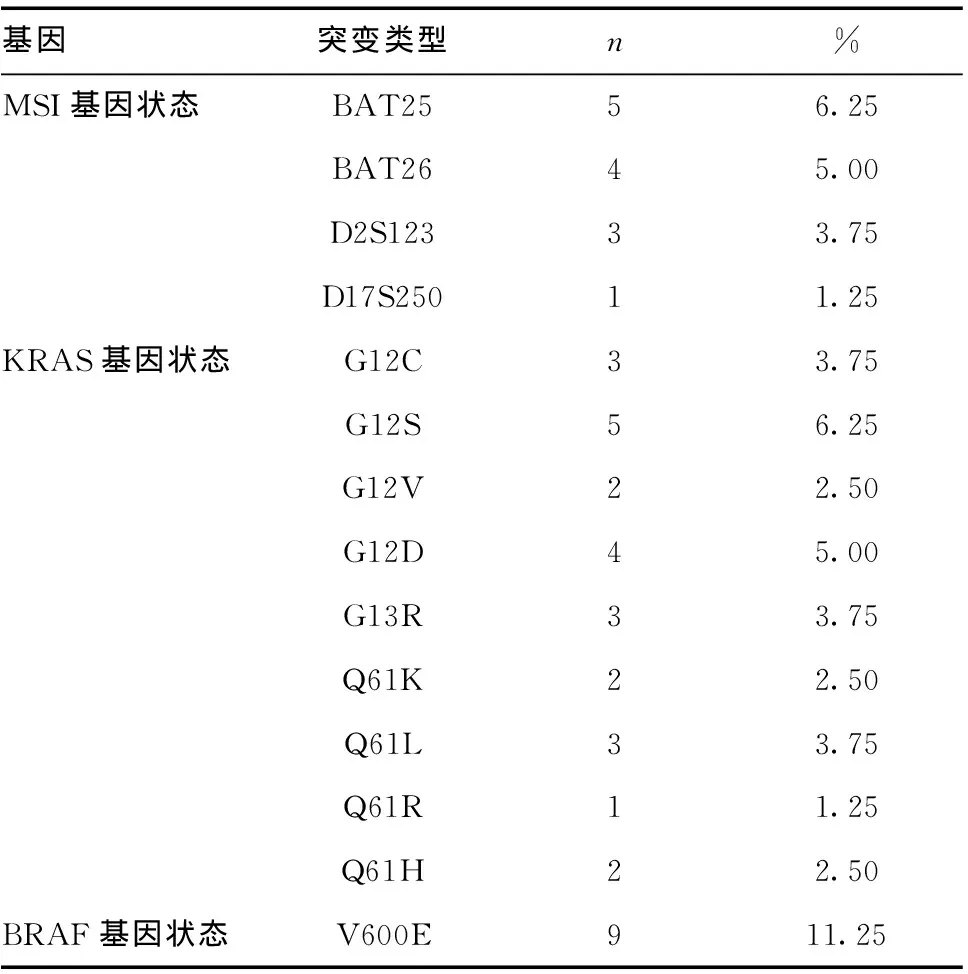
表3 MSI、KRAS、BRAF基因突变发生情况
2.4组织MSI、BRAF状态与疗效的相关性:Pearson法分析结果显示,组织MSI-L+MSS、BRAF突变型与疗效呈明显负相关(r=-5.328,-6.419,均P<0.01)。
3 讨论
在以往临床治疗中,晚期结肠癌可出现高复发率、低有效率等情况[10],严重影响了患者的生存质量。目前,临床普遍使用抑制剂联合标准化疗治疗晚期结肠癌,而这类治疗方案需要检测肿瘤组织中基因的突变状态。近年来,大量临床研究证实动态监测肿瘤组织的基因状态可用于评估疗效及预后[11],为预测疾病进展提供一定的参考依据。如闵力等[12]发现甘油-3-磷酸脱氢酶1(GPD1)基因在结肠癌患者中不仅可抑制肿瘤细胞增生,且GPD1低表达可作为不良预后的独立预测因素。
本研究结果说明晚期结肠癌患者的MSI、BRAF状态可对贝伐珠单抗联合化疗的效果产生一定影响。徐蕾等[13]研究发现,对于给予贝伐珠单抗联合一线化疗治疗的晚期结直肠癌患者,KRAS基因突变状态与疗效之间尚无明确联系,与本研究结果类似。但王珏等[14]在使用化疗联合贝伐珠单抗治疗晚期结肠癌患者时发现,LSCC组的疗效显著优于RSCC组,究其原因可能为RSCC中KRAS基因突变率高于LSCC,说明监测结肠癌患者的KRAS基因突变情况可用于评估疗效及预后,造成上述不同结论的原因可能与地域、个体差异性,样本量大小等因素有关。MS又被称为简单重复序列,广泛存在于基因组,近年来作为肿瘤标志物及预后的影响因子被大量研究,而MSI最早被发现与结直肠癌中,不少学者认为MSI与结直肠癌的预后密切相关[15],可指导临床用药。周乐其等[16]认为相较于MSI-H状态的中晚期结直肠癌患者,MSI-L+MSS状态患者一线治疗的疗效明显更差。本研究通过分析,初步拟定了晚期结直肠癌患者MSI状态对贝伐珠单抗联合化疗效果的影响。另外,陈海霞等[17]研究发现,结直肠癌患者中BRAF基因突变型与野生型相比,更易出现预后不良。
本研究显示,MSI-L+MSS、BRAF突变型是影响贝伐珠单抗联合化疗治疗晚期左右半结肠癌患者疗效的独立危险因素,组织MSI-L+MSS、BRAF突变型与疗效呈明显负相关。有文献显示,针对Ⅱ/Ⅲ期结直肠癌患者,MSI-L+MSS状态患者的总生存期及无病生存期明显少于MSI-H状态患者,预后相对较差[18]。罗长顺等[19]研究发现,MSS状态直肠癌患者体内程序性死亡受体配体1(PD-L1)在肿瘤浸润淋巴细胞(TIL)中的阳性比例明显低于MSI-H状态患者,而PD-L1在TIL细胞内的阳性表达是影响患者临床疗效的重要因素。与杨迁妮等[20]的意见相悖,其认为MSI-H晚期结直肠癌患者3年生存率低于MSS型者,可能与MSI-H晚期结直肠癌患者化疗的有效率低相关,但因本研究MSI-H结直肠癌的样本量相对较少,且可能与化疗方案相关。另外,何兴状等[21]证实BRAF V600E突变是影响结肠癌患者预后的独立危险因素,验证了本研究结果。
综上所述,联合检测组织MSI、BRAF基因状态可用于评估晚期左右半结肠癌患者临床疗效,MSI-L+MSS、BRAF突变型与疗效呈明显负相关,但此次研究存在一定的选择局限性,样本量偏小,仅发现13例MSI-H及9例BRAF突变型患者,随访时间短,相关结论及MSI、BRAF状态与患者远期预后的关系仍需扩大样本量行进一步研究。
