miR-181a通过NF-κB通路调控胃癌细胞系SGC-7901的凋亡及迁移
2023-12-20曲晓媛房俊楠
卢 强,曲晓媛,王 枫,房俊楠
(1.山东中医药高等专科学校免病教研室,山东 烟台 264100;2.山东中医药高等专科学校口腔教研室,山东 烟台 264100)
胃癌作为世界癌症死亡的主要原因[1],癌症则具有异质性。研究表明,miRNAs参与促进或抑制癌细胞的调节过程,可作为癌症管理的生物标志物[2-3]。NF-κB信号通路是参与炎性反应和先天免疫调节的主要信号级联反应。其也越来越被认为是癌症发生和发展的许多步骤的关键参与者。异常NF-κB激活可以改变染色质景观以支持致癌发展[4]。哺乳动物中的NF-κB转录因子家族包括五个成员RelA(p65)、RelB、c-Rel、NF-κB1(p105/p50)和NF-κB2(p100/p52)。小非编码RNA(microRNA/miRNA)的功能障碍会干扰致癌或肿瘤抑制靶基因的表达,这与癌症发病机制有关[5]。已经发表miRNA可以通过调节NF-κB信号通路而促进癌症转移,如miR-1910-3p[6]。通过前期工作及预实验结果,结合相关文献本研究提出如下假说:miR-181a通过NF-κB信号通路调控胃癌细胞生长及侵袭。相关研究在临床病例标本及胃癌细胞层面展开,深入研究miR-181a调控胃癌细胞生长及侵袭相关的分子机制,为进一步理解胃癌的发病机制以及为胃癌的诊疗靶点选择提供新的理论依据。
1 资料与方法
1.1纳入病例标本:本研究纳入潍坊医学院附属医院2015年1月~2017年12月的90例胃癌患者胃部病变区标本及血液标本,所有病例标本经由病理科室HE染色确诊为不同分期胃癌组织标本,排除其他相关性疾病。另纳入30例癌旁组织作为对照组,经病理科室HE染色确诊胃癌病变。本研究经过本院医学伦理委员会同意。
1.2细胞培养及细胞转染:本实验中使用的胃癌细胞MKN45、SGC-7901、MGC803及BGC-823购自ATCC公司。细胞用含胎牛血清(10%)的DMEM培养基(Gibco,USA)在37℃、5% CO2、湿度95%的培养箱内进行培养。收集处于对数期胃癌细胞系,制成4×104个/ml细胞悬液,100 μl接种于96孔细胞培养板中,置于37℃、5% CO2培养箱中过夜培养。将SGC-7901细胞悬液进行计数,接种至6孔板中;放入培养箱中待密度达到70%左右;将6孔培养板中加入800 μl的OPTI-MEM;转染比例为每孔转染2 μg质粒和2 μl Lipofectamine 2000,首先将二者分别溶于100 μl OPTI-MEM,室温静置5 min,然后将二者充分混匀,室温静置25 min;把两者的混合液倒入6孔板中,放入37℃,5%CO2培养箱中培养6 h后,去除混合液,每孔加入1.5ml完全培养基,然后进行后续检测。实验分组为miR-181a高表达组(181a-up)、miR-181a高表达对照组(181a-up-control)、miR-181a低表达组(181a-down)和miR-181a低表达对照组(181a-down-control)。
1.3RT-qPCR检测RNA水平:使用TRIzol提取总RNA。TaqMan MicroRNA逆转录试剂盒(美国Life Technologies)用于将总RNA逆转录为特定microRNA的cDNA。使用Taq Man MicroRNA检测试剂盒(美国应用生物系统公司)检测miR-181a表达水平。PCR扩增程序如下:在94℃下变性5 min,然后在94℃下变性30 s,在60℃下变性30 s,在72℃下变性40 s,共40个循环。以GAPDH为内参。见表1。

表1 miR-181a和U6定量PCR引物
1.4TUNEL法检测SGC7901细胞凋亡:将每组胃癌细胞系SGC7901接种到24孔板(2×105个/孔)中,用PBS洗涤,用4%多聚甲醛固定30 min,然后用含有0.3%Triton X-100的PBS处理5 min以获得通透性。随后加入50 μl TUNEL测定溶液并在37℃下避光孵育1 h。Hoechst试剂对细胞核进行染色。PBS洗涤3次后封片并在共聚焦显微镜下观察TUNEL标记阳性细胞以及Hoechst标记细胞核。
1.5划痕实验检测细胞迁移能力:对于迁移能力测定,用200 μl无血清培养基悬浮1×105个细胞进行细胞接种。带接种细胞融合至90%以上PBS缓冲液洗掉掉落的细胞,并用无血清基础培养基培养。显微镜拍摄24 h,48 h和72 h镜下细胞,并记录划痕面积(S1、S2),细胞迁移率=(S1-S2)/S1×100%,每组实验重复3次,在显微镜(×100)下计数。
1.6Western印迹分析:使用RIPA缓冲液从培养细胞中提取总蛋白,包括PMSF蛋白酶抑制剂(碧泰生物技术,中国)和磷酸酶抑制剂(Servicebio,中国)。蛋白质浓度通过BCA蛋白质测定试剂盒(Beyotime Biotechnology,中国)测量。将10 μg总蛋白裂解物在10% SDS-PAGE(Yeasen生物技术有限公司)中电泳。用SDS-PAGE凝胶分离后,将蛋白质转移到0.45 mm/0.22 mm聚偏二氟乙烯(Merck Millipore,Billerica,MA)上。将膜在室温下用5%脱脂牛奶封闭2 h。除去封闭溶液,加入稀释的一抗在4℃下过夜。然后,用TBST洗涤5次,5 min/次。然后,将膜与p-p65、总p65、p50和p150、抗Caspase3和抗Caspase9,GAPDH在4℃下过夜。随后,使用二抗(1∶7 500,#ASO14,#AS003)将膜在室温下孵育1 h。室温下用TBST洗涤膜3次,5 min/次,用ECL试剂(ABclonal,中国)检测目标蛋白。通过图像J软件(Ver 1.5.3)量化蛋白质条带的强度。
2 结果
2.1miR-181a在胃癌患者中的临床资料分析:通过RT-qPCR检测miR-181a在胃癌组织和癌旁组织的表达水平并进行生存分析。结果表明,胃癌组织与癌旁组织比较,miR-181a高表达且差异有统计学意义(P<0.05),如图1A。低表达的miR-181a在胃癌患者中总生存更好(P=0.020 6),如图1B。这提示,miR-181a可能是胃癌中的癌基因。

图1 miR-181a在胃癌组织中的表达和生存分析
2.2miR-181a抑制SGC7901癌细胞凋亡:利用TUNEL法检测miR-181a抑制SGC7901癌细胞凋亡。Hoechst将细胞核染成蓝色,TUNEL将断裂的DNA染成绿色,如图2A。结果显示,与miR-181a-up组相比,miR-181a-down组细胞核染色更紧实且TUNEL荧光强度更大。miR-181a-down组细胞核染色更紧实且TUNEL荧光强度更大。对SGC7901细胞的TUNEL阳性细胞计数并计算比率,如图2B。结果表明,miR-181a-up与miR-181a-down组与其对照组比较,差异有统计学意义(P<0.05),此外,与miR-181a-up组比较,miR-181a-down组阳性率更高(P<0.05)。Western印迹实验检测凋亡相关蛋白质Caspase3和Caspase9并进行量化,如图2C,结果显示与miR-181a-up组比较,miR-181a-down组Caspase3和Caspase9的表达量更高(P<0.05)。这说明,miR-181a可以抑制SGC7901癌细胞凋亡,这将有利于癌细胞存活。
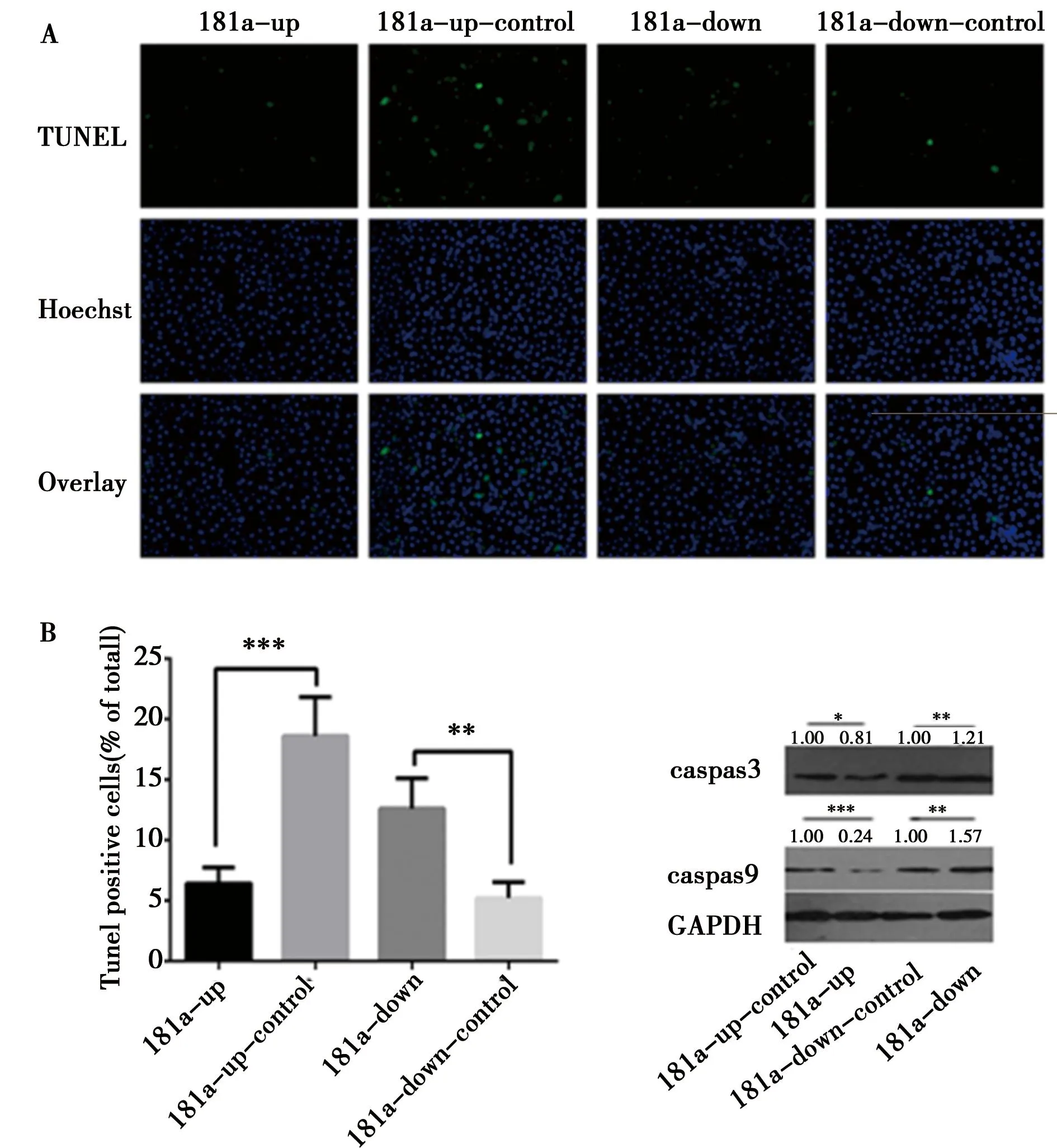
图2A:共聚焦观察SGC7901细胞荧光强度以及细胞形态;图2B:SGC7901细胞的TUNEL阳性细胞率。图2C:Western印迹检测凋亡相关蛋白质Caspase3和Caspase9

图3A:划痕实验检测出miR-181a促进SGC7901迁移;图3B:柱形图可视化数据表明miR-181a促进SGC7901迁移
2.3miR-181a促进SGC790迁移:本研究选取SGC-7901胃癌细胞作为工具细胞,转染miR-181a-down和miR-181a-up质粒,并用RT-qPCR检测不同时间段miR-181a的表达状况,本研究使用划痕实验技术分析miR-181a对胃癌细胞迁移的影响。结果显示,与对照组比较上调miR-181a后,SGC-7901细胞迁移增强,下调miR-181a后产生相反结果。此外,miR-181a-down组比miR-181a-up组迁移能力弱。
2.4miR-181a激活NF-κB信号通路:RT-qPCR结果显示,p105、p50和p65在miR-181a-up组表达量高于miR-181a-down组,见图4A。Western印迹实验表明p-p65、总p65、p50和p150在miR-181a-up组表达量高于miR-181a-down组,见图4B。

图4A:RT-qPCR结果显示p105、p50和p65在miR-181a-up组表达量高于miR-181a-down组;图4B:Western印迹实验表明p-p65、总p65、p50和p150在miR-181a-up组表达量高于miR-181a-down组
3 讨论
NF-κB是最重要的细胞内核转录因子之一,其在受各种刺激影响的许多基因的转录调控中起着核心作用[7]。近年来的大量研究强调了IKK/NF-κB系统如何硬连线控制局部和全身代谢网络,这些网络塑造了机体生理学、细胞分化、能量稳态以及从2型糖尿病和肥胖到慢性炎性反应性疾病、自身免疫和癌症等一系列人类病理。在这个框架中,NF-κB信号传导似乎在控制代谢适应疾病中发生的环境变化和组织稳态破坏方面尤为重要。NF-κB已被证明可以调节miRNA的表达,反之,一些miRNA直接或间接地调节NF-κB的表达[8-10]。有研究表明,miR-181a通过抑制NF-κB途径来阻止癌细胞侵袭和迁移,例如非小细胞肺癌[11],B细胞样弥漫性大B细胞淋巴瘤[12]和结直肠癌[13]。
NF-κB亚基Rel是生发中心B细胞和人B细胞淋巴瘤能量代谢和生物合成途径的主要调节因子,在某些临床前动物模型中,用小分子Rel抑制剂治疗可以有效抵消淋巴瘤发生。鉴于异常NF-κB活性在恶性和非恶性病变中的普遍作用,对NF-κB如何调节代谢的更多了解可能为开发针对各种疾病的治疗靶点和诊断工具提供信息。尽管制药行业在过去三十年中积极努力开发特异性IKK/NF-κB抑制剂,但由于阻断IKK/NF-κB通路核心成分的药物具有排他性的靶向毒性,因此没有一种药物获得临床批准。因此,深入表征IKK/NF-κB依赖性疾病的代谢驱动因素似乎是确定NF-κB途径中可操作候选靶点的合乎逻辑的第一步,理想情况下规避了常规IKK/NF-κB靶向药物的排他性毒性。
胃癌是全球癌症死亡的主要原因并具有较高发生率[1]。NF-κB驱动的基因产物包括细胞因子/趋化因子、生长因子、抗凋亡因子、血管生成调节剂和金属蛋白酶。NF-κB转录的许多基因促进胃癌发生并且NF-κB系统推荐用于靶向治疗[14],因此明确NF-κB影响癌症的机制将有利于患者的合理用药。miR-181家族参与了胃癌的发生发展。miR-181a-2-3p通过靶向MYLK刺激胃癌进展[15]。miR-181a-5p-TCL1A-Akt/mTOR-c-MYC环调节胃癌自噬作为肿瘤抑制因子[16]。miR-181a通过靶向RASSF1A促进细胞增殖并抑制胃癌细胞凋亡[17]。
至今,在胃癌中尚无miR-181a对NF-κB途径的影响,因此本研究在临床病例标本及胃癌细胞层面展开,深入研究miR-181a通过对NF-κB通路调控胃癌细胞生长及侵袭相关的分子机制,这将为胃癌的个体化诊疗提供理论依据。本文先通过临床样本检测miR-181a在胃癌组织中的表达以及与临床病理参数的统计学意义,推测miR-181a在胃癌中是致癌还是抑癌基因。之后以胃癌细胞系SGC7901为基础,设置miR-181a-up,miR-181a-up-control,miR-181a-down,miR-181a-down-control分组检测miR-181a上下调对NF-κB信号通路相关基因表达水平的差异性,探讨miR-181a通过NF-κB信号通路影响胃癌细胞生长、侵袭的机制,以期为胃癌的临床治疗提供新依据。结果显示,miR-181a抑制SGC7901癌细胞凋亡并促进癌细胞侵袭。miR-181a通过提高NF-κB1和RelA的RNA水平以及p-p65、总p65、p50和p150的蛋白质水平激活NF-κB信号通路。miR-181a-NF-κB分子调控轴的阐释为进一步理解胃癌的发病机制以及胃癌的靶向精准医疗提供了理论基础。
