基于铁死亡探讨温阳复元方对脑缺血再灌注损伤大鼠神经损伤的保护机制
2023-12-20向军军李丽琴李建铮莫雪妮陈炜胡跃强广西中医药大学第一附属医院广西南宁53003广西中医药大学广西南宁530000
向军军,李丽琴,李建铮,莫雪妮,陈炜,胡跃强(.广西中医药大学第一附属医院,广西南宁 53003;. 广西中医药大学,广西南宁 530000)
缺血性脑卒中(Ischemic stroke,IS)是临床中常见的脑卒中类型,是世界范围内致残率和死亡率最高的疾病之一[1]。目前缺血性脑卒中的治疗方法主要包括药物溶栓或介入手术,可快速使血管恢复灌注[2]。然而缺血区域因恢复灌注所造成的脑缺血再灌注损伤(Cerebral ischemia-reperfusion injury,CIRI)可通过炎性反应、钙离子超载、自由基过度形成、兴奋性氨基酸的毒性作用等诱发或加重对神经元的损伤[3]。近年来发现铁代谢介导的铁稳态失衡参与脑缺血再灌注损伤的病理生理学过程,并发现改善铁代谢,维持细胞内外铁稳态有望成为改善脑缺血再灌注损伤的关键干预途径[4]。
铁调节蛋白(iron regulatory proteins,IRP)/铁反应原件(iron responsive elements,IRE)是目前维持细胞内铁稳态的主要调节机制,IRE 是存在于目标mRNA中的一个高度保守的核苷酸序列,与IRP结合形成发夹结构,其在转录后水平发挥调节作用;IRP包括IRP1 和IRP2 两型,其中IRP1 是一种双功能酶,已证实膜铁转运蛋白受体1(Transferrin receptor protein 1,TFR1)与膜铁转运蛋白(Recombinant Ferroportin ,FPN)是IRE 的主要目标基因[5]。研究[6]发现,当细胞内铁过载时,IRP1 终止与IRE 目标基因(TFR1 及FPN)结合,增加细胞内铁的输出而减少铁摄取,维持细胞内铁稳态。
温阳复元方是本课题组经多年临床实践凝练而成的治疗缺血性脑卒中的有效方剂,经多中心临床研究[7-8]发现该方可有效地促进患者神经肢体功能康复。动物实验研究[9]发现该方改善脑缺血再灌注损伤大鼠神经功能缺损的机制可能与上调人类猫白血病C亚类病毒受体(Feline leukemia virus subgroup C receptor,FLVCR)和胸腺癌抵抗蛋白(Breast Cancer Resistance Protein,BCRP)的表达有关;而BCRP 与FLVCR 作为血红素铁转运蛋白,与铁代谢关系密切[10],因此,我们推测该方对脑缺血再灌注损伤大鼠的神经保护作用可能与通过IRP1 调节脑铁代谢,进而抑制铁死亡有关。
本研究拟从温阳复元方改善脑铁代谢角度,探索缺血性脑卒中的潜在治疗靶点,以期为该方的临床运用提供科学依据。
1 材料与方法
1.1 动物健康雄性SPF级SD大鼠72只,3月龄,体质量(250±50)g,由湖南斯莱克景达实验动物有限公司提供,动物质量合格证号: 430727221102400862,动物生产许可证号:SCXK(湘)2019-0004。动物饲养在广西中医药大学第一附属医院动物实验中心,各组大鼠自由饮食、饮水,室温、60%湿度的受控环境中,适应性喂养1周。本研究经广西中医药大学伦理委员会批准,伦理审批号: DW20211204-196,实验流程及动物处理遵循动物实验管理条例。
1.2 药物及试剂温阳复元方由经典方四逆汤化裁而来,方药组成:白附片30 g(先煎1 h)、黄芪30 g、党参30 g、石菖蒲20 g、淫羊藿15 g、田三七15 g、干姜10 g、炙甘草6 g。所有药材均由广西中医药大学第一附属医院药剂科统一采购,由广西仙茱中药科技有限公司制备(批号:20190701),经广西中医药大学第一附属医院陈超副主任药师鉴定为正品,符合2020 年版《中华人民共和国药典》规范。加入药材总质量7倍的蒸馏水浸泡药材30 min,待药材完全吸水后,白附片先煎1 h(大火煮开,文火煎1 h),后加入其他药物武火煮开后,文火煮1 h,用无菌纱布滤过、收集药液;继续加约7 倍的水继续煎煮40 min,滤过,将2次药液混合,大火浓缩至含原生药浓度1.0 g·mL-1的溶液,4 ℃冰箱中保存备用。灌胃剂量计算方法参照药理实验方法[11],按人与大鼠体表面积换算系数,成人(70 kg)每日服用156 g 原生药,则大鼠温阳复元方的用药剂量为18.0 g·kg-1。
MCAO 线栓,河南平顶山豫顺生物科技有限公司,批号:2543;TRIzol ReagentRNA 试剂盒,美国Ambion 公司,批号:284909;Erastin 铁死亡诱导剂,美国MedChemExpress 公司,批号:118342;Ferrostatin-1 铁死亡抑制剂,美国Selleckchem 公司,批号:S7243;戊巴比妥钠,美国Serve 公司,批号:201505;Western 一抗稀释液、Western 二抗稀释液、ECL 化学发光底物试剂盒(特超敏),均购自中国Biosharp 公司,批号依次为:BL506A、BL536A、BL520A;2×S6Universal SYBR高效RIPA组织/细胞快速裂解液、IRP1 抗体、TfR1 抗体、FPN 抗体、还原型谷胱甘肽(GSH)含量检测试剂盒、铁含量检测试剂盒、anti-GAPDH Rabbit polyclone、二甲基亚砜(DMSO),均购自中国Solarbio 公司,批号依次为:F3525、K111307P、DF1356、AF5343、BC1175、B26465、BL006B、DB371。
1.3 仪器DP73 显微镜,日本Olympus 公司;LightCycler 96 Instrument PCR 仪,瑞士Roche 公司;ChemiScope 6000 型化学发光成像系统,上海勤翔科学仪器有限公司;MDF-382E型超低温保存箱,日本三洋公司;BV-2 型电泳仪、BT-2 型转膜仪,武汉赛维尔生物科技有限公司;H-600型透射电镜,日本日立公司;M200PRO型多功能酶标仪,瑞士TECAN公司。
1.4 分组、模型复制及给药72 只SD 雄性大鼠,按照随机数字表法随机分为假手术组、模型组、温阳复元方组、铁死亡诱导剂组、温阳复元方+铁死亡诱导剂组、铁死亡抑制剂组,每组12只。
术前禁食不禁水12 h,采用线栓法制备大脑中动脉闭塞/再灌注(MCAO/R)大鼠模型[12]:以40 mg·kg-1戊巴比妥钠腹腔注射麻醉,沿颈前正中线切口,逐层分离且充分暴露颈动脉,小心分离迷走神经与颈总动脉以及颈外、颈内动脉,并结扎颈总动脉和颈外动脉,线栓经颈内动脉插入至大脑中动脉(深度约17~18 mm),形成大鼠右侧脑缺血。所有手术均为右侧大脑中动脉栓塞。假手术组手术步骤同模型组,但线栓只插入颈内动脉深度9 mm,不堵塞大脑中动脉。参照Longa 等[13]的评分标准进行神经功能缺损评分,评分1~3 分表明造模成功,不符合者进行剔除。
铁死亡诱导剂和铁死亡抑制剂用10%二甲基亚砜(DMSO)按要求配置,于造模前24 h开始按分组分别以100、5 mg·kg-1腹腔注射;温阳复元方组于清醒后2 h 开始灌胃18.0 g·kg-1;模型组、假手术组灌胃等体积蒸馏水,自由饮食饮水。各干预措施均为每天1次,连续7 d。
1.5 标本采集与处理造模后第7天,神经功能缺损评分后,随机取6 只大鼠采用戊巴比妥(30 mg·kg-1)腹腔麻醉后解剖开大鼠胸腔暴露心脏,剪开右心耳,将注射器针头经心尖插入至主动脉端并固定好,用100 mL 生理盐水通过注射器快速注入,待心脏无血色液体流出,前爪、肺部颜色变成白色后,开颅取脑,切取右侧缺血周边组织进行取材;随机取其中3 只的组织置于4%多聚甲醛中固定,用于HE染色等其他指标检测;将另外3只缺血区域皮质部位组织切成1 mm3的组织块,投入预冷的电镜固定液中,于4 ℃冰箱保存。剩余6只麻醉后,冰上操作快速取右侧缺血区域组织并迅速投入液氮中冷冻,然后存放于-80 ℃冰箱保存,用于RT-qPCR 及Western Blot等分子检测。
1.6 大鼠神经功能缺失的Longa 评分法大鼠神经功能缺损评分参照Longa 等[13]的评分标准:0 分为无神经功能缺失症状,活动正常者;1分为提尾时左侧前肢不能完全伸展;2 分为行走时向左侧转圈(追尾现象);3分为行走时向左侧倾斜;4分为不能自主行走,意识丧失。
1.7 脑组织苏木素-伊红染色取脑组织样本,经常规脱水透明、浸蜡、石蜡包埋后,进行组织蜡块切片,切片厚度约3~5 μm。脱蜡脱水处理后,进行苏木素及伊红染色,封片,光学显微镜下观察脑组织神经元分布、形态学等病理改变并拍照保存。
1.8 生化法检测脑组织Fe2+和GSH 含量取脑组织样本,各组分别称取0.1 g 脑组织,加入0.9 mL 的匀浆介质,冰水浴中剪碎、研磨,制成10%的匀浆液;以2 500 r·min-1离心15 min(离心半径8 cm),吸取上清液。按照GSH 试剂盒及铁含量检测试剂盒说明书进行相应操作,计算组织中Fe2+和GSH的含量。
1.9 RT-qPCR 法检测缺血区域脑组织中TFR1、IRP1、FPN mRNA 的表达水平提取脑组织总mRNA 后,添加TRIzol 试剂以保持样品中RNA 的完整性,测定总mRNA 的纯度和浓度,反转录制备互补DNA。将样品加入96 孔板进行PCR 扩增。记录在每个反应管中达到设定阈值时荧光信号经历的循环数(Ct 值)。通过2-ΔΔCt方法确定基因表达的差异,基因引物序列见表1,引物由北京擎科生物技术公司合成。
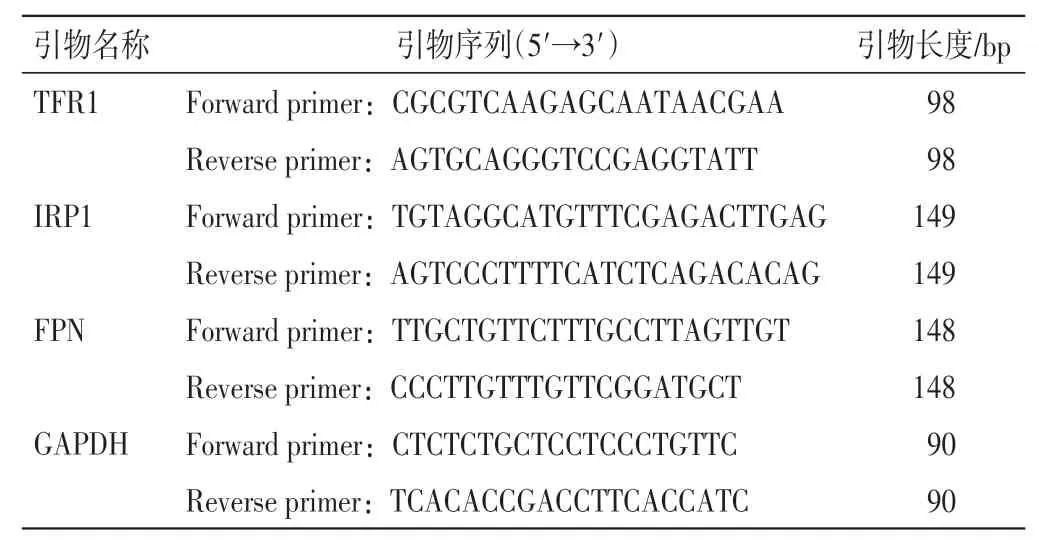
表1 qPCR 引物序列Table 1 Primer sequences of qPCR
1.10 Western Blot 法检测缺血区域脑组织中TFR1、IRP1 和FPN 蛋白的表达水平取脑组织样本,经常规蛋白提取、配胶与电泳、转膜,再加入一抗4 ℃下孵育过夜,TBST 洗涤3 次,每次5 min;然后加入二抗在室温下孵育1 h 后,将PVDF 膜用TBST在脱色振荡器上于室温下洗涤3次,每次5 min;取出后加入显影液,将膜置于全自动化学发光图像分析仪扫描并保存结果图像。经ImageJ 软件分析目的蛋白条带灰度值,以GAPDH 作为内参蛋白,计算出目的蛋白的相对表达量。
1.11 透射电镜观察缺血区域脑组织中线粒体超微结构变化将样品用戊二醛中固定,经过磷酸漂洗液漂洗,锇酸固定,乙醇梯度脱水,包埋;然后经恒温烘箱内聚合,半薄定位及超薄切片机切片,醋酸铀-枸橼酸铅双染色;最后,在透射电镜下观察并摄片。
1.12 统计学处理方法采用SPSS 20.0统计软件进行数据分析,参数数值以均数± 标准差(±s)表示。采用One-Way ANOVA检验比较各组间的差异,P<0.05表示差异有统计学意义。所有制图均应用Graphpad 9.0软件制作。
2 结果
2.1 温阳复元方对CIRI 大鼠神经功能缺损的影响如表2 所示,与假手术组比较,模型组大鼠在术后1、3、7 d时神经功能缺损评分明显升高,差异有统计学意义(P<0.01)。与模型组比较,温阳复元方组及铁死亡抑制剂组大鼠在术后1、3、7 d时神经功能缺损评分降低,差异有统计学意义(P<0.05);且铁死亡抑制剂组与温阳复元方组比较,在各个观察时间点神经功能缺损评分的差异无统计学意义(P>0.05)。与温阳复元方组比较,铁死亡诱导剂组及温阳复元方+铁死亡诱导剂组大鼠在各时间点的神经功能缺损评分明显升高,差异有统计学意义(P<0.05);而与模型组比,则差异均无统计学意义(P>0.05)。
表2 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠再灌注不同时间点神经功能缺损评分的影响(±s,分;n=12)Table 2 Effect of Wenyang Fuyuan Prescription on neurological function deficit scores at different time points of rats with cerebral ischemia reperfusion injury(CIRI)(±s,scores;n=12)

表2 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠再灌注不同时间点神经功能缺损评分的影响(±s,分;n=12)Table 2 Effect of Wenyang Fuyuan Prescription on neurological function deficit scores at different time points of rats with cerebral ischemia reperfusion injury(CIRI)(±s,scores;n=12)
注:与假手术组比较,**P<0.01;与模型组比较,△P<0.05;与温阳复元方组比较,#P<0.05
术后7 d 0.00±0.00 1.87±0.50**0.62±0.54△1.82±0.83#1.69±0.71#0.56±0.52△组别假手术组模型组温阳复元方组铁死亡诱导剂组温阳复元方+铁死亡诱导剂组铁死亡抑制剂组术后1 d 0.00±0.00 2.08±0.62**1.02±0.54△2.16±0.75#2.09±0.78#1.00±0.50△术后3 d 0.00±0.00 2.00±0.18**1.00±0.50△2.09±0.78#1.78±0.67#0.89±0.33△
2.2 温阳复元方对CIRI 大鼠脑组织神经元形态学的影响如图1所示,假手术组大鼠脑组织神经细胞排列紧密整齐,细胞形态完整规则、胞核淡染大而圆;而模型组、铁死亡诱导剂组以及温阳复元方+铁死亡诱导剂组大鼠神经元细胞排列紊乱,细胞数目减少且水肿,细胞核淡染固缩,边缘出现空泡,各组病理损伤程度相似。温阳复元方组和铁死亡抑制剂组神经元细胞排列有序,细胞形态相对规则完整,核染色清晰,病理损伤明显减轻。
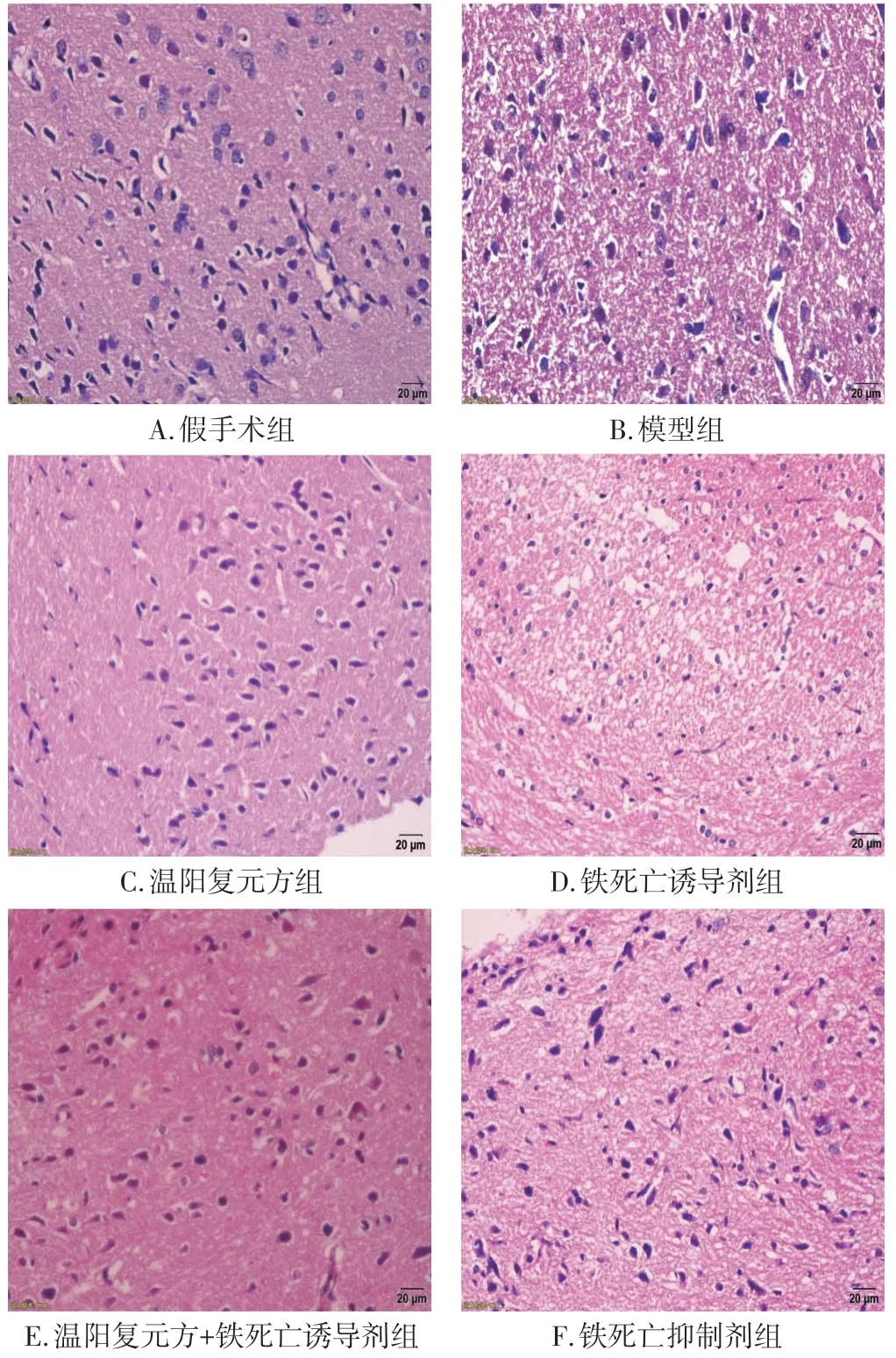
图1 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠缺血区域脑组织病理形态的影响(HE 染色,×400)Figure 1 Effect of Wenyang Fuyuan Prescription on the pathological morphology ischemic brain tissue in rats with cerebral ischemia reperfusion injury(CIRI)(HE,×400)
2.3 温阳复元方对CIRI 大鼠脑组织中Fe2+及GSH含量变化的影响如表3所示,与假手术组比较,模型组大鼠脑组织Fe2+含量明显升高、GSH 含量降低,差异均有统计学意义(P<0.01)。与模型组比较,温阳复元方组与铁死亡抑制剂组大鼠脑组织Fe2+含量下降、GSH含量上升,差异均有统计学意义(P<0.05);且铁死亡抑制剂组与温阳复元方组比较,Fe2+及GSH含量的差异无统计学意义(P>0.05)。与温阳复元方组比较,铁死亡诱导剂组及温阳复元方+铁死亡诱导剂组大鼠脑组织Fe2+含量明显升高、GSH 含量降低,差异有统计学意义(P<0.05,P<0.01);而与模型组比,则差异均无统计学意义(P>0.05)。
表3 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠脑组织中Fe2+及GSH 含量变化的影响(±s,n=6)Table 3 Effect of Wenyang Fuyuan Prescription on the contents of Fe2 +and GSH of brain tissue in rats with cerebral ischemia reperfusion injury(CIRI)(±s,n=6)

表3 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠脑组织中Fe2+及GSH 含量变化的影响(±s,n=6)Table 3 Effect of Wenyang Fuyuan Prescription on the contents of Fe2 +and GSH of brain tissue in rats with cerebral ischemia reperfusion injury(CIRI)(±s,n=6)
注:与假手术组比较,**P<0.01;与模型组比较,△P<0.05;与温阳复元方组比较,#P<0.05,##P<0.01
GSH/(μg·g-1)104.50±11.66 52.83±13.17**92.00±15.20△52.83±7.15#57.54±10.79#83.83±13.21△组别假手术组模型组温阳复元方组铁死亡诱导剂组温阳复元方+铁死亡诱导剂组铁死亡抑制剂组Fe2+/(μg·g-1)10.33±1.70 18.23±3.02**11.82±2.57△17.79±3.58##17.25±2.70#11.15±2.15△
2.4 温阳复元方对CIRI 大鼠TFR1、IRP1 和FPN mRNA 表达的影响如表4 所示,与假手术组比较,模型组大鼠IRP1、FPN mRNA 表达水平降低,TFR1 mRNA 表达水平升高(P<0.01)。与模型组比较,温阳复元方组及铁死亡抑制剂组大鼠IRP1、FPN mRNA表达水平升高(P<0.05),而TFR1 mRNA表达水平下降(P<0.05);且铁死亡抑制剂组与温阳复元方组比较,各基因表达水平的差异无统计学意义(P>0.05)。与温阳复元方组比较,铁死亡诱导剂组和温阳复元方+铁死亡诱导剂组大鼠IRP1、FPN mRNA 表达水平降低、TFR1 mRNA 表达水平上升(P<0.05);而与模型组比,则差异均无统计学意义(P>0.05)。
表4 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠脑组织TFR1、IRP1 和FPN mRNA 表达的影响(±s,n=6)Table 4 Effect of Wenyang Fuyuan Prescription on the mRNA expressions of TFR1,IRP1 and FPN in brain tissue of rats with cerebral ischemia reperfusion injury(CIRI)(±s,n=6)

表4 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠脑组织TFR1、IRP1 和FPN mRNA 表达的影响(±s,n=6)Table 4 Effect of Wenyang Fuyuan Prescription on the mRNA expressions of TFR1,IRP1 and FPN in brain tissue of rats with cerebral ischemia reperfusion injury(CIRI)(±s,n=6)
注:与假手术组比较,**P<0.01;与模型组比较,△P<0.05;与温阳复元方组比较,#P<0.05
FPN 0.998±0.076 0.622±0.124**0.846±0.133△0.514±0.115#0.509±0.166#0.891±0.025△组别假手术组模型组温阳复元方组铁死亡诱导剂组温阳复元方+铁死亡诱导剂组铁死亡抑制剂组IRP1 1.295±0.165 0.846±0.181**1.439±0.335△0.898±0.191#0.893±0.128#1.203±0.135△TFR1 0.424±0.147 0.854±0.117**0.457±0.183△0.786±0.135#0.796±0.232#0.465±0.215△
2.5 温阳复元方对CIRI 大鼠TFR1、IRP1 和FPN蛋白表达的影响如图2所示,与假手术组比较,模型组大鼠FPN、IRP1 蛋白表达下降(P<0.05,P<0.01),TFR1 蛋白表达升高(P<0.01)。与模型组比较,温阳复元方组及铁死亡抑制剂组大鼠FPN、IRP1 mRNA升高(P<0.05,P<0.01),而TFR1 mRNA表达量下降(P<0.01);且铁死亡抑制剂组与温阳复元方组比较,各基因表达的差异无统计学意义(P>0.05)。与温阳复元方组比较,铁死亡诱导剂组及温阳复元方+铁死亡诱导剂组大鼠FPN、IRP1蛋白表达下降(P<0.05,P<0.01),TFR1 蛋白表达量升高(P<0.01);而与模型组比,则差异均无统计学意义(P>0.05)。

图2 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠脑组织TFR1、IRP1 和FPN 蛋白表达的影响(±s,n=6)Figure 2 Effect of Wenyang Fuyuan Prescription on the protein expressions of TFR1,IRP1 and FPN in brain tissue of rats with cerebral ischemia reperfusion injury(CIRI)(±s,n=6)
2.6 透射电子显微镜观察各组大鼠神经元线粒体结构变化如图3所示,假手术组大鼠线粒体结构正常且清晰、线粒体包膜完整、线粒体嵴清晰可见;模型组缺血区域神经元线粒体数目减少且萎缩、线粒体嵴断裂甚至溶解消失、膜密度增加;与模型组比较,温阳复元方组和铁死亡抑制剂组神经元线粒体结构相对清晰,线粒体包膜、线粒体嵴相对完整,线粒体嵴清晰;而与温阳复元方组比较,铁死亡诱导剂组和温阳复元方+铁死亡诱导剂组大鼠神经元线粒体形态学相似,表现为线粒体数目减少,线粒体膜密度增加甚至破裂,线粒体嵴断裂溶解。

图3 温阳复元方对脑缺血再灌注损伤(CIRI)大鼠脑组织神经元超微结构的影响(×6 000)Figure 3 Effect of Wenyang Fuyuan Prescription on the ultrastructural changes of neurons in brain tissue of rats with cerebral ischemia reperfusion injury(CIRI)(×6 000)
3 讨论
缺血性脑卒中属于中医学“脑卒中”“中风”范畴,今人论中风病机本质均认为其病机以“脏腑虚衰、正气亏虚”为本,“痰、瘀、风、火、痰、湿”为标[14]。受《黄帝内经》及《伤寒论》重阳思想的影响,课题组经多年理论与实践凝练[15]认为,中风的本质是肾虚无力潜阳,伤其本则肾阳亏损、温煦无力,导致痰浊丛生、堵塞脑络,进一步提出“阳虚”是中风病的发病之本,并贯穿于中风病的始终;因此,提出治疗需以温阳培本为大法,治则为温阳益气、化痰通络(即温阳复元法),创立了温阳复元方治疗的方法。方中白附子能起少阴之真阳,恢复元阳之虚;黄芪、党参与白附子合用温阳益气,三者共为君药;桂枝能化太阳之气,淫羊藿有引阳入阴、启阴交阳之能,二者为臣;桂枝与白附片相合,则气机运转,生化之机乃能畅通,得淫羊藿则一出一入,一开一合,使内外宣通,阴阳协和;再佐以石菖蒲化痰开窍,三七活血散瘀。诸药合用,共奏温阳益气、化痰通络之功。课题组前期[7-8]已证明温阳复元方在改善脑卒中患者神经功能缺损方面疗效显著。在基础实验[9]中也证实可通过改善脑缺血再灌注损伤大鼠铁代谢和抗氧化水平对神经损伤起到保护作用。本研究通过神经功能缺损评分检测,显示模型组大鼠的神经功能缺损评分较假手术组明显升高,而温阳复元方和铁死亡抑制剂干预后,可明显降低大鼠神经功能评分,改善大鼠的神经缺损症状。同时还发现温阳复元方+铁死亡诱导剂联合干预与单纯铁死亡诱导剂干预后,两组大鼠神经功能缺损评分明显高于温阳复元方组且差异均有统计学意义,而与模型组比较则差异均无统计学意义,这说明温阳复元方改善大鼠的神经功能作用机制可能与抑制铁死亡有关。
目前研究铁死亡的主要特征包括细胞形态学和分子生物学两方面。细胞形态方面,主要表现为细胞线粒体变小,膜密度增高,嵴减少;细胞分子方面,主要表现为铁依赖的脂质过氧化增高,包括Fe2+和GSH的耗竭[16]。本研究结果显示,模型组大鼠脑组织中Fe2+含量上调、GSH 含量显著下降,HE 染色显示神经细胞数目减少且排列稀疏、细胞周围空泡大量形成;电镜下可见线粒体膜破裂或密度增多,线粒嵴溶解断裂。而温阳复元方和铁死亡抑制剂干预后,可降低Fe2+含量,上调GSH 含量,HE 及电镜观察显示可显著改善大鼠神经细胞病理性损伤。这提示温阳复元方可能具有通过抑制铁死亡而发挥神经损伤的保护作用,这与曾劲松等[17]的研究结果相似。但该方抑制铁死亡的具体机制尚不明确。
铁死亡的机制包括铁代谢、氨基酸代谢及脂质代谢[18]。近年来研究[19-20]发现,大脑的铁代谢紊乱参与缺血性脑卒中后神经损伤的病理过程。因此,探索改善铁代谢抑制神经细胞铁死亡也成为神经系统领域的焦点。研究[21]发现,当脑缺血再灌注损伤发生后,铁代谢紊乱导致TFR1增加和FPN减少,从而促使细胞外三价铁离子(Fe3+)进入细胞内转化为游离的二价亚铁离子Fe2+,在大脑中异常积聚,造成铁稳态失衡,并通过芬顿(Fenton)反应产生的自由基,诱导细胞脂质过氧化导致线粒体铁死亡,最终引起神经系统的功能障碍。在脑内,IRP/IRE 调节的异常,会导致脑内的铁水平发生明显变化,引起多种铁代谢失衡相关疾病,IRP 包括IRP1 和IRP2 两型,其中IRP1是一种双功能酶,已证实TFR1与FPN是IRE的主要目标基因[5]。而当细胞内铁缺乏时,IRP1 与FPNmRNA 5’UTR结合导致翻译终止,减少细胞内铁输出,同时与TFR1 mRNA 3’UTR结合,增加了细胞的铁摄取;反之,当细胞内铁过载时,IRP1 终止与IRE 目标基因(TFR1 及FPN)结合,增加细胞内铁的输出而减少铁摄取,维持细胞内铁稳态[5,22]。因此,改善铁代谢对维持细胞内外铁稳态具有重要作用。脑缺血时导致FPN 下调,从而增强铁的吸收能力,减弱铁的释放能力,加剧了铁在细胞中的积累[23]。Erastin 铁死亡诱导剂与Ferrostatin-1 铁死亡抑制剂是目前公认的具有诱导和抑制铁死亡的化学制剂,前者能够通过阻断细胞内GSH 的合成,削弱细胞的抗氧化能力,最终导致铁死亡的发生[24];而后者通过抑制脂质体中由铁和微量脂质氢过氧化物引发的过氧化反应,清除多余铁离子及活性氧自由基,进而拮抗铁死亡[25]。因此,本研究选用Erastin和Ferrostatin-1作为对照组,一定程度上可对温阳复元方的药效作用提供参考。本结果显示,模型组大鼠IRP1、FPN蛋白及mRNA 表达水平明显降低,TFR1 蛋白及mRNA表达水平明显升高,这说明脑缺血再灌注损伤后可能铁代谢紊乱参与激活了铁死亡途径。而中药温阳复元方与铁死亡抑制剂干预可明显逆转上述改变,且两者之间的差异没有统计学意义,这一定程度证实了温阳复元方发挥的神经保护作用可能与抑制铁死亡有关。同时研究还发现温阳复元方+铁死亡诱导剂与铁死亡诱导剂干预后显示,两组大鼠脑梗死区域IRP1、FPN 蛋白及mRNA 表达水平明显低于中药温阳复元方组,TFR1 蛋白及mRNA 表达水平明显升高,这一定程度上证实了温阳复元方的神经保护作用可能与铁依赖的脂质过氧化诱导的铁死亡有关。这与部分学者的研究[17,26]有相似之处,一定程度上证实了中药复方可通过改善脑铁代谢抑制线粒体铁死亡途径对脑缺血再灌注损伤大鼠神经功能起到保护作用。
综上,我们可以得出推论,温阳复元方可改善大鼠神经功能损伤及脑缺血再灌注损伤后大鼠脑缺血区域神经病理损伤,其机制可能与该方可上调铁调蛋白IRP1 表达,进而通过调节铁代谢途径发挥抑制铁死亡有关,这为温阳复元方治疗缺血性脑卒中提供了实验依据。但该方是否还存在其他的途径同时作用于调节铁死亡机制的靶点,这是今后需要继续深入研究的部分。
