常春藤皂苷元对葡聚糖硫酸钠诱导小鼠溃疡性结肠炎的作用及机制研究
2023-12-20叶志明刘冰张陆勇广东药科大学新药研发中心广东广州50006广东药科大学药学院广东广州50006
叶志明,刘冰,张陆勇(.广东药科大学新药研发中心,广东广州 50006;. 广东药科大学药学院,广东广州 50006)
溃疡性结肠炎(Ulcerative colitis,UC)是一种复杂的胃肠道慢性炎症性疾病[1-2],其特征是结肠持续发生炎症,伴有红斑、糜烂、颗粒状、出血、易碎性和溃疡等症状[3]。UC的典型组织病理学改变包括隐窝密度降低及结构扭曲、黏膜表面不规则、严重的弥漫性跨黏膜炎症和肠上皮屏障功能受损。研究[2]表明,包括炎症反应在内的多种因素可诱发UC。目前用于治疗UC的药物主要有水杨酸制剂、激素、免疫抑制剂、生物学制剂等[3-4],长期使用容易引起不良反应[5]。因此,寻找新的有效药物对治疗UC 具有重要意义。常春藤皂苷元(Hederagenin,Hed)分子式为C30H48O4,是主要来源于五加科常春藤属植物中华常春藤提取物的一种五环三萜类化合物,广泛分布于续断、威灵仙、白头翁、金银花等多种中药[6]。常春藤皂苷元具有抗癌、抗炎、抗抑郁、抗菌、抗病毒、抗糖尿病等多种药理作用。研究显示,常春藤皂苷元具有很强的抗炎药理活性,可治疗多种炎症相关疾病[7-9],如常春藤皂苷元能通过抑制促炎因子分泌来减轻乙醇引起的肝损伤[10];在小鼠脑缺血再灌注模型中,常春藤皂苷元可抑制炎症因子白细胞介素6(IL-6)的表达,改善脑组织损伤[11]。然而,尚未见常春藤皂苷元对UC作用的研究报道。因此,本实验拟通过体内外实验观察常春藤皂苷元对葡聚糖硫酸钠(Dextran sodium sulfate,DSS)诱导小鼠UC 的作用,并探讨相关机制,以期为UC的防治研究提供一定的实验依据。
1 材料与方法
1.1 细胞RAW264.7 小鼠单核巨噬细胞白血病细胞,购自赛百慷(上海)生物技术股份有限公司。使用DMEM 培养基(含有10%胎牛血清、100 U·mL-1青霉素、100 μg·mL-1链霉素)在37 ℃、5% CO2加湿培养箱中培养。
1.2 动物SPF 级雄性C57BL/6 小鼠30 只,6~8 周龄,体质量(22±2)g,由广东省医学实验动物中心提供,实验动物生产许可证号:SCXK(粤)2018-0002,动物质量合格证号:44007200103458。小鼠饲养在广东药科大学SPF 级实验动物中心,12 h 昼夜交替,温度为22~26 ℃,湿度为50%~70%,实验动物使用许可证号:SYXK(粤)2017-0125。动物实验经广东药科大学实验动物管理与使用委员会批准,动物伦理批文号:gdpulacspf2022102。
1.3 药物及试剂常春藤皂苷元(HPLC≥98%,CAS号:465-99-6),南京春秋生物工程有限公司;DSS(分子量为36 000~50 000,批号:0216011080),美国MP 公司;柳氮磺吡啶(批号:H31020557),上海信谊天平药业有限公司;Gibco DMEM 培养基(批号:8120373)、南美胎牛血清(批号:2243863),美国Gibco公司;脂多糖(LPS,批号:L2880)、噻唑蓝四唑溴化铵(MTT),美国Sigma 公司;人尿粪隐血测试盒(批号:C027-1-1),南京建成生物工程研究所;TLR4 抗体(批号: 19811-1-AP),武汉三鹰生物技术公司;核转录因子κB(NF-κB)抗体(批号:ab32536),英国Abcam 公司;p-NF-κB 抗体(批号:3033S),美国CST 公司;β-actin 抗体(批号:GTX109639)、 山羊抗兔 IgG 二抗( 批号:GTX213110-01),美国Gene Tex 公司;BCA蛋白定量试剂盒(批号:SK258367),美国Thermo Fisher 科技公司;HE染液(批号:BL700B),北京兰杰柯科技有限公司;IL-1β ELISA 检测试剂盒(批号:EK201B)、IL-6 ELISA 检测试剂盒(批号:EK206)、肿瘤坏死因子α(TNF-α)ELISA 检测试剂盒(批号:EK282),杭州联科生物技术股份有限公司。
1.4 主要仪器1510 型全波长酶标仪、EVOS M5000型智能细胞成像系统,美国Thermo Fisher 科技公司;Microfugu20R型高速冷冻离心机、Allegra X-12R大型离心机,美国Beckman Coulter 公司;HF151UV型CO2培养箱,香港力康生物医疗科技控股有限公司;伯乐小型垂直电泳转印系统,美国Bio-Rad 公司;3300 Mini 型化学发光成像系统,上海勤翔科学仪器有限公司。
1.5 体外实验
1.5.1细胞培养、分组及干预 RAW264.7 细胞用含10%胎牛血清的DMEM 培养基在37 ℃、5% CO2标准加湿培养箱中培养。常春藤皂苷元溶于DMSO中,配制成浓度为50 mmol·L-1的母液,临用前用DMEM 培养基配制成相应浓度。细胞分组:空白组、LPS 组(1 μg·mL-1)、LPS+2.5 μmol·L-1常春藤皂苷元组、LPS+5 μmol·L-1常春藤皂苷元组和LPS+10 μmol·L-1常春藤皂苷元组;采用LPS(1 μg·mL-1)干预24 h 建立体外细胞炎症模型,并用常春藤皂苷元(2.5、5、10 μmol·L-1)共孵育24 h进行干预。
1.5.2MTT 法检测细胞存活率 将RAW264.7 细胞消化并计数,以每孔5×103个细胞接种于96孔板中,细胞贴壁后,用不同浓度药物(0、2.5、5、10、20、40 μmol·L-1常春藤皂苷元)处理细胞24 h。药物干预结束后,每孔中加入180 μL 无血清培养基和20 μL MTT 溶液(5 mg·mL-1),在37 ℃下避光孵育4 h。吸弃上清液,每孔加入150 μL DMSO,使用酶标仪在570 nm波长下测量吸光度(A)值。计算:细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.5.3ELISA 法测定细胞上清液中IL-1β、IL-6、TNF-α 水平 RAW264.7 细胞分组及干预同“1.5.1”项下。细胞培养24 h 后收集上清液,严格按照ELISA试剂盒说明书步骤操作,测定炎症因子IL-1β、IL-6、TNF-α水平。
1.5.4Western Blot 法检测细胞中TLR4/NF-κB 通路相关蛋白的表达水平 将RAW264.7 细胞接种于6 孔板中,细胞分组及干预同“1.5.1”项下。培养24 h 后收集各组细胞,冰上加入RIPA 细胞裂解液30 min后,以4 ℃、12 000 r · min-1(离心半径=8 cm)离心30 min,收集上清液;采用BCA 法测定蛋白浓度。制胶(10%分离胶、4%浓缩胶),上样后以SDSPAGE 电泳法分离蛋白样品(80 V、20 min 跑上层胶,120 V、60 min 跑下层胶);电泳结束后进行蛋白转膜(300 mA、60 min);用5%脱脂奶粉封闭1 h后,TBST 洗膜3 次,每次10 min;4 ℃下孵育一抗[TLR4(1∶1 000)、NF-κB(1∶1 000)、p-NF-κB(1∶1 000)、β-actin(1∶1 000)]过夜;TBST 洗膜3 次,每次10 min,室温下孵育二抗1 h;滴加ECL 化学发光液显色,在凝胶成像系统中曝光,拍照;采用ImageJ 图像分析软件测定各蛋白条带灰度值,以β-actin为内参,对目的蛋白进行半定量分析。
1.6 体内实验
1.6.1分组、模型复制、给药及样本采集 C57BL/6小鼠适应性饲养7 d 后,随机分成6 组:空白组、模型组、柳氮磺吡啶组(200 mg·kg-1)及常春藤皂苷元低、中、高剂量组(12.5、25、50 mg·kg-1)[8],每组5 只。小鼠自由饮用3% DSS 溶液7 d,诱导建立UC模型[12]。造模同时按照上述剂量以20 mL·kg-1体积单次灌胃给药,空白组及模型组给予等量生理盐水灌胃,每日1 次,连续7 d。第8 天,经苯巴比妥钠麻醉后处死小鼠,解剖分离结肠组织;测量结肠从直肠近端至回盲部的长度;剪取远端结肠组织,分为2 份,1 份立即用4%多聚甲醛溶液固定,另1 份于-80 ℃下保存。
1.6.2疾病活动指数(DAI)评价 实验过程每日记录小鼠体质量、大便性状及便血情况,并参照相关研究[13]进行DAI 评分,以评估UC 严重程度,DAI 评分标准见表1。计算:DAI=体质量下降评分+大便性状评分+大便隐血情况评分。小鼠出现体质量明显下降,DAI显著升高,小鼠粪便松散或稀便并出现隐血或肉眼血便,则表示UC模型复制成功。
1.6.3小鼠结肠组织病理学观察 取4%多聚甲醛溶液固定后的结肠组织,经过脱水、石蜡包埋、组织切片后,进行常规HE染色;在显微镜下观察结肠组织病理情况并拍照。根据相关研究[14]进行病理学评分,评分标准如下: 0分:无炎症迹象;1分:低白细胞浸润;2 分:中度白细胞浸润;3 分:高白细胞浸润,中度纤维化,高血管密度,结肠壁增厚,中度杯状细胞丢失,局灶性隐窝丢失;4分:白细胞透壁浸润,杯状细胞大量丢失,广泛纤维化,弥漫性隐窝丢失。
1.6.4ELISA法测定结肠组织中IL-1β、IL-6、TNF-α水平[15]取小鼠结肠组织适量,加入生理盐水进行匀浆(60 Hz,120 s)后,以4 ℃、12 000 r·min-1(离心半径=8 cm)离心30 min,收集匀浆上清液;采用BCA蛋白检测试剂盒测定蛋白浓度;严格按照ELISA试剂盒说明书步骤操作,测定炎症因子IL-1β、IL-6、TNF-α水平。
1.6.5Western Blot 法检测结肠组织中TLR4/NF-κB 通路相关蛋白的表达水平 取小鼠结肠组织适量,加入生理盐水进行匀浆(60 Hz,120 s)后,以4 ℃、12 000 r·min-1(离心半径=8 cm)离心30 min,收集匀浆上清液;采用BCA 法测定蛋白浓度。按照“1.5.4”项下方法检测小鼠结肠组织中TLR4、p-NFκB 、NF-κB蛋白表达水平。
1.7 统计学处理方法采用GraphPad Prism 8.0.2统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 常春藤皂苷元对RAW264.7 细胞存活率的影响结果见图1。与空白组(0 μmol·L-1组)比较,2.5~10 μmol·L-1常春藤皂苷元对RAW264.7 细胞无明显毒性作用,细胞存活率无明显变化(P>0.05),故选择该浓度范围作为后续实验中常春藤皂苷元的干预浓度。
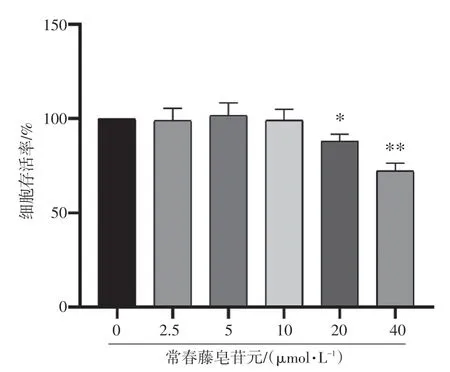
图1 常春藤皂苷元对RAW264.7 细胞存活率的影响(±s,n=3)Figure 1 Effect of hederagenin on cell viability of RAW264.7 cells(±s,n=3)
2.2 常春藤皂苷元对LPS 刺激的RAW264.7 细胞炎症因子表达水平的影响结果见表2。与空白组比较,LPS 组RAW264.7 细胞的IL-1β、IL-6、TNF-α表达水平显著升高(P<0.01)。与LPS 组比较,常春藤皂苷元2.5、5、10 μmol·L-1浓度组RAW264.7细胞的IL-1β、TNF-α 表达水平明显降低(P<0.05,P<0.01),常春藤皂苷元5、10 μmol·L-1浓度组RAW264.7 细胞的IL-6 表达水平明显降低(P<0.05,P<0.01)。结果表明,常春藤皂苷元能够抑制LPS刺激RAW264.7细胞的炎症因子分泌。
2.3 常春藤皂苷元对LPS 刺激的RAW264.7 细胞TLR4/NF-κB 通路的影响结果见图2。与空白组比较,LPS组RAW264.7细胞的TLR4、p-NF-κB/NF-κB蛋白表达水平显著升高(P<0.01)。与LPS 组比较,常春藤皂苷元2.5、5、10 μmol·L-1浓度组RAW264.7细胞的TLR4、p-NF-κB/NF-κB蛋白表达水平明显降低(P<0.05,P<0.01)。结果表明,常春藤皂苷元能够抑制LPS 刺激的RAW264.7 细胞TLR4/NF-κB 信号通路的激活。
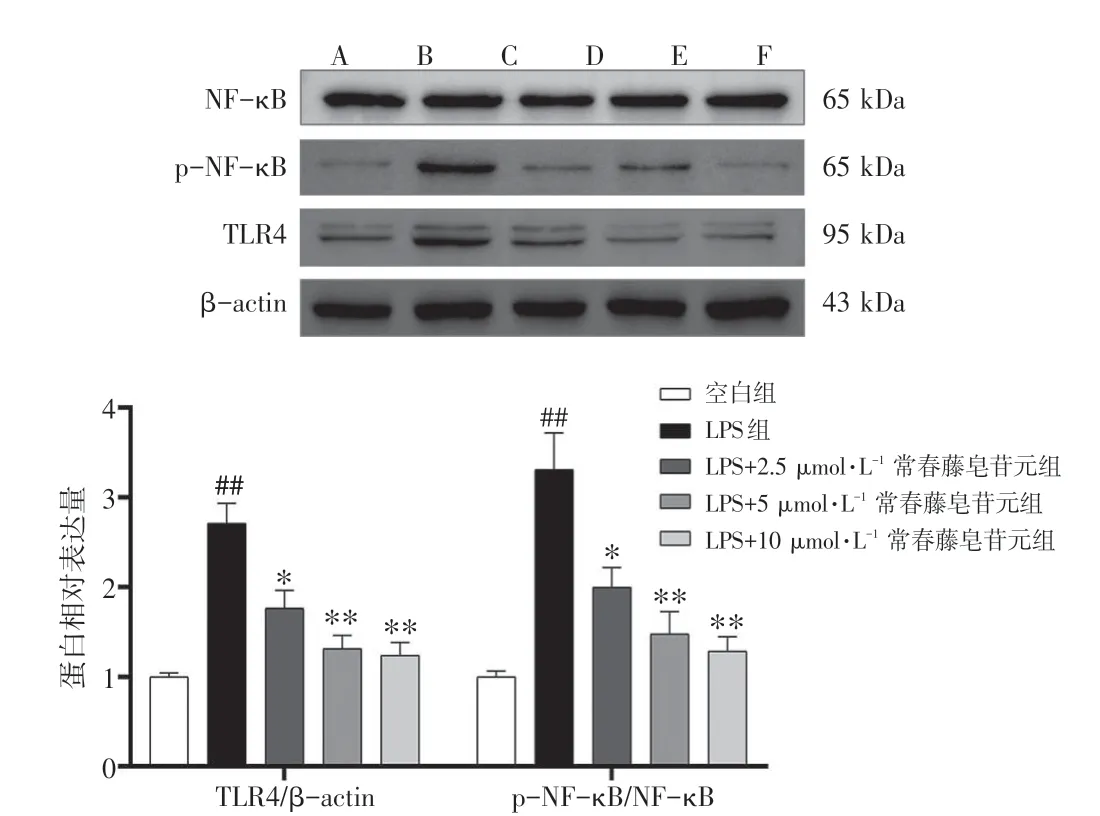
图2 常春藤皂苷元对脂多糖(LPS)刺激的RAW264.7 细胞TLR4、p-NF-κB、NF-κB 蛋白表达水平的影响(±s,n=3)Figure 2 Effects of hederagenin on protein expression levels of TLR4,p-NF-κB and NF-κB in RAW264.7 cells stimulated with LPS(±s,n=3)
表2 常春藤皂苷元对脂多糖(LPS)刺激的RAW264.7 细胞IL-1β、IL-6、TNF-α 表达水平的影响(±s,n=3)Table 2 Effects of hederagenin on the expression levels of IL-1β,IL-6 and TNF-α in RAW264.7 cells stimulated by LPS(±s,n=3)
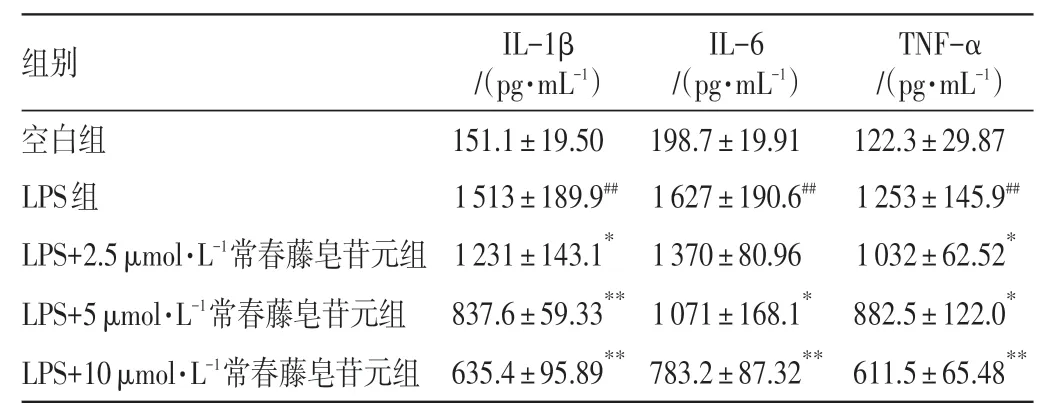
表2 常春藤皂苷元对脂多糖(LPS)刺激的RAW264.7 细胞IL-1β、IL-6、TNF-α 表达水平的影响(±s,n=3)Table 2 Effects of hederagenin on the expression levels of IL-1β,IL-6 and TNF-α in RAW264.7 cells stimulated by LPS(±s,n=3)
注:与空白组比较,##P<0.01;与LPS组比较,*P<0.05,**P<0.01
TNF-α/(pg·mL-1)122.3±29.87 1 253±145.9##1 032±62.52*882.5±122.0*611.5±65.48**组别空白组LPS组LPS+2.5 μmol·L-1常春藤皂苷元组LPS+5 μmol·L-1常春藤皂苷元组LPS+10 μmol·L-1常春藤皂苷元组IL-1β/(pg·mL-1)151.1±19.50 1 513±189.9##1 231±143.1*837.6±59.33**635.4±95.89**IL-6/(pg·mL-1)198.7±19.91 1 627±190.6##1 370±80.96 1 071±168.1*783.2±87.32**
2.4 常春藤皂苷元对UC 小鼠体质量、DAI、结肠长度的影响结果见图3。与空白组比较,模型组小鼠的体质量持续降低(P<0.01),DAI 评分显著升高(P<0.01),结肠长度显著缩短(P<0.01)。与模型组比较,常春藤皂苷元低、中、高剂量组小鼠的体质量明显增加(P<0.05,P<0.01),DAI 评分明显降低(P<0.05,P<0.01);常春藤皂苷元中、高剂量组小鼠的结肠长度明显增加(P<0.05,P<0.01)。结果表明,常春藤皂苷元对DSS 诱导的UC 小鼠具有治疗作用。
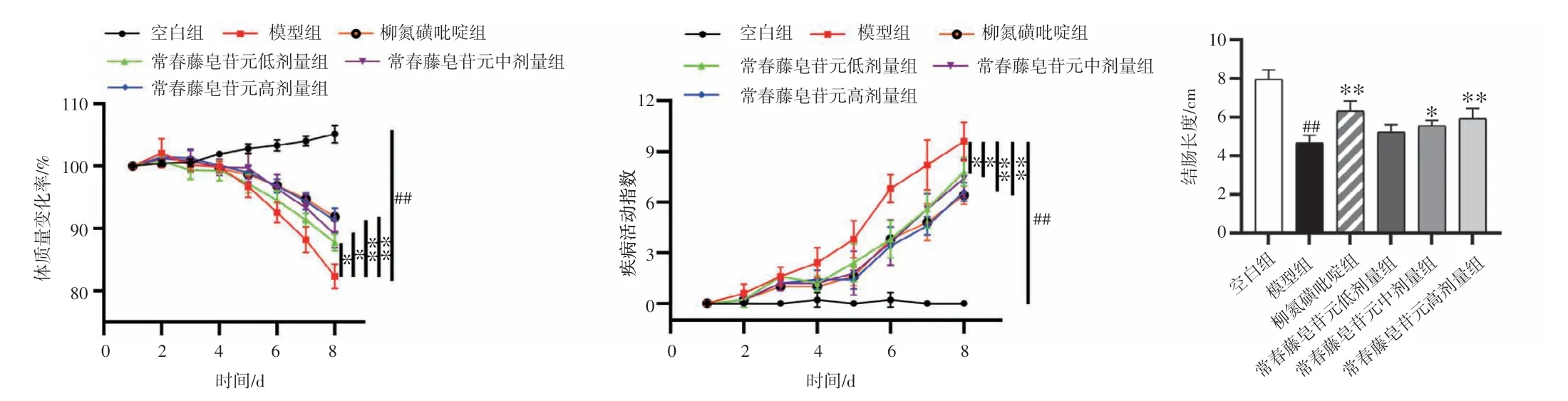
图3 常春藤皂苷元对溃疡性结肠炎小鼠体质量、疾病活动指数(DAI)、结肠长度的影响(±s,n=5)Figure 3 Effects of hederagenin on the body mass and disease activity index(DAI) score and colonic length in ulcerative colitis mice(±s,n=5)
2.5 常春藤皂苷元对UC 小鼠结肠组织病理变化影响结果见图4。空白组小鼠的结肠组织纹理清晰,形态完整,无充血,黏膜肠上皮细胞排列整齐。与空白组比较,模型组小鼠的结肠组织出现明显的上皮细胞损伤,包括隐窝结构弥漫性损伤、杯状细胞丢失和大量中性粒细胞浸润至固有层,结肠组织病理学评分显著升高(P<0.01);与模型组比较,常春藤皂苷元低、中、高剂量组小鼠结肠组织病理损伤有不同程度的改善,尤其高剂量组小鼠结肠组织具有相对完整的隐窝结构,上皮变形较少,炎症细胞浸润明显减少,中、高剂量组的结肠组织病理学评分明显降低(P<0.05,P<0.01)。结果表明,常春藤皂苷元能够有效改善DSS 诱导的UC 小鼠结肠组织病理损伤。
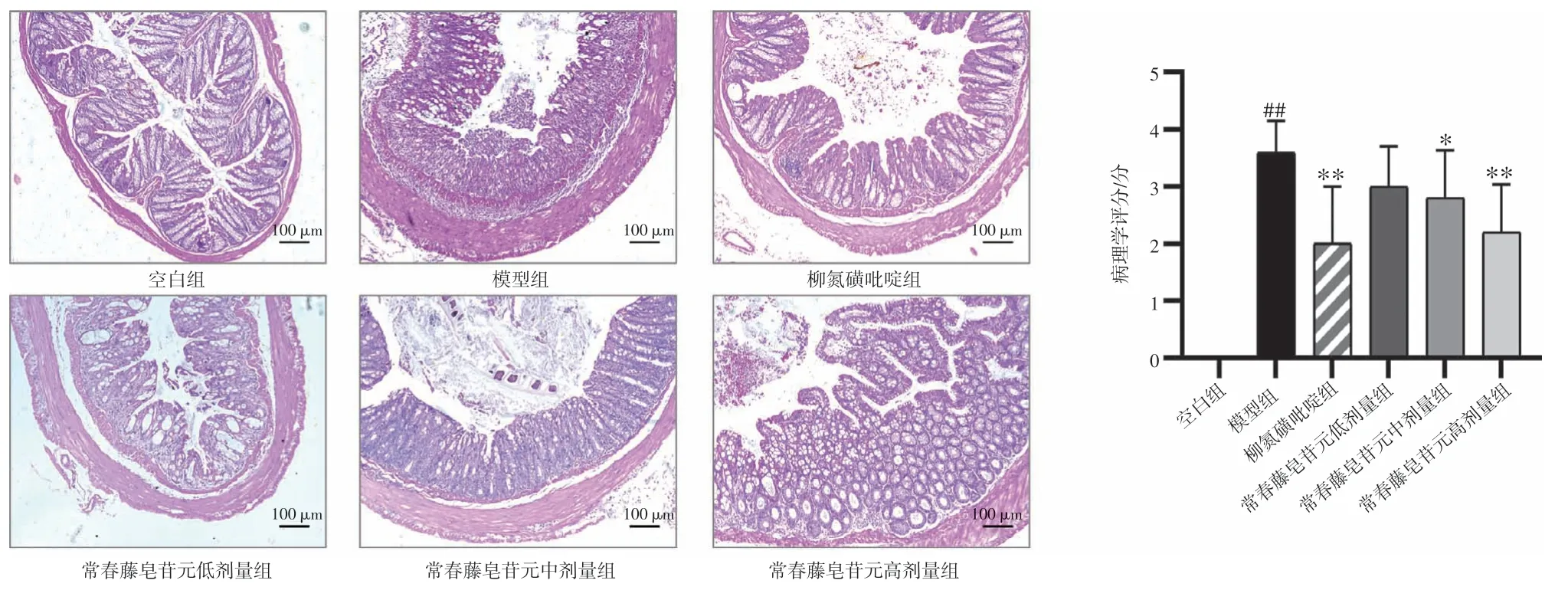
图4 常春藤皂苷元对溃疡性结肠炎小鼠结肠组织病理变化的影响(HE 染色,×100;±s,n=5)Figure 4 Effect of hederagenin on pathological changes of colonic tissue in ulcerative colitis mice(HE staining,×100;±s,n=5)
2.6 常春藤皂苷元对UC 小鼠结肠组织中炎症因子水平的影响结果见表3。与空白组比较,模型组小鼠结肠组织中的促炎细胞因子IL-1β、IL-6、TNF-α表达水平显著升高(P<0.01)。与模型组比较,常春藤皂苷元中、高剂量组小鼠结肠组织中IL-1β、IL-6、TNF-α 表达水平显著降低(P<0.05,P<0.01)。结果表明,常春藤皂苷元能够抑制DSS 诱导UC小鼠结肠组织中的炎症因子表达。
表3 常春藤皂苷元对溃疡性结肠炎小鼠结肠组织中IL-1β、IL-6、TNF-α 水平的影响(±s,n=5)Table 3 Effects of hederagenin on IL-1β,IL-6 and TNF-α levels in colonic tissue of ulcerative colitis mice(±s,n=5)
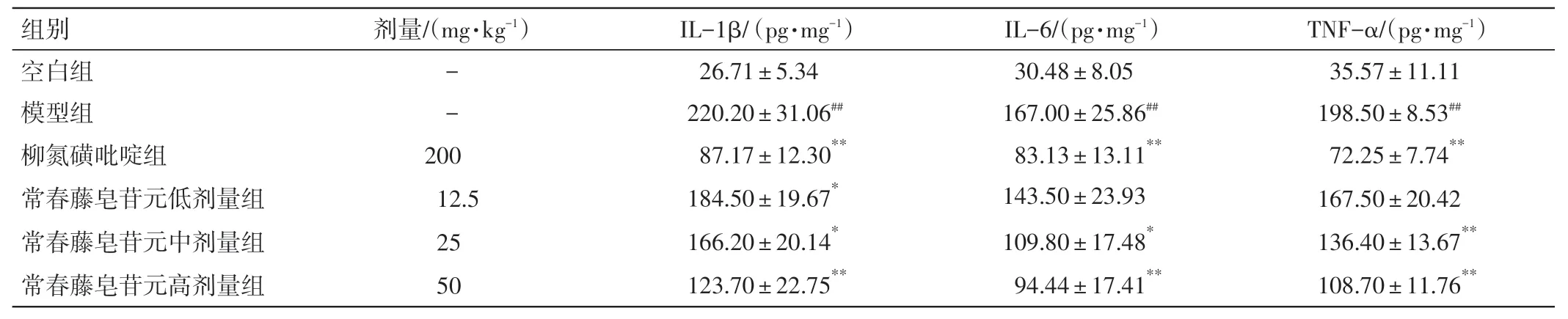
表3 常春藤皂苷元对溃疡性结肠炎小鼠结肠组织中IL-1β、IL-6、TNF-α 水平的影响(±s,n=5)Table 3 Effects of hederagenin on IL-1β,IL-6 and TNF-α levels in colonic tissue of ulcerative colitis mice(±s,n=5)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
TNF-α/(pg·mg-1)35.57±11.11 198.50±8.53##72.25±7.74**167.50±20.42 136.40±13.67**108.70±11.76**组别空白组模型组柳氮磺吡啶组常春藤皂苷元低剂量组常春藤皂苷元中剂量组常春藤皂苷元高剂量组剂量/(mg·kg-1)--200 12.5 25 50 IL-1β/(pg·mg-1)26.71±5.34 220.20±31.06##87.17±12.30**184.50±19.67*166.20±20.14*123.70±22.75**IL-6/(pg·mg-1)30.48±8.05 167.00±25.86##83.13±13.11**143.50±23.93 109.80±17.48*94.44±17.41**
2.7 常春藤皂苷元对UC 小鼠结肠组织TLR4/NF-κB通路的影响结果见图5。与空白组比较,模型组小鼠结肠组织中TLR4、p-NF-κB/NF-κB蛋白表达水平显著升高(P<0.01);与模型组比较,常春藤皂苷元低、中、高剂量组小鼠结肠组织中TLR4、p-NF-κB/NF-κB 蛋白表达水平明显降低(P<0.05,P<0.01)。结果表明,常春藤皂苷元能够抑制DSS 诱导UC 小鼠结肠组织TLR4/NF-κB通路的激活。
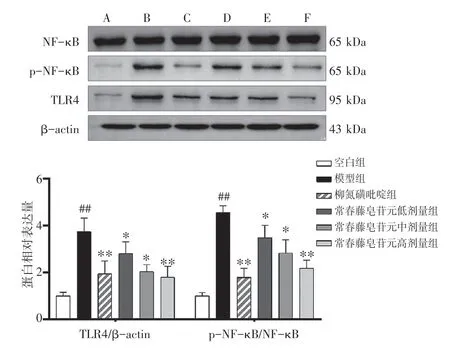
图5 常春藤皂苷元对溃疡性结肠炎小鼠结肠组织中TLR4、p-NF-κB、NF-κB 蛋白表达水平的影响(±s,n=5)Figure 5 Effects of hederagenin on protein expression levels of TLR4,p-NF-κB and NF-κB in colonic tissue of ulcerative colitis mice(±s,n=5)
3 讨论
溃疡性结肠炎(UC)是人类炎症性肠病的主要形式之一,具有较高的发病率,严重影响人类健康和造成巨大的社会经济负担。研究[1-2]表明,遗传因素、环境因素、微生物因素和肠道免疫系统中的分子相互作用能够促进UC的发生发展。目前临床上UC的治疗药物主要包括糖皮质激素类、免疫抑制剂等,存在较多副作用,因此迫切需要发掘更高效、安全的治疗药物。
本研究结果显示,常春藤皂苷元干预DSS诱导的UC 小鼠后,可显著缓解其体质量降低、水样腹泻、便血及结肠长度缩短等症状,明显降低DAI评分;有效改善UC小鼠结肠组织病理损伤;抑制小鼠结肠组织中的炎症因子IL-1β、IL-6、TNF-α表达。结果表明,常春藤皂苷元能够通过抗炎活性对DSS 诱导的UC小鼠发挥防治作用。
TLR4/NF-κB 通路与炎症细胞因子的产生密切相关。Toll 样受体(Toll-like receptors,TLRs)是先天免疫系统中一个保守的模式识别受体家族,通过识别不同的危险相关分子模式、病原相关分子模式和外源性配体,以介导相关的免疫反应[16]。TLR4 是第一个被发现的TLRs 成员,它通过识别和结合多种内源性和外源性配体,并转导这些信号,调节炎症介质和细胞因子的表达,在免疫防御和免疫调节中发挥重要作用[17-19]。NF-κB 是TLR4 信号通路的下游效应器,是一种普遍存在的重要核转录因子,介导多种炎症的发生发展[20-22]。TLR4 与内源性或外源性配体结合后,NF-κB 抑制因子激酶被NF-κB 诱导激酶磷酸化,活化的NF-κB 可刺激IL-1β、IL-6 和TNF-α等炎症因子大量分泌[23]。本研究结果表明,DSS诱导能够激活TLR4/NF-κB 信号通路,上调UC 小鼠结肠组织中TLR4蛋白表达和NF-κB蛋白磷酸化水平,而常春藤皂苷元能够抑制结肠组织中TLR4蛋白表达及NF-κB 蛋白磷酸化水平,并降低IL-1β、IL-6 和TNF-α 等炎症因子的分泌水平。此外,通过体外实验也表明,常春藤皂苷元能够抑制LPS 诱导的RAW267.4 细胞TLR4/NF-κB 信号通路激活。研究结果表明,通过抑制TLR4/NF-κB通路来减轻炎症反应可能是常春藤皂苷元发挥抗UC的重要机制。
综上所述,常春藤皂苷元对DSS 诱导的UC 小鼠具有防治作用,能够有效改善其结肠组织病理损伤,抑制炎症因子IL-1β、IL-6、TNF-α分泌,其作用机制可能与抑制TLR4/NF-κB通路有关。
