低温等离子体对气调包装中荧光假单胞菌的抑杀机理
2023-12-16徐慧倩胡家杰邓尚贵缪文华
徐慧倩,胡家杰,邓尚贵,缪文华
(浙江海洋大学食品与药学学院 浙江舟山 316022)
低温等离子体(Cold atmospheric plasma,CAP)作为物质的第4 态,主要是通过电场对气体进行电离产生等离子体,而其构成的主要物质为带电粒子,包括正、负离子,激发态分子和原子、自由基等物质[1],它主要应用于医学技术[2]、环境保护[3]、食品保鲜[4]等领域。因其具有绿色无污染、杀菌功效好、安全且操作简便等优点而被人们认为具有良好的前景,是21 世纪可大力发展的新技术。气调包装(Modified atmosphere packaging,MAP)是一种通过置换包装盒里的气体来达到保鲜目的的技术,通常使用的填充气体有N2、CO2、O2和稀有气体等[5]。N2是一种惰性气体,主要用来置换氧气以此来减少需氧菌的生长,而CO2对细菌具有抑制作用,通过使细胞酸化而影响其代谢活动[6-7]。有研究表明,CO2在低温等离子体反应器中可以转化为CO 和O2[8]。
荧光假单胞菌(Pseudomonas fluorescens)是一种需氧性的革兰氏阴性菌,通常存在于水产品、肉制品以及乳制品中[9],会引起败血症或败血性休克等[10]。它们会产生胞外蛋白酶来分解水产品中的蛋白质,具有很强的生物膜形成能力,从而增加细菌对杀菌剂的抵抗力以及抗生素的耐药性[11]。虽然关于低温等离子体杀菌保鲜效果的研究已比较广泛,包括畜产品、水产品、果蔬生鲜等,但是对于CAP 在气调环境下杀菌的致死机理有待研究深入。本文采用正交试验选定处理电压为50 kV,气调气体体积比为V(N2)∶V(CO2)=3 ∶2,在此条件下通过改变CAP 处理时间(0,60,180,300 s)对荧光假单胞菌的抑菌机理进行研究,为低温等离子体协同气调包装的杀菌保鲜方式应用于食品等提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 荧光假单胞菌,分离自舟山带鱼中,经初步形态学观察和镜检后通过16S rDNA 鉴定为荧光假单胞菌(相似度为99.93%),冻存于-80℃冰箱中。
1.1.2 试剂 氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾,国药集团化学试剂公司;胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB),青岛海博生物科技有限公司;CCK-8 试剂盒,上海碧云天生物技术有限公司;碱性磷酸酶(Alkaline phosphatase,AKP)试剂盒、Na+/K+-ATPase(ATP)酶试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒、过氧化氢酶(Catalase,CAT)试剂盒,南京建成生物工程研究所;碘化丙啶(Propidium iodide,PI)试剂盒,北京百奥莱博科技有限公司。
1.2 仪器与设备
Phenix BK 130/36 低温等离子体处理装置,美国凤凰科技公司;MAP-H360 气调保鲜包装机,苏州森瑞保鲜设备有限公司;U-2800 紫外-可见分光光度计、F-7000 荧光分光光度计、SU8220 场发射扫描电子显微镜,株式会社日立制作所;Centrifuge 5424 高速离心机,德国艾本德股份公司;BSP-250 生化培养箱,上海博迅医疗生物仪器股份有限公司。
1.3 方法
1.3.1 菌悬液的制备 将分离出的荧光假单胞菌冻存液进行复苏和传代培养,平板划线后挑取3~4 个单菌落于50 mL TSB 中混匀,置于30 ℃培养箱中培养18~24 h。取培养后的菌液离心,去除上清液,用磷酸盐缓冲溶液(Phosphate buffered solution,PBS,0.01 mol/L,pH 值在7.2~7.4 范围)轻轻漂洗3 次后再用PBS 重悬,测量其在波长600 nm 处的OD 值,调整浓度后制成菌悬液,其含菌数量约为108CFU/mL。
1.3.2 单因素实验及正交试验设计
1.3.2.1 单因素实验设计 移取制备好的菌悬液于培养皿中,以不同体积比例的N2和CO2进行充气包装。
固定处理电压为50 kV,固定处理时间为180 s,以不同N2含量(50%,55%,60%,65%,70%)进行气调包装(剩余气体以CO2进行填充,即50%,45%,40%,35%,30%,下同)后进行低温等离子体处理。
固定处理电压为50 kV,N2含量为60%,以不同处理时间(60,120,150,180,240 s)进行低温等离子体处理。
固定处理时间为180 s,N2含量为60%,以不同处理电压(40,45,50,55,60 kV)进行低温等离子体处理。
1.3.2.2 杀菌率测定 将处理后的菌悬液混匀后立即进行稀释和涂布,置于30 ℃培养箱中培养24 h 后观察计数。每个处理组平行3 次,以平均值作为最终结果。杀菌率的计算公式见式(1)。
式中,λ——杀菌率,%;γ0——未经CAP 处理的菌落数,CFU/mL;γ1——CAP 处理后的菌落数,CFU/mL。
1.3.2.3 正交试验设计 根据单因素实验结果设计三因素三水平的正交试验,因素水平设置如表1 所示,以杀菌率为指标来研究低温等离子体协同气调包装对荧光假单胞菌杀菌工艺的测定及优化。
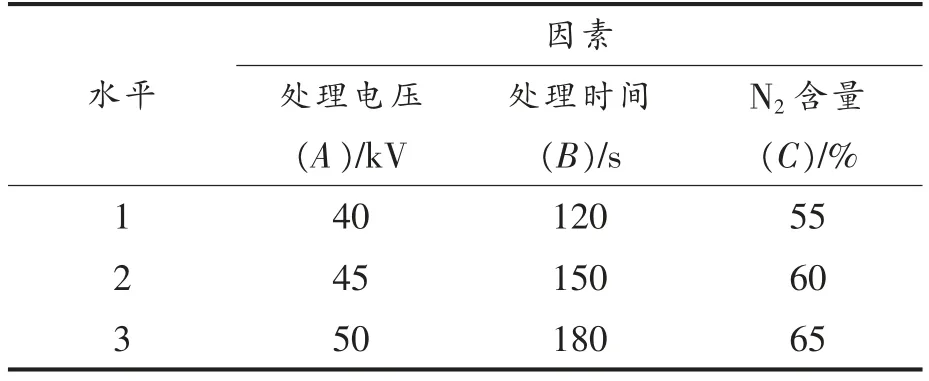
表1 因素水平设置表Table 1 Factor level setting table
1.3.3 样品的制备 将菌悬液混匀后置于培养皿中,以气调气体体积比为N2∶CO2=3∶2(即氮气60%,二氧化碳40%)的条件进行充气包装。之后进行CAP 处理,处理电压为50 kV;处理时间分别为0,60,180,300 s,以0 s 处理组作为对照组,立即进行试验。
1.3.4 细胞活性的测定 细胞活性的测定采取CCK-8 法。根据CCK-8 试剂盒说明书进行测定,分别在30 ℃下培养0,0.5,1,2,4 h,测定其在波长450 nm 处的OD 值。细菌存活率计算公式如下:
式中,A0——空白的吸光度;A1——处理组的吸光度;A2——对照组的吸光度。
1.3.5 细胞壁的通透性 细胞壁的通透性主要通过测定AKP 的活力体现。将样品以1 500 r/min 转速离心10 min,用PBS 重悬,在冰水浴中破碎细胞,取上清液作为待测样品,然后根据AKP 试剂盒说明书进行测定。
1.3.6 细胞膜的完整性
1.3.6.1 细菌核酸和蛋白质泄露含量的测定 参考Xiang 等[12]的方法并稍作修改。将样品以10 000 r/min 转速离心10 min,用PBS 漂洗沉淀3次后吸取上清液,分别测量波长260 nm 和280 nm 处的OD 值。
1.3.6.2 ATP 活性的测定 将样品以1 500 r/min转速离心10 min,沉淀用0.85%无菌生理盐水重悬,在冰水浴中破碎细胞,取上清液为待测样品,然后根据ATP 试剂盒说明书进行测定。
1.3.6.3 PI 荧光染色的测定 参考康超娣[13]的方法并稍作修改。将样品以6 000 r/min 转速离心10 min,沉淀用PBS 重悬,取900 μL 待测液,添加100 μL PI 储备液(储备液质量浓度为10 μg/mL),反应后于暗室静置30 min,用荧光分光光度计测量样品的荧光强度(激发波长536 nm,发射波长617 nm,狭缝宽度5 mm,光电倍增管电压700 V)。
1.3.7 菌体内抗氧化酶活性的测定 菌体内的抗氧化酶活性主要以SOD 和CAT 来呈现,根据SOD 试剂盒说明书和CAT 试剂盒说明书分别进行操作和测定。
1.3.8 微观结构的测定 微观结构的变化通过扫描电子显微镜(Scanning electron microscope,SEM)来观察。参考Tang 等[14]的步骤并稍作修改,将样品以6 000 r/min 转速离心10 min,用PBS 轻轻漂洗3 次后留菌体,沿管壁缓缓加入2.5%戊二醛溶液,于室温下固定2 h,然后转入4 ℃固定12 h,使用乙醇进行稀释脱水,干燥后喷金,观察细菌的微观形态结构。
1.3.9 数据分析及处理 用SPSS 19 进行数据分析,用Origin 9.1 进行图片绘制,结果以平均值±标准偏差来呈现,P<0.05 为显著差异。
2 结果与分析
2.1 单因素实验及正交试验结果
2.1.1 不同因素对荧光假单胞菌的杀菌效果 如图1a 所示,杀菌率随着处理电压的增加而增加(40~50 kV,P<0.05),当处理电压为40 kV 时,杀菌率为80.13%,当处理电压升至50 kV 时,杀菌率已经达到了99.99%,而当处理电压继续增加时,杀菌率已趋于100%,已无显著性差异(P>0.05)。这可能是因为当电压较低时,杀菌物质如活性粒子中的活性氧(Reactive oxygen species,ROS)和活性氮(Reactive nitrogen species,RNS)等产生的数量较少或无法完全激发,不能有效杀死荧光假单胞菌[15]。然而,当处理电压为60 kV时,CAP 放电比较剧烈,当电极板距离不变时,处理电压增大会使电场强度增大,而电场强度越大则越容易被击穿[16],从而导致产生的活性粒子等外漏影响试验结果,并且给试验人员试验安全带来隐患。因此从安全角度来说,选择最优CAP 处理电压为50 kV。

图1 不同因素对荧光假单胞菌杀菌率的影响Fig.1 Effects of different factors on the sterilization rate of Pseudomonas fluorescens
如图1b 所示,杀菌率随着处理时间的延长而显著增加(60~180 s,P<0.05),当处理时间为60 s和180 s 时,杀菌率分别为76.25%和99.99%,而当处理时间继续增加时,杀菌率趋于100%,已无显著性差异(P>0.05)。这可能是因为在一定时间内CAP 产生的活性粒子量不变,延长处理时间可能会增加活性粒子与样品的接触时间,杀菌效果增强。CAP 作用的时间越长,杀菌率就越高,最终趋于稳定,这时再延长处理时间,杀菌效果也不会有明显变化。因此从经济角度来说,选择最优CAP处理时间为180 s。
如图1c 所示,杀菌率随着氮气含量的增加而呈现先升后降的趋势(P<0.05)。当N2含量为60%时,杀菌率达到99.60%。因此选择最优氮气含量为60%。
2.1.2 低温等离子体协同气调包装处理条件的正交试验优化 正交试验设计及结果如表2 所示,正交试验方差分析如表3 所示。

表2 正交试验设计及结果Table 2 Orthogonal experimental design and result
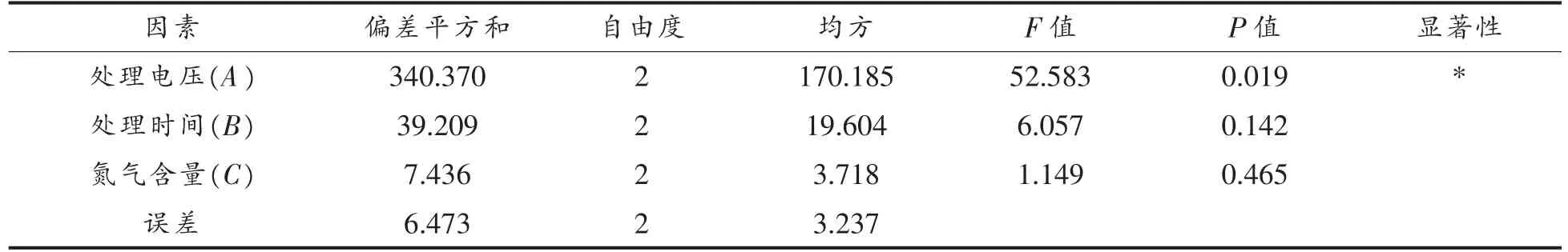
表3 正交试验方差分析Table 3 Orthogonal test analysis of variance
由表2 的极差R 可知,低温等离子体对荧光假单胞菌的各影响因素的主次分别为A、B、C,即处理电压、处理时间、氮气含量。通过比较K 的大小来确定最佳组合是A3B3C2。由表3 可知,因素A的P 值小于0.05,因素B 和因素C 的P 值均大于0.05,说明此试验中处理电压对杀菌率影响显著,以杀菌率为指标来判断杀菌效果的强弱,因此杀菌率越高的因素水平作为最佳水平,选择50 kV作为处理电压;处理时间和氮气含量比例影响不显著,因此直接选择处理时间180 s 和氮气含量60%。
2.1.3 验证试验 对上述优化后的结果进行3 次验证试验,表4 为正交试验验证结果。荧光假单胞菌在处理电压为50 kV,处理时间为180 s,氮气含量为60%的条件下进行CAP 处理,测得杀菌率为99.49%。将优化后的结果应用于抑菌机理试验。

表4 正交试验验证结果Table 4 Orthogonal test to verify the results
2.2 菌体内细胞活性的结果分析
细胞与试剂反应会产生甲臜,依据颜色的深浅和OD 值可以测定细胞的活力及数量[17]。表5 为CCK-8 法测定不同处理时间的荧光假单胞菌的存活率。分析可知,除了0 h 外,荧光假单胞菌的存活率随处理时间的增加而显著降低(P<0.05),培养时间越久,存活率降低速率也越快。由表5 可知,在培养2 h 和4 h 时,60 s 处理组差异较小,细菌存活率大于60%,而180 s 和300 s 处理组的细菌活性仍然在降低。这可能是CAP 处理后使得荧光假单胞菌发生氧化应激反应,而氧化应激可以诱发细胞凋亡[18],处理时间越长,氧化应激反应越明显,最终使细胞存活率降低。
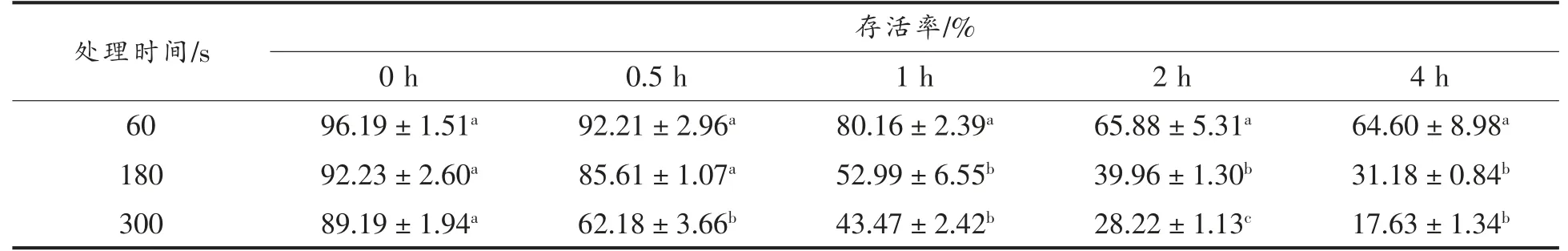
表5 低温等离子体协同气调包装对荧光假单胞菌存活率的影响Table 5 Effects of CAP combined with MAP on the survival rate of Pseudomonas fluorescens
2.3 细胞壁通透性的结果分析
AKP 是介于细胞壁和细胞膜之间的一种酶,其活力能够反映细胞壁的通透性,当细胞受损时,AKP 会从细胞中流出,导致酶活力降低[19-20]。如图2 所示,AKP 的活力随着处理时间的增加而显著降低(P<0.05),0,60,180 s 和300 s 处理组的AKP值分别为21.50,15.69,12.09,11.33 金氏单位/g prot。AKP 活力下降可能是因为CAP 处理时产生的ROS 会破坏细胞壁,使细胞壁松弛甚至破裂继而失去保护作用。此外,有研究表明,酶失活还可能是因为等离子体产生的羟自由基、超氧阴离子自由基、过氧化氢自由基等的作用,这些自由基与氨基酸侧链发生化学反应诱导结构变化,最终导致蛋白质失活[21-22]。

图2 低温等离子体协同气调包装对荧光假单胞菌AKP 的影响Fig.2 Effects of CAP combined with MAP on AKP of Pseudomonas fluorescens
2.4 细胞膜完整性的结果分析
2.4.1 核酸和蛋白质泄露含量的结果分析 核酸是生物体重要的遗传物质,对于生命的生长及延续都起着决定性作用,并控制蛋白质的合成及代谢过程[23],而蛋白质是生命活动的主要承担者,是机体不可或缺的重要部分,主要担负营养物质的运输和细胞机体代谢[24]。核酸和蛋白质分别在波长为260 nm 和280 nm 处有最大吸收峰[25],通过测定菌液上清液在对应波长处的OD 值可以判断荧光假单胞菌的核酸和蛋白质泄露情况。如图3所示,随着处理时间的增加,OD260nm值和OD280nm值也随之增长,效果显著(P<0.05)。低温等离子体协同气调包装处理后,60,180 s 和300 s 处理组的OD260nm值相较于0 s 处理组分别增加了0.01,0.03 和0.04,而OD280nm值相较于0 s 处理组分别增加了0.01,0.03 和0.06。这表明核酸和蛋白质在细胞外液中增加,说明细胞已经破裂。其原因可能是等离子体产生的ROS、RNS 等物质不仅破坏了细胞膜的完整性,而且对细胞膜产生了不可逆的损伤,使胞内大分子物质流出,导致核酸和蛋白质等物质的泄露[26-27],同时伴随着处理时间的延长,CAP 产生的ROS 会破坏细胞膜的脂质层,导致细胞出现氧化应激反应,使得OD 值上升。
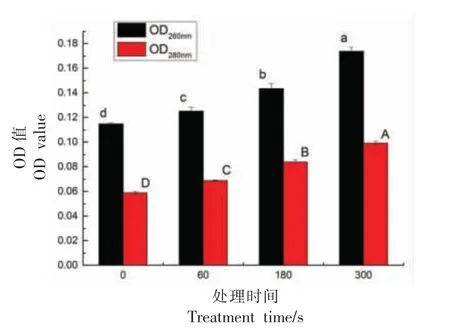
图3 低温等离子体协同气调包装对荧光假单胞菌的核酸和蛋白质泄露含量的影响Fig.3 Effects of CAP combined with MAP on nucleic acid and protein leakage of Pseudomonas fluorescens
2.4.2 ATP 活性的结果分析 ATP 主要存在于组织细胞及细胞器的膜上,是细菌生物膜中的一种蛋白酶,在物质运输、能量转换和信息传输中起重要作用,用于维持细胞内外的K+和Na+的平衡[28]。当机体状态改变时,ATP 酶活性也会随之发生改变。如图4 所示,ATP 活性随着处理时间的增加而显著降低(P<0.05),60,180 s 和300 s处理组的ATP 活性相较于0 s 处理组而言分别下降了7.28,13.10,17.09 U/mg prot。这可能是因为CAP 破坏了细胞膜而导致膜内外产生电势差,使菌体内部的离子流出,ATP 活性降低,从而让细胞内的多种生物酶不能正常运作,细胞的正常代谢活动受阻[29]。除此之外,ATP 下降还可能是因为CAP 处理时抑制了三羧酸循环以及糖酵解相关的酶的活性,导致细菌的代谢功能障碍[9]。

图4 低温等离子体协同气调包装对荧光假单胞菌的ATP 的影响Fig.4 Effects of CAP combined with MAP on ATP of Pseudomonas fluorescens
2.4.3 PI 荧光染色的结果分析 PI 是一种核酸染料,可以用于细胞核的染色,因为PI 无法透过正常的细胞膜,当细胞膜被破坏或者细胞凋亡时,细胞核才能被PI 染色,因此PI 荧光染色也可用来表示细胞膜的完整性[28,30]。如图5 所示,PI荧光强度随着处理时间的增加而显著升高(P<0.05),这是由于当CAP 处理时破坏了细胞膜的完整性,导致核酸泄露,细胞淬灭,使PI 染料进入细胞膜内,荧光强度增强。这与核酸和蛋白质含量的泄露的结果也相一致。有研究表明,PI 升高还可能是细胞产生氧化应激反应[31],因为荧光假单胞菌受到CAP 处理时抗氧化酶失活,产生氧化应激反应,诱导蛋白质氧化以及造成DNA的损伤,最终使细胞走向凋亡。当CAP 处理的时间增长时,细胞受到ROS、RNS 等物质的作用体现在其长久的延续性和接触面,使细胞凋亡。然而180 s 和300 s 处理组的PI 荧光强度相差不显著(P>0.05),这可能是随着处理时间的延长,凋亡的细胞碎片慢慢开始积聚,阻碍了CAP 产生的活性粒子、带电粒子等物质与正常细胞的接触,从而增加了正常生长代谢的荧光假单胞菌对低温等离子体的抵抗力[32]。

图5 低温等离子体协同气调包装对荧光假单胞菌的PI 荧光染色的影响Fig.5 Effects of CAP combined with MAP on PI fluorescence staining of Pseudomonas fluorescens
2.5 菌体内抗氧化酶活性的结果分析
酶在生物体的生命活动中起着非常重要的作用,生物体内的生化反应离不开酶的作用,其主要构成成分为蛋白质。因此酶一旦失活或变性,那么生物体的功能与状态也会发生相应的改变,这也能体现在细菌新陈代谢的变化上[33]。SOD 和CAT都是抗氧化酶,可以通过分解ROS 来减少氧化应激反应,是抗氧化应激反应中重要的酶[34]。
如图6a 所示,SOD 活性随处理时间的增加而降低(P<0.05),其原因可能是CAP 处理时产生的ROS、RNS、带电粒子等虽然在被细胞体内的SOD与CAT 等抗氧化酶分解,然而持续性作用导致抗氧化酶失活,细胞产生氧化应激反应加剧,使得细胞中的ROS 持续增加,加速了蛋白质的氧化和核酸等物质的泄露以及DNA 的损伤,最终导致了细胞的死亡[35]。如图6b 所示,CAT 活性随处理时间的增加而降低(P<0.05),其原因可能是CAP 处理时产生的H2O2被CAT 分解,当处理时间增加时,CAT 活性在下降,ROS、H2O2等物质继续攻击和伤害细胞,细胞难以继续维持氧化还原的平衡状态,而当ROS 积累并超出临界值时,其不能及时被清除,进而继续破坏细胞内的CAT 等抗氧化酶[36]。当细胞中的氧化还原平衡最终被完全打破时便导致了细胞的死亡,达到了杀菌的目的。

图6 低温等离子体协同气调包装对荧光假单胞菌的抗氧化酶的影响Fig.6 Effects of CAP combined with MAP on antioxidant enzyme of Pseudomonas fluorescens
CAP 处理后会导致细胞损伤,继而破坏内源性抗氧化酶SOD 和CAT 的活性[37]。有研究表明,许多刺激能够通过增加细胞内的ROS 来激活多种氧化应激途径,从而导致细胞凋亡[38],而SOD、CAT 等抗氧化酶都可以抑制细胞凋亡[39]。当SOD和CAT 活性较高时有利于保护细胞免受ROS 的损伤,同时可以减少膜脂过氧化来维持细胞膜完整性。
2.6 微观结构的结果分析
如图7 所示为各处理组的SEM 结果,对照组的荧光假单胞菌呈现出完整的杆状,而由于气调包装对其影响而呈现出轻微不光滑现象。在经过处理后的荧光假单胞菌的细胞形态发生了变化,表面粗糙、破损、黏连,这可能是当细胞受损后,胞内物质流出使多个细胞聚集黏连[40]。180 s 和300 s 处理组的细胞形状发生了显著的改变,然而,有些细胞仍然保持着完整的膜结构[37]。因此,从微观结构来看,CAP 可以破坏荧光假单胞菌的细胞膜,增加其细胞壁的通透性,抑制其生长或使细胞因无法正常代谢生长而死亡。

图7 低温等离子体协同气调包装对荧光假单胞菌的微观结构的影响Fig.7 Effects of CAP combined with MAP on the microstructure of Pseudomonas fluorescens
3 结论
本研究以荧光假单胞菌为试验对象,以杀菌率为指标,通过单因素实验和正交试验得到优化后的最佳处理条件,即处理电压50 kV,处理时间180 s,氮气含量60%,在此条件下测得杀菌率为99.49%。低温等离子体耦合气调包装对荧光假单胞菌的抑菌机理研究表明,随着CAP 处理时间的增加,细胞存活率下降;细胞壁和细胞膜的完整性被破坏,AKP 活力下降,核酸和蛋白质泄露量增加,ATP 活性下降,PI 荧光强度增强;细胞体内的抗氧化酶失活;表面形态被破坏等。因此,低温等离子体协同气调包装可导致细胞失活或死亡,处理时间越长,细胞形态变化越显著。综上所述,低温等离子体技术通过产生活性粒子可引起菌体内部分酶的失活、蛋白质的变性、能量代谢的停止、细胞壁和细胞膜的破坏以及DNA 等遗传物质的损伤等[41],最终使荧光假单胞菌死亡。
