应用液质联用代谢组学技术探究Pb2+胁迫对大麦籽粒中差异代谢物及关键通路的影响
2023-12-15王冀菲曹冬梅崔航杨建张东杰
王冀菲,曹冬梅,2,3,4,崔航,4,杨建,张东杰,3,5
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)(2.黑龙江省农产品加工与质量安全重点实验室,黑龙江大庆 163319)(3.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江大庆 163319)(4.国家杂粮工程技术研究中心,黑龙江大庆 163319)(5.北大荒现代农业产业技术省级培育协同创新中心,黑龙江大庆 163319)
大麦(Hordeum vulgareL.)是禾本科作物,别名牟麦、饭麦、赤膊麦,与小麦的营养成分近似,但纤维素含量略高,为全球第五大粮食作物[1]。大麦的籽粒收获后主要应用于啤酒酿造、食品加工、食品保健品等。相比于其他谷物类作物,大麦含有丰富的可溶性β-葡聚糖纤维、淀粉、蛋白质、多酚[2-6]、抗氧化酶和类黄酮等营养物质,可调节人体肠道菌群,降低人体患慢性疾病的风险。同时,大麦能够抵御生物及非生物胁迫[7-10],对生长环境变化感知灵敏,使大麦成为Pb2+胁迫生长条件下探究营养物质变化的理想作物模型。随着工业化进程的发展,田间农药[11]和磷肥[12]的大量使用、粮食产品加工后的废弃排放等行为,导致土地金属污染现象越来越严重。我国耕地土壤的污染指数达19.4%,其中重金属Pb2+为土壤环境污染的主要污染物之一,点位超标率达1.5%[13],超标土壤面积达9.45万km2。土壤受到Pb2+污染的影响,Pb2+随粮食作物生长进入食物链并在人体中富集,当超过人体耐受极限值后容易引起严重的急慢性Pb2+中毒[14],危害人体健康。
研究植物内源代谢物[15],代谢组学可以对其进行一个相对全面的分析[16]。因此,选择代谢组学技术对Pb2+胁迫条件下大麦中产生的代谢产物进行差异研究[17]。目前,代谢组学常用检测方法有核磁共振[18-20]、气相色谱-质谱联用[21]、液相色谱-质谱联用[22]以及仅近年来新兴的毛血管电泳-质谱联用[23]技术。LC-MS液相色谱作为分离系统,具备分析分离性能好、灵敏度高和专属性强等优势,适用于植物代谢差异代谢物的定性定量分析。罗庆[24]应用LC-MS代谢组学技术探究不同Pb浓度胁迫下的东南景天根系分泌物的差异变化,定性出16种差异代谢物,糖脂代谢和能量循环差异变化显著。郭山等[25]通过使用LC-MS技术,对不同浓度Cd胁迫下的凤眼莲代谢物进行差异分析,筛选主要发生变化的代谢通路与有机酸代谢及氨基酸代谢有关。王晶晶[26]探究青梗菜在不同浓度Cr胁迫下植物体内小分子代谢物及代谢通路分析,从青梗菜筛选出多种差异代谢物,氨基酸代谢和能量代谢通路响应了不同浓度的Cr胁迫。Zhao等[27]采用高效液相色谱-质谱联用技术探究低温条件下影响草菇品质的差异代谢物,共有216个差异代谢物,主要差异产生涉及氨基酸代谢、碳水化合物代谢等39条代谢通路。本实验以Pb2+胁迫生长的大麦为原材料,进行代谢组学分析,筛选出具有代表性的差异代谢物及代谢通路,以探究大麦对Pb2+胁迫的响应机制及Pb2+胁迫对大麦营养价值的影响。
1 材料与方法
1.1 材料与仪器
选取优质CK15大麦,购自黑龙江省佳木斯农科院;硝酸铅,购自郑州中天泓达化工科技有限公司;甲醇(色谱纯)、乙腈(分析纯),均购自Fisher Chemical公司;甲酸,购自CNW公司;异丙醇,购自Merck公司;L-2-氯苯丙氨酸,购自Adamas-beta有限公司。本研究在实验过程中为消除其余可能存在的金属离子对结果准确性的影响,故实验全程均使用去离子水。
Vanquish超高效液相、Q Exactive HFX高分辨率质谱、Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱、Heraeus Frescol17离心机,均购自Thermo Fisher Scientific公司;FOSS-KN295组织研磨仪,购自丹麦福斯仪器公司。
1.2 实验方法
1.2.1 大麦模拟田间种植实验
选取大小均匀一致、饱满、健康无损伤的CK15大麦种子,放入m=10%次氯酸钠溶液中浸泡10 min后用去离子水反复冲洗3~5次,于干燥通风的环境中放置24 h自然风干[28]。种植区选择在黑龙江八一农垦大学试验田进行模拟田间实验,并采集农田表层耕作土壤,平铺在塑料薄膜上风干,压碎,剔除其中的根系及石块后过筛待用;种植时每株大麦间隔5 cm,每组大麦种植12箱,播种在塑料箱(长0.6 m,宽0.5 m,高0.45 m)中[29]。取12.5 kg过筛后土壤,使用从前期萌发实验中确定的Pb2+含量(1600 mg/kg土壤)进行土壤拌种,将硝酸铅与土壤混合均匀后开始种植大麦,并分别于7、10、14 d合理间苗,保证每箱4~6株大麦幼苗。
1.2.2 代谢组学样品制备
将收获后的大麦籽粒经冷冻组织研磨仪研磨6 min后过100目筛,称取过筛后样品50 mg至2 mL离心管中,加入研磨珠、400 µL提取液(V甲醇:V水=4:1)与0.02 mg/mL内标(L-2-氯苯丙氨酸)。将样品置于-20 ℃中低温超声30 min;超声结束后于12000 r/min离心15 min,使用移液枪吸取静置后上清液于进样瓶中上机检测,剩余样品分别吸取等量上清液混合成质控样品(QC)上机检测。
1.2.3 LC-MS代谢组学设备及参数设置
本研究数据使用UHPLC -Q Exactive HF-X系统进行代谢组学分析。所选用色谱柱为:ACQUITY UPLC HSS T3(100 mm×2.1 mm i.d.,1.8 µm;Waters,Milford,USA),具体质谱参数设置如表1所示。
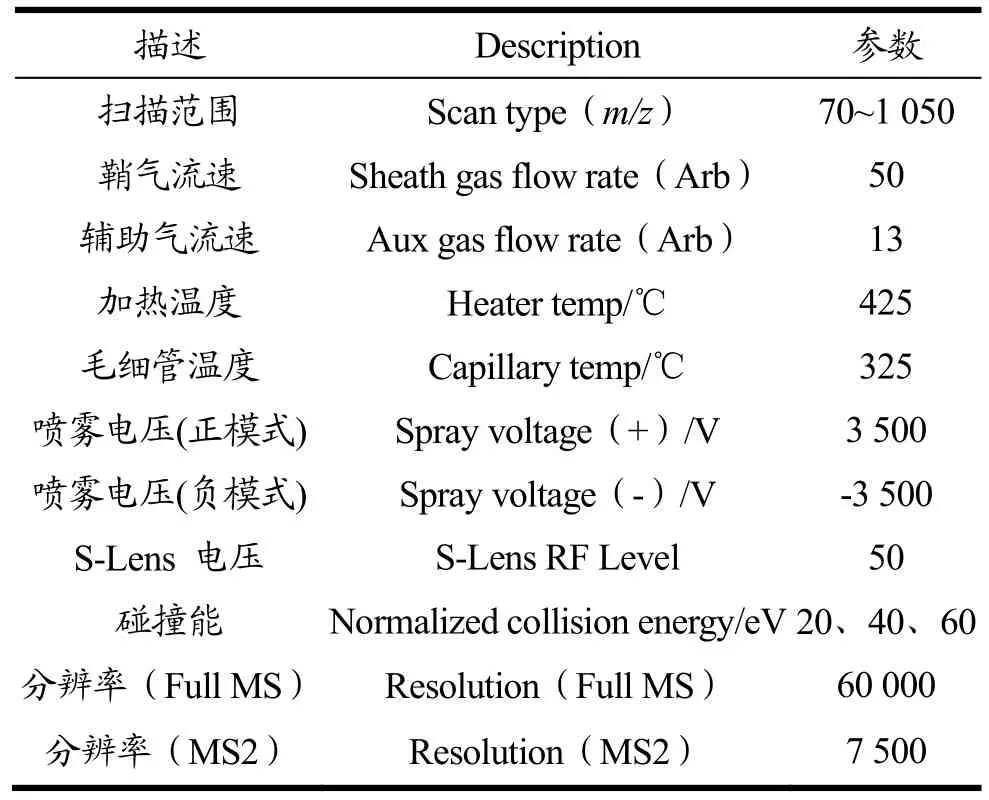
表1 质谱参数Table 1 Mass spectrum parameters
1.2.4 数据处理
多元数据分析应用R软件包进行数据处理以及峰的提取和对齐,再通过PCA、PLS-DA。应用学生式t检验结合PLS-DA的多变量分析(P<0.05,VIP>1),用来筛选差异代谢物,以揭示GSCK-GS1600组大麦籽粒的代谢物类型和关键代谢途径的差异。采用Pearson相关检验系数进行相关分析,同时使用HMDB进一步鉴定代谢产物分子;最后将筛选出的差异代谢物进行KEGG数据库注释分析对差异代谢物参与的代谢途径进行可视化分析。
2 结果与分析
2.1 多元统计学分析
2.1.1 主成分分析(PCA)
图1a、b分别为正、负离子模式下GSCK-GS1600组的PCA得分图。由图中可以看出,所有样本点均处在置信区间内,且组间样本点分离度良好;组内样本点稍有部分聚集,推测为品种相同所导致代谢物相似。有研究表明,Pb2+对于大麦苗期营养物质影响极显著[30],而相同培养条件下Pb2+胁迫对于大麦籽粒的代谢产物有何明显差异,使得后续针对数据进行的PLS-DA分析更为重要。
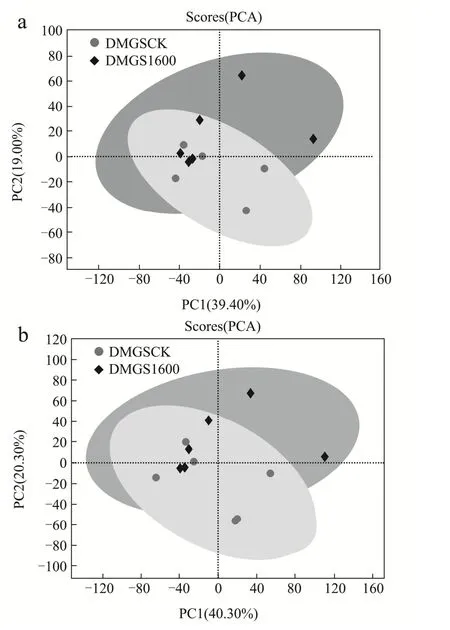
图1 Pb2+胁迫GSCK-GS1600组PCA得分图Fig.1 PCA score map of Pb2+ stress GSCK-GS1600 group
2.1.2 偏最小二乘判别-分析(PLS-DA)
图2a、2b分别为正、负离子模式下GSCK-GS1600组的PLS-DA得分图。所有的数据在建立PLS-DA模型时,均通过200次响应排序检验(RPT)进行验证,且结果显示Q2>0.5,说明实验数据没有假阳性现象,模型具有更高的可靠性。基于PLS-DA结合帕莱托换算(Par)得分图显示,GSCK-GS1600组样本点的分离趋势明显、程度大,说明分类效果显著,即可以清晰的解释实验组与对照组之间的差异,证明Pb2+胁迫对大麦籽粒代谢物存在一定的影响,并且两组模型的预测能力较好、无过拟合现象。

图2 GSCK-GS1600组PLS-DA得分图Fig.2 PLS-DA score ofGSCK-GS1600 group
由图2a的PLS-DA得分图可以看出GS1600组的大麦籽粒样本点对比GSCK组,其样本点分布的离散程度较好,说明大麦籽粒再受到Pb2+胁迫后其内部代谢物类型变化较大。在大麦生长过程中拌Pb土壤呈可溶态性Pb2+,可以与植物螯合肽、金属硫蛋白等小分子肽形成络合物[31,32],堆积在大麦果实中,使Pb2+对大麦的代谢产物在一定程度上发生改变,故呈现在PLS-DA得分图中。
2.2 差异代谢物相关性分析
图3 为通过Pearson相关分析所得到的GSCK-GS1600组差异代谢产物相关性图。在两组实验中,GSCK组与GS1600组之间有几种不同的差异代谢物,其中对苯二甲酸、伞形酮、柠檬酸、橙钝叶决明素、马尔维丁、苹果酸、表儿茶素、2-吡咯烷酮、甘油磷脂、D-2-氨基丁酸化合物聚为一类,这些化合物在GSCK组与GS1600组中呈正相关,与其他代谢产物呈负相关(P<0.05),表明上述化合物的相对含量变化趋势相似,以上化合物均含有羧基及羟基,且多为杂环类化合物,说明有相似化学基团的代谢物在受Pb2+胁迫大麦籽粒中有较强的相关性。

图3 GSCK-GS1600组差异代谢物相关性分析图Fig.3 Correlation Analysis of differential metabolites between GSCK-GS1600 group
2.3 Pb2+胁迫大麦籽粒差异代谢物定性分析
图4为GSCK-GS1600组差异代谢物筛选火山图,图中每个点代表一个特定的代谢物,点的大小表示VIP值。从图中可以直观看出,含量下调的代谢物数量多于含量上调的代谢物数量;其中上调代谢物多数为苯环和有机杂环类化合物,下调代谢物多数为有机氧化合物、脂质化合物和有机酸。脂质类代谢物的减少会抑制细胞的生长和增值[33],减少大麦生长过程中的能量供应,营养成分流失。而大麦籽粒中有机酸含量的高低,将可能会直接影响大麦的品质[34],破坏其化学稳定性。GSCK-GS1600两组样品之间的差异表明,当筛选条件VIP>1,P<0.05时,阳离子模式下共筛选出26个差异代谢物,其中11个含量上调,15个含量下调;阴离子模式下筛选出24个差异代谢物,其中9个含量上调,15个含量下调。如表2中,主要差异代谢物为:有机杂环化合物、有机含氧化合物、脂质及类脂分子以及有机酸类化合物。在Pb2+胁迫作用下,植物体内次级代谢物开始增加,促进有机酸等代谢物的合成。
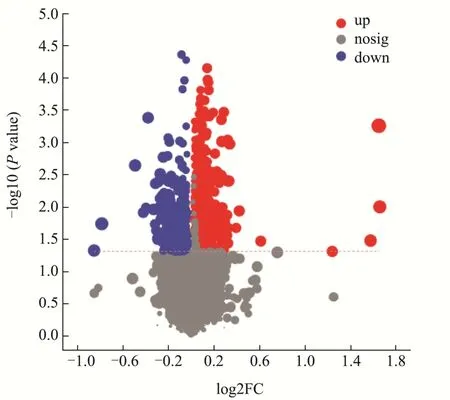
图4 GSCK-GS1600组差异代谢物筛选火山图Fig.4 Screening diagram of differential metabolites between GSCK-GS1600 group

表2 重要差异代谢物鉴定结果表Table 2 Identification results of important differential metabolites
通过表2可知,在GSCK-GS1600组的差异代谢物对比中,产生差异的多数为有机杂环类化合物和苯丙素聚酮类化合物。其中,GS1600组存在3种有机杂环类化合物的代谢物、2种苯丙素聚酮类的代谢物表达量显著高于GSCK组。根据差异代谢物鉴定结果分析可知,甘油脂质类代谢物的含量呈下降趋势,其中甘油二酯含量下降极显著。在大麦生长过程中,由于重金属Pb的胁迫会诱导细胞生成大量活性氧,改变了大麦内部氧化还原电位的稳定[35]。有机氧类化合物整体呈上升趋势,羧酸及其衍生物在大麦籽粒成熟阶段呈上升趋势,谷胱甘肽及L-同型谷胱甘肽含量显著上升,且谷胱甘肽易被H2O2激发,随着Pb2+浓度的升高,谷胱甘肽含量到达峰值后下降。甾醇类激素化合物呈上升趋势,且甾醇α含量显著上调,植物通过分泌甾醇类激素与Pb2+发生螯合[36],甾醇结构中含有活泼的酚羟基,可通过捕获过量的自由基获得强抗氧化力,来消除Pb2+对叶绿素代谢通路的影响,减少大麦在生长过程中产生叶面泛黄、黑色素显著增加[37]等不良影响。
2.4 差异代谢物层次聚类分析
图5为GSCK-GS1600组差异代谢物层次聚类热图,显示不同种代谢物分类中具有生物活性的关键差异代谢物,直观展示差异代谢物的含量变化。由层次聚类图的右侧可以看出,GS1600对比GSCK组中前10个差异代谢物的表达量显著增高,多为杂环类化合物及含苯环化合物和酪胺葡萄糖醛酸类代谢物,说明Pb2+胁迫会使大麦籽粒中苯环类化合物和酪胺葡萄糖醛酸的表达量增加。
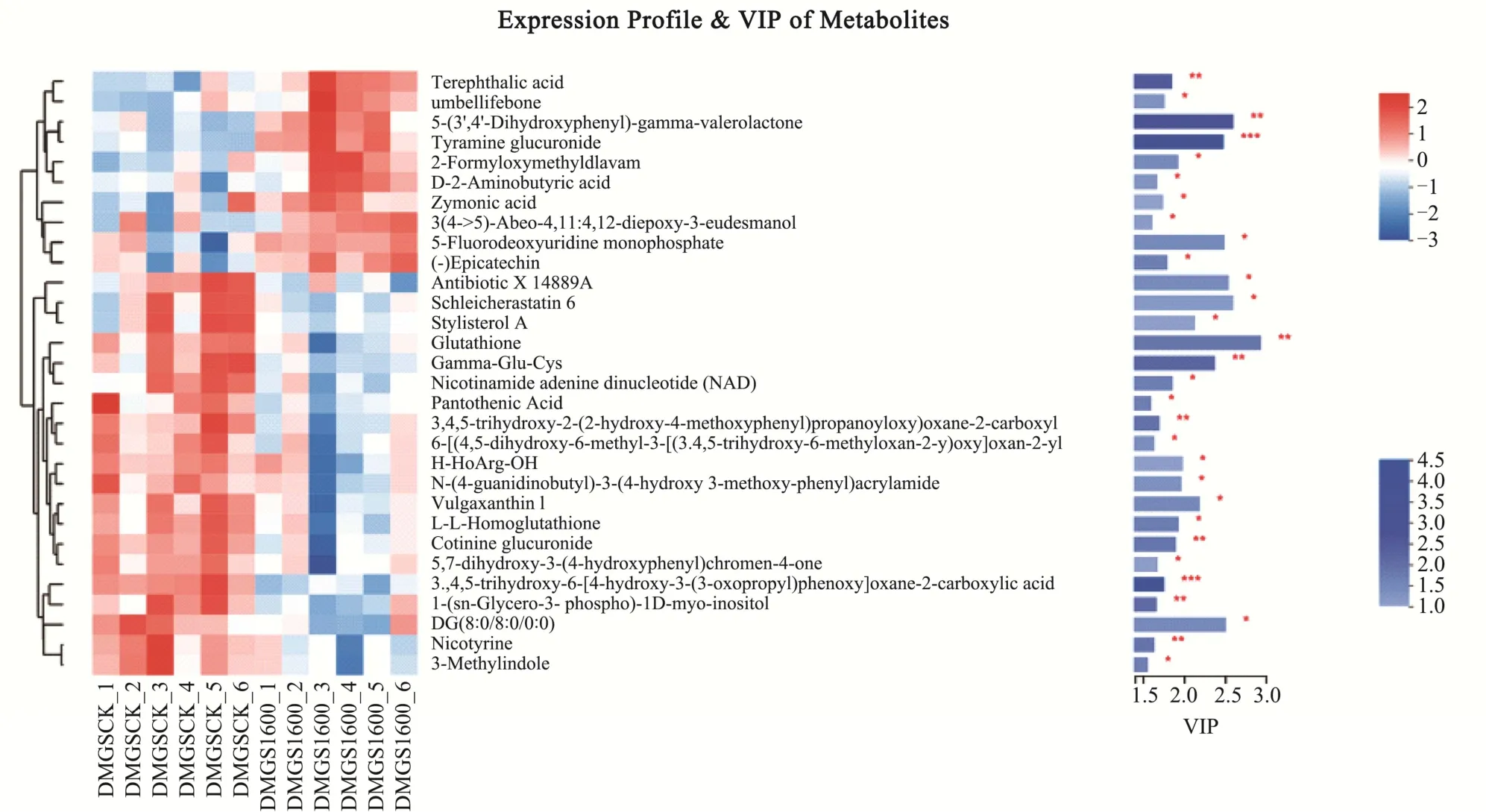
图5 GSCK-GS1600组代谢物层次聚类热图Fig.5 GSCK-GS1600 group metabolites hierarchical clustering heat map
根据HMDB代谢组学数据库,GSCK-GS1600组在阳离子和阴离子模式下共鉴定出38种差异代谢物,将其按化学类别分为8种脂质和类脂分子、7种有机酸及衍生物、7种有机氧化合物、5种有机杂环化合物、苯环型化合物、4种苯丙素类和聚酮类化合物和2种类核苷、核苷酸类似物。与GSCK组相比,受到Pb2+胁迫的大麦籽粒GS1600组的差异代谢物有明显的上调或下调,该结果与差异代谢物筛选火山图中所得到的研究结果一致,7个分类中,各组中主要积累的代谢物为脂质和类脂分子、有机酸及衍生物以及有机氧化合物,而积累的含氮有机化合物、生物碱及衍生物以及核苷、核苷酸和类似物较少。有研究表明,脂质分子占大麦籽粒重量的18%[38],其中甘油二酯、甘油磷脂等大麦中代表性脂质及类脂分子含量变化显著。在Pb2+的胁迫下,大麦根系会分有机酸化合物来减轻重金属胁迫对大麦的影响[39],抵御Pb2+对大麦生长过程及对大麦籽实产生的不良影响。可以将类脂分子、有机酸和有机含氧化合物判断为大麦生理健康的重要代谢物。
2.5 KEGG关键代谢通路分析
根据KEGG京都基因与基因组百科全书数据库来筛选关键代谢通路,以确定与差异代谢物相关联最明显代谢通路。由表3可知,KEGG共识别了16条代谢通路;其中,4条为关键代谢通路。GSCK-GS1600组的差异代谢物参与以下关键代谢通路,分别为苯丙烷代谢、柠檬酸循环、谷胱甘肽代谢、糖氧化物和二羧酸代谢、泛酸盐和CoA生物合成、苯丙烷代谢、光合生物中的碳固定、氨基酸糖和核苷酸糖代谢、苯丙氨酸代谢、玉米素生物合成、戊糖和葡萄糖醛酸的相互转化、泛醌和其他萜类醌生物合成、β-丙氨酸代谢、丙氨酸和天冬氨酸和谷氨酸代谢、色氨酸代谢、酪氨酸代谢。
在Pb2+胁迫大麦生长过程中,柠檬酸循环、谷胱甘肽代谢、糖氧化物和二羧酸代谢、苯丙烷代谢主要产生特定差异代谢物。而Pb2+作为农作物非必需元素,农作物会建立防御机制,来减少Pb2+所带来的危害[40]。大量研究表明,重金属胁迫作物生长,利用合成谷胱甘肽、有机酸、苯丙烷、可溶性糖等物质从而将重金属络合形成其他化合物[41]。柠檬酸循环、谷胱甘肽代谢、糖氧化物和二羧酸代谢及苯丙烷代谢的显著途径变化支持了这些结果,同时光合生物的固碳作用、β-丙氨酸代谢、玉米素生物合成、泛酸盐和CoA生物合成、丙酮酸代谢、丙氨酸和天冬氨酸和谷氨酸代谢在Pb2+胁迫实验中也受到了很大的影响。此外,一些有生物合成途径产生的代谢产物受到Pb2+胁迫生长过程的影响,如柠檬酸循环、谷胱甘肽代谢、糖氧化物和二羧酸代谢、苯丙烷代谢主要产生特定差异代谢物,并影响了一些代谢物的变化,包括柠檬酸、苹果酸、甲氧基肉桂醛、对羟基丙烯酸、γ-谷氨酰胺-半胱氨酸、谷胱甘肽。
谷胱甘肽代谢通路中共有两种差异代谢产物随着Pb2+含量的增加而增加,由双-γ-谷氨酰胱氨酸经双-γ-谷氨酰胱氨酸还原酶还原生成γ-谷氨酰胺-半胱氨酸,由谷胱甘肽合酶合成谷胱甘肽,Pb2+胁迫谷胱甘肽代谢通路中的双-γ-谷氨酰胱氨(谷胱甘肽前体)含量增加,大量生成γ-谷氨酰胺-半胱氨酸并促使Pb2+胁迫大麦籽粒组中谷胱甘肽含量增加,从而调节因添加Pb2+而被破坏的氧化还原系统。柠檬酸循环与糖氧化物和二羧酸代谢,共同含有两种相同的差异代谢产物,随Pb2+含量的增加而减少,由顺乌头酸经乌头酸水合酶催化生成异柠檬酸,经裂解缩合生成苹果酸脱氢生成草酰乙酸,Pb2+胁迫大麦籽粒使其持水率降低,使大麦气孔调节能力下降,影响呼吸作用,柠檬酸循环中柠檬酸和苹果酸生成受到影响,从而影响大麦果实中糖类、脂类、氨基酸类物质的合成,使大麦生长过程中,无法达到基础生长过程所需的能量供给要求,产生不良影响,使大麦中营养物质流失。苯丙烷代谢通路中含有甲氧基肉桂醛及对羟基丙烯酸两个差异代谢物含量增加,由苯丙氨酸解氨酶依次反应生成甲氧基肉桂醛、对羟基丙烯酸,随重金属铅含量的增加苯丙烷代谢中的关键酶的生成量增加[42],使苯丙烷代谢分泌更多次级代谢产物到大麦根系周围土壤中,来增加大麦的非生物胁迫能力[43],使大麦增强重金属铅污染环境下的耐受能力。
3 讨论
Pb是目前污染土壤情况最严重的重金属之一。由于其不是植物生长的必需元素,如果土壤含Pb量超标,会很难去除,从而使一些不能“选择性自主移动”的农作物不可避免地受到Pb污染的毒害[44]。有研究表明,Pb能够抑制种子萌发,降低种子活力,抑制植株生长,并积累在植株体内[45,46]。过量的Pb2+进入人体会损伤肠胃健康、毒害肾脏、损害神经,导致高血压、铅性贫血,影响人的智力发育,降低人体免疫力。本研究通过大麦种植实验,对在Pb2+胁迫的环境下成熟的大麦籽粒进行LC-MS代谢组学分析,以此探究大麦籽粒受到Pb2+胁迫后的内部营养物质及可能产生毒害物质的代谢机理。Pb2+胁迫对大麦籽粒的影响最直观的体现在关键差异代谢物和关键代谢通路上。通过层次聚类热力图可以看出对含量发生变化的关键代谢物产生的影响,其中大麦籽粒受到Pb2+胁迫后,主要累积的代谢物为脂类代谢物和有机酸类代谢物。脂类代谢物主要是为大麦籽粒的生长提供能量,其积累可以证明大麦籽粒受到胁迫后其呼吸作用受到抑制,生命活动减弱,会对大麦籽粒的品质造成影响;而有机酸类代谢物的累积则是大麦籽粒抵御外界胁迫的一种防御手段,当大麦籽粒感受到Pb2+胁迫时,其根系就会不断的分泌有机酸与之进行螯合,形成重金属-有机酸螯合物,阻止其进入大麦籽粒内部,以减轻对大麦籽粒的危害。
通过KEGG通路分析发现,Pb2+胁迫会主要对大麦籽粒中柠檬酸循环和氨基酸代谢有显著影响。Pb2+胁迫大麦籽粒会使其持水率降低,使大麦气孔调节能力下降,影响呼吸作用,导致柠檬酸循环受到影响,从而影响大麦果实中糖类代谢物、脂类代谢物和氨基酸类代谢物的合成,使大麦籽粒无法达到基础生长过程所需的能量供给要求;大麦籽粒的持水率降低也会影响大麦籽粒的口感,最终影响大麦籽粒的品质。同时氨基酸合成的减少也会导致其中营养物质的流失和。但经过分析发现,受到Pb2+胁迫后的大麦籽粒内部未产生有害物质,如发生意外食用的情况,不会对人体产生不良影响。
4 结论
本研究以模拟Pb污染大麦种植区,添加土壤中外源Pb2+的方式,来模拟Pb2+污染环境下的大麦盆栽实验。经过一个完整的大麦生长周期后,应用LC-MS非靶向代谢组学探究Pb2+胁迫大麦籽粒的代谢机理。研究结果表明,Pb2+胁迫组大麦籽粒(GS1600)与对照组大麦籽粒(GSCK)中有38种代谢产物,其中多数为脂质和类脂分子、有机酸及衍生物及有机氧化合物。根据Pearson相关分析显示,含有羧基及羟基的杂环类化合物多与其他代谢产物呈负相关(P<0.05)。通过差异代谢物层次聚类热力图表明,大麦籽粒中的有机杂环化合物、有机含氧化合物、脂质及类脂分子以及有机酸类化合物发生了显著变化。在铅胁迫条件下,差异代谢物的化学类别丰富,基于KEGG关键通路分析,共筛选出16条代谢通路,其中主要产生特定差异代谢物的关键代谢通路共4条:谷胱甘肽代谢,柠檬酸循环,糖氧化物和二羧酸代谢,苯丙烷代谢。关键差异代谢物为柠檬酸,苹果酸,γ-谷氨酰胺-半胱氨酸,谷胱甘肽,甲氧基肉桂醛,对羟基丙烯酸。因此,可进一步探究Pb2+胁迫下大麦结构之间的相互作用及变化,为受污染大麦的回收利用提供理论依据,增加受污染大麦的回收利用率,减少食物浪费,以减轻粮食安全问题。
