纳米花固定化葡萄糖异构酶的制备及性能分析
2023-12-15王世杰崔诗琦姜晓冬王红英钱斯日古楞
王世杰,崔诗琦,姜晓冬,王红英,钱斯日古楞
(大连工业大学生物工程学院,辽宁大连 116034)
葡萄糖异构酶,又称木糖异构酶,是一种可以将醛糖异构化为相应酮糖的异构酶,在工业生产中具有很高的应用价值。葡萄糖异构酶在自然界中的来源十分广泛,微生物乃至植物和动物细胞中都有葡萄糖异构酶的存在[1]。葡萄糖异构酶是生产高果糖浆的关键酶,金属离子对葡萄糖异构酶酶活影响较大[2]。游离葡萄糖异构酶的价格较昂贵、易失活、稳定性不佳、难以回收利用等缺点限制了其应用与发展[3,4]。
酶的固定化不仅能保持酶的活性,还可以提高酶的稳定性,便于酶的分离回收。因此,固定化酶被广泛应用于生物、医学、工业生产等领域。传统的固定化酶交联法、吸附法、包埋法、共价结合法[5-8],虽然可以提高酶的稳定性,但交联法与共价结合法由于反应条件激烈,会使酶蛋白结构发生变化,从而降低酶活[9,10];包埋法由于包埋载体的存在,会使底物与酶之间的相互作用受到阻碍,降低催化效率[11];吸附法中物理相互作用不强,温度、pH和搅拌等条件很可能造成酶的脱落等[12]。纳米花固定化技术是一种新型的固定化技术,它通过酶蛋白、金属离子与磷酸根离子之间的自组装,形成类似花状的结晶复合体[13],在形成过程中,无机磷酸盐会充当载体,将酶固定在纳米级的层状花瓣中,最终这些花瓣聚集成微米级的花状结构[14],因此被称为纳米花。纳米花固定化技术一定程度上是一种包埋技术,金属离子和阴离子结合形成沉淀的过程中,酶蛋白附着在上面,但其合成环境温和,合成方法简单,绿色。纳米花的花状结构增加了比表面积的同时对酶起到保护作用,不仅可以提高酶的活性,在酶的稳定性提升方面同样表现良好,因此备受关注[15]。
本文致力于葡萄糖异构酶的固定化研究,采用共沉淀法,制备出纳米花固定化葡萄糖异构酶,并对制备条件进行优化,结合扫描电镜、透射电镜、傅里叶变换红外光谱、X-射线衍射等技术及方法对固定化酶的结构进行了表征,并分析其酶学性质;结果证实,该方法能够制备出纳米花固定化葡萄糖异构酶,且其酶学性质表现良好。
1 材料与方法
1.1 主要仪器
热场发射扫描电镜,日本电子株式会社;X-Max50能谱仪,英国牛津仪器公司;透射式电子显微镜,日本电子株式会社;红外光谱仪,美国珀金埃尔默仪器有限公司;X-射线衍射仪,日本岛津;V-1300紫外可见分光光度计,上海美析仪器有限公司。
1.2 实验材料
葡萄糖异构酶(10 U/mg),诺维信生物技术有限公司;咔唑乙醇、L-半胱氨酸盐酸盐,上海源叶生物科技有限公司;硫酸铜,天津市天力化学试剂有限公司;D-果糖(分析纯),上海源叶生物科技有限公司;硫酸镁(分析纯),天津市大茂化学试剂厂。
1.3 纳米花固定化酶GI@NFs的制备
量取一定量的葡萄糖异构酶液,溶解于PBS缓冲液中,并与一定浓度的CuSO4溶液混合,在25 ℃条件下静置反应24 h;在8000 r/min条件下离心5 min后收集沉淀;沉淀用去离子水冲洗3次,冷冻干燥获得粉末状纳米花固定化酶GI@NFs。
1.4 酶活的测定
果糖标准曲线的绘制,以D-果糖为标准物,半胱氨酸盐酸盐、浓硫酸、咔唑酒精混合溶液为显色剂,在560 nm处测定吸光值,得到的回归方程为Y=0.5575x+0.0208,R2=0.9993。
葡萄糖异构酶活力的测定采用硫酸咔唑法。0.75 mL酶液或1 mg固定化酶中加入0.75 mL磷酸盐缓冲液(pH值7.4)和0.25 mL硫酸镁溶液(12 g/L),混匀后加入0.75 mL 70%的葡萄糖溶液;在70 ℃条件下准确反应1 h。取1 mL反应液,加入0.2 mL半胱氨酸盐溶液(24 g/L)和6 mL浓硫酸,混匀后加入0.2 mL咔唑酒精(1.2 g/L);混匀后在60 ℃下条件下水浴保温10 min以上;冷却后在560 nm处测定吸光值。
式中:
A——酶活力,在70 ℃、pH值7.4条件下,每分钟生成1 μmoL D-果糖所需的酶量定义为1酶活(U)。
E——从标准曲线对应560 nm吸光值上读出的果糖质量,mg。
1.5 制备条件的优化
1.5.1 PBS浓度
PBS浓度设置为2、4、6、8、10、12 mmol/L,分别取30 μL酶液溶于9 mL pH值7.4 PBS后,充分摇匀,然后加入30 μL CuSO4摇匀后在25 ℃条件下静置24 h,于8000 r/min下离心5 min收集沉淀,用去离子水清洗3次以后,测定酶活,确定最适PBS浓度。
1.5.2 CuSO4添加量
CuSO4添加量设置为15、30、45、60、75、90 μL,分别取30 μL酶液溶于9 mL pH值7.4 PBS后,充分摇匀,然后加入CuSO4摇匀后在25 ℃条件下静置24 h,于8000 r/min下离心5 min收集沉淀,用去离子水清洗 3次以后,测定酶活,确定最适CuSO4添加量。
1.5.3 酶添加量
酶的添加量设置为20、30、40、50、60、70 μL,分别溶于9 mL pH值7.4 PBS后,充分摇匀,然后加入30 μL CuSO4摇匀后在25 ℃条件下静置24 h,于8000 r/min下离心5 min收集沉淀,用去离子水清洗3次以后,测定酶活,确定最适酶添加量。
1.5.4 制备温度
制备温度设置为5、15、25、35、45、55 ℃,分别取40 μL酶液溶于9 mL pH值7.4 PBS后,充分摇匀,然后加入30 μL CuSO4摇匀后在不同温度条件下静置24 h,于8000 r/min下离心5 min收集沉淀,用去离子水清洗3次以后,测定酶活,确定最适制备温度。
1.5.5 制备pH值
制备pH设置为5.4、6.4、7.4、8.4、9.4、10.4,分别取40 μL酶液溶于9 mL不同pH的PBS后,充分摇匀,然后加入30 μL CuSO4摇匀后在35 ℃条件下静置24 h,于8000 r/min下离心5 min收集沉淀,用去离子水清洗3次以后,测定酶活,确定最适制备pH值。
1.5.6 制备时间
制备时间设置为6、12、18、24、30、36 h,分别取40 μL酶液溶于9 mL pH值7.4 PBS后,充分摇匀,然后加入30 μL CuSO4摇匀后在35 ℃条件下静置不同时间,于8000 r/min下离心5 min收集沉淀,用去离子水清洗3次以后,测定酶活,确定最适制备时间。
1.6 GI@NFs的酶学性质
以下GI@NFs均为1.5最适条件下制备,酶活测定参照1.4方法,在测得最优条件(温度、pH)后,在最优条件下测定酶活。
1.6.1 反应温度对酶活的影响
分别在30、40、50、60、70、80 ℃条件下,测定游离酶和GI@NFs的酶活。
1.6.2 反应pH条件对酶活的影响
在最适反应温度下,分别调节缓冲液pH值为4、5、6、7、8、9、10,测定游离酶和GI@NFs的酶活。
1.6.3 热稳定性
将游离酶和GI@NFs在40、50、60、70、80、90 ℃条件下放置2 h,测定游离酶和GI@NFs的酶活。
1.6.4 pH稳定性
将游离酶和GI@NFs分别在pH值为4、5、6、7、8、9的缓冲液中保存24 h后,测定游离酶和GI@NFs的酶活。
1.6.5 重复利用率
在最适温度和pH值下对GI@NFs酶活进行测定,并于8000 r/min下离心5 min收集沉淀,用去离子水清洗3次,重复测其酶活,比较其酶活力变化。
1.6.6 储存稳定性
将固定化酶和游离酶在pH值7.4,0.2 mol/L磷酸缓冲液条件4 ℃保存,每隔1周测定一次酶活,观察储存时间的延长对酶活影响。
1.7 数据分析
本文实验数据用平均值±标准差表示,平均值由3组平行实验所得,采用SPSS和Origin 8.6对结果进行分析处理。
2 结果与分析
2.1 GI@NFs制备条件的优化
2.1.1 PBS浓度
PBS浓度是影响纳米花的形成以及酶活表现的重要因素。从图1中看出,固定化葡萄糖异构酶的活力随制备PBS浓度的增加而提高,PBS浓度6 mmol/L时其活力达到最高值,随后活力逐渐降低,这可能是随着磷酸根离子浓度的增加,有利于纳米花的形成,而浓度太高时,反而不会形成纳米花,而是形成纳米薄片[16],因此确定6 mmol/L为制备GI@NFs的最适PBS浓度。

图1 PBS浓度对GI@NFs酶活的影响Fig.1 Effect of PBS concentration on GI@NFs enzyme activity
2.1.2 CuSO4添加量
纳米花成核和生长始于Cu2+结合位点,进而形成了独立的花瓣,这是纳米花形成的关键步骤。所以金属离子浓度是影响纳米花花瓣形成和酶活的重要条件。实验结果如图2所示,固定化葡萄糖异构酶的活力随着CuSO4(16 g/L)添加量的增加而提高,在30 μL的添加量时活力达到最大值,随后持续下降,Cu2+浓度的增加可以促进GI@NFs的形成,但随着浓度的增加,可能会阻止酶与底物的接触,甚至会抑制酶活,因此确定30 μL为制备GI@NFs的CuSO4最适添加量。
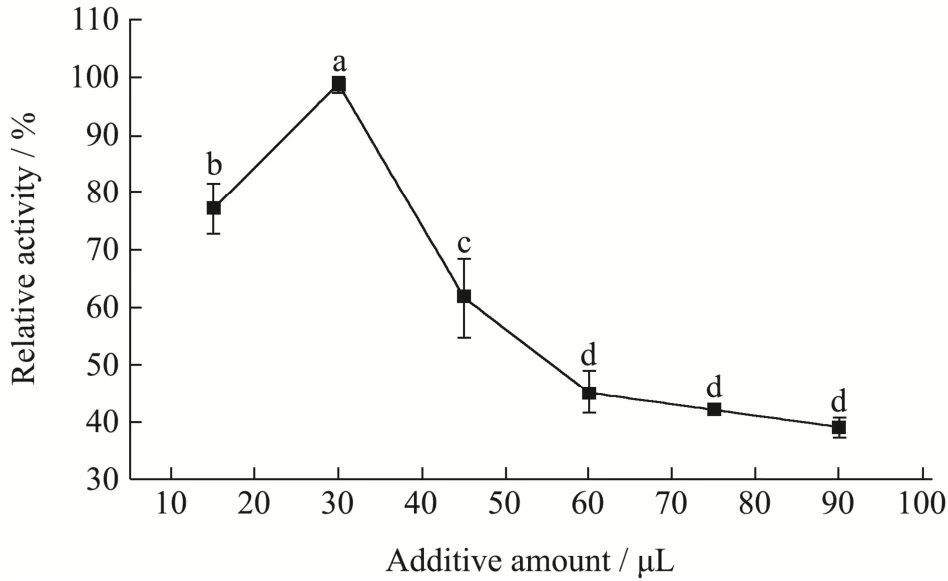
图2 CuSO4添加量对GI@NFs酶活的影响Fig.2 Effect of CuSO4 additive concentration on GI@NFs enzyme activity
2.1.3 酶添加量
酶蛋白的浓度是影响纳米花制备的主要因素之一。从图3中看出,固定化葡萄糖异构酶的活力随酶蛋白增加而提高,添加量40 μL时,酶活力达到最高值,随后固定化酶活力下降,随着酶添加量的提高,更多的酶分子被固定在纳米花上,继续增加酶添加量,多余的酶分子无法被固定,其活力反而会降低,因此确定40 μL为制备GI@NFs的最适酶添加量。

图3 GI添加量对GI@NFs酶活的影响Fig.3 Effect of GI additive concentration on GI@NFs enzyme activity
2.1.4 制备温度
温度对纳米花固定化酶制备的影响,结果如图4。由图可见,随着制备反应温度提高,固定化酶的活力增加,35 ℃时其酶活力达到最高值,随后逐渐下降,随着温度的提高,纳米花的形成速度会加快,但是温度过高会形成更多的沉淀,但纳米花的量会变少,同时,高温可能导致酶的变性失活,从而降低酶活因此,确定35 ℃为制备GI@NFs的最适制备温度。
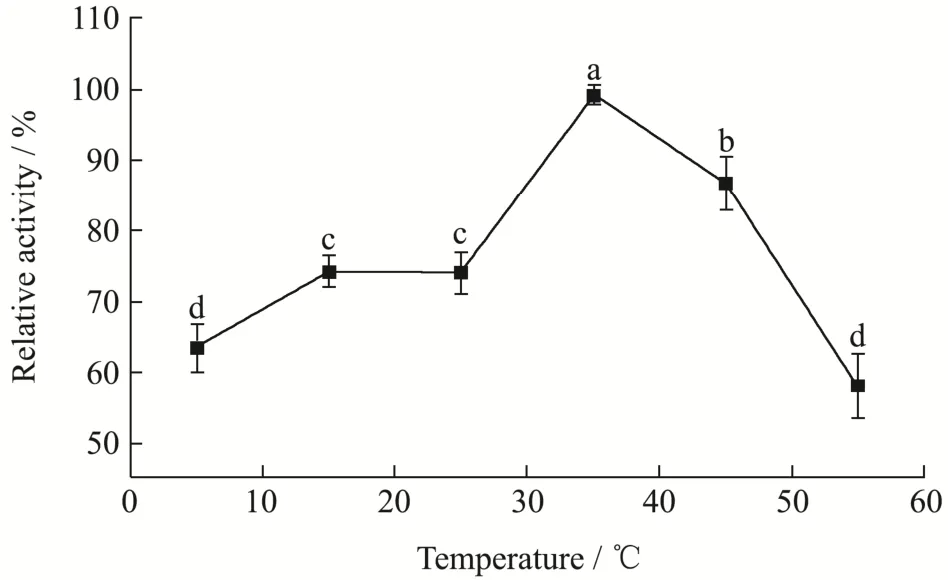
图4 温度对GI@NFs酶活的影响Fig.4 Effect of temperature on GI@NFs enzyme activity
2.1.5 制备pH值
pH条件对制备纳米花固定化葡萄糖异构酶活力表现的影响,如图5所示。由图可见,反应体系的pH值小于7.4时,固定化酶活力随着pH值的增加而提高,pH值7.4时,酶活力达到最高值,随后其活力持续下降;原因可能是在酸性和碱性条件下游离酶的酶活都会降低,酶失活,所以形成的纳米花的酶活同样会降低,因此,确定pH值7.4为制备GI@NFs的最适反应pH值。

图5 pH值对GI@NFs酶活的影响Fig.5 Effect of pH value on GI@NFs enzyme activity
2.1.6 制备时间
制备反应时间不仅影响形成纳米花的花形和松散度,还会影响其酶活力。反应时间的影响从图6中可看出,随着反应时间的延长,固定化酶的活力提高,18 h时达到最高值,随后活力下降;随着制备时间的增加,形成了更多的纳米花,但是时间继续增加,形成较大的纳米花聚集物,从而降低酶活,因此,确定18 h为制备GI@NFs的最适反应时间。

图6 时间对GI@NFs酶活的影响Fig.6 Effect of time on GI@NFs enzyme activity
2.2 纳米花固定化酶的形态结构
2.2.1 微观形貌表征
采用扫描电镜(Scanning Electron Microscope ,SEM)和透射电镜(Transmission Electron Microscope,TEM)对制备纳米花固定化酶GI@NFs的微观形貌进行表征,结果如图7所示。由图可见,GI@NFs呈花状,花瓣呈片状,且张开;酶蛋白在花瓣上均匀分布,呈点状。以上结构特征增加了酶与底物的接触面积,并且对酶起到支撑和保护作用,有利于酶活表现。

图7 GI@NFs的SEM图(a、b)和TEM图(c、d)Fig.7 SEM (a, b) and TEM (c, d) images of GI@NFs
2.2.2 能谱分析
利用X-射线能谱分析(Energy Dispersive Spectroscopy,EDS)对纳米花固定化酶的元素组成进行分析,结果如图8。由图可见,GI@NFs能级色谱图中的P、O、Cu元素来自于Cu3(PO4)2,而N、O元素来自与酶蛋白,这说明了GI@NFs是由制备离子与酶蛋白通过自组装形成。

图8 GI@NFs的能级色谱图Fig.8 Energy level chromatogram of GI@NFs
2.2.3 傅里叶红外光谱分析
GI@NFs、Cu3(PO4)2和GI在傅里叶变换红外光谱仪(Fourier Transform Infrared Spectrometer,FT-IR)的吸收特征峰如图9所示。由图可知,在630 cm-1、991 cm-1和1060 cm-1处为表现P-O的伸缩振动峰,说明GI@NFs中有PO43-基团;在1400 cm-1处表现C=O的伸缩振动峰,该峰在GI和GI@NFs中均有出现,由GI引起,因此可以进一步确定说明GI@NFs是由Cu2+、PO43-和GI构成[17,18]。

图9 Cu3(PO4)2、GI和GI@NFs的FT-IR表征Fig.9 FT-IR characterization of Cu3(PO4)2, GI and GI@NFs
2.2.4 GI@NFs的X-射线衍射分析
GI@NFs的X-射线衍射(X-ray Diffraction,XRD)结果如图10所示。对比Cu3(PO4)2·3H2O的标准卡片(JPSCD 00-022-0548),GI@NFs的衍射峰与其基本一致,表明制备的GI@NFs具有良好的结晶度。
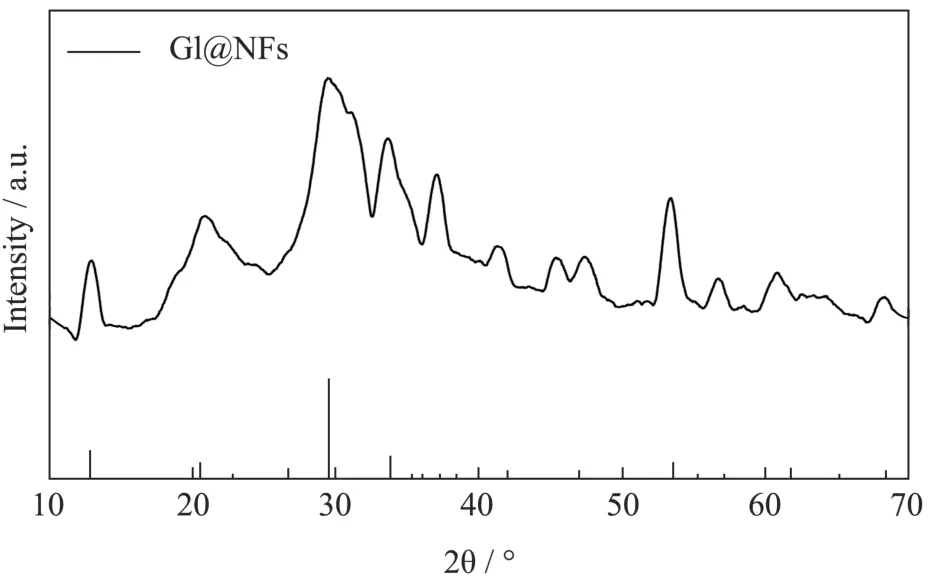
图10 GI@NFs的XRD表征Fig.10XRD characterization of Cu3(PO4)2 and GI@NFs
2.3 纳米化固定化酶GI@NFs的酶学性质
2.3.1 反应温度对酶活的影响
反应温度的变化对GI@NFs酶活的影响如图11所示。由图可见,固定化葡萄糖异构酶的活力随反应温度的提高而增加,在60 ℃时其活力达到最高值;随后酶活缓慢下降,但在80 ℃时仍保持其最高活力的70%以上。最后确定60 ℃为GI@NFs的最适反应温度,这比其游离酶的提高10 ℃,纳米花结构将酶分子限制在花瓣内,阻挡了高温对酶结构变化的影响,避免了酶的变形失活[19],更高的反应温度有利于工业应用。
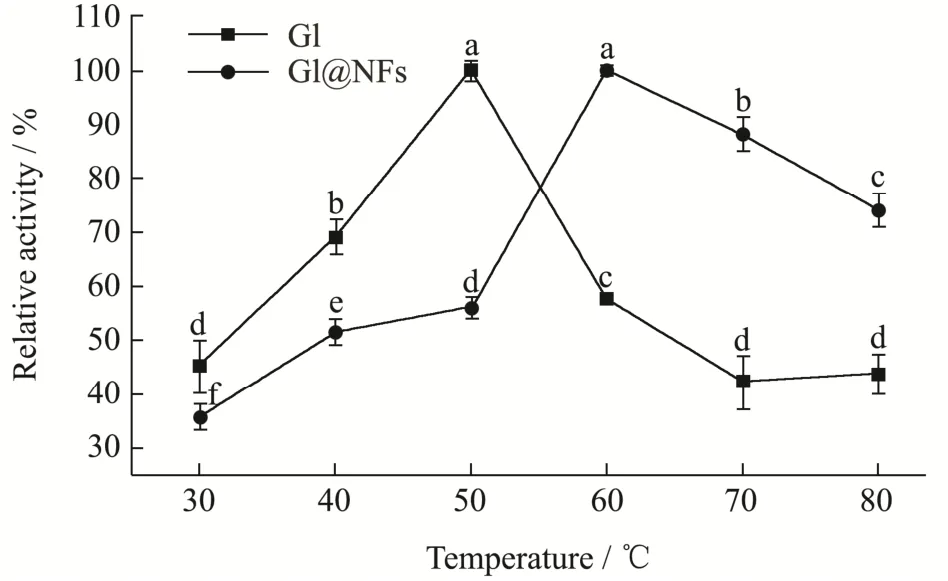
图11 GI和GI@NFS的最适反应温度Fig.11 Optimum reaction temperatures of GI and GI@NFS
2.3.2 反应pH条件对酶活的影响
反应pH条件对GI@NFs酶活的影响如图12所示。在酸性和弱碱性条件下,固定化葡萄糖异构酶的活力随pH值的增加而提高,在pH值为8时活力达到最高值;随后其活力缓慢下降,在pH值为10时仍保持其最高活力的85%以上。最后确定pH值为8为GI@NFs的最适pH值条件;其游离酶的最适pH值为7,这可能是由于葡萄糖异构酶和无机盐载体之间的相互作用,使酶分子的刚性增强,同时纳米花结构降低了葡萄糖异构酶对pH值的敏感性,从而拥有更广的pH值反应范围。

图12 GI和GI@NFs的最适反应pHFIg. 12 Optimal pH of GI and GI@NFs
2.3.3 热稳定性
将固定化酶和游离酶在不同温度下放置2 h后测定其酶活,结果如图13。由图可见,随着保存温度的增加,固定化葡萄糖异构酶和及其游离酶的残余活力均有下降,但固定化酶的活力下降比游离酶的缓慢,且保持相对较高活力,这表明纳米花固定化葡萄糖异构酶表现良好的热稳定性,纳米花结构对酶分子起到了很好的保护作用,使其受到外界环境变化的影响变小。

图13 GI和GI@NFs的热稳定性Fig.13 Thermal stability of GI and GI@NFs
2.3.4 pH稳定性
将固定化葡萄糖异构酶和游离酶在不同pH条件下保存24 h后测定其酶活,结果如图14。由图可见,固定化酶及游离酶在pH值7时其残余活力均表现最高,而在酸性和碱性条件下,它们活力均不同程度的下降;但固定化酶的残余活力保持均比其游离酶的明显高,在pH值4和9时固定化酶仍保持87.06%和73.51%的活力,而游离酶仅存34.21%和43.52%,说明GI@NFs有较强的pH稳定性,原因可能是纳米花结构保护了酶的活性中心,降低对pH的敏感性,从而增强了酶的pH稳定性。

图14 GI和GI@NFs的酸碱稳定性Fig.14 Acid base stability of GI and GI@NFs
2.3.5 重复利用率
纳米化固定化葡萄糖异构酶的重复利用率研究中共进行了8次连续的测酶活试验,结果如图15。由图可见,在连续8次测定酶活时,固定化酶的活力持续下降,但下降缓慢,在第8次测定时其活力仍保持最初活力的60.32%,说明纳米花固定化葡萄糖异构酶表现良好的操作稳定性,其活性降低原因可能是由于反应完成后,酶分子与无机载体的结合力变弱,再经过离心洗涤,部分酶分子从纳米花中洗脱,同时,由于反应温度为60 ℃,在反应过程中,部分酶蛋白变性失活,导致酶活降低。

图15 GI@NFs的重复利用率Fig.15 Reuse rate of GI@NFs
2.3.6 储存稳定性
纳米化固定化酶GI@NFs在4 ℃保存5周过程中的酶活表现如图16。由图可见,在存储过程中固定化酶和其游离酶的活力均下降,但固定化酶的活力下降要比游离酶的缓慢,在第5周测定时,固定化酶的酶活保持62.16%,而游离酶只有32.19%,这表明,纳米花结构减少了酶的自溶和变性,纳米花固定化葡萄糖异构酶表现良好的储存稳定性。

图16 GI和GI@NFs的储存稳定性Fig.16 Storage stability of GI and GI@NFs
3 结论
本文成功制备了葡萄糖异构酶纳米花,研究了PBS浓浓度、酶添加量、金属离子添加量及反应温度、环境pH值条件和反应时间对葡萄糖异构酶纳米花制备的影响,结果显示,40 μL酶液溶解于9 mL pH值为7.4的PBS缓冲液,再与30 μL CuSO4混合,35 ℃、静置反应18 h制备的纳米花固定化葡萄糖异构酶具有完整的花型,且其花瓣结构均匀、分散。
纳米花固定化酶GI@NFs的酶学性质研究中发现,GI@NFs的最适反应温度相较于游离酶提高了10 ℃;最适反应pH比其游离酶的有所提高,且在弱酸弱碱环境下均具有较高酶活;在最适反应条件下,GI@NFs的负载量40.36 mg/g,游离酶的酶活为10 U/mg,而GI@NFs的酶活为18.31 U/mg,GI@NFs的活力比其游离酶的活力提高了83.06%。GI@NFs表现出更高的热稳定性,在不同温度下都表现出相对更高的酶活力;在不同pH值下保存24 h固定化酶的活力保持均比其游离酶的明显高,在pH值为4和9时固定化酶仍保持87.06%和73.51%的活力,而游离酶的仅为34.21%和43.52%;固定化葡萄糖异构酶在4 ℃下保存5周时,其活力仍保持最初活力的62.16%,表现较好的储存稳定性;重复利用8次时,活力仍能保持其最初活性的60.32%。
综上所述,纳米花固定化方法是一种简便快捷的固定化方法,相比于传统的固定化方法,使用该方法固定化葡萄糖异构酶制备方法简便,反应条件温和,不仅可以有效提高葡萄糖异构酶的酶活,且GI@NFs具有更高的稳定性和重复利用率,因此该方法制备的纳米花固定化葡萄糖异构酶在工业相关生产中有一定的应用前景。
