HIF-1α 纳米抗体的制备及其抑制黑素瘤生长的作用
2023-12-15李佳敏秦蓉芬迟志端王富明范瑞文
李佳敏 ,贾 琼 ,秦蓉芬 ,迟志端 ,王富明 ,范瑞文
(1.山西农业大学 动物医学学院,山西 太谷 030801;2.晋中市庄子乡综合便民服务中心,山西 晋中 030600)
氧是生命活动中所必需的物质,且在其中起重要作用[1]。缺氧在恶性肿瘤中是较为常见的,且缺氧还是肿瘤生长环境最显著的特征之一[2]。组织和细胞是通过缺氧诱导因子(Hypoxia inducible factor,HIF)诱导相应靶基因来适应氧气浓度[3]。HIF-1、HIF-2 及HIF-3 是HIF 的3 种亚型,均由氧调节型α 亚基和组成型β 亚基构成,α 亚基是活性亚基,又分为HIF-1α,HIF-2α 和HIF-3α[4]。HIF-1α 与氧浓度的关系密切,HIF-1α 是缺氧细胞基因表达的关键,其稳定性和活性受各种翻译后修饰、羟基化、乙酰化和磷酸化的调节[5]。HIF-1α 成为许多适应低氧微环境疾病的主要参与者,如癌症、中风和心脏病[6]。因此,阻断HIF-1α 的表达或阻断其相互作用的蛋白质会抑制肿瘤生长[7]。HIF-1α 在肿瘤组织中表达增高,一方面与肿瘤组织增生过快造成局部组织缺氧有关,另一方面,HIF-1α 是多种依赖氧张力的调节因子[8],与某些癌基因激活或抑癌基因失活有关。因此,HIF-1α 的表达量可作为检测恶性肿瘤的标准。
黑色素瘤来源于黑色素细胞,是一种具有侵袭性的皮肤癌[9-10]。黑色素瘤虽然发病率不高,但其死亡率较高[11-12]。黑色素瘤多发于哺乳动物皮肤和黏膜,均具有侵袭性和致死性,且预后差[13-14]。HIF-1α 的表达与肿瘤的发生发展有关,研究其在黑色素瘤发病和发展机制中的作用对于改善患者的临床结果至关重要[15]。HIF-1α 介导不同过程的基因转录,包括应激适应、代谢、凋亡、肿瘤生长、血管生成和侵袭[16]。近年来研究还发现,HIF-1α 参与了PI3K/Akt/mTOR、Ras/RAF/MEK/ERK、JAK/STAT、Wnt/β-catenin、Notch 等信号通路[17-18],这些路径及其相关的复杂变化影响黑色素瘤的生长和发展、新陈代谢、运动和细胞凋亡[19]。
传统抗体药物分子较大,结构复杂,较易失活且价格昂贵。纳米抗体的优势在于分子小、渗透性强,能够针对传统单抗所不能触及的抗原表位设计药物,使其更好地到达肿瘤内部以及穿透血脑屏障[20]。因此,基于HIF-1α 表达受到抑制将发挥抗肿瘤功能,结合纳米抗体的优势,本研究以羊驼源黑色素瘤B16 噬菌体文库制备HIF-1α 纳米抗体,并验证其在黑素瘤的生长和发展过程中的作用,旨在为抑制肿瘤生长提供新思路。
1 材料和方法
1.1 试验材料
大肠杆菌TG1、辅助噬菌体M13K07、B16 细胞和羊驼源黑色素瘤B16 噬菌体文库、正常小鼠脑组织切片均由山西农业大学羊驼生物工程实验室保存提供。HIF-1α 多肽购自武汉三鹰生物科技有限公司。
1.2 试验方法
1.2.1 HIF-1α 纳米抗体的筛选 将HIF-1α 多肽稀释至终质量浓度为20 μg/mL,包被免疫管,4 ℃静置过夜,以备用。将TG1 接种于5 mL 2YT 培养基中,37 ℃、200 r/min 过夜振荡培养以活化。
将500 μL 噬菌体文库溶于100 mL 2YT/AG溶液培养基中,37 ℃、200 r/min 振荡培养至D600nm值为0.4~0.6;加入100 μL 辅助噬菌体,混匀静置30 min,再37 ℃、200 r/min 振荡30 min,弃上清,加入100 mL 2YT/AK 液体培养基重悬沉淀,30 ℃、200 r/min 振荡培养至过夜。次日,将TG1 接入30 mL 2YT 中,37 ℃、200 r/min 培养至D600nm=0.4备用。4 ℃、11 000 r/min 离心10 min,去上清加入1/5 体积遇冷的PEG/NaCl,冰上放置70 min。离心后用2.4 mL 无菌PBS 重新悬浮菌体沉淀,再次离心,回收上清加入事先包被20 μL/mLHIF-1α 多肽的免疫包被管中。37 ℃封闭1 h 后用PBS 冲洗,并加入三乙醇胺,缓慢振荡15 min,加入Tris-HCl中和。将其涂布于2YT/AG 平板,30 ℃培养过夜。次日收集菌落,作为HIF-1α 一级文库。
按上述方法,分别以10、5、2.5 μg/mL 的HIF-1α 质量浓度进行第2 轮、3 轮、4 轮的淘筛。从第4 轮筛选洗脱物滴定的平板上,随机挑取96 个单克隆接种于2YTAG 中与30 ℃振荡培养8 h,加入稀释的噬菌体,37 ℃振荡培养1 h 后离心,弃去上清用含有Kana 抗性的培养基重悬沉淀,37 ℃过夜培养。
将HIF-1α 蛋白和BSA 蛋白包被于96 孔板,用ELISA 法筛选阳性克隆并进行测序,比对测序结果,在NCBI基因库中选择VHH序列并用DNAMAN进行比对和ORF Finder 软件进行氨基酸序列分析,选取能够完整表达蛋白质的菌株,进行后续试验。
1.2.2 载体的构建 按阳性克隆的DNA 序列设计引物(含BamHI、SalI 酶切位点):HIF-1α-F:5'-CGGGATCCGAGTCGGGAGGAGGCTTGG-3';HIF-1α -R:5'-GCGTCGACTGAGGAGACGGT GACTAGGG-3'。
PCR 扩增反应体系为50 μL:2×Es Taq Master Mix 25 μL,上下游引物各2 μL,模板5 μL,ddH2O补至50 μL。PCR 反应条件:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,共35 个循环;72 ℃延伸10 min。
PCR 产物通过1.0%琼脂糖凝胶电泳胶回收,将回收产物和PMD19-T 连接,PMD-19T 反应体系为:PMD-19T 1 μL,回收产物4 μL,Solution Buffer 1 μL。之后再以BamHI、SalI 将19TNbHIF-1α 和pET-28a 进行双酶切并进行T4 连接(双酶切体系为:10×QuickCut Buffer 5 μL,BamHⅠ 1 μL,SalⅠ 1 μL,19TNbHIF-1α 质粒8 μL,ddH2O 35 μL;T4 连接体系为:回收菌体质粒6 μL,回收载体2 μL,T4 连接酶1 μL,T4Buffer 2 μL,ddH2O 9 μL,将连接产物转化至E.coliDH5α,涂布于含100 μg/mL Kana 的LB 平板上37 ℃培养过夜,挑取单克隆接种于LB-Kana 液体培养基摇至D600为0.4~0.6 后测序,将测序结果正确的质粒命名为pET28a-NbHIF-1α。
1.2.3 HIF-1α 纳米抗体表达与纯化 将5 μL pET28a-NbHIF-1α 提取质粒,将该质粒转入BL21(DE3)中,冰浴30 min,42 ℃热激45 s,再冰浴3 min,37 ℃、200 r/min 振荡活化1 h,菌液接种于LBKana 液体培养基中,37 ℃、200 r/min 振荡至D600为0.6,加入0.3 mmol/L 的异丙基-β-D-硫代半乳糖苷(IPTG),28 ℃、200 r/min 摇菌4 h 后收菌,将菌液沉淀用PBS 清洗2 次后超声破碎,16 000 g 离心30 min。使用AKTA 层析系统与镍离子金属螯合亲和层析介质(Ni-NTA)预装柱对带有His 标签的纳米抗体进行纯化,分别用不同梯度咪唑和分子筛除去杂蛋白,将蛋白用超滤管浓缩后分装,-80 ℃保存。
1.2.4 HIF-1α 纳米抗体的应用 将6 周龄正常小鼠脑组织研磨后提取总蛋白后进行SDS-PAGE 电泳,将纯化的HIF-1α 纳米抗体作为一抗、HRPHis-Tag 作为二抗进行Western Blot 检测脑组织中HIF-1α 蛋白的表达。
将制备的小鼠脑组织制备石蜡切片经脱蜡、抗原修复,然后在3%双氧水中室温孵育30 min。用PBS 洗涤后,用5%BSA 在37 ℃封闭1 h,然后与纯化的纳米抗体或PBS(空白对照)孵育,之后于37 ℃在His-tag 抗体孵育1 h。DAB 显色,随时观察停止显色,然后用苏木精复染,脱色封片,检测小鼠脑组织中HIF-1α 表达分布。
1.2.5 HIF-1α纳米抗体对黑素瘤细胞增殖的影响待B16 细胞在培养皿中长到80%~90%,与HIF-1α 纳米抗体加入96 孔板中,并保证每孔2 000 个,37 ℃、5%CO2培养箱中待6 h 后,在每孔中加入10 μL CCK-8 工作液,检测0、3、6、9 h 的450 nm 波长的吸光度。
1.2.6 HIF-1α 纳米抗体对黑素瘤细胞迁移的影响 将培养到80%~90%的B16 细胞传代至12 孔板中,待细胞长满12 孔板后,使用直尺与100 μL 枪头在12 孔板划平行线,用PBS 缓冲液洗净残留细胞。试验组加入HIF-1α 纳米抗体。分别在划痕0、12、24、36 h 后对同一位置进行拍照,观察细胞迁移结果。
1.2.7 HIF-1α 纳米抗体对增值相关蛋白表达的影响 选取培养状态良好且培养到80%~90%的丰度,细胞传代到6 孔板中,试验组和对照组各3 个孔。试验组中加入HIF-1α 抗体,放入培养箱中进行过夜培养。培养至对数生长期,收集细胞,提取细胞总蛋白。用所提蛋白进行Westen Blot 检测,以β-actin为内参,检测细胞中Ras、RAF1、ERK1/2、RAC1 和VEGF 蛋白表达量。
2 结果与分析
2.1 HIF-1α 纳米抗体的筛选及序列特征
通过对阳性克隆的序列进行比对,筛选出6 个VHH 序列。经过ELISA 法对6 个阳性克隆进行抗原结合力检测,选取1A12 作为候选克隆(表1)。1A12 的核苷酸序列与NCBI 数据库中的VHH 序列相似性达到78%(图1-A),通过对1A12 克隆的氨基酸序列分析,发现该序列没有形成跨膜区(图1-B),为亲水性蛋白(图1-C)。1A12 的氨基酸序列由88 个氨基酸构成,含有完整的4 个框架区(FR1~FR4)和3 个高度可变抗原结合区即互补决定区(CDR1~CDR3),其中CDR3 是抗原特异性识别的区域,含有11 个氨基酸(图1-D)。
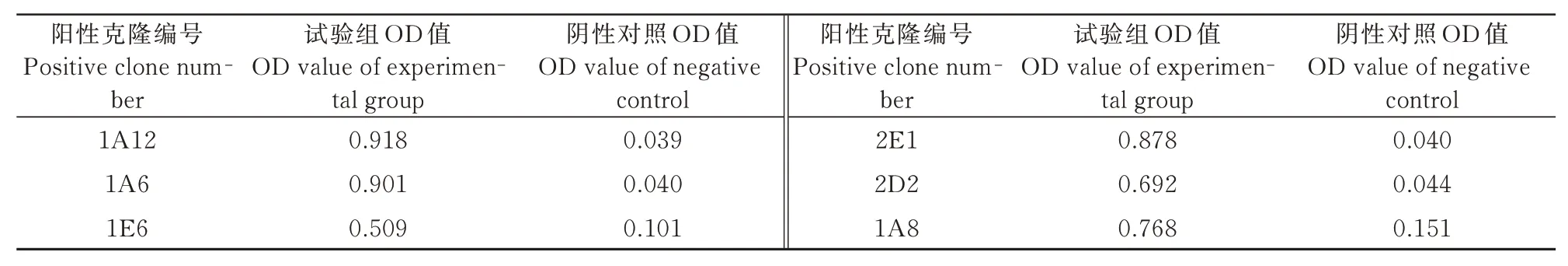
表1 HIF-1α 单克隆ELISA 筛选结果Tab.1 Monoclonal screening of HIF-1α by ELISA
2.2 纳米抗体表达、纯化与结合性检测
以挑选出的VHH(1A12)序列质粒为模板进行PCR,扩增出大小约为400 bp 的VHH 片段(图2-A)。将VHH 片段与PMD19-T 连接后再连接到pET-28a 表达载体上以构建质粒(图2-B)。

图2 质粒的构建Fig.2 Construction of the plasmid
构建的质粒经原核表达和纯化后,用考马斯亮蓝染色以及Western Blot 进行鉴定,结果发现,考马斯亮蓝染色得到的条带较单一(图3-A);Western Blot 检测发现大小约为16 ku 的特异性条带(图3-B),说明该蛋白为表达所得的特异蛋白。
选取小鼠脑组织,免疫组织化学一抗试验组用HIF-1α 纳米抗体,用PBS 作对照,可看出大脑组织中的免疫阳性信号(图3-C),由此可见,HIF-1α 纳米抗体可以与抗原HIF-1α 结合,用于HIF-1α 的组织定位。
Western Blot 试验中一抗用纯化所得的HIF-1α 纳米抗体,选取小鼠脑组织提取蛋白,结果显示,HIF-1α 纳米抗体作为一抗可以与抗原HIF-1α 结合,检测到特异性的免疫阳性条带,分子质量约为100、120、130 ku(图3-D),说明脑组织中表达HIF-1α。由此可知,制备的HIF-1α 纳米抗体可用于Western Blot 试验的一抗以检测组织中HIF-1α 抗原表达的相对定量。
2.3 HIF-1α 纳米抗体对黑色素瘤细胞增殖、迁移及其相关蛋白表达的影响
将HIF-1α 纳米抗体加入B16 细胞培养基中,用CCK-8 法检测并观察对B16 细胞增殖的影响,结果显示,在HIF-1α 纳米抗体作用下,在3~9 h 内,加入HIF-1α 纳米抗体的B16 细胞表现出了抑制效果(图4-A)。将HIF-1α纳米抗体加入B16细胞培养基中,用细胞划痕试验检测HIF-1α 纳米抗体对B16细胞迁移的影响。B16 细胞在培养0、12、24、36 h 检测,在12 h 时已出现抑制细胞迁移现象(图4-B)。
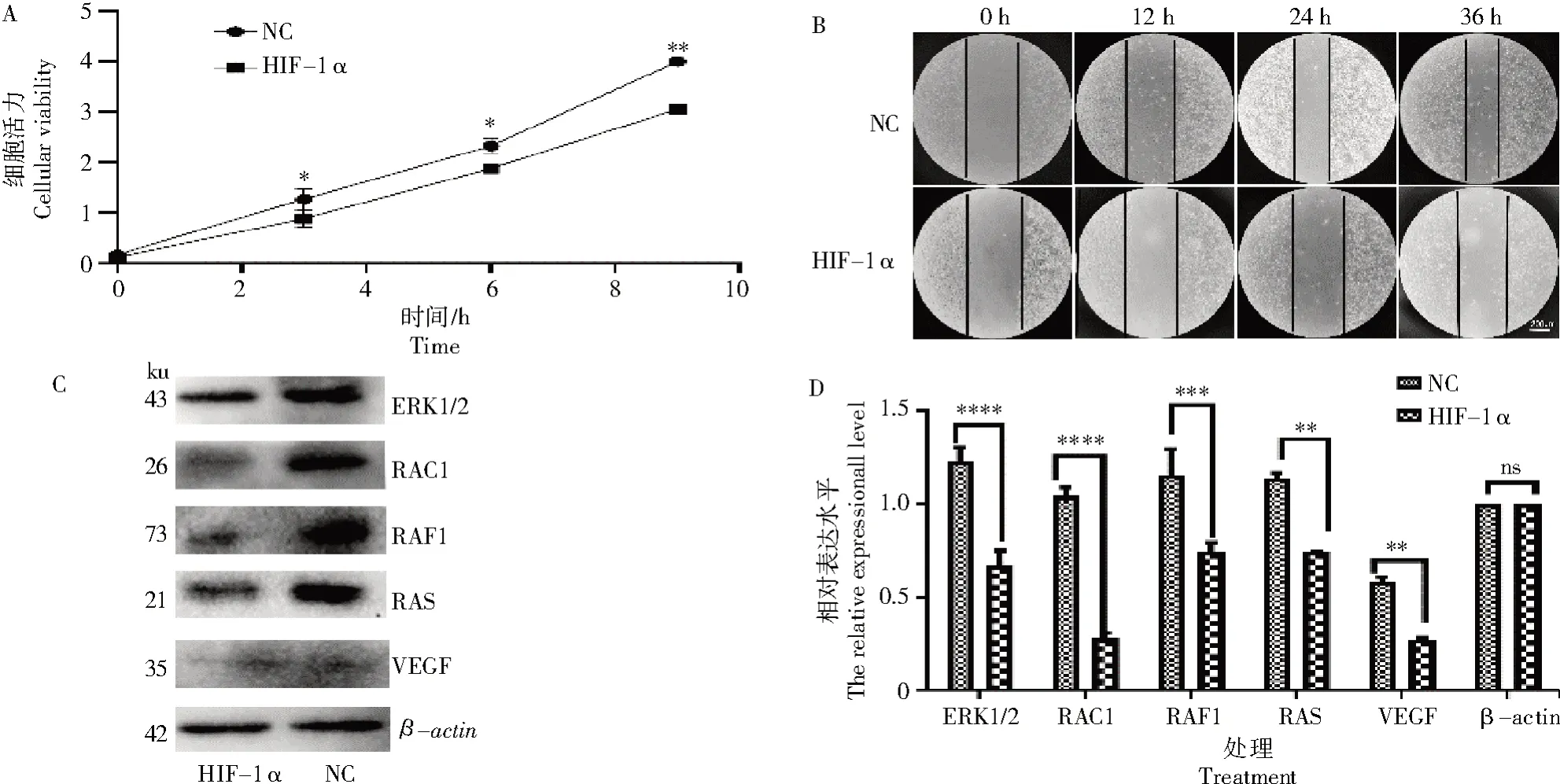
图4 HIF-1α 纳米抗体对B16 细胞增殖、迁移及其相关蛋白表达的影响Fig.4 Effects of HIF-1α nano-antibody on proliferation,migration,and expression of the related proteins in B16 cells
在CCK-8 法检测HIF-1α 纳米抗体抑制B16细胞增殖的基础上,提取HIF-1α 纳米抗体处理15 h后的B16 细胞总蛋白,用Western Blot 检测VEGF、RAS、ERK、RAC 和RAF 蛋白的表达量,与对照组相比,HIF-1α 纳米抗体处理B16 细胞后其蛋白量均呈下降趋势(图4-C、D)。
3 结论与讨论
HIF-1α 亚基是碱性-环-螺旋(basic-helixloop-helix, Bhlh)–PAS(per/ARNT/Sim,PAS))超家族成员之一[21],HIF-1α 位于多种致癌和抑癌途径的交汇点,包括PI3K/AKT 和MAPK/ERK 信号通路,而这些信号通路是分子信号网络的核心,控制着许多细胞的生长、增殖、分化和生存,而肿瘤组织常高表达HIF-1α[22-23]。通过多种方式抑制HIF-1α 的表达有望成为治疗黑色素瘤的方法。
本研究通过已建立的羊驼源黑素瘤噬菌体文库,以HIF-1α 多肽进行4 轮淘筛,筛选出1 株阳性单克隆菌株,经过原核表达载体构建并诱导表达目的蛋白,镍柱纯化得到HIF-1α 纳米抗体。所得的纳米抗体抗原特异性识别区域CDR3 含有11 个氨基酸残基超过了传统抗体CDR3 的平均长度(7~9 个氨基酸残基),可增大与抗原的接触面积,因此其与抗原具有较好的亲和性。VEGF 家族是一类血管调节因子[24],新生血管生成是肿瘤转移的潜在机制之一,血管参与加速肿瘤生长、促进肿瘤转移等过程[25]。在黑素瘤细胞中,HIF-1α 纳米抗体穿过细胞膜进入胞质中,与HIF-1α 结合后,抑制VEGF 下游靶基因表达,并抑制Ras 信号路径中关键基因的表达,同时使黑素瘤细胞中ERK 和P-ERK 表达下调,ERK 是丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)家族成员之一,该酶被激活后,成为磷酸化的ERK(P-ERK)。p-ERK 可以介导信号由胞浆向胞核传递,参与调节细胞的生长、发育、分化、分裂等多种生理过程,其异常表达在细胞的恶性转化和肿瘤的发生发展中起重要作用[26]。并且发现HIF-1α 纳米抗体在黑素瘤细胞中引起RAF1 表达下调,通过PLC-γ-PKC-Raf-MEKMAPK 信号通路使细胞增殖和迁移速度下降[27]。此外,在肿瘤组织中,由于新生血管管壁仅有1 层内皮细胞,缺乏基底膜,内皮细胞间常有裂隙,同时VEGF 本身可提高血管通透性,并刺激内皮细胞释放胶原酶使肿瘤细胞与肿瘤组织分离脱落,为肿瘤的转移创造了条件[28]。因此,HIF-1α 纳米抗体在黑素瘤组织中可能会通过抑制血管形成而成为抑制肿瘤生长和发展的新材料。
本研究获得的HIF-1α 纳米抗体分子质量约为16 ku,没有跨膜结构,具有亲水性。HIF-1α 纳米抗体在构建原核表达载体时加入了His 标签,将HIF-1α 纳米抗体作为Western Blot 和免疫组织化学技术中的一抗,与组织细胞中的HIF-1α 特异性结合,使用HRP-His-tag 抗体作为二抗,来检测HIF-1α在组织中的含量及分布。将自备的HIF-1α 纳米抗体作用于B16 细胞时,HIF-1α 纳米抗体与HIF-1α结合,直接影响下游靶基因VEGF,并引发该信号通路的下调,抑制B16 细胞的增殖和迁移,揭示其可能在黑色素瘤增殖、侵袭和转移中发挥着较为重要的作用,可作为基因治疗黑色素瘤的靶点。
