角叉菜胶诱导大鼠血瘀证模型再评价❋
2023-12-15姚明江付国静樊雪鸣杜琬晴迟显苏高云霄刘红喜刘建勋张允岭
刘 悦,姚明江,2,3,付国静,樊雪鸣,杜琬晴,迟显苏,高云霄,2,3,张 震,刘红喜,刘建勋,2,3△,张允岭△
(1.中国中医科学院西苑医院,北京 100091;2.中国中医科学院西苑医院基础医学研究所,北京 100091;3.北京市中药药理重点实验室,北京 100091)
血瘀证是临床常见的中医证候。明代王肯堂《证治准绳·杂病·蓄血篇》曰“百病由污血者多”,指出瘀血致病广泛,病证错综繁多。现代多种疾病如心脑血管疾病、恶性肿瘤、内分泌及代谢疾病、免疫系统疾病等皆以血瘀为发病基础[1-4]。中医学认为,正气亏虚、寒热暑湿、食滞痰浊、情志刺激等病理因素皆可引起血行不畅,如气虚无力推动血行则致气虚血瘀,寒邪凝滞血脉则致寒凝血瘀、肝气郁结,气血运行不畅,则致气滞血瘀[5]。近年来,血瘀证的临床和基础研究不断深入,成为中医及中西医结合研究的热点领域。而血瘀证动物模型的制备也在摸索中不断丰富和完善,无疑成为助力血瘀证现代化研究的重要载体和手段。
从与血瘀相关的异常的病理机制切入制备模型是目前构建血瘀证动物模型的常见思路[6]。角叉菜胶(Carrageenan,Ca)是从海藻提取的含硫酸多糖物质,因其致炎活性常被用来制备炎症及血瘀模型。近年来不乏有利用角叉菜胶诱导动物血瘀证模型的报道,但目前仍缺乏一套具有系统性、科学性、全面性的涉及中医血瘀证候宏观表征、现代医学微观指标及组织病理相协同的血瘀证动物模型评价体系。因此,本研究采用腹腔注射不同剂量角叉菜胶的方法,考察血瘀证模型制备的关键环节,以期为血瘀证相关研究工作提供最佳动物模型。本研究经中国中医科学院西苑医院伦理委员会审批通过,批号2021XLC011-2。
1 材料
1.1 实验动物
SPF级雄性SD大鼠120只,体质量(200~220)g,购自北京维通利华有限公司。动物许可证号:SCXK(京)2018-0018。将大鼠置于22~24 ℃恒温环境,湿度控制在50%~60%。自由摄食、饮水。
1.2 主要试剂
角叉菜胶(上海麦克林生化科技有限公司,货号C804872);多聚甲醛固定液(武汉赛维尔生物科技有限公司,货号G1101);二磷酸腺苷(adenosinediphosphate, ADP)诱聚剂(法国HYPHEN BioMed公司,货号:F2000702);苏木素-伊红(hematoxylin and eosin,HE)染色试剂盒(北京中科万邦生物科技有限公司,货号20211202)。
1.3 主要仪器
激光散斑血流监测视频系统(瑞典PERIMED公司,型号PeriCam PSI HR);数码相机(尼康光学仪器有限公司,型号D90);全自动血流变测试仪(北京赛科希德科技股份有限公司,型号SA6600);血小板聚集检测仪(江苏英诺华医疗技术有限公司,型号PL-12);正置智能型显微镜及采集系统(奥林巴斯中国有限公司,型号BX53)。
2 方法
2.1 药物制备
用0.9% 氯化钠溶液将角叉菜胶配成不同浓度溶液,等体积给药。现配现用。
2.2 动物分组及造模方法
按照体质量将120只大鼠随机分为4组,每组30只,即:正常对照组(N),角叉菜胶5 mg/kg剂量组(低剂量组),角叉菜胶10 mg/kg剂量组(中剂量组),角叉菜胶20 mg/kg剂量组(高剂量组);每组再分为24 h和48 h两个亚组,每亚组15只。
造模方法:模型低、中、高各剂量组分别腹腔注射相应剂量角叉菜胶,正常对照组腹腔注射等体积0.9%氯化钠溶液。
2.3 检测指标及方法
分别于造模后的24 h和48 h,检测以下指标。
2.3.1 动物一般情况 观察大鼠的一般体征,包括活动情况、精神状态、饮食情况、毛色等。
2.3.2 大鼠黑尾长度 各组大鼠用2%戊巴比妥钠腹腔麻醉,在相同角度和光线下采用数码相机对大鼠尾部进行图像采集。后期用Image-Pro-Plus 6.0软件对图像进行处理分析,测量黑尾长度。
2.3.3 尾端血流灌注量 采用激光散斑血流监测视频系统检测大鼠尾端血流灌注量。将光标聚焦于大鼠尾尖上1 cm处,开始观察并记录尾端血流灌注量,生成激光血流灌注散斑图像,使用配套软件PIM Soft分析各组大鼠尾端平均血流灌注量。
2.3.4 舌象采集 大鼠呈仰卧位,在固定光源、固定拍摄环境及固定光照强度下,用镊子将老鼠舌尖轻轻拉出,将舌根暴露出来,将比色卡置于舌旁,数码相机固定焦距,对大鼠舌象进行拍摄。图像采集后用Photoshop图像处理软件进行图像分析,选取舌面固定3个点,分别读取像素区域的R(红色)、G(绿色)、及B(蓝色)分量值,取平均值。舌象色彩饱和度分析参照文献方法[7-8]。
2.3.5 血液流变学指标检测 大鼠腹主动脉采血5 mL于肝素抗凝管中,按照SA6600全自动血流变测试仪检测方法检测样本低、中、高切全血黏度值。
2.3.6 血小板聚集率检测 大鼠腹主动脉采血2 mL于3.8%枸橼酸钠抗凝管。按照PL-12血小板聚集检测仪检测方法对大鼠血小板聚集率进行检测。
2.3.7 尾组织病理学 从距大鼠尾尖3 cm处,截取鼠尾,采用组织固定液固定,经脱钙处理后,石蜡包埋,按鼠尾横截面进行切片,HE染色,显微镜下观察各组鼠尾病理形态变化。
2.4 统计学方法

3 结果
3.1 大鼠一般情况
正常对照组大鼠一般情况良好,饮食正常,活动自如,精神状态良好,毛发柔顺有光泽。低剂量组在造模48 h后可见皮毛疏松,其余未见明显异常。中剂量组及高剂量组大鼠在造模后24 h和48 h出现活动减少,进食减少,皮毛疏松无光泽,毛发直立,耳廓脉络紫暗等体征。
3.2 模型组黑尾长度比较
造模后24 h,模型低、中、高剂量组均出现黑尾,且黑尾长度依次增长,高剂量组较低剂量组黑尾长度显著增长(P<0.01);造模后48 h,中剂量组和高剂量组较低剂量组黑尾长度明显增长(中剂量组:P<0.01;高剂量组:P<0.05)。整体来看,低剂量组和中剂量组造模后48 h较造模后24 h黑尾长度显著增长(P<0.01)。见表1、图1。
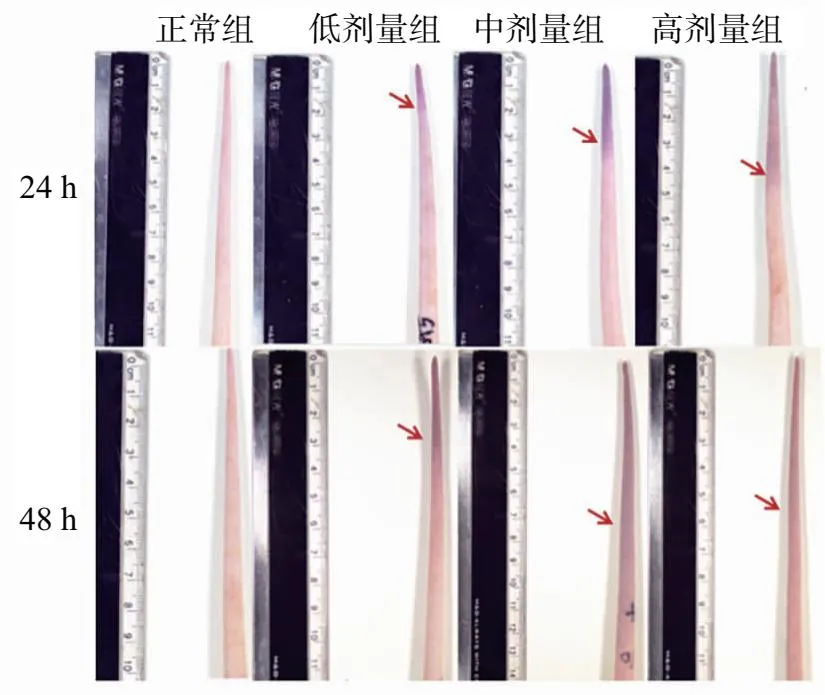
图1 各组大鼠黑尾图片

表1 各组大鼠黑尾长度比较
3.3 各组尾端血流灌注量比较
血流灌注量图像中红色像素点多代表单位面积内血流量充盈,绿色和蓝色代表单位面积内血流量减少。如图3所示,正常组红色像素点较多,尾端血流充盈。造模后24 h及48 h,模型组各剂量组较正常组尾端血流量显著降低(P<0.01),模型各组之间差异无统计学意义。整体来看,造模后24 h和造模后48 h模型各组之间尾端血流灌注量差异无统计学意义。见图2、图3。
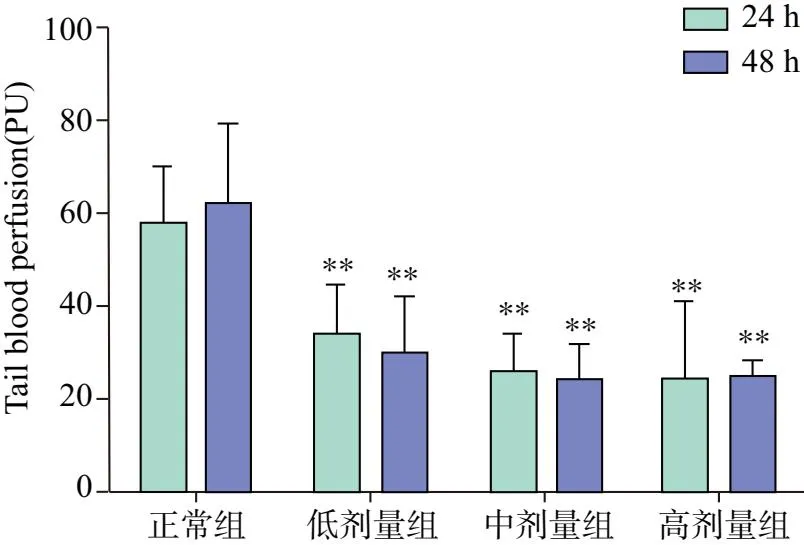
注:与正常组比较**P<0.01图2 各组尾端血流灌注量比较

图3 各组尾端血流灌注量图片
3.4 舌象RGB分析
舌象RGB色彩模式分析结果显示,造模后24 h,模型组各组大鼠舌象R值和B值较正常组显著下降(R值:P<0.01,B值:P<0.05),中剂量组和高剂量组大鼠舌象G值较正常组明显降低(中剂量组:P<0.05,高剂量组:P<0.01);与低剂量组比较,中剂量组和高剂量组大鼠舌象R值明显下降(P<0.05)。造模后48 h,与正常组比较,模型组各组大鼠舌象R值显著下降(P<0.01),中剂量组和高剂量组舌象G值和B值较正常组明显下降(P<0.05);与低剂量组比较,中剂量组和高剂量组大鼠舌象R值明显下降(P<0.05)。见图4、图5及图6。

图4 各组大鼠舌象采集照片
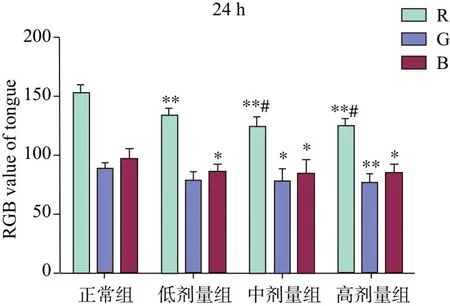
注:红(R);绿(G);蓝(B);与正常组比较*P<0.05,**P<0.01;与低剂量组比较#P<0.05图5 24 h大鼠舌象RGB色彩模式分析结果

注:红(R);绿(G);蓝(B);与正常组比较*P<0.05,**P<0.01;与低剂量组比较#P<0.05图6 48 h大鼠舌象RGB色彩模式分析结果
3.5 血液流变学指标变化
血液流变学指标检测结果显示,造模后24 h,与对照组比较,中剂量组和高剂量组的全血黏度(低、中、高切)显著升高(P<0.01),低剂量组全血黏度(中、高切)明显升高(P<0.05);造模后48 h,中剂量组和高剂量组的全血黏度(低、中、高切)较对照组明显升高(P<0.05),低剂量组全血黏度(低、中、高切)较对照组差异无统计学意义。见表2、表3。

表2 造模24 h后大鼠全血血流变结果比较

表3 造模48 h后大鼠全血血流变结果比较
3.6 血小板聚集率比较
血小板聚集率分析结果显示,造模后24 h,中剂量组和高剂量组血小板最大聚集率较正常组显著升高(中剂量组:P<0.01,高剂量组:P<0.05),而低剂量组较正常对照组差异无统计学意义。造模后48 h,与正常对照组比较,中剂量组和高剂量组血小板最大聚集率显著升高(中剂量组:P<0.05,高剂量组:P<0.01),而低剂量组较正常对照组差异无统计学意义。见表4。

表4 大鼠血小板最大聚集率结果比较
3.7 尾组织病理
正常组大鼠尾部血管壁光滑,管壁较厚,未见炎性细胞浸润,组织间隙无水肿。低剂量组可见少量炎性细胞;中剂量组和高剂量组可见大量炎性细胞浸润,组织间隙水肿,管壁较薄,红细胞溢出。见图7。
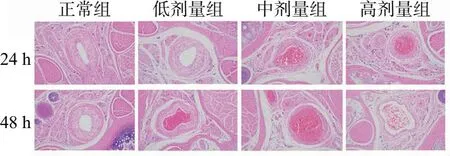
图7 大鼠尾组织病理切片图(HE染色,×20)
4 讨论
模型评价是证候模型研究的核心[9]。中医理论认为“有诸内,必形于诸外”。中医证候宏观上表现为形之于外的症状与体征,微观上表现为体内组织、细胞、分子等不同层面的生物学变化[10]。因此,将中医证候宏观表征、现代医学微观指标及组织病理形态学相协同评价动物模型,则有助于模型的制备更具科学性和可信度。
临床上多种疾病的发生发展都伴随有血瘀症状[11]。瘀血阻内,血行不畅,气机升降失调,临床上患者常有精神萎靡、纳食减少、肌肤甲错、舌暗淡等症状;瘀阻于肢体肌肤,又可见局部肿痛、瘀斑形成。本研究利用不同剂量的角叉菜胶诱导大鼠血瘀证模型,并在造模后的24 h和48 h两个不同时间点对模型进行综合评价。将大鼠行为活动异常、皮毛疏松无光泽、黑尾、舌质暗淡作为评判血瘀证的宏观表征。研究结果显示,模型中剂量组及高剂量组大鼠在造模后24 h和48 h均出现活动减少,进食减少,皮毛疏松无光泽,毛发直立,耳郭脉络紫暗等体征,提示中剂量组及高剂量组大鼠有明显的血瘀表现。舌象RGB值可作为评价中医证候的重要参考指标[12]。结果显示,模型中剂量组及高剂量组在造模后24 h及48 h舌象R、G、B值较正常组显著下降,说明中剂量组及高剂量组大鼠舌象偏暗淡,符合“血瘀”征象。此外,在造模后24 h和48 h,模型低、中、高剂量组均出现不同程度的黑尾。且在造模后48 h,中剂量组和高剂量组较低剂量组黑尾长度明显增长。提示中剂量组及高剂量组血瘀征象更为明显。
大量基础研究表明,血瘀证的生物学基础涉及微循环障碍、血液流变性异常、血小板功能损伤、炎症反应等病理环节[11]。本研究中,各组大鼠尾部血流灌注量结果显示,模型组各剂量组较正常组大鼠尾端血流灌注量显著降低。说明模型组大鼠体内存在明显的血行缓慢、血液瘀滞的状态。血液流变性是诊断血瘀证及评价活血化瘀药物功效的重要依据[13]。在造模后24 h和48 h,中剂量组和高剂量组的全血黏度(低、中、高切)较正常对照组均呈显著升高,提示中剂量组和高剂量组大鼠血液呈高黏、浓稠的状态。血小板聚集功能亢进是血栓形成的关键病理环节[14]。气滞血瘀与气虚血瘀大鼠模型研究显示,两种动物模型的血小板聚集率均较对照组显著升高[15]。本研究结果显示,造模后24 h和48 h,中剂量组和高剂量组血小板最大聚集率较正常组显著升高。此外,大鼠尾组织HE染色病理切片显示,中剂量组和高剂量组可见大量炎性细胞浸润,组织间隙水肿,且有大量红细胞溢出,符合角叉菜胶炎性病理损伤的特征。
综合以上研究结果,中剂量(10 mg/kg)及高剂量(20 mg/kg)角叉菜胶诱导的大鼠血瘀模型在造模后24 h和48 h呈现更稳定、更典型的血瘀征象。本次研究结果未呈现明显的量效关系和时效关系,这或许是客观情况的反映,同时也与本研究的样本量小、大鼠个体差异大等因素有关。因此,未来研究可扩大样本量,进一步验证此模型的构建方法和评价方法的可重复性及科学性。
本研究对不同浓度角叉菜胶诱导的血瘀证动物模型进行了科学、全面的评价,为研究者们提供了可供选择的造模剂量及可供参考的评价体系。研究者可在此基础上,构建以血瘀为基础的复合证候模型或病证结合模型,并从“方证相应”的角度,选用适宜的活血化瘀药物进行反证来验证证候属性[16]。同时,随着基因工程和多组学等先进技术的发展,未来研究可借助这些手段,充分挖掘血瘀证候蕴含的多层次的生物学基础和科学内涵,更好地助力血瘀证候模型的标准化和规范化研究。
