MRI列线图模型对软组织肉瘤病理分级预测价值
2023-12-14梁皓昱王鹤翔侯峰王童语李琪媛高传平
梁皓昱,王鹤翔,侯峰,王童语,李琪媛,高传平
(青岛大学附属医院,山东 青岛 266003 1 放射科; 2 病理科)
软组织肉瘤(STS)是一组罕见的、具有较高异质性的恶性间叶源性病变[1],病死率接近50%[2]。正确评估STS组织病理学分级对制定治疗计划和预测预后具有重要意义[3]。根据法国癌症中心联合会组织学分级系统,STS分为Ⅰ~Ⅲ级[4]。术前组织病理分级是能否进行新辅助化疗的重要临床依据,对于高级别STS(Ⅲ级)病人,术前新辅助化疗可提供额外治疗收益,改善病人预后;对于低级别STS(Ⅰ~Ⅱ级)病人,术前明确的组织病理分级可以避免化疗引起的各种潜在副作用[5]。经皮穿刺活检是目前最常见的STS术前病理学诊断方法,但受肿瘤内部异质性导致的穿刺抽样误差的影响,术前活检结果可能并不准确,进而对后续诊疗方案制定产生误导。因此,找到一种无创的术前STS分级预测方法以帮助病人制定准确有效的治疗方案至关重要。磁共振成像(MRI)因具有良好的组织分辨力,被广泛应用于STS术前评估,主要用于确定肿瘤侵犯范围[6-7]。既往研究多局限于分析MRI征象对STS病理分级的预测价值,并未构建相关列线图预测模型[8-9]。本文回顾性分析137例STS病人MRI图像,探讨STS的各种MRI特征与STS病理分级之间的联系,筛选STS分级预测因子,构建列线图预测模型,为术前评估STS病理分级提供依据。现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性收集2008年3月—2022年1月于青岛大学附属医院行STS切除术病人的MRI影像学资料。病人纳入标准:①术后病理证实为STS;②治疗前2周内行MRI检查,影像学资料完整,包含横断面T1WI、脂肪抑制T2WI(FS-T2WI)和对比增强T1WI(CE-T1WI);③根据术后病理标本获得明确的病理分级。病人排除标准:①MRI图像质量差,无法评估信号特征;②MR检查前接受过相关治疗。最终137例STS病人被纳入研究, 其中男86例, 女51例;年龄4~90岁, 中位年龄50岁。根据法国癌症中心联合会组织学分级系统,Ⅰ、Ⅱ级(低级别)STS 82例,Ⅲ级(高级别)STS 55例。
1.2 检查方法
MRI信息来源于5台设备,包括美国GE HDx 1.5 T、美国GE HDx 3.0 T、德国Siemens 3.0 T Magnetom Skyra、荷兰Philips Achieva 1.5 T及德国Siemens Prisma 3.0 T。MRI序列扫描参数为:横断位T1WI(TR 500~600 ms, TE 10~15 ms),横断位FS-T2WI(TR 2 400~4 500 ms, TE 70~120 ms),横断位CE-T1WI(TR 500~600 ms, TE 10~15 ms)。3个序列层厚为3~5 mm,层间距1 mm,矩阵320×320,FOV 200~400 mm。CE-T1WI扫描前用高压注射器静脉注射0.2 mL/kg Gd-DTPA(Magnevist, Bayer Healthcare Pharmaceuticals),注射造影剂后立即采集轴向图像。
1.3 图像分析及临床信息获取
MRI图像由2名工作5年以上放射科医师进行回顾性分析,评估结果不一致时通过协商达到一致。MRI征象评估内容包括:①病灶数量(单发或多发);②深度(浅或深,最大深度超过8 cm定义为深部病灶);③T1WI信号异质性(无或有,≥50%肿瘤体积信号不均匀定义为有异质性);④T2WI信号异质性(无或有,≥50%肿瘤体积信号不均匀定义为有异质性);⑤坏死信号(无、坏死信号<50%肿瘤体积或坏死信号≥50%肿瘤体积);⑥瘤周水肿(无、局限性或弥漫性);⑦增强后边缘清晰度(清晰边缘占>90%肿瘤周长、清晰边缘占50%~90%肿瘤周长或清晰边缘占<50%肿瘤周长);⑧瘤周强化(无或有);⑨部位(四肢、躯干浅表部、头颈部或腹盆腔)。收集病人临床资料,包括年龄、性别及术前TNM分期。根据第8版美国癌症联合委员会分期指南评估术前TNM分期,其中T分期代表原发肿瘤最大径(肿瘤最大径≤5 cm为T1期,5 cm<肿瘤最大径≤10 cm为T2期,10 cm<肿瘤最大径≤15 cm为T3期,肿瘤最大径>15 cm为T4期),N分期代表周围淋巴结转移情况,M分期代表远处转移情况。
1.4 预测模型构建
使用单因素Logistic回归分析筛选与高级别STS相关的临床和MRI特征,将P<0.05的临床和MRI特征输入多因素Logistic回归分析。多因素Logistic回归中P<0.05的特征被选为STS病理分级预测因子,纳入用以构建预测模型,并生成列线图。基于10折交叉验证,验证模型预测效能,采用中位受试者工作特征曲线下面积(AUC)及中位准确度评价列线图模型的预测性能。采用校准曲线和决策曲线评估预测模型的校准度和临床适用度。
1.5 统计学分析
采用IBM SPSS Statistics Version 25软件进行统计学处理。不符合正态分布的资料用M(Q25~Q75)表示,数据间的比较采用Mann-WhitneyU检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。预测模型构建、列线图绘制和模型性能评估使用R软件(版本4.1.0)。
2 结 果
2.1 病理学诊断
病理诊断结果见表1。黏液样脂肪肉瘤、黏液样纤维肉瘤、平滑肌肉瘤和骨外骨肉瘤约占低级别STS的55%(45/82)。黏液样纤维肉瘤、多形性未分化肉瘤、黏液样脂肪肉瘤、去分化脂肪肉瘤和未分化梭形细胞瘤约占高级别STS的62%(34/55)。
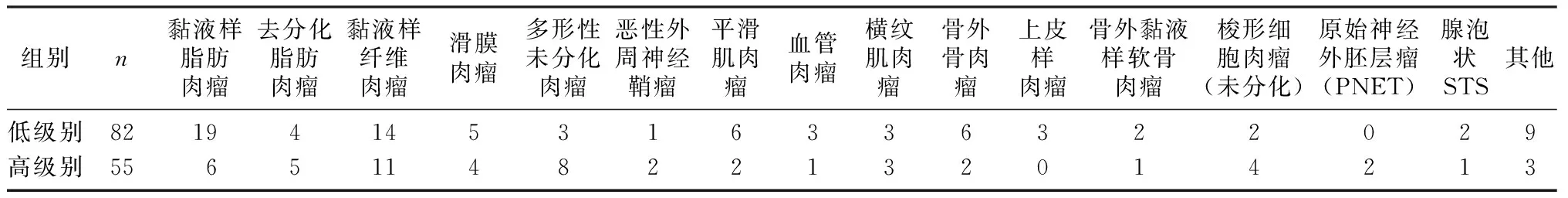
表1 137例STS的病理诊断(例)
2.2 STS病人临床和MRI特征
单因素分析结果显示,低级别、高级别STS病人性别及年龄差异均无统计学意义(P>0.05)。T分期、N分期、深度、T1WI信号异质性、T2WI信号异质性、坏死信号、瘤周水肿、增强后边缘清晰度、瘤周强化和部位在低级别、高级别STS间差异有统计学意义(χ2=5.354~38.349,P<0.05)。见表2。

表2 137例STS病人的一般资料(例)
2.3 预测模型构建和分析
单因素及多因素Logistic回归分析显示,N分期、深度、T2WI信号异质性及瘤周强化为STS分级预测因子(图1A~F),进一步被用于构建预测模型。见表3。该预测模型显示出了较好的预测效能,中位AUC为0.898,中位准确度为82.1%,中位敏感度为70.8%,中位特异度为89.3%,中位阳性预测值为81.0%,中位阴性预测值为82.7%。校准曲线和决策曲线显示,该预测模型具有较好的校准效率与临床适用度(图2)。基于该预测模型构建的列线图见图3。

A~C:低级别STS病人MRI特征。病人,男,59岁,平滑肌肉瘤,病理分级为低级别。A:横轴位T1WI,肿瘤位于右侧腓骨外侧肌间隙内;B:横轴位FS-T2WI,肿瘤信号异质性<50%肿瘤体积;C:横轴位CE-T1WI,无瘤周强化。D~F:高级别STS病人MRI特征。病人,女,60岁,黏液纤维肉瘤,病理分级为高级别。D:横轴位T1WI,肿瘤位于右侧大腿肌间隙内;E:横轴位FS-T2WI,肿瘤信号异质性≥50%肿瘤体积;F:横轴位CE-T1WI,瘤周强化。
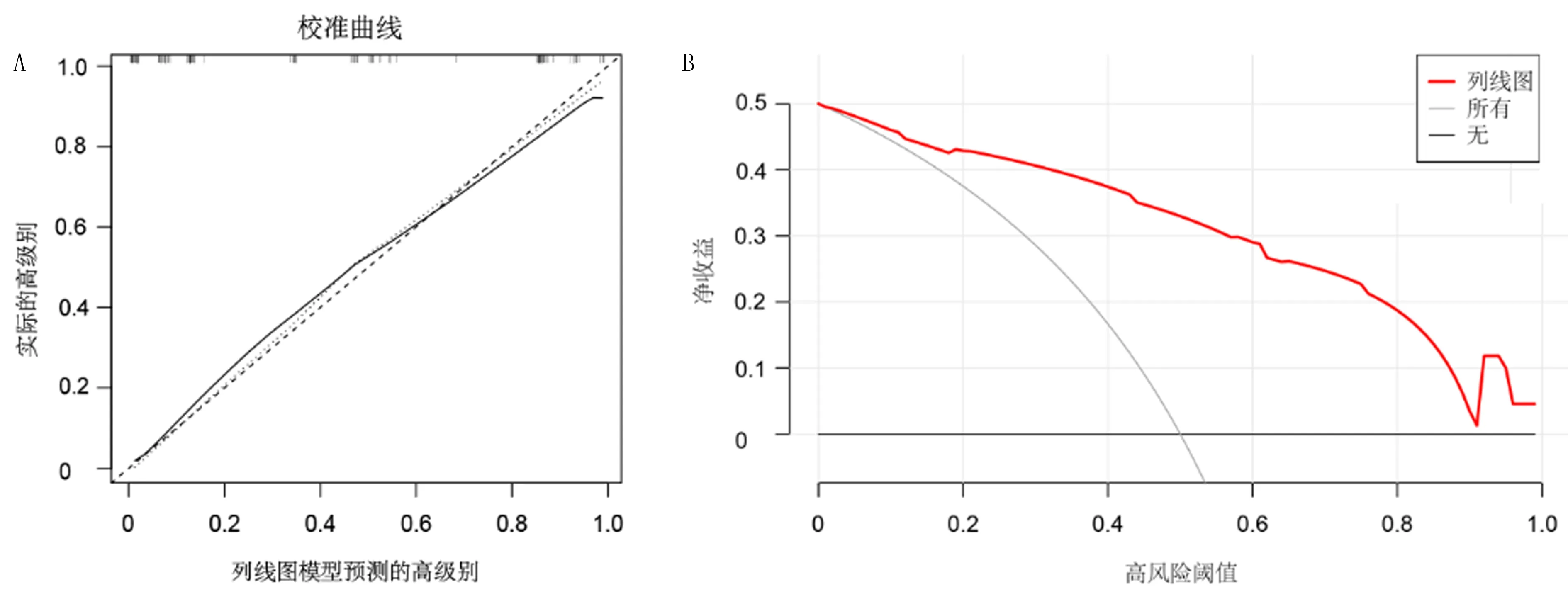
A:校准曲线;B:决策曲线。
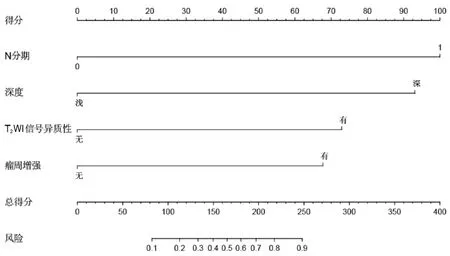
图3 基于术前MRI影像特征STS病理分级预测列线图

表3 单因素和多因素Logistic回归分析与STS病理分级相关的临床因素
3 讨 论
STS病理分级与病人的转移风险和总生存期密切相关,是评估STS病人能否从术前新辅助化疗获得治疗收益的最重要依据[10]。本研究基于临床及MRI特征构建的STS分级预测模型显示了较好的预测效能(交叉验证中位AUC为0.898,中位准确度为82.1%),具有较好的校准度及临床适用度,并生成列线图。列线图是该预测模型的可视化工具,通过读取病人每个高级别STS风险因子得分并累积总分,准确评估该病人STS病理分级为高级别的风险,可为病人临床治疗方案制定提供依据,具有较大的临床应用潜力。
本研究结果显示,4个临床及MRI特征可作为STS分级预测因子,高级别STS的风险预测因子为N1期、深部病灶、T2WI信号异质性≥50%肿瘤体积和瘤周强化。高级别STS通常体积更大,瘤体内异源性分化更严重,同时伴有更多的坏死区域[11],导致高级别STS在T2WI序列上表现更强的异质性;同时,高级别STS具有更强侵袭性的外围生长模式,外围血管增生更明显[12],导致瘤周强化。相关研究显示,T2WI信号异质性及瘤周强化是STS病理分级的独立预测因子[8-9],本研究结果与其一致。
周围淋巴结转移(N1期)被认为是STS侵袭和远处转移的风险因子,预示病人不良预后。COINDRE等[13]研究认为,高级别是STS最重要的转移风险及不良预后的风险指标。本研究结果表明,N分期与STS病理分级有显著关联,N1期是高级别STS的重要风险因子。病灶深度被认为是STS病人预后和远处转移的重要预测指标[3]。本研究结果显示,78.2%(43/55)的高级别STS位于深部,仅有37.9%(31/82)低级别STS发现于深部,可能的原因是位于深部的STS早期症状不明显,发现较晚,肿瘤进展时间较长,造成肿瘤异源性分化增多,从而进展为高级别STS。有研究发现,瘤周水肿高信号可有效鉴别低、高级别STS。本研究结果与其不同。瘤周水肿高信号产生的原因有二,一是单纯水肿,二是肿瘤细胞浸润,如果研究只评估MRI平扫图像而没有参考MRI增强图像,则不能有效鉴别瘤周水肿高信号产生的原因。本研究通过对比同层面FS-T2WI及CE-T1WI两个序列,将瘤周高信号鉴别并定义为瘤周水肿(代表单纯水肿)和瘤周强化(代表肿瘤细胞浸润)两个特征,并验证瘤周强化是高级别STS的有效预测因子。
术前新辅助化疗可显著改善高级别STS预后,因此,术前获得准确的STS分级对病人制定个体化治疗方案有重要意义。目前,术前获取STS分级的常规方法为影像介导下经皮穿刺活检。但是由于肿瘤异质性导致的抽样误差的存在,穿刺活检病理分级评估的分级可能会低于术后病理确认的病灶实际分级。本研究提出的预测模型具有较高的中位准确度(82.1%),较CROMBÉ等[9]提出的预测模型准确度(70.2%)更高,具有校正术前穿刺活检结果的潜力,可为病人治疗方案制定提供参考依据。
综上所述,基于术前MRI影像学特征的列线图模型可有效预测STS病理分级,为病人临床治疗方案制定提供依据,具有较大的临床应用潜力。本研究存在以下局限性:①本研究作为回顾性研究,难以避免选择偏倚;②本研究纳入的病例数较少,模型的泛化性有待进一步验证。在后续研究中,我们将采用多中心、大样本数据进行进一步分析研究,以验证本文结果的准确性。
