白藜芦醇对ox-LDL诱导的内皮细胞铁死亡影响
2023-12-14游福蓉杜占慧宗丽娟王勤拯张成邢泉生
游福蓉,杜占慧,宗丽娟,王勤拯,张成,邢泉生
(青岛大学附属妇女儿童医院,山东 青岛 266034 1 心脏中心; 2 普外科)
动脉粥样硬化(AS)是以脂质蓄积和炎症细胞浸润为主要特征的慢性炎症性过程,是冠心病、心肌梗死、脑卒中等众多心脑血管事件的病理基础[1-3]。AS发病机制复杂,与多种因素密切相关,其中内皮细胞功能障碍是AS发生发展的始动环节[4]。内皮细胞功能障碍有利于氧化低密度脂蛋白(ox-LDL)浸润至内皮下层,同时选择性招募单核细胞进入内皮下层转变为巨噬细胞,通过吞噬经理化修饰的脂蛋白形成泡沫细胞引发局部炎症反应,从而诱导AS的发生发展[3,5]。铁死亡是近年发现的一种铁依赖的新型细胞死亡方式,其特征是铁依赖的活性氧(ROS)和脂质过氧化物的蓄积、谷胱甘肽(GSH)的耗竭以及谷胱甘肽过氧化物酶4(GPX4)的失活等[1-2]。多项研究结果表明,铁死亡是内皮细胞功能障碍的重要原因,在推动AS进展中发挥了重要作用[3-4]。白藜芦醇为一种天然植物多酚,主要存在于葡萄、花生、虎杖、大豆等多种植物中,具有抗炎、抗肿瘤、抗病毒、延缓衰老等功效[6-7]。近年来研究发现,白藜芦醇可通过调节血脂水平、抗血小板聚集、抗炎、抑制低密度脂蛋白氧化修饰、抑制斑块内新生血管等作用发挥抗AS作用[8-10]。但有关白藜芦醇对血管内皮细胞铁死亡的影响尚未见报道。因此,本研究利用铁死亡诱导剂ox-LDL建立人脐静脉内皮细胞(HUVECs)铁死亡模型,探讨白藜芦醇对血管内皮细胞铁死亡的影响及机制,从而为明确中医药治疗AS疾病作用机制提供新的科学依据。
1 材料与方法
1.1 主要材料
HUVECs购自武汉普诺赛生命科技有限公司;内皮细胞培养液购自美国Sciencell公司;ox-LDL购自美国默克公司;白藜芦醇,分子式为C14H12O3,分子量228.24,纯度99.94%,购自美国MedChemExpress公司;ROS检测试剂盒购自中国白鲨生物有限公司;亚铁离子(Fe2+)检测试剂盒购自中国赛默飞世尔公司;GSH及丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;CCK-8溶液购自武汉Proteintech公司;兔抗GPX4以及鼠抗β-肌动蛋白(β-actin)单克隆抗体购自英国Abcam公司;兔抗铁蛋白重链(FTH1)单克隆抗体购自Abmart公司;兔抗溶质载体家族7成员11(SLC7A11)单克隆抗体、山羊抗兔lgG-HRP及山羊抗鼠lgG-HRP二抗购自美国Proteintech公司。
1.2 实验方法
1.2.1细胞培养及分组 HUVECs置于37 ℃、含体积分数0.05 CO2培养箱中,用内皮细胞培养液培养。将正常的HUVECs随机分为对照组(A组)、ox-LDL组(B组)及白藜芦醇低、中、高剂量组(C、D、E组)。A组在正常生长条件下培养,B组加入含有100 mg/L ox-LDL的内皮细胞培养液培养24 h,C、D、E组分别用白藜芦醇5、10、20 μmol/L预处理4 h后,更换为含有100 mg/L ox-LDL的内皮细胞培养液培养24 h。
1.2.2CCK-8法检测细胞存活率 取对数生长期HUVECs,以每孔5 000个接种于96孔板中,待细胞贴壁、按照实验分组加入相应药物处理后,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,应用酶标仪在450 nm波长下检测各孔的光密度(OD)值。然后计算细胞存活率,细胞存活率=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。每组设4个复孔,实验独立重复3次。
1.2.3细胞中Fe2+、ROS、MDA和GSH含量检测将HUVECs按每孔2×105个接种于6孔板内,在37 ℃、含体积分数0.05 CO2培养箱中培养24 h后,按照实验分组加入相应药物进行处理。收集各组细胞,使用Fe2+、ROS、GSH、MDA检测试剂盒测定细胞内Fe2+、ROS、GSH、MDA含量,实验步骤严格按照说明书进行。每组设3个复孔,实验独立重复3次。
1.2.4免疫印迹法检测细胞内GPX4、SLC7A11和FTH1蛋白表达 将HUVECs接种于6孔板,按照实验分组加入相应药物处理。收集各组细胞并提取总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳反应后,转膜、封闭,加入一抗(β-actin、GPX4、FTH1和SLC7A11,以1∶1 000抗体稀释液稀释)4 ℃孵育过夜,加入羊抗兔二抗(以1∶5 000抗体稀释液稀释)和羊抗鼠二抗(以1∶10 000抗体稀释液稀释)室温孵育1 h,洗去二抗,用ECL试剂盒显色,在凝胶成像仪上显影并拍照,用Image J软件分析条带灰度值。结果以目的蛋白与β-actin灰度值的比值表示。实验独立重复3次。
1.2.5免疫荧光法检测细胞内GPX4、SLC7A11和FTH1表达 将HUVECs按每孔2×103个接种于24孔板内,在37 ℃、含体积分数0.05 CO2培养箱中培养24 h后,按实验分组加入相应药物处理。用40 g/L多聚甲醛室温固定15 min,PBS浸洗,5 g/L Triton X-100透膜15 min,50 g/L BSA封闭1 h,去除封闭液,加入GPX4(应用1∶200抗体稀释液稀释)、SLC7A11(应用1∶200抗体稀释液稀释)以及FTH1(以1∶100抗体稀释液稀释)一抗4 ℃孵育过夜。用PBS洗净一抗后,加入荧光标记的羊抗兔二抗(以1∶200抗体稀释液稀释)室温避光孵育1 h。用PBS洗净二抗后,以DAPI染核10 min,用含抗荧光淬灭剂的封片液封片。荧光显微镜下观察并采集图像。应用Image J软件分析记录每张图片的平均荧光强度。实验独立重复3次。
1.3 统计学方法

2 结 果
2.1 ox-LDL和白藜芦醇对HUVECs存活率影响
CCK-8实验结果显示,ox-LDL浓度为50、100、150、200 mg/L逐渐升高时,HUVECs存活率逐渐降低。当ox-LDL浓度为100 mg/L时,与对照相比,细胞存活率为54.30%,差异具有统计学意义(F=655.08,P<0.01)。因此,为保证有足够活力的细胞进行后续实验,本研究选择100 mg/L ox-LDL干预24 h作为诱导细胞铁死亡的条件。见图1。与对照相比,5、10、20 μmol/L浓度的白藜芦醇对细胞存活率无明显影响(P>0.05),说明本实验中所用不同剂量的白藜芦醇对HUVECs无损伤作用。见图2。
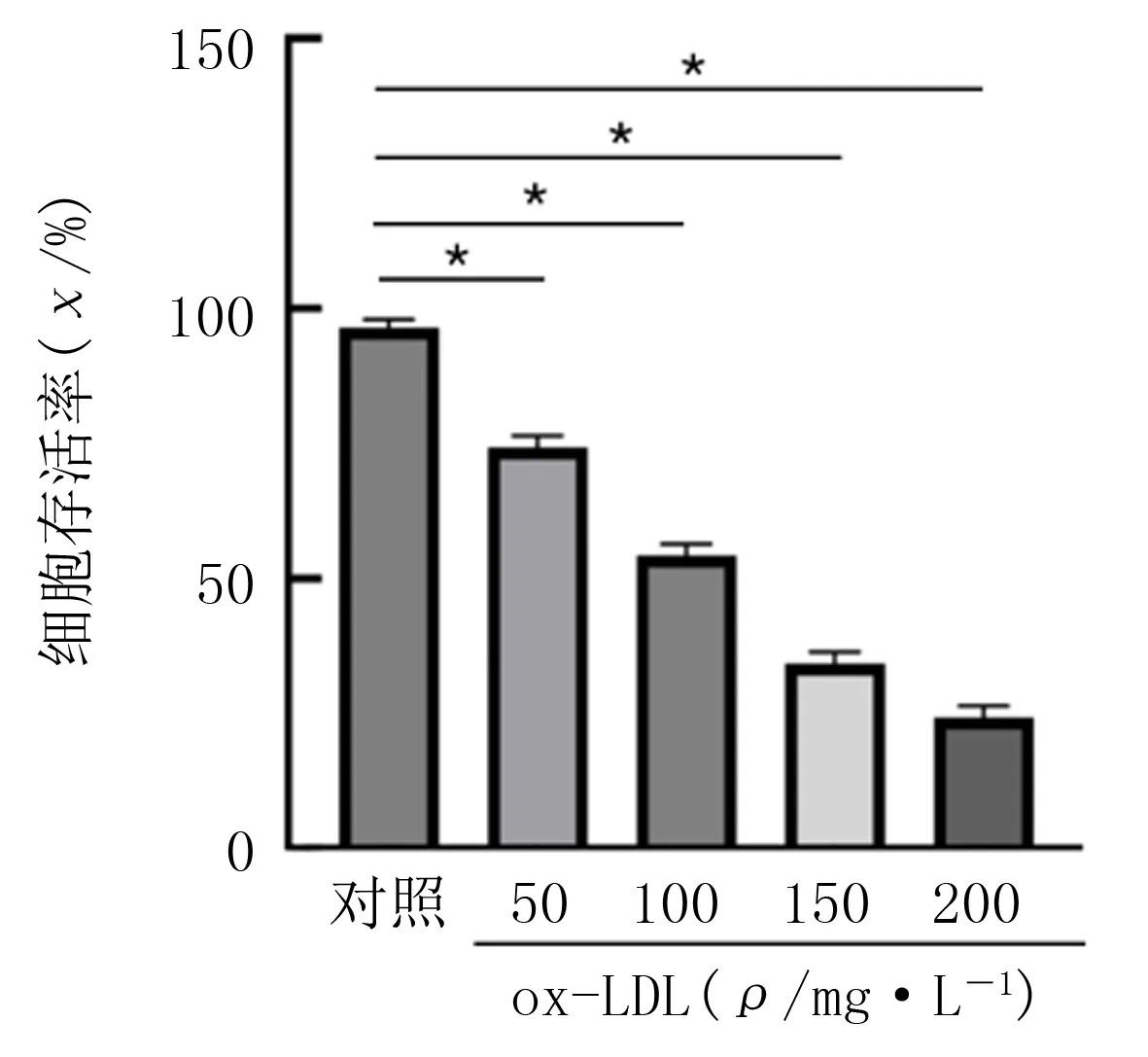
注:n=4,*P<0.01。

注:n=4,ns表示P>0.05。
2.2 白藜芦醇对ox-LDL诱导的HUVECs存活率的影响
CCK-8实验结果显示,各组HUVECs存活率差异具有统计学意义(F=200.00,P<0.01)。B组细胞存活率较A组显著降低(P<0.01);而经低、中、高剂量白藜芦醇预处理可减轻ox-LDL诱导的HUVECs损伤,并呈剂量依赖性,与B组比较,C、D、E组细胞存活率显著升高,差异具有统计学意义(P<0.01)。见图3。

注:n=4;与A组相比,*P<0.01;与B组相比,#P<0.01。
2.3 白藜芦醇对ox-LDL诱导HUVECs中ROS、MDA、GSH和Fe2+含量的影响
各组HUVECs中ROS、MDA、GSH和Fe2+含量比较,差异均有统计学意义(F=30.26~415.07,P<0.05)。与A组相比,B组HUVECs中ROS、MDA和Fe2+含量显著增加,而GSH含量显著降低(P<0.05);与B组相比较,C、D、E组HUVECs中ROS、MDA和Fe2+含量显著降低,GSH含量显著升高(P<0.05)。见表1。

表1 各组HUVECs中GSH、MDA、Fe2+和ROS含量的比较
2.4 白藜芦醇对ox-LDL诱导HUVECs中GPX4、FTH1和SLC7A11表达的影响
免疫印迹法检测结果显示,各组HUVECs中GPX4、FTH1和SLC7A11蛋白表达比较,差异均具有统计学意义(F=58.62~88.92,P<0.05)。与A组相比较,B组HUVECs中GPX4、FTH1以及SLC7A11蛋白的表达显著降低(P<0.05);与B组相比较,C、D、E组HUVECs中GPX4、FTH1和SLC7A11蛋白的表达显著增加(P<0.05)。见图4和表2。

表2 各组HUVECs中GPX4、FTH1和SLC7A11蛋白表达的比较

图4 免疫印迹法检测各组细胞中GPX4、FTH1和SLC7A11蛋白表达
免疫荧光法检测结果显示,各组HUVECs中GPX4、FTH1和SLC7A11表达比较,差异均有统计学意义(F=62.18~722.16,P<0.05)。与A组相比,B组HUVECs中GPX4、FTH1和SLC7A11蛋白表达显著降低(P<0.05);与B组相比,E组HUVECs中GPX4、FTH1和SLC7A11表达显著增加(P<0.05)。见图5和表3。

表3 各组HUVECs中GPX4、FTH1和SLC7A11表达的比较

A、B、C分别示A组、B组和E组GPX4的表达,绿色为GPX4染色,蓝色为DAPI荧光染色下的细胞核;D、E、F分别示A组、B组和E组FTH1的表达,绿色为FTH1染色,蓝色为DAPI荧光染色下的细胞核;G、H、I分别示A组、B组和E组SLC7A11的表达,绿色为SLC7A11染色,蓝色为DAPI荧光染色下的细胞核。白色箭头示目的蛋白表达区域。免疫荧光染色,100倍。
3 讨 论
随着社会老龄化加重及居民不健康生活方式增加,我国AS诱发的多种心血管疾病发病率、死亡率持续升高。AS发病机制复杂,主要与内皮细胞功能障碍、炎症反应、氧化应激、血栓形成及脂质浸润等密切相关[1-3]。目前逆转AS严重后果的疗法仍然有限。白藜芦醇作为多酚类植物化合物的代表,可以通过调节脂质代谢、抑制ROS生成、维持内皮功能稳定等来发挥抗AS作用。但白藜芦醇的具体作用机制至今尚未完全阐明。因此,本研究从铁死亡的角度来探讨白藜芦醇对AS的作用及其潜在机制。有研究表明,血管内皮细胞用ox-LDL处理后表现出铁死亡的特征,使用铁死亡抑制剂则明显逆转了细胞的死亡[11]。因此,本研究使用ox-LDL诱导HUVECs发生铁死亡。本文结果显示,ox-LDL处理后内皮细胞活力明显下降,出现铁死亡;经白藜芦醇(5、10、20 μmol/L)预处理可以降低细胞铁死亡,减少ROS和MDA产生,显著提高内皮细胞活力,且该效应随着白藜芦醇剂量增加而增强。这表明白藜芦醇对ox-LDL诱导的铁死亡有拮抗作用,从而可以延缓AS病程进展。
内皮细胞损伤是AS早期病理改变。有研究表明,铁死亡通过多种生理机制参与AS的内皮细胞损伤,如铁过载可以促进ROS产生并且激活局部肾素-血管紧张素系统,诱导血管内皮细胞中氧化应激水平升高,导致内皮损伤,增加AS斑块的不稳定性[12];铁死亡抑制剂通过减轻铁死亡引起的内皮细胞氧化损伤而发挥抗AS作用[3]。由此可见,铁死亡已成为调节内皮细胞功能的关键角色。
铁死亡是一种铁依赖的可调节的氧化性细胞死亡方式[13],在生物化学方面表现为细胞内抗氧化系统GSH/GPX4失活,过量的Fe2+通过芬顿反应产生大量的ROS,与细胞膜上的多不饱和脂肪酸发生氧化应激反应,导致脂质过氧化物积累,使MDA生成增多。本研究经ox-LDL处理的HUVECs中,Fe2+、ROS和MDA含量增加,FTH1和GSH水平下降;而白藜芦醇干预可降低细胞内Fe2+、ROS和MDA含量,提高FTH1和GSH的水平。MDA是ROS介导脂质过氧化生成的一种不饱和醛类物质,由于它与亲核化合物的反应性以及在没有活性的情况下,能使蛋白质和DNA发生反应,生成特殊的加合物而产生细胞毒性[14]。相关研究表明,MDA可以促进巨噬细胞产生炎症因子,从而加重血管周围的炎症反应并损伤血管内皮细胞,破坏内皮结构完整性并造成内皮功能障碍,促进AS的发生[15]。因此,MDA被认为是造成血管功能障碍的介质之一。GSH是体内的非酶抗氧化剂,可以作为硒依赖性GPX4的辅因子和底物来减少脂质过氧化物,在降低氧化应激水平中起着关键作用[16-19]。由此可见,白藜芦醇通过提高HUVECs抗氧化能力和降低MDA含量来减轻ox-LDL诱导产生的细胞损伤。铁蛋白为细胞提供了一种以氧化还原非活性形式锁住过量铁的手段,以防止铁介导的细胞和组织损伤。铁蛋白由铁蛋白轻链和FTH1构成,是一种储铁蛋白复合体,可调控储存的铁离子。FTH1在铁蛋白结构中起到关键作用,也是铁死亡发生的标志性蛋白,可催化Fe2+氧化发挥储铁功能进而减少细胞内Fe2+。FTH1水平降低导致体内Fe2+水平升高,过量的Fe2+会引起脂质代谢紊乱,导致ROS水平升高,促进铁死亡发生[18,20]。本研究结果表明,白藜芦醇能够通过调节氧化应激清除过量的Fe2+,抑制铁死亡的发生。
GPX4作为细胞内唯一可直接降低磷脂过氧化的抗氧化酶,是铁死亡的重要调节因子[21]。GPX4以GSH为还原剂,催化过氧化物的过氧键转变为羟基,将过氧化物转变为类脂醇,使其失去氧化活性,进而抑制铁死亡[16,22]。GSH和GXP4被认为是细胞发生铁死亡的标志物[23-24]。本研究结果显示,ox-LDL组HUVECs存活率降低,GSH含量降低,GPX4蛋白的表达下调;给予白藜芦醇预处理后,细胞存活率升高,GSH含量升高,GPX4蛋白表达上调,提示白藜芦醇可以减轻HUVECs铁死亡。
SLC7A11是胱氨酸/谷氨酸交换转运体(System Xc-)的底物特异性亚基,在抗氧化剂GSH的生物合成中起着核心作用。SLC7A11的活性被抑制会导致GSH合成减少,引发氧化损伤,最终导致铁死亡的发生。研究表明,System Xc-和GPX4的活性状态是调节铁死亡的关键机制[25]。有文献报道,高良姜素通过激活SLC7A11/GPX4轴抑制铁死亡,从而对脑缺血再灌注后沙鼠的海马神经元发挥保护作用;淫羊藿苷通过调节SLC7A11/GPX4信号通路抑制高糖诱导的小胶质细胞铁死亡;鹿红方通过SLC7A11/GPX4信号通路减轻心肌缺血再灌注损伤引起的心肌细胞铁死亡[26-33]。本研究结果显示,ox-LDL组HUVECs中,GPX4和SLC7A11蛋白的表达显著降低;而给予白藜芦醇预处理后,细胞中GPX4和SLC7A11蛋白的表达显著升高。由此推测,白藜芦醇可能通过激活SLC7A11/GPX4轴来对抗ox-LDL诱导的铁死亡。
综上所述,调控铁死亡可能为白藜芦醇治疗AS的重要机制,本研究结果为深入挖掘中医药治疗AS疾病作用机制提供了新思路。但本研究仅在细胞层面初步探讨了白藜芦醇对ox-LDL诱导铁死亡的可能作用机制,存在一定的局限性,后续将深入研究白藜芦醇调节铁死亡的直接机制和作用靶点。
